1
Предлагается способ получения гетероциклически замещенных производных небуларина, которые могут найти применение в медицине.,,
Известен способ получения N -замешенных производных пуринрибоаида, заключающийся во взаимодействии 6-галоген
(меркапто)пуринрибознда с соответствующим замещенным амином.
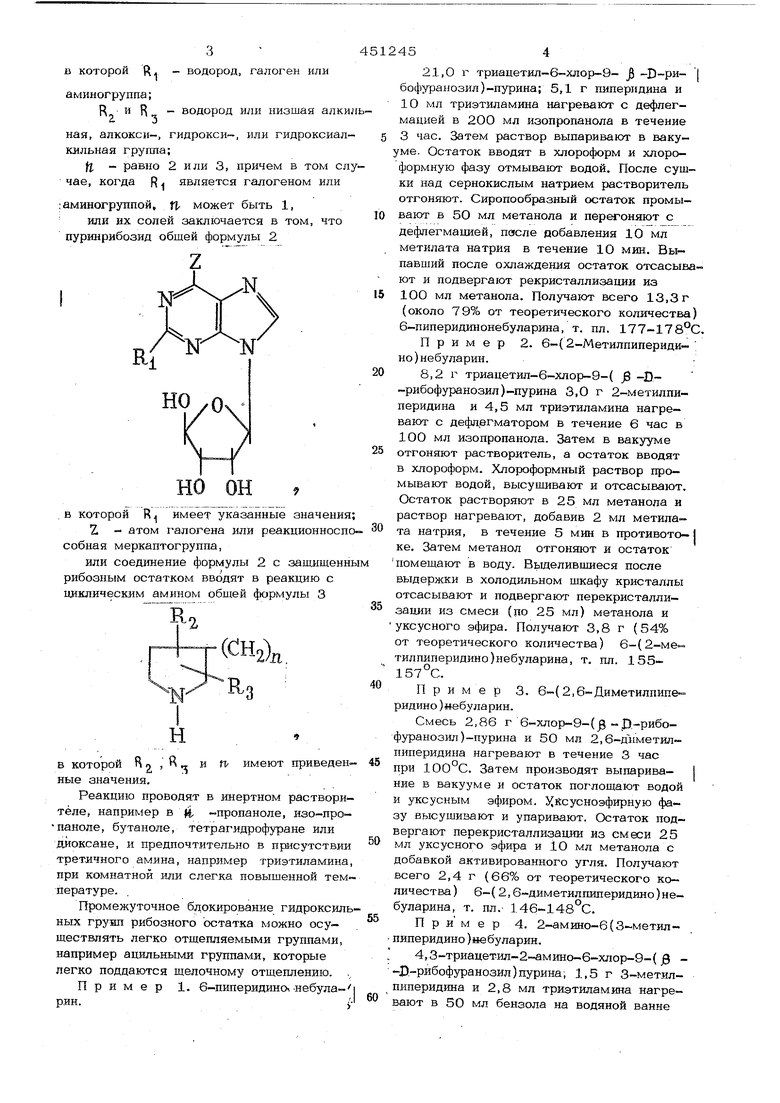
Предлагаемый основанный на известной реакции способ получения гетероциклически замещенных производных небуларина общей формулы 1 в которой R. - водород, галоген или аминогруппа; R. и R, - водород или низшая а а 3 или гидрокси ная, алкокси-, гидроксИ кильная группа; fl - равно 2 или 3, причем в том чае, когда R является галогеном ил ; аминогруппой, л может быть 1, или их солей заключается в том, ч пуринрибозид обшей формулы 2 rN vv но он в которой R имеет указанные значе Z - атом галогена или реакционн собная меркаптогруппа, или соединение формулы 2 с защищ рибозным остатком вводят в реакцию циклическим амином общей формулы 3 О )л, 3 П имеют приве в которой 1л 2 ные значения. Реакцию проводят в инертном раств теле, например в м, -пропаноле, изопаноле, бутаноле, тетрагидрофуране ил дйоксане, и предпочтительно в присутс трет-ичного амина, например триэтилам при комнатной или слегка повышенной пературе. Промежуточное бдокирование гидрок ных грунп рибозного остатка можно ос ществлять легко отщепляемыми группа например ацильными группами, которые легко поддаются щелочному отщеплению Пример 1. 6-пиперидино-.-небу рин. 454 21,0 1 триацетил-6-хлор-9- -D-рибофуранозил)-пурина; 5,1 г пиперидина и 10 мл триэтиламина нагревают с дефлегмацией в 200 мл изопропанола в течение 3 час. Затем раствор выпаривают в вакуме. Остаток вводят в хлороформ и хлороформную фазу отмывануг водой. После сушки над сернокислым натрием растворитель отгоняют. Сиропообразный остаток промывают в 5О мл метанола и перегоняют с дефлегмацией, пясле добавления 10 мл метилата натрия в течение 10 мин. Выпавпшй после охлаждения остаток отсасывают и подвергают рекристаллизации из 10О мл метанола. Получают всего 13,3 г (около 79% от теоретического количества) 6-пиперидинонебуларина, т. пл. 177-178°С, Пример 2. 6-( 2-Метилпипериди- ; но)небуларин. 8,2 г триацетил-6-хлор-9-( -D-рибофуранозил)-пурина 3,0 г 2-метилдиперидина и 4,5 мл триэтиламина нагревают с дефлегматором в течение 6 час в 100 мл изопропанола. Затем в вакууме отгоняют растворитель, а остаток вводят в хлороформ. Хлороформный раствор промывают водой, БысуЕшвают и отсасывают. Остаток растворяют в 25 мл метанола и раствор нагревают, добавив 2 мл метилата натрия, в течение 5 мин в нротивото-1 ке. Затем метанол отгоняют и остаток помещают в воду. Выделившиеся после выдержки в холодильном шкафу кристаллы отсасывают и подвергают перекристаллизации из смеси (по 25 мл) метанола и уксусного эфира. Получают 3,8 г (54% от теоретического количества) 6-(2-метилпиперидино)небуларина, т. пл. 155157°С. Пример 3. 6-(2,6-Диметилпиперидино)«ебуларин. Смесь 2,86 г 6-хлор-9-( - Д-рибофуранозил)-пурина и 50 мл 2,6-Д11метил пиперидина нагревают в течение 3 час при 1ОО°С. Затем производят выпарива- I ние в вакууме и остаток поглощают водой и уксусным эфиром. Х сусноэфирную фазу высушивают и упаривают. Остаток подвергают перекристаллизации из смеси 25 мл уксусного эфира и 1О мл метанола с добавкой активированного угля. Получают всего 2,4 г (66% от теоретического количества) 6-( 2,6-диметилшшеридино)небуларина, т. пл.- 146-148°С, П р и м е р 4. 2-амино-6(3-метил пиперидино)небуларин. 4,3-триацетил-2-амино-6-хлор-9-( -Д-рибофуранозил)пурина, 1,5 г 3-метилпиперидина и 2,8 мл триэтиламина нагревают в 50 мл бензола на водяной ванне примерно в течение 6 час. Бензольную фазу затем промывают водой и выпаривают. Остаток помещают в насышеьшый аммиаком метанол и раствор выдерживают в течение ночи при комнатной температуре. Затем состав вновь выпаривают в вакууме, а оставшийся сироп дважды подвергают перекристаллизации из уксусного эфира. Получают 0,8г (22% от теоретиче ского количества) 2-ам1Шо-6-(3-метилшш рицине )небуларина, т. пл. 153-155°С (спе кание при 148°С). Пример 5. 2-Хлор-6-1Шрролидино небуларин. 4,5 г триацетил-2,6-дихлор-9-( - D -рибофуранозил)пурина, 1,1 г пирролидина и 2,8 мл триэтиламина растворяют в 5О мл бензола. После выдержки в течение 1 час при комнатной температуре реакция заканчивается. Далее поступают, как в при мере 4. После перекристаллизации из бута нола получают 2,5 г (7О% от теоретическ го выхода) 2-хлор-6-шфролидшюнебуларина, т. пл. 229°С. Пример 6. 2-Хлор-6-(2-метш1пиперидино)небуларин. 3,5 г триацетил-2,6-дихлор-9-( g -О -рибофуранозял)пурина, 2,5 г метилпиперидина и 2,8 мл триэтиламнна в 5О мл хлоро4юрма оставляют на ночь при комнатной температуре. Хлороформную фазу промывают слабой соляшой кислотой, затем во дои, сушат и выпаривают. Остаток обрабатывают ЗО мл метанола, насыщенного ам- миаком, и выдерживают раствор в тече- ние ночи при комнатной температуре. Метанол отгоняют, а остаток помещают в про стой эфир и воду. Эфирную фазу высушивают и отсасывают. Сиропообразный остаток не поддается кристаллизации, его растэоряют в уксусном эфире и продукт осаждают вливая состав каплями в лигроин. В конечном счете получают 2,4 г (64% от теоретического выхода) хроматографически чист го 2-хлор-6-( 2-метилпиперидина), спекающегося примерно при Пример 7. 2-Хлор-6-гексаметиле иминонебуларин. 4,5 г триацетил-2,6-дихлор-9-( 3 -D-рибофуранозил) .пурина, 1,5 г гексаметиленимина и 2,8 г триэтиламина в 50 мл бензола оставляют на ночь при комнатной температуре. Затем процесс и очистку ве- дут, как в примере 6. Таким путем получают 2,9 г (76% теоретического выхода) хроматографически чистого 2-хлор-6-гексаметилениминонебуларина, спекающегося примерно при 50°С. Аналогичным образом получают следующие соединения: из триаиетил-6-хлор-9( -D -рибофуранозил) пурина и 3- летилпмлеридина 6-(й- : метшшипер идин)небуларнн, т. пл -149151°С (54% от теоретического выхода); из трнацетил-6-хлор-9-( - D -рибофуранозил )ебуларина и 4-(1етнлшшеридина 6-(4-метилпиперидино)небуларин, т. шт.163-164°С (58% от теоретического выхода); из триацетш1-6-хлор-9-( - D -рибофуранозил) пурина и 4- 1етоксипиперидина 6(4-метоксишшеридино)небуларин, т. пл. 156-157°С (34% от теоретического выхода); из триацетил-6-хлор-9-( - D -рибо1 фуранозил) пурина и 4-(2-гидроксиэтил) пиперидина 6- С4-( 2-гидрокснэтил) пиперидино| небуларин, т. пл. 182-184 С (2О% от теоретического выхода); из триацетил-6-хлор-9-( - D -рибо- ; фуранозил) пурина и гексаметиленимина б- ексаметилениминонебуларин, т. пл. 178-179 С (50% от теоретического выхода); из триацетил-2-ам1шо-6-хлор-9-( 0 - -рибофуранозил)пурина и пиперидина 2-амино-6-пш1еридш1онебуяарин, спекающийся, начиная примерно от 11О°С (25% от теоретического выхода); из триацетил-2-амино-6-хлор-9-( -&-рибофуранозил)пурина к 4-изопропоксипиперидина 2-амино-6-(4-изопропоксипиперидино)небуларин, т. пл. 123-125 С (4% от теоретического выхода); из триацетил-2-амино-6-хлор-9-( j8 -J) -рибофуранозил)пурина и пирролидина 2-аминошфролидинонебуларин, спекающийся, начиная от примерно 8О°С (23% от ; теоретического выхода); из триацетил-2-амино-6-хлор-9-( - -D -рибофуранозил) пурина и гексаметиленимина 2-амино-6-гексаметилениминонебуларин, спекающийся при температуре, начиная от 7О С (42% от теоретического выхода ); из триацетил-2,6-дихлор-9-( -D - . -рибофуранозилпурина и . пиперидина 2-хлор-б-пкперидинонебуларин, спекающийся, начиная от (25% от теоретического выхода); из триацетил-2,6-дихло1 -9-( -D -рибофуранозил) пурина и З-метилшшеридина 2-хлор-6-( 3-метилпиперидино)небуларнн, спёкающийся, начиная от примерно 75 С (86% от теоретического вызорда); . из триацетш1-2,6-дихлор-9-( -В -рибофуранозил)пурина и 4-метилпипериди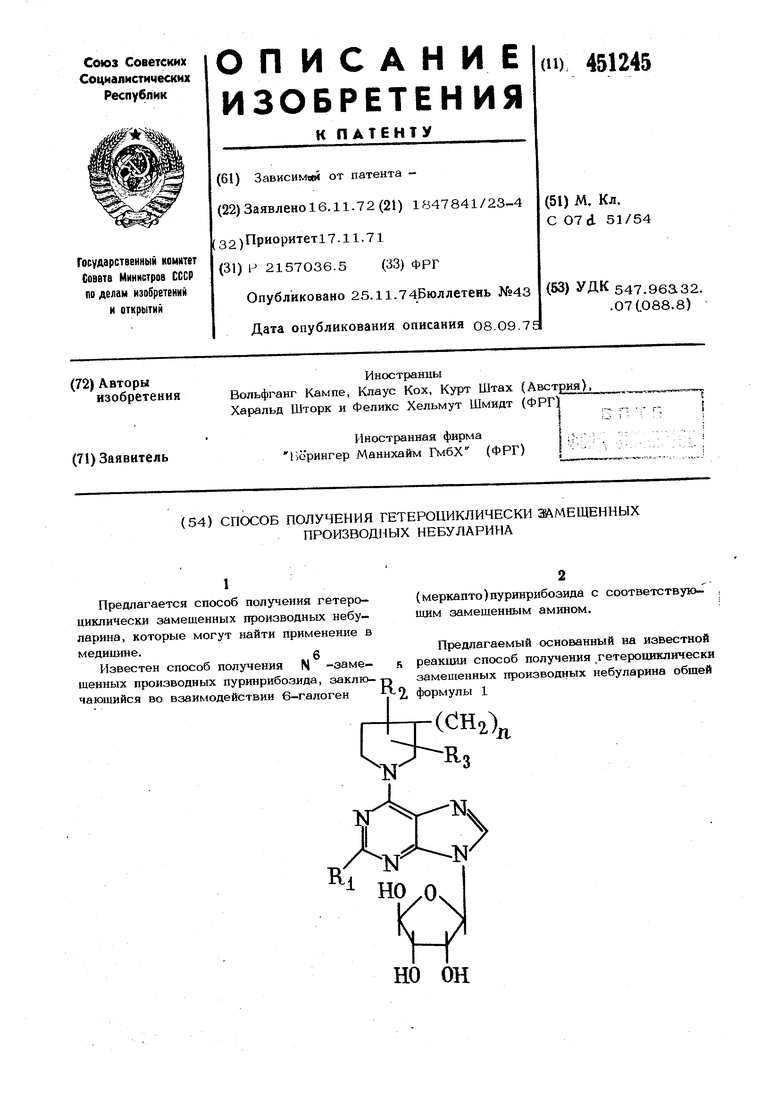

| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения (6)замещенных производных аденозина | 1972 |
|
SU539532A3 |
| Способ получения (6)-аралкиладенозина | 1971 |
|
SU469253A3 |
| Способ получения /6//-дизамещенных производных аденозина" | 1973 |
|
SU515459A3 |
| Способ получения производных аденозина | 1971 |
|
SU444368A1 |
| ПИРАМИДО[5,4-D]ПИРИМИДИНЫ И ЛЕКАРСТВЕННЫЕ СРЕДСТВА СО СВОЙСТВАМИ ИНГИБИТОРА ТИРОЗИНКИНАЗЫ СЕМЕЙСТВА РЕЦЕПТОРОВ ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА НА ИХ ОСНОВЕ | 1997 |
|
RU2195461C2 |
| Способ получения производных пурина или их солей | 1977 |
|
SU700064A3 |
| СПОСОБ ПОЛУЧЕНИЯ 2,6-ДИХЛОР-9-(2,3,5-ТРИ-O-АЦЕТИЛ-β-D-РИБОФУРАНОЗИЛ)ПУРИНА | 2007 |
|
RU2324699C1 |
| Способ получения производных резоруфина | 1986 |
|
SU1621811A3 |
| СПОСОБ ПОЛУЧЕНИЯ 9-(БЕТА-D-АРАБИНОФУРАНОЗИЛ)-6-(N-L-СЕРИЛАМИДО)-2-ХЛОРПУРИНА | 2014 |
|
RU2563257C1 |
| СПОСОБ ПОЛУЧЕНИЯ 7-ЗАМЕЩЕННОГО-3-ХИНОЛИН И 3-ХИНОЛ-4-ОН КАРБОНИТРИЛОВ | 2003 |
|
RU2309149C2 |


Авторы
Даты
1974-11-25—Публикация
1972-11-16—Подача