хлорсукцинимид, хлорациламид, такой как хлорацетамид или же сам галоген. В качестве реагентов, выделяющих отрицательно за)яжеииый галоген, используют хлористый или фтористый водород и галогенид щелочного металла, в особенности галогенид лития, наиример хлорид лития.
Присоедииеиие галогена к А9(11)-двойной связи стероида всегда иронзводят с таким расчетом, чтобы ноложите.тьно заряжеииый галогеи ирисоединялся в ноложеиие 9, а отрицательно заряженный галогеи - в ноложеиие 11 молекулы. Ато.1иый вес галогеиа в иоложеиин 9, вследств 1е известных различиых значеннй э.лектроотрицательности у галогенов, никогда не может быть меньипв, чем у галогена в ноложеини 11. Присоедииение галогена к А9(11) - двойной связи осуществляют нредночтнтельио ири -75°С до +50°С.
Оамылеине 21-ацилоксисоедииеиий ираводят известным ириемом, нанример с номощью алкоголята щелочного металла, растворенного в сиирте, или }юдиым раствором гидрата окиси щелочного металла или карбоната щелочного металла.
Этерификацию свободной 21-оксигруипы ироводят известным сиособом, наиример воздействием ангидрида или галогеиида кислоты иа 21-оксистероид в ирисутствии основного катализатора, такого как ниридин, лутидин, водный раствор двууглекислого натрия.
Исходные соединения общей формулы II можио получать иутем отщепления воды от известного Па-, или 11р-окси-21-ацилокси-6а,16а-диметил-4-прегнадиен-3,20-дионов или их Д-соедииений известным сиособом.
Пример 1. а) 6,5 г Па, 21-диокси-6а, 16а-диметил-1,4-ирегнадиеи-3, 20-диона растворяют в 65 мл диметилформамида, смещивают с 13 мл ангидрида уксусиой кислоты и 650 ацетата свинца (II) и иеремещивают 2 ч ири комиатной температуре.
Затем реакционную смесь прибавляют по канлям нри неремещивании к 300 мл 10%-ного раствора ацетата натрия, неремещивают 1 ч, отсасывают выделивщийся в виде осадка иродукт, нромывают его водой и высущивают в вакууме нри 60°С.
Получают 6,5 г 11а-окси-21-ацетокси-6а, 16а-диметил-1,4-ирегнадиеи-3, 20-диона в виде «сырого по степени чистоты продукта, имеющего т. пл. 160-164°С, который после перекристаллизации из диизоироиилового эфира дает 5,1 г чистого иродукта с т. ил. 170- 171°С;
б) 5,3 г 11а-оксц-21-ацетокси-6а, 16а-диметил-1,4-лрегнадиеи-3, 20-диона растворяют в 25 мл сухого пиридина и при неремещивании и охлажеднии примерно до 0°С смещивают с 3 мл хлорида метансульфокислоты, добавляемой по каплям. Затем продолжают неремешивание реа1кционной 30 мин при 0°С, донолнительно 90 мин при 10-20°С и
прибавляют ио канлям смесь 600 мл ледяной воды и 30 мл концентрированной хлористоводородной кислоты. Перемешивают полученную смесь 1 ч, отсасывают выделившийся продукт и высущивают его в вакууме при температуре . Получают 6,3 г Па-мезилокси-21 ацетокси-ба, 16а-диметил-1,4-прегнадиеи-3, 20-диои в виде «сырого иродукта, имеющего т. нл. 174-175°С.
в) 6,3 г 11а-мезилокси-21-ацетокси-6а, 16я-диметил-1,4-ирегнадиен-3, 20-днона растворяют в 120 мл ледяной уксусной кислоты, смешивают с 11,5 безводного уксуснокислого иатрия и нагревают в атмосфере азота ири
перемешивании 6 ч нри темиературе кипения. Затем в вакууме ири температуре обогревающей ваииы 60°С, отгоняют 50 мл ледяной уксусной кислоты, остаток добавляют ио каилям иримерио к 600 мл ледяной воды и смесь
перемешивают еще 1 ч. Отсасывают продукт, выпавший в виде осадка, промывают его водой до нейтральной среды и высушивают в вакуу.ме ири 40°С. Получают 4,9 г 21-ацетокси-бос, 1 ба-диметил-1,4,9 (П) -ирегнатриен-3,
20-диои в виде «сырого продукта с т. пл. 153-163°С.
г) 0,5 г 21-ацетокси-ба, 16а-диметил-1,4,9(11)-прегиатриен-3, 20-диона растворяют в 20 мл ледяиой уксусиой кислоты, смещивают с 2 г хлорида и охлаждают ирн.мерно до 0°С. Затем к полученной смеси добавляют раствор 198 мг N-имида хлорянтарной кислоты и 52 г хлористого водорода, растворенного в 0,5 мл тетрагидрофурана и неремешивают 4,5 ч при комнатной температуре. Затем иродукт осаждают ледяной водой, отсасывают и растворяют в метиленхлориде. Метиленхлоридную фазу нромывают водой до нейтральной реакции, унаривают в вакууме и остаток нерекристаллизовывают из смеси эфира с нентаном. Получают 9а, Пр-дихлор-21-ацетокси-ба, 16а-диметил-1,4-нрегнадиец-3, 20-дион, имеющий т. пл. 180-18ГС.
Пример 2. 300 мг 9а, Пр-дихлор-21-ацетокси-ба, 1 ба-диметил-1,4-црегнадиен-З, 20-диона сусиендируют в 3 мл метиленхлорида и 20 мл мета.нола, охлаждают смесь при.мерно до 0°С, смещивают с раствором 18 мг гидрата окиси калия в 0,6 мл метанола и перемеишвают 10 мни. Затем нейтрализуют уксусной кислотой, разбавляют хлороформом, промывают хлороформную фазу водой и упаривают в вакууме досуха.
Остаток нерекристаллизовывают из смеси ацетона с гексаном и получают 9а, Пр-дихлор-21-окси-6а, 1 ба-диметил-1,4-ирегнадиен-3, 20-дион, имеющий т. разложения 205°С.
Предмет изобретения
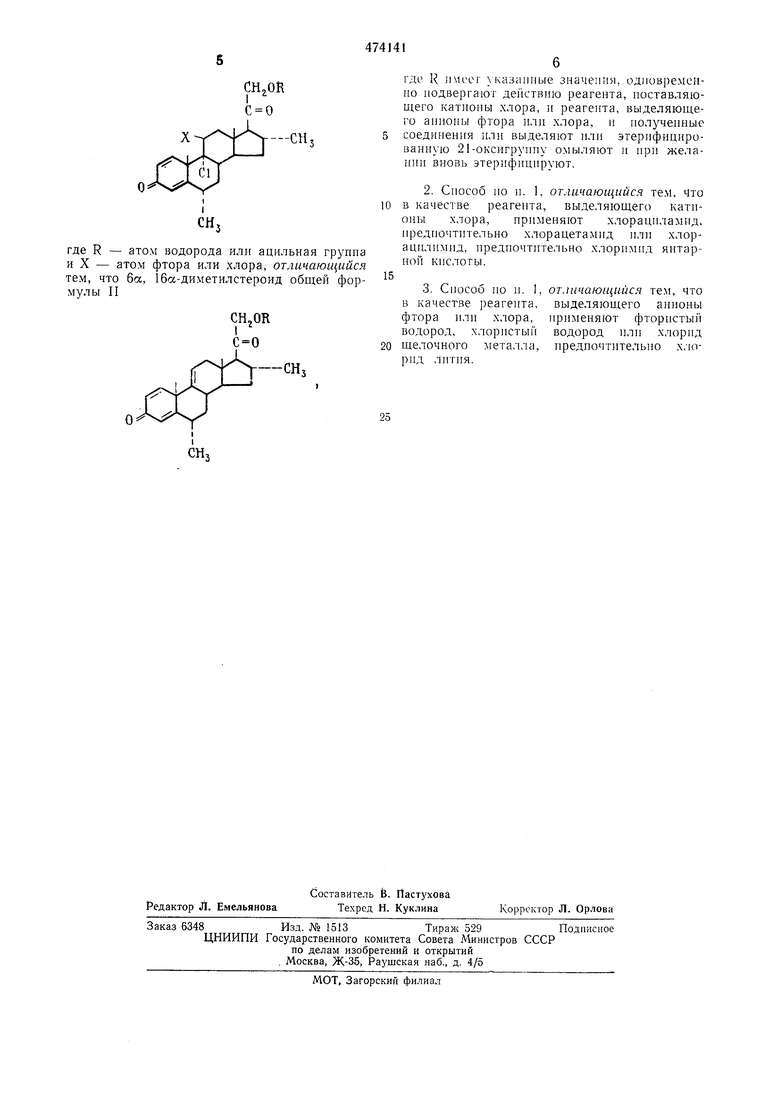
1. Сиособ нолучения производных 6а, 16а65 -диметилстероидов общей формулы I
СН„ОК
I
с о
-CHj
где R - атом водорода или ацильная групиа и X - атом фтора или хлора, отличающийся тем, что 6а, 16а-диметилстероид общей формулы II
CHjOR
-сн,
где R имеет указанные значения, одновременно иодвергают действию реагента, поставляющего катионы хлора, и реагента, выделяющего анионы фтора или хлора, и нолзче11ные соединения или выделяют или этерифицироваииую 21-оксигруппу ОМЕ ТЛЯЮТ и при лчелании вновь этерифицируют.
2. Сиособ но и. 1, отличающийся тем, что в качестве реагента, выделяющего кати сны хлора, ирименяют хлорациламид. нредночтительио хлорацетамид или хлорацилимид, иредпочтительно хлоримид яитариой кислоты.
отличающийся те.м, что выделяющего анионы
ирименяют фтористый водород или хлорид нредночтительно хло



Авторы
Даты
1975-06-15—Публикация
1971-11-26—Подача