шению к динитросоединенйю формулы (II). Но если степень превращения соединения формулы (II) не удовлетворительна, можно также применять большие количества этиленимЕна, вплоть до двух или трехкратного молярного количества. Предпочитают же одно или полуторакратное молярное количество этиленимина формулы (III) в расчете на применяемое молярное количество динитросоединения формулы (II).
Реакционная температура, зависящая от реакционной способности компонентов, поддерживается на уровне 20-120 0, предпочтительно 40-90°С.
В качестве R и R в соединениях формул (II) и (1П), кроме водорода, используются также и алкоксигрунпы, алкильные, алкеннльные, цианалкильные, гндроксиалкильные, N-формиламнноалкильные, карбалкоксиалкильные, карбалкоксиалкенильные, алкоксиалкильные группы с , предпочтительно 1-4, углеродными атомами, содержащие в ароматическом кольце функциональные группы такие, как галоген-, нитро-, амино-, оксигруппы или алкильные или галогеналкильные остатки .с 1-4, предпочтительно I или 2, углеродными атомами.
В качестве замещенных этилениминов используют такие, у которых один из остатков R и Ry - водород.
В качестве этиленимпн-комнонентов могут быть использованы, например:
а)различные N-алкил-этиленимины такие, как N-метил-, N-этил-, N-пронил-, N-изопроПИЛ-, N-бутил-, N-изобутнл-, N- (1-метилбутил)-, N- (1-этилгекснл)-, М-этил-2-циклогекСИЛ-, Н-октилэтиленими«;
б)различные N-алкенилэтиленимины такие, как N-аллнл-, N- (2,3-бутенил)-, N- (3,4-бутенил) -этиленимин;
в)различные N-алкинилэтиленимины такие, как N-пропинил- или N-бутинилэтиленимин;
г)N-цианалкилэтилеиимины такие, как N-2-цианэтил-, К-4-циа«бутилэтилвнимин;
д)N-оксиалкилэтиленимины такие, как N-(2-оксиэтил)-, N- (3-оксипропил)-, N- (2-оксипронил)-, N-(3-оксибутил)-, N-(4-оксибутил)-, N- (8-оксиоктил)-этиленимин;
е)N- (N-формиламиноэтил)-, N- (N-ацетиламиноэтил)-, N- I- (1,2-цропенил) -2-карбометоксиэтил -, N- (карбометоксиэтил)-, N-(2-карбоэтоксиэтил)-, N- (1-метил-2-карбоэтоксиэтил) -этиленимин;
ж)N-аралкилэтиленимины такие, как N-бензил-, N-2-фенилэтилэтиленимин и также их в 2,3- и/или 4-положении моно- или динитрированные, моно- или дигалогенированные или моно- или диалкилированные (ал-кильными группами с 1-4 С-атомами) производные;
з)(З-оксобутил)-, N- (3-оксопентил)-, (метилсульфонил) -этил -, N- 2- (этилсульфонил) -этил -, N- 2- (фенилсульфонил)-этил -этиленимин;
и) N- (метоксиэтил)-, N- (этоксиэтил)-, N-(метоксипропил)-, N- (метилтиоэтил)-, N-(атилтиоэтил)-, N- (этилтиопропил)-этиленимин.
Среди динитрокомпонентов формулы (II) наиболее реакционноспособпыми являются те, у которых атом хлора стоит в нара-положении по отношению к СРз-группе, т. е. между обеими нитрогруннами, например, 4-хлор-3,5-динитротрифторметилбензол или 2,4-дихлор-3,5-ди|Нитротрифторметилбензол. При положении между СРз- и иитрогруппой, т. е. у 2-хлор-3,5-динитро-трифторметил-бензола, реакционная способность атома хлора немного слабее. Если в ароматическом кольце находятся два атома хлора, то реагирует, как отмечено выше, предпочтительно располагающийся между обеими нитрогруппами атом хлора.
При проведении реакции к динитросоединению формулы (II), растворенному в растворителе, или к его расплаву, нагретому до реакционной температуры, прибавляют при интенсивном перемешивании этиленимин формулы (П1), растворенный, нреимущественно,
в том же растворителе, что и динитросоединение.
Слабо-желтый цвет раствора в ходе реакции изменяется в желто-коричневый.
В качестве растворителей иснользуют
обычные, инертные в условиях реакции растворители, такие жак бензол, толуол, ксилол, хлорбензол, хлороформ, тетрахлористый углерод, диизопропиловый эфир или тетрагидрофуран.
По окончании реакции растворитель отгоняют, и очистку целевого продукта проводят, например, нерекристаллизацией или хроматографией на колонке. Особенно легко отделяется реакционный продукт от пенрореагировавшего динитросоедннения путем растворения в концентрированной сериой кислоте н последовательного осаждения водой илн льдом.
Идентичность получаемых по изобретению
продуктов показана элементарными анализами и спектральными (ИК-, ЯМР-) данными. Продукты имеют желтый цвет.
Пример 1. 4- (N-p-хлорэтил) -N-аллиламино-3,5-динитротрифторметил бензол.
К нагретому до -1-50°С раствору 27,0 г (0,1 моль) 4-хлор-3,5-динитротрифторметилбензола в 50 мл бензола прибавляют по каплям при перемещивании в течение 30 мин раствор 8,3 г (0,1 моль) N-аллилэтиленимина
в 30 мл бензола. После двухчасового неремешивания при 50°С отгоняют бензол. Остаток кристаллизуется немедленно: т. пл. 33-36°С, выход 35,3 г (100% от теории).
Пайдено, %: С 41,0; Н 3,2; N 11,8; С1 10,3.
Ci2HiiClF3iN3O4; мол. вес. 353,5.
Вычислено, %: С 40,7; Н 3,1; N 11,9; С1 10,0.
Пример 2. 4- (М-р-хлорэтил-М-р-цианэтил) -амино-3,5-динитротрифторметилбензол.
К кипящему раствору 27,0 г (0,1 моль) 4хлор-3,5-дИ(Нитротрифторметилбензола в 50мл бензола прибавляют по каплям в течение часа 9,6 г (0,1 моль) N- (р-цианэтил) -этиленнмина в 30 мл бензола. Продолжают перемешивание 2 час при точке кипения, затем упаривают бензол во вращающемся испарителе под вакуумом водоструйного насоса. Остаток (37 г) снова растворяют в бензоле и хроматографируют на колонке, наполненной силикагелем (150 г). Сначала вымыаают из адсорбата 500 мл бензола 4,9 г непрореагиропавшего 4-хлор-3,5-динитротрифторметилбензола, дальнейшими 2500 мл бензола вымывают 25,4 г реакционного продукта (т. нл. 65-
67°С). Выход составляет 85% от теории, в расчете на прореагировавший дннитрохлорбензол. Продукт может быть перекристаллнзован из этанола или изопропанола.
Найдено, %: С 39,5; Н 2,6; С1 9,8; F 16,5; N 15,2.
Ci2HioClF3N4O4; мол. вес. 366,5. Вычислено, %: С 39,3; Н 2,7; С1 9,7; F 15,6; N 15,2.
При м е р 3. При том же режиме, что и в примере 2, получают Н-(3-хлорэтил-3,5-динитро-4-трифторметил-анилины взаимодейстРезультаты представлены в таблице.

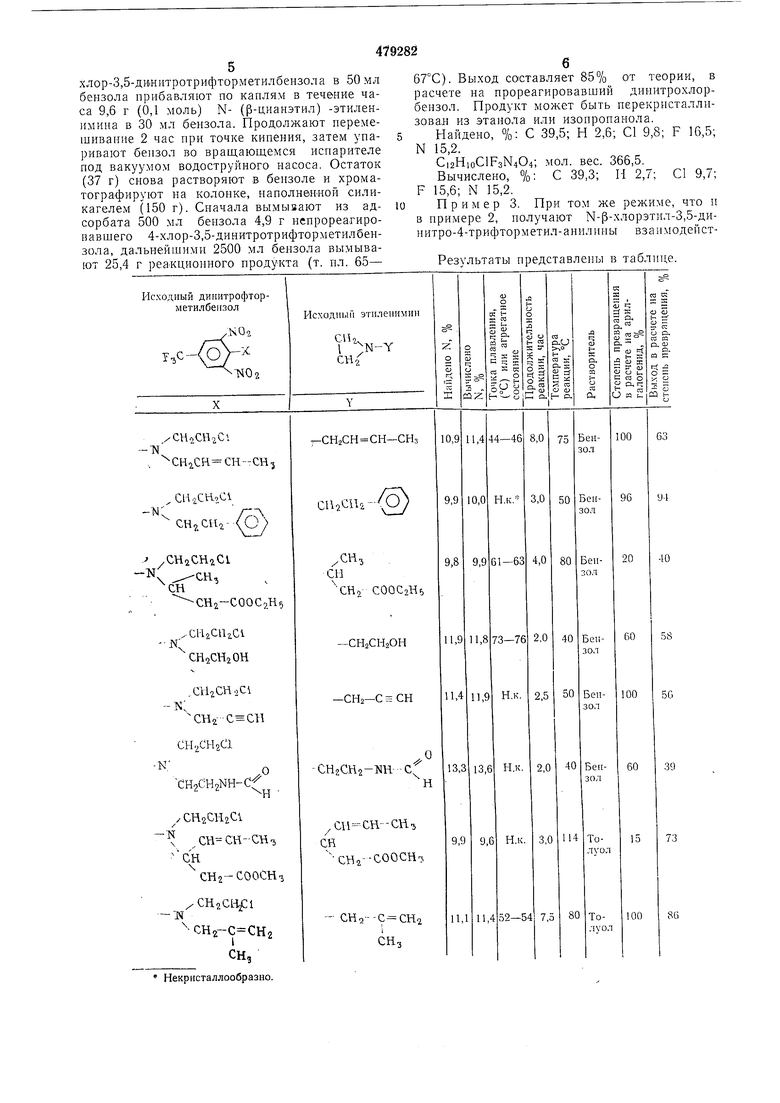


Некр исталлообразно. вием 4-хлор-3,5-динитро-трифторметилбензола с N-замещенными зтилениминами. Пример 4. 4- (N-p-хлорэтил) - (N-p-карбэтоксиэтил) -ами«о- 3,5 -динитротрифторметилбензол. К раствору 27,0 г (0,1 моль) 4-хлор-3,5-динитротрифторметилбензола при температуре 60°С прибавляют по капля в течение часа при перемешивании раствор 14,3 г (0,1 моль) N- (р-карбэтоксизтил) -этилепимина в 30 мл бензола. Перемешивают еще 1 час при 60°С. При охлаждении встряхивают, охлаждая с 100 мл концентрированной серной кислоты, отделяют кислотную фазу и промывают ее одИН раз 100 мл бензола. Затем льют сернокислотную фазу па лед и растворяют выпавшийпродукт в бензоле. После супжи сульфатом натрия и удаления растворителя получают 34,0 г (82% от теории) кристаллического продукта с т. пл. 64-67°С. Найдено, %: С 40,7; П 3,7; С 8,7; F 13,5; N 10,2. CuHisClFsNsOe; мол. вес. 413,5. Вычислено, %: С 40,7; П 3,6; С1 8,6; F 13,8; N 10,2. Пример 5. 2- (Н-аллил-Н-р-хлорэтил) -амино-3,5-динитротрифторметилбензол. К раствору 16,2 г (0,06 моль) 2-хлор-3,5-дипитротрифторметилбензола в 30 мл толуола, температуру которого поддерживают , прибавляют по каплям раствор 5,0 г (0,06 моль) N-аллнлэтнленимииа в 20 .мл толуола в течение 45 мин. Перемешивают еше некоторое время при 70°С и упаривают толуол во враш ающемся испарителе под вакуумом водоструйного насоса. Остаток (21 г) растворяют в 50 мл бензола и отфильтровывают через колонку, наполненную 200 г силикагеля. После упаривания растворителя получают продукт в виде кристаллов с т. пл. 38-42°С. Выход составляет 17,2 г (81% от теории). Найдено, %: С 40,5; Н 3,2; N 11,6; CI 10,8. С12Н11С1РзКзО4; мол. вес. 353,5. Вычислено, %: С 40,7; Н 3,1; N 11,9; С1 10,1. Пример 6. 4- (Л-р-карбэтоксиэтнл-М-р-хлорэтил) - амино-2-хлор- 3,5 -динитротрифторметилбензол. К кипяш,ему раствору из 18,3 г (0,06 моль) 2,4 - дихлор - 3,5 - динитротрифторметилбензола в 30 мл бензола прибавляют по каплям с пермешиванием в течение 45 мин раствор из 8,6 г (0,06 моль) N-p-карбэтоксиэтилэтиленимина в 20 мл бензола. Перемешивают еш,е 10 мин при температуре кипения. После отгонки растворителя во вращаюш,емся испарителе под вакуумом водоструйного пасоса остается 27 г некристаллизуюшегося веш,ества. Хроматографированием на силикагеле (как опнсаио в примере 2) получают 11 г непрореагировавшего 2,4-дихлор-3,5-динитротрифторметилбензола и 11,7 г некристаллизуюшегося реакционного продукта. Выход составляет 92% от теории в расчете па прореагировавший 2,4-дихлор-3,5-дипитротрифторметилбензол, степень превращения последнего составляет 40%. Найдено, %: С 37,5; П 3,1; N 9,4; С1 15,8. СиНкСЬРзХзОс; мол. вес. 448. Вычислено, %: С 37,9; П 3,3; N 9,6; 15,8. Пример 7. 4- (N-p-хлорэтил) -N-fl-бутил) -амино-3,5-динитротрифторметилббнзол. К нагретому до -|-50°С раствору из 27,0 г (0,1 моль) 4-хлор-3,5-динитротрифторметилбензола в 50 мл бензола прибавляют по каплям при -пере.мешивании в течение 40 мин раствор 9,9 г (0,1 моль) N-п-бутилэтиленимипа в 30 мл бензола. По окончании введения этиленимина отгоняют бензол во вращающемся иснарителе под вакуумом водоструйного насоса. Получают Кристаллический остаток с т. пл. 84-86°С. Выход составляет 36,9 г, что отвечает 100% от теории. После перекристаллизации ii,i этанола точка плавления - 87- 89°С. Найдено, %: С 42,0; Н 4,0; С1 9,9; С,зН,5С1РзМз04; мол. вес. 369,5. Вычислено, % С 42,3; Н 4,1; N 11,4. Пример 8. 4- (М-р-хлорэтил-К-нропил)-амино-3,5-динитротрифторметил бензол. К нагретому до 50°С раствору 27,0 г (0,1 моль) 4-хлор-3,5-динитротрифторметилбензола в 50 мл бензола прибавляют по капля.м при перемешивании в течение 1,5 час pacTBop 8,5 г (0,1 моль) N-пропилэтиленимиа в 30 мл бензола. Продолжают перемешивание 30 мин, и отгоняют бензол во вращающемся испарителе под вакуумом водоструйного насоса. Получают 36 г красно-коричневого быстро кристаллизующегося остатка (что отвечает 100%). После перекристаллизации из танола получают желтые кристаллы с т. пл 46-48°С. Найдено, %: С 40,4; Н 3,9; N 11,8; С1 9,9. Ci2Hi2ClF3N04; мол. вес. 355,5. Вычислено, %: С 40,5; Н 3,65; N 11,8; 1 10,0. Предмет изобретения 1. Снособ получения N- (р-хлорэтил) -диитротрифторметиланилинов общей формулы (I) ,CSi2-Cf,Cl где Кд. и RJ, - водород, алкоксигруппа ли органический остатоК, а-углеродный атом оторого связан минимально с одним водоодным атомом или связан тройной связью с ругим углеродным атомо.м, и R - водород ли хлор, причем в случае орто-положения миногруппы по отношению к СРз-группе - водород, па основе хлорированных в 2-, 4- или 2,4-положв 1ии динитротрифторметилбепзолов с последующим выделением целевого продукта известным способом, отличающийся тем, что, с целью упрощения техцологического процесса, взаимодействию с хлорированными динитрофторметилбеизолами общей формулы (II) где п - 1 или 2 и хлор находится в парии/или орто-положении к СРз-групле, подвергают замещениые этиленимииы общей формулы (III) СН,/ 1 СИ2в ч где Ry и RJ, имеют указанные выще значения. 2. Способ по п. 1, отличающийся тем, что нроцесс проводят при температуре 20-120°С.

Авторы
Даты
1975-07-30—Публикация
1972-07-20—Подача