(54) СПОСОБ ПОЛУЧЕНИЯ ФЕНИЛИМИДАЗОЛИДИНОНОВ
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ФЕНИЛИМИДАЗОЛИДИНОНОВ | 1972 |
|
SU453839A3 |
| Способ получения производных пиперазина | 1973 |
|
SU503516A3 |
| Способ получения производныхпиперазина | 1973 |
|
SU509228A3 |
| Способ получения фенилимидазолидинонов | 1973 |
|
SU498907A3 |
| Способ получения производных пиперазина | 1973 |
|
SU505358A3 |
| Способ получения фенилимидазолидинонов | 1972 |
|
SU493067A3 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 1,1Л-ТРИХЛОРЭТАНА | 1972 |
|
SU353412A1 |
| Способ получения производных пиперазина | 1973 |
|
SU499806A3 |
| Способ получения производных пиперазина | 1974 |
|
SU500757A3 |
| Способ получения рацемических или оптически активных производных пиперазина | 1971 |
|
SU437293A1 |

Изобретение относится к способу получения новых соединений - фенилимидазолидинонов, обладающих физиологической активностью.
Применение широко известного способа синтеза имидазолидонов на основе этилендиаминов позволило синтезировать новые соединения, обладающие ценными свойствами. Описываемый способ получения фенилимидазолидинонов формулы I
О
-N СНг
сн,-
где R означает атом водорода, низщую алкильную или алкоксигруппу или атом галогена,
R - одну из групп в мета- или пара-положении
-CHRi-Q-A,
-CHR2-А и
-О-CHR2-CHRi-Q-А
Причем А радикал
или-S
Q означает неразветвленную или разветвленную алкиленовую цепь с 1-4 атомами углерода,
RI - атом водорода, низщую алкоксигруппу или группу -О-СО-Rb,
R2-атом водорода или метильную группу,
Rs и R4 могут быть одинаковыми или различными и означают атом водорода, низшую алкильную или алкоксигруппу, атом галогена или трифторметильную группу или вместе образуют приконденсированное алифатическое или ароматическое пяти- или шестичленное кольцо,
Rs - низщую алкильную группу, которая может быть замещена галогеном, или алкоксиили диалкиламиногруппу,
Z - ароматическое кольцо с 1-2 гетероатомами, к которому может быть приконденсировано и бензольное кольцо, R, - атом водорода или низший неразветвлениый или разветвеленный алкильный, алкенильный, алкинильный или диалкиламиноалкильный радикал или аралкильный радикал, заключающийся в том что производные этилендиамина формулы II B-NH М Н,-СИ, где R, R, R имеют указаниые зиачения, подвергают циклизации путем взаимодействия с производиыми угольной кислоты или с металлическими цианатами в присутствии кислот. В качестве производных угольной кислоты используют фосген, сложные эфиры хлоругольиой кислоты, сложные эфиры угольиой кислоты, М,М-карбоиилдиимидазол, мочевину. Вместо аминов формулы II можно применять и такие соединения, как карбаматы, мочевины и хлориды карбаминовой кислоты. Если соединения согласно изобретению образуют рацематы или диастереомериые антиподные пары, они обычным методом могут быть разделены на диастереомерные рацематы или иа отдельные оптические антиподы. Исходные продукты частично оиисаиы или могут быть получены обычными методами синтеза. Пример 1. 15,5 г (0,05 моля) (4-аминофеиил)-этил -4-(2 - этилфенил) - пиперазина в 85 мл ледяной уксусной кислоты смешивают с 1,6 г параформальдегида и раствором 4,1 г цианида калия в 7 мл воды при 15- 20°С и выдерживают в течение ночи при комнатной температуре, в результате чего реакция заканчивается. Образовавшийся продукт имеет т. пл. 137-138°С и его в среде метанола с РЮг в качестве катализатора гидрируют и в беизоле смешивают с указанным количеством N,N - карбонилдиимидазола, растворенного в тетрагидрофураие. Смесь в течение ночи оставляют стоять при комнатной температуре, затем в течение 2 ч кипятят с обратным холодильником и образовавшийся продукт выделяют в форме основания (т. пл. 178- 181°С). Аналогично получают соединения формулы I, где R означает водород, а R имеет значения /7-СН,-СН. -N N-C,H, /v-O-CHo-CHj-N N VcHrCHrCHs л-СН -СНг-N NПример 2. 1-(4 - Имидазолидинон - (2)илфеиилметил)-4-фенилииперазии. 13,35 г 1-фенил-4-(4-аминобензил)-цииеразина в 85 мл ледяной уксусной кислоты смешивают с 1,6 г царафор:мальдегида и раствором 4,1 г цианида калия в 7 мл воды при 15- 20°С. После многочасового стояния при комнатной температуре образуется цианмет1илавдииовое соединение, которое гидрируют вметаноле над PtOj. Полученное лроиэводное этилендиа(мина растворяют в .бензоле и смешивают с рассчитанным количеством Ы,М-карбонилдиимидазола, растворенного в тетрагидрофуране. Оставляют стоять в течение нескольких часов при комнатной температуре и затем кипятят в течение 2 ч с обратным холодильником. Получают указанное соединение с т. пл. 218°С (из этанола). Соответственно примеру 2 получают следующие соединения: //- / / Л-N , Уи к-н СНГ СИ, сн,-сн II N-CHf-/ VN N-H / -У СИгСНг -Б СНгСНг N / /I I - си г-сиг Пример 3. 1 - 4 - Имидазолидинон-(2)лфенэтил -4- (2-пиридил) -пиперазин. 14,1 г 1-(4 - аминофенэтнл)-4-(2 - циридил)иперазина в 85 мл ледяной уксусной кислоты мешивают с 1,6 г параформальдегида и с
раствором 4,1 г цианида .калия в 7 мл воды при 15-20°С и оставляют стоять в течение ночи при комнатной температуре. При этом реакция заканчивается. Образовавшееся цианэтиламиносоединение в среде метанола в присутствии РЮ2 в качестве катализатора гидрируют в соответствующее производное этилендиамина. Это производное в бензоле смешивают с рассчитанным количеством Ы,М-карбонилдиимидазола, растворенного в тетрагидрофуране. После стояния в течение ночи при комнатной температуре в течение 2 ч кипятят еще с обратным холодильником и полученное соединение
- СНгСИг-К N
- Имидазолпдинон - (2) - нлфенэтнл 4-(3 - хлорфен11л)-пиперазин.
Н,С
СНг-СНг -N N
С,Н
2Л5
10
СИ.
СН-СП,-Х N15
/
N
20 изолируют как основание; т. пл. 200°С, Дигидрохлорид основания имеет т. пл. 299--302°С. Аналогично примерам 1-3 получают следующие соединения: СИ, , I о / -сигСн-Ь) с -/ - / СНг-СИг-Сиг-/ Л- сигси - н N-/ ycHrCH2H-N JN - /I / -ги,/ СНг-СИг
R 25 30 35 40
Кислота/т, пл. iMin
т. разл. соли, С
и/или т. пл. основания,
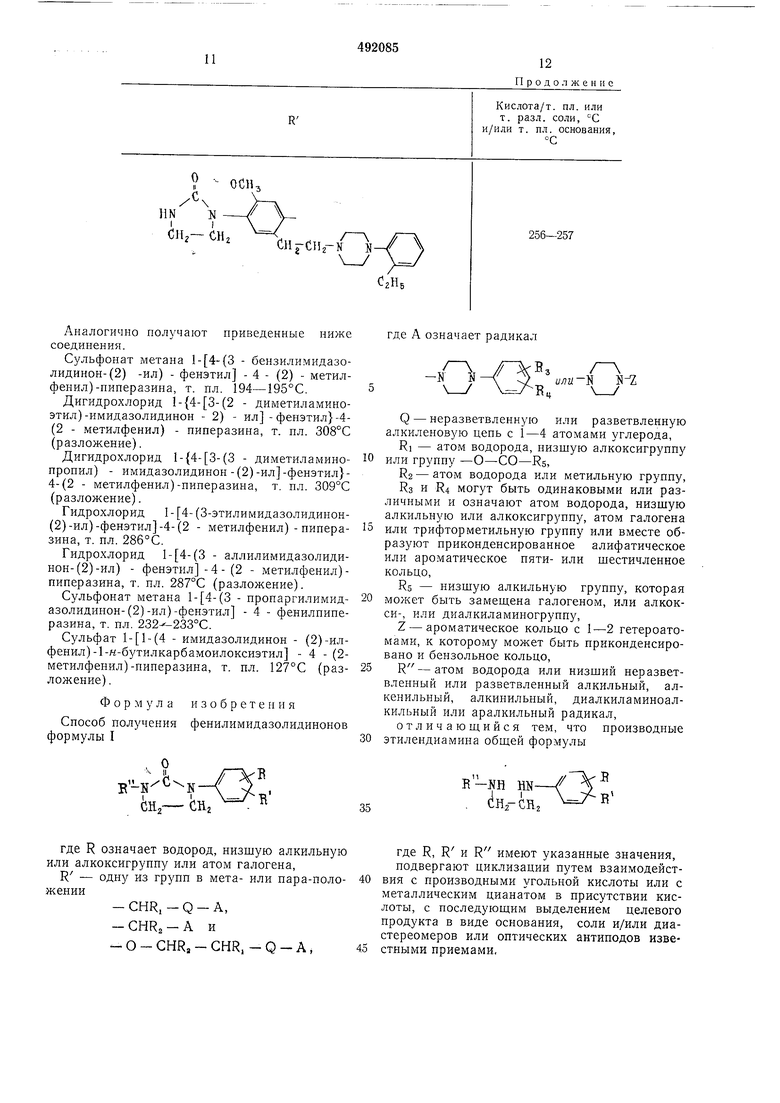
- Имидазолпдинон - (2) - плфенэтил 4- (2-хинолил)-пиперазлп. (3 - Метилимидазолидпнон - (2)-ил)фенэтил -4-(2 - метилфенил)-пиперазнн. (3 - к - Бутилимидазолидинон-(2)-ил)фенэтил - 4 - (2-метилфенил)-пиперазин. (4 - Имидазолидинон - (2) - илфенил)1-ацетилоксиэтил -4 - (2 - метплфенил) - пиперазин. (4 - Имидазолидинон - (2) - илфенил)1 - метилкарбалюнлоксиэтил -4 - (2 - метплфенил)-пиперазин. (4 - Имидазолидинон - (2) - илфенил)1-этоксиэтил - 4 - (2 - метилфенил)-пиперазин. Аналогично получают соединения формулы I, в которых R означает водород, значения R приведены в таблице.
/7-(СНг
N N /
СНзЗОзН/211 195
/-/-CHOH-CH,-N N
СНз5ОзН/191 223
R
/7-(СНг),К N/
Л-(СНг)
J: /
/7-(CH2)rN N-СбН
л-(СНг)г -N Ж
/-СН -СН-и N
V. V-нО/7-(CH,j),
СН;
-jTl-/
(CHj
г-г
СНз
-(сн,), сн
Продолжение
Кислота/т, пл. или
т. разл. соли, °С
и/или т. пл. основания,
С
СНз50гН/263-265
СНзЗОзН/241
СНз5ОзН/271
СНз50зН/216-217
HCI/299-301 СНз
СНзЗОзН/325
СНзЗОзН/269-271
сн.
HCI/278-280
/ -fCHj -jTjf
СНзЗОзН/2а5-236
R
/7-(CH2),-N N
/7-{СН2)2-S Ы
Л-0-((1Н2)з-Н N
/ )/
10
Продолжение
Кислота/т, пл. или
т. разл. соли, °С
н/нли т. пл. основания,
СНз5ОзН/295-298
СНз5ОзН/255-256
CH,SO,H/175
(СНг) -N N
СНз5О,Н/202
-СНг-СН-/ В
-СНгСН-К N-f Vciij
CHj
-CH,-CH- / к -(
сн.
-СНг-СН-Ы N с,СНя
СНг- СН - N N CU,
СНзЗОзН/248-250
СНз5ОзН/236-238
-СИ,
сн.
CH,SO,H/300-301
СНзЗОзН/218
сг
СНз50зН/275-279
-СНг-СН-N N Cll
СНз50зН/270
Авторы
Даты
1975-11-15—Публикация
1973-11-14—Подача