или зфиро- или амино-связанный полимерный носитель, замещенный алкилом, аралкилом или арилом.
Способ заключаетсй в том, что взаимодействие проводят при добавлении соединений общей формулы
Х
( )
в которой X означает группу С-0, С- или - N - и X и N являются членами 5-6-членного гетероциклического кольца, аннелированного с бензольным ядром и/или содержащего 1 или 2 других, гетероатома; их рК составляет 3,7 - 4,2.
Продукты выделяют известными способами.
Установление значений рК может производиться в 0,5 М растворе в омеси из 6 ч. диметилового эфира диэтиленгликоля и 4 ч. воды при . Если значение рК соединений формулы 1У в таких условиях выше ( К -гидроксипиперидин) или ниже (1-окси-б-нитро-бензотриазол), то их положительное действие снижается. Обычно соединение общей формулы l5 берут в количестве от 0,1 до примерно 1 экв., однако можно также использовать меньшие или большие количества.
Пригодны следующие соединения формулы iv : 1-гидроксибензотриазолы, например 1-ГИДРОКСИ-5,6-димвтилбензотриазол, 1-гидрокси-5-метил7-бензотриазол, 1-гидрокси-6-метил-бензотриазол, 1-гидрокси-5-метокси-ббнзотриазол, 1-гидрокси-4-метил-бензотриазол, 1-гидрокси-б-бром-бензотриазол, 1-гидрокси-6-хлор-бензотриазол, 1-гидрокси-5-хлор-бензотриазол, циклические гидроксамовые кислоты, например пиридоны: 1-гидрокси-2-пиридон, 1-гидрокси-б-метил-2-пиридон, 1-гидрокСи-4,б-диметил-2-пиридон, 1-гидрокси-3,4,6-триметил-2-пиридон, 1-гидрокси-3,5-ДИХЛОР-4,б-димeтил-2-пиpидoн, N -гидрокси-сукцинимид или 1-ГИДРОКСИ-2-ОКСИ-2,3-дигидроиндолы, как 1-гидрокси-б-хлор-2-окси-2,3-дигидро-индол, циклические гидроксамовые кислоты с азотом в качестве гетероатома в кольце, например 3-гидрокси-4-окси-З,4-дигидрохиназолин, 3-гидрокси-2-метил-4-окси-3,4-дигидрохиназолин, З-гидрокси-4-оксо-З,4-дигидро-1,2,3-бензотриазин, 3-гидрокСИ-4-ОКСИ-2-фенил-3,4-дигидрохинаксолин, циклические гидроксамовые кислоты с кислородом или серой в качестве гетероатома в кольце, например пригодные замещенные 4-гидрокси-Я,4-дигидро-3-окси-1,4,2-бензо оксазины и
4-гидрокси-З,4-дигидро-3-6кси-1,4, 2-бензотриазины, или циклические тиогидроксамовые кислоты, на,пример 3гидрокси-4-метил-2,З-дигидро-триазол-2-тион.
В качестве заместителей соединеий формулы IV могут быть использованы алкил- или алкокси-остатки с 1-3 С-атомами, хлор.
Аминокомпонент Ж может использоваться либо свободным, либо как соль инеральных кислот сильных или слабых рганических кислот, например п -тоуолсульфо-, трифторуксусной или уксусной кислоты. Если имеется солеобразование с сильными кислотами, то для освобождения аминогруппы должны обавляться третичные органические основания, кактриэтиламин или N этилморфолин. Также возможйо применение соединений обшей формулы ip в иде соли, например натриевой соли 1-гидроксибёнзотриазола. При этом одновременно освобождается аминогруппа (образование натриевой соли) и образуется необходимое для катализа 1-гидроксисоединение формулы Iv .
В качестве защитной группы Y могут быть использованы обычные в химии пептидов защитные группы. Предпочтительно применяют аралкилоксикарбонил, например бензилоксикарбонил- или треталкилоксикарбонил-, например трет-бутилоксикарбонил-Остатки.
ОН-группа у серина, треонина или тирозина может остаться незащищенной. Но она также может защищаться с помощью пригодных групп, например бутил-или бензилгрупп.
Для получения цистеин- и цистинпептидов должна защищаться SH -группа цистеина при помощи обычных в химии . пептидов SH -защитных групп, или проводиться I реакция симметричных или несимметричных цистеинпептидов, которые затем могут восстанавливаться до цистеинпептидов.
W означает в карбонильном компоненте общей формулы iTj полимерный носитель, который эфирно- или амидообразно связан с карбоксильной группой. В качестве пригодных полимеров можно использовать сшитый с 1-2% ди винилбензрла полистирол, сшитыа diaнолформальдегидные конденсационные продукты, сшитые фенолэфир-формальдагидные конденсационные продукты, покрытые с химически связанным полистиролом пластмассовые поверхности, полибензиловые смолы или фенилзамещенные стеклянные поверхности. Ппигодными группами сцепления являются, например,галогенметил-, галогенацетил- или аминобензгидрилгруппы.
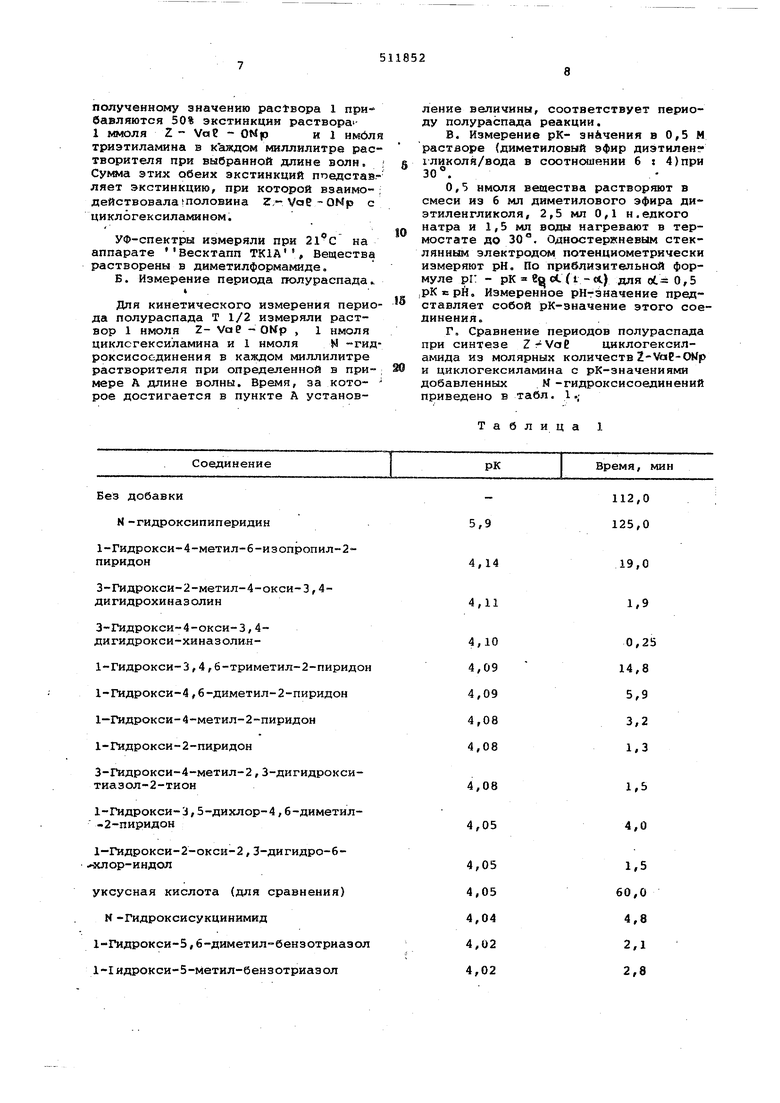
Взаимодействие обычно приводят в астворителях, например диметилфорамиде, диметилацетамиде, тетраметилочевине, или , -диметиламиде осфорной кислоты, в данном случае ри добавлении небольшого количества воды. Реакционная температура 0-40 , преимущественно комнатная. Обработка обычно лроисходит прост так как N -гидроксисоединения общей формулы ly , как 1-гидроксибензотриазол или 3-гидрокси-4-окси-3,4-дигид рохиназолин, г«эгут извлекаться экстр дней при встряхивании в делительной воронке с карбонатом натрия или кали или с содовым раствором. Другие соединения, например 1-гидрокси-2, пир дон или 3-гидрокси-4-метил-2,3-дигид ро-триаэол-2-тион, растворяются в во де и могут легко удаляться. N -гидроксисоединения из тяжелорастворимых производных пептицидов могут экстрагироваться изопропанолом, спиртом, метанолом, тетрагидрофураном или горячей ВОДОЙ. Возникающие при взаимодействии фенолы имеют свойства растворения, аналогичные Ы -гидроксисое динениям и выделяются с ними. При N -ацил-пептид- активных эфи рах добавление N - гидроксисоединений общей формулы IV не вызывает повышения рацемизации. Как при нитрофенил-, так и при трихлорфенил-эфирах нельзя увидеть рацемизации ни с добавкой, ни без добавки N -гидрокси соединений. По другому ведет себя пептахлорфениловый эфир, который дае примерно до 80% рацемизированного трипептида. Путем добавления 1-гидроксибензотриазола эта сильная степень рацемизации могла быть снижена на 26-54%. При добавлении 2-гидрокси пиридин-натриевой соли можно увидеть обратный эффект: рацемизация еще более усиливалась. Путем добавления N -гидроксисоединений общей формулы 1У можно преодолевать пространственное затруднение, которое может мешать взаимодейс вию с активированными эфирами, напри мер при взаимодействии fps изолей цинактивных эфиров с Н-CyS/Tift/- - он . Взаимодействие Np3-iLe-OT ср с H-Cy5(T2t)-set- ьеп - он в диметилформамиде не может проводиться до конца. Через 5 недель опыт прерывается, так как при помощи тонкослойной хроматографии наряду с конечным продуктом и исходным материалом обнаружены многие продукты разложения. Напротив, если добавлен, на пример, 1-гидроксибензотриазол, 3гидрокси-4-окси-З,4-дигидрохиназолин или 1-гидрокси-2-пиридон, реакция за канчивается уже через 15-20 час. Примечание. Вос-трет-бутилоксикарбонил-;Z- бензилоксикарбонил; NpS- о-нитрофенилсульфенил; трет-бутиловый эфир; ОМе- метиловый зфир; бензиловый эфир; ONp- р-нитрофениловый эфир; ОТЬр - 2,4,5-триклорфениловыЯ эфир; ОРср - пентахлорфениловый эфир; OSuN - гидроксисукцинимид-эфир; Tft - тритил; трет-бутил-; Mbh - 4,4 -диметокси-бенагидрил;. СНА - циклогексиламин Применение соединений формулы |У может делать их полезными также в методах пептидной конденсации в твердой фазе. Например, из N -защищенных аминокислот и поли-4-гидрокси-Знитро-стирольной смолы можно получать соответствующие нерастворимые эфиры, которые затем реагируют с растворимыми аминосоединениями в соответствующие амиды или пептиды. Использованием N -гидроксисоединений может быть значительно сокращено время реакции. При измененном методе Маррифилда в твердой фазе, при котором часто используются N -защищенные активные эфиры аминокислот, например нитрофениловый эфир, добавки повышают выход продукта и сокращают реакционное время. В качестве структурных звеньев пептидов принимаются во внимание все аминокислоты в их U -или D -форме, встречающиеся в естественных пептидах. Также возможно применение -аминокислот, например )-аланина, или других, только синтетически или полусинтетически доступных аминокислот, например оС-метил-аланина, 4-метил-3,4-диокси- . L-фенилаланина или -хлораланина. Применением гидроксисоединений в названных сильнополярных растворителях приводит к гелеобразованию, которые из-за их хороших свойств растворения удобны при синтезе высших пептидов. Пример 1. Определение периода полураспада при синтезе циклогексиламида из молярных количеств Z VaЕ ONp и циклогексиламина при добавлении различных N -гидроксисоединений и зависимости периода полураспада от рК-значения N -гидроксисоединений . А. Установление периода полураспада . Раствор 1 : 0,5 нмоля циклогексиламина, 0,5 нмоля р-нитрофенола и 1,0 нмоль N -гидроксисоединения на 1 мл диметилформамида. Раствор и : 1,0 нмоль р-нитрофенола на 1 мл диметилформамида. Раствор Tl : 1,0 нмоль К-гидроксисоединения на 1 мл диметилформамида. Сравнивают УФ-крив е (рбласть 330300 м) растворов I ,11 и Ш , чтобы обнаружить благоприятные длины волн для измерения р-нитрофенола. При этой длине волны измеряется экстинкция, К полученному значению раствора I прибавляются 50% экстинкции раствора1 ммоля Z - VaP - ОМр и 1 нмбл триэтиламина в каждом миллилитре рас творителя при выбранной длине волн, Сумма этих обеих экстинкции ппедстав.ляет экстинкцию, при которой взаимодействовала половина ZT-Vag-ONp с циклогексиламином. УФ-спектры измеряли при 21 С аппарате Весктапп ТК1А, Вещества растворены в диметилформамиде. Б. Измерение периода гтолураспада Для кинетического измерения перио да полураспада Т 1/2 измеряли раствор 1 нмоля 2- Vae - ОМр , 1 имел я циклсгексиламина и 1 нмоля N гид роксисоединения в каждом миллилитре растворителя при определенной в примере А длине волны. Время, за которое достигается в пункте А установление величины, соответствует периоду полураспада реакции. В. Измерение рК- значения в 0,5 М растворе (диметиловый эфир диэтиленхликоля/вода в соотношении б : 4)при 30°. О,5 нмоля вещества растворяют в смеси из б мл диметилового эфира диэтиленгликоля, 2,5 мл 0,1 н.едкого натра и 1,5 мл воды нагревают в термостате до 30°. Одностеркневым стеклянным электродом потенциометрически измеряют рН. По приблизительной формуле рг: - рк гцс.(1 -л) для oL 0,5 ,рК рН, Измеренное рНгэначение представляет собой рК-значение этого соединения. Г. Сравнение периодов полураспада при синтезе циклогексиламида из молярных количеств2-VaE-OMp и циклогексиламина с рК-значениями добавленных М -гидроксисоединений приведено в табл. 1.; Таблица 1













| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ИМИДАЗО[1,5-А]ПИРИДИНА КАК ИНГИБИТОРЫ СЕРИНПРОТЕАЗ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1996 |
|
RU2175327C2 |
| Способ получения -пироглутамил -гистидил- -пролинамида | 1971 |
|
SU515447A3 |
| Способ получени -лейцин-13-мотилина | 1976 |
|
SU593659A3 |
| Способ получения пептидов | 1970 |
|
SU439967A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ПЕПТИДАМИДОВ ИЛИ ИХ ФИЗИОЛОГИЧЕСКИ СОВМЕСТИМЫХ АЦЕТАТОВ ИЛИ ГИДРОХЛОРИДОВ | 1991 |
|
RU2036200C1 |
| ЗАМЕЩЕННЫЕ 5-ЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2151143C1 |
| Способ получения полипептидов или их солей | 1977 |
|
SU910116A3 |
| Способ получения октапептидов | 1981 |
|
SU993816A3 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ КАРБОНОВОЙ КИСЛОТЫ И ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1994 |
|
RU2145959C1 |
| Способ получения производных феноксиалкилкарбоновых кислот или их солей | 1975 |
|
SU674670A3 |

З-Гидрокси-4-окси-З,4дигидрокси-хиназолия1-Гидрокси-3,4,6-триметил-2-пиридо 1-Гидрокси-4,6-диметил-2-пиридон 1-Гидрокси-4-метил-2-пиридон 1-Гидрокси-2-пиридон
3-Л1Дрокси-4-метил-2,3-дигидрокситиазол-2-тион
1-Гидрокси-3,5-дихлор-4,б-диметил-2-пиридон
1-ГИДРОКСИ-2-ОКСИ-2,3-дигидро-б зслор-индол
уксусная кислота (для сравнения)
М-Гидроксисукцинимид 1-ГИДРОКСИ-5,6-диметил-бензотриазо 1-1идрокси-5-метил-бензотриазол
0,25 14,8 5,9 3,2 1.3
1,5 4,0
1,5 60,0 4,8 2,1 2,8 Пример 2. Получение исходных продуктов. А. HBV H-PhG - ОКГр 4,2 г Z- РП& - ONp суспендируют в 10 мл ледяной уксусной кислоты. За тем добавляют 10 мл насыщенной HBV ледяной уксусной кислоты и перемешивают один час при комнатной температуре. Затем высаживают гидробромид большим количеством эфира и после этого хорошо промывают эфиром. Выход продукта 3,5 г; т.пл. 216-218°С. Б. HBV H-Phe - OP 5,47 г 2 -рне -ОР обрабатывают аналогично примеру А. Выход продукта 4.1г; т.пл. 205°(разложение). В. HBV Н - РИе - ОТ . 4,78 г Z-Pne - ОТ обрабатывают аналогично примеру А. Выход продукта 4.2г; т.пл. 220 (разложение). Г. -Phe -Ot 2,49 г Вое- Len - OH-IH O растворяют в уксусном эфире. Уксусный эфир сушат сульфатом натрия, концентрируют и остаток сушат в глубоком вакууме. Остаток растворяют в 20 мл абсолютного тетрагидрофурана и раствор охлаждают до -10°. При перемешивании и охлаждении льдом прикапывают 1,2 мл N -этилморфолина и затем раствор 1,27-г изобутилового эфира хлормуравь иной кислоты в слегка охлажденном тетрагидрофуране. Перемешивают 10 мин при - 10° , затем добавляют 3,35 г НВр-Н - Phe - ONp и медленно приПродолжение табл. 1 капывают раствов 1,2 мл N -этилморфина в 5 мл тетрагидрофурана. Перемешивают еще 1 час при 0° и 1 час при комнатной температуре, отсасывают осадок, концентрируют фильтрат и остаток растирают с изопропанолом. Выход продукта 3,77 г; т.пл. 150 - 152. После перекристаллизации из изопропанола : выход 3,10 г; т.пл. 152-153 : ,2 (, в диматилацетамиде) . Д. Вое-йен - phe - ОРср . Из 1,97 г Вое-Ьеп , 0,93 мл N-этилморфолина 1,0 г изобутилового эфира хлормуравьиной кислоты аналогично примеру Г получают смешанный ангидрид, который взаимодействует с 3,55 г HBV- Н - Phe - и 0,93 МП К этил морфолина. Выход продукта 3,35 г; т.пл. 145-147° . После перекристаллизации из изопропанола ; выход 2,11 п т.пл. 163-164 ; ctjj, - 29,1 (с 1, в диметилацетамиде). Е. Вое -ьеп - Phe - ОТср Из 2,3 г Бос - Len -OH-IH O, 1,1 мл N -этилморфолина и 1,17 г изобутилового эфира хлормуравьиной кислоты получают смешанный ангидрид, который превращают с 3,6 г HBV H-Phe-( и 1,1 мл К-зтилморфолина. Выход продукта 3,7 г; т.пл. 143-145 ле перекристаллизации из изопропанола выход 3,2 г т.пл. 150-151°, 6L -48,4 (с, диметилацетамиде). Способ получения Boc-ueti-Phe-i-VaBOBt Вое - Ьел РИе - активных эфиров.
К раствору 105 мл (0,5 ммолей) Hte-H-Vae-OBu в 2,S МП 0,2 М Ы-этилморфолин/дилаетилацетамид раствора добавляют катализирующую добавку {1-гидроксибензотриазол или 2-гидрокси-пиридина натриевую соль) и 0,5 ммоля соответствующего Вое-uen-Piieактивного эфира (250 мл Boc-ben-Phe-ONP, 313 мг Вое-Len - Phe- OP , 279 мг
Вое- ten -ОТ ). Оетавляют стоять определенное время, разбавляют 50 мл ук2-Гидрокси-пиридина
ON р
3-Гидрокси-4-окси-3,4дигидро-диназолин
Пример 3. Синтез Nps-iEe-Cys (Totj-Sei.l.en - ОН
А. ПолучениеWps - JCe активного эфира.
Молярное количество Nps - изолейцина и трихлорфенола соответствующего- N -гидроксисукцинимида подвергают взаимодействию в уксусном эфире при 0° с небольшим избытком дициклогексилкарбодиимида (ДЦК). Перемешивают 1 час при о , затем 3 часа при
сусного эфира, эфирный раствор экстрагируют в делительной воронке МаНСОг-KHSO -, NaHCOj- и NACI - раствором, сушат сульфатом натрия и концентрируют. Остаток парционально гидролизуют, трифторацетилируют и газохромаграфируют.
Результаты газохроматографического определения рацемизации приведены в табл . 2 .
Таблиц
70 час
2
10 мин
1,0
комнатной температуре, отсасывают осадок и фильтрат концентрируют. Остаток перекристаллизовывают из изопропанола.
Nps - iEe - ОТ ; т.пл. 9597.
Nps - iEe - 0; т.пл. 105-108° Б. Nps- iEe - Cys/TvtJ - sev-l,««- ОН 2,9 г ммолей) H-Cys(Tv-t -Sev-l,en OHHgO и 8 мг (5 ммолей) 1-гидрокси5,6-диметил-бензотриазола растворяют в 25 МП диметилформамида. К нему добавляют 2,32 г (5 ммолей)Мрз-1 е-ОТс р. и оставляют стоять 1$ час при комнатной температуре. Исходный трипептид не был обнаружен с помощью тонкослой ной хроматографии. Диметилформамид отгоняют в вакууме и остаток растворяют с раствором бикарбоната натрия. Осадок растворяют в уксусном эфире и извлекают в делительной воронке с раствором KHS04 и водой. Остаток растирают с эфиром. Продукт аморфный. Ег выход 3,6 г (82% от теоретического); toC - 23,5° (с 1, Б диметилацет амиде). В. Исследование с помощью тонкослойной хроматографии синтеза KpS-iEeN - гидроксисоединение
Эфир
OSU
3-Гидрокси-4-окси-3,4-дигидро-хиназолин
1-Гидроксибензотриазол 3-Гидрокси-4-окси-3,4-дигидро-хиназолин
3-Гидрокси-2-метил-4-окси-3,4-дигидро-хиназолин
3-Гидрокси-4-окси-2-фенил-3,4-Дигидрот
ср хиназолин
1-ГИДРОКСИ-5,6-диметил-бензотриазол 1-Гидрокси-2-пиридон 1-Гидрокси-4-метил-2-пиридон 1-ГИДРОКСИ-2,4-диметил-2-пиридон
Пример 4. Состав 2-Phe-VaE-OM А. С 1 экв. 1-Гидроксибензотри. азола и 2 - Phe - ОРср
К раствору 0,92 г (5,5 ммоля) нее - Н - Vae - оМе, 0,72 мг N этилморфолинаи 675 г (5 ммолей) 1гидроксибензотриазола в 10 мл диметилформамида добавляют 2,75 г(5 ммолей) 2.- Phe - OP . Смесь перемешивают 5 мин, концентрируют в глубоком вакууме, распределяют остаток между уксусным эфиром и 2 Н.раствором соды извлекают в делительной воронке один
Конец реакции (реакционное время)
Прервана через 5 недель, т.к. не было установлено полного превращения
То же
Примерно 15 час То же
npHjvepHo 7 дней
То же
Примерно 20 час То же То же Примерно 4 дня
раз с раствором KHSO, три раза с 2н. раствором соды и один раз с водой, сушат с сульфатом натрия, концентрируют и остаток растворяют с петролейным эфиром. Выход продукта 2,08 г; т.пл. 99-104. После перекристаллиза ции из смеси уксусный эфир/петролейный эфир; выход 1,7 г (83% от теоретического); т.пл. 112-114°.
Б. С 0,1 экв. 1-гидроксйбензотриазола и Z-Plie-OTcp
К раствору 0,92 г (5,5 мг«хпей) нее-Н Vae - ОМе , 0,72 мл -этилморфолина и 67,5 мг (0,5 ммоля) 1-CysfJVtl-Sev-Len-да uj NpS- ee-OTcp соответствующего Npg - ICe - osu и H-CyslTvtl-Sev - ben -OH К раствору 116,3 мг (0,2 ммоля) Н -C4S|Tvi|-Sev-ue«-oH-H Oв 2 мл диметилформамида добавляют 0,2 ммоля К -гидроксисоединения и 111 мг 0,22 /NPS - Ite - 89,2 мг (0,25 ммоля) NpS - its - OSw . Через различные промежутки времени на пленочную силикагельную пластину наносят одну каплю реакционного раствора. Опускают в смесь метиленхлорид/метднол (8 : 2) и выделяют ангидрином.В табл.3 приведены результаты этого исследования. Таблица 3 -гидроксибензотриазола в 10 мг димети формамида добавляют 2,4 г (5 ммолей) Z - Phe - ОТср .. Перемешивают 5 мин и работают до выхода продукта 1,66 г (81% от теоретического); т.пл. 112-114° . В. С 1 экв. 1-гидроксибензотриазо натриевой соли и Z-Phe - ONp . К раствору 0,92 г (5,5 ммолей) НСЕ - Н Vae - ОМе в 10 мл диметилформамида добавляют 865 г (5,5 ммолей) натриевой соли 1-гидроксибензотриазола и 2,1 г (5 ммоля) Z-Phe-ONp . Переме шивают 5 мин и работают по примеру А до выхода продукта 1,65 г (80% от те оретического); т.пл. Иб . Пример 5. Синтезг-Vae-Vcte-OM К раствору 0,92 г (5,5 ммолей) нее-Н - Vae - оме в Ю мл диметилфор мамида добавляют 865 г (5,5 ммолей) 1-гидроксибензотриазол-натриевой сол и 1,87 г (5 ммолей) Z-VaB - QNp . Сме перемешивают 5 мин и работают по при меру 4А до выхода 1,66 г (91% от тео ретического); т.пл. 108-110° С. Пример 6. Синтез 2-ben-§Ei,i(OBu -Asrj( Tyv(BiJ)-OH (ряд из инсулин-А-цепей). 1. Z-Lieii- u(OBu)-flsn (Mbh)- Tyv(Bu) - ОН К раствору 1,53 г { 2 ммоля) Н - §eu(OBti)- 8nfMbii)-Tyv(Bu) - он и 270 мг ( 2 ммоля) 1-гидроксибепзотриазола в 5 мл диметилформамида добавляют 1,5 г (2,2 ммоля) 2 - uen - ОР,, позволяют 10 мин стоять и концентрируют в глубоком вакууме. Остаток рас тирают с 2 Н.раствором соды. Раствор отстаивают, остаток растирают с водо затем отсасывают. Фильтруекий материал распределяют между 2,5%-ным -раствором и уксусным эфиром. Эфирный раствор сушат и концентрируют. Остаток растирают со смесью эфир/петролейннй эфир и отсасывают. Выход продукта 1,8 г (89% от теоретического); т.пл. 174-176°. Это соединение по тонкослойной хроматографии является идентичным пробе, которая получена cz-Uen-OSu Время реакции 24 час; выход 84%. Разный результат получают при применении З-гидрокси-4-окси-З,4-дигидроксихиназолина, 1-гидрокси-5,6диметил-бензотриазола или 1-гидрокси пиридона вместо 1-гидроксибензотриазола. И. Получение исходного вещества H-getj(OBu)- Asn(Mt)h) -Tyv(Btj-t)-OH A.Z-Asri(Mbh)-Tyv(BtJ)-он 100 г (0,138 ммоля)2-Азп(Мьп)-TkjYfBu)-OH суспендируют в смеси из 770 мл дио.сана и 200 мл воды. При 37 медленно прикапывают 138 мл 1 н.раствора едко го натра (тимолфталина в качестве индикатора). По окончании реакции подкисляют с 300 мл 2 н.раствора лимонной кислоты. Выпавший продукт отсасывают и промывают водой. Переосаждают из смеси метанол/вода. Выход продукта 88 г (90% от теоретического) ; т.пл. 212-213° (.р + 7,6. (с 1, в диметилформамиде) . Б. Н - A$h(Mbh) - Ту vlSut) - ОН Через раствор 87,5 г (0,123 моля) г-А8п(мьй) -TyvvBu)- он в ледяной уксусной кислоте, к которому добавляют немногоР6б(он)2 /Ва5О катализатора водород пропускают до тех пор, пока не прекратится образование COj . Концентрируют и растирают остаток основательно с насыш.енным раствором ацетата натрия. Отсасывают, сушат над PjOj и высаживают из смеси тетрагидрофуран петролейный эфир. Выход продукта 63,5 г (90% от теоретического); т.пл. 207-209° . + 11,1° (с 1, в ледяной уксусной кислоте). В .Z-geu(OB и-) - AsTi(Mbh) - Tyv(Bu-) - ОН К раствору 63 г (0,109 моля) H-Asn(Mbti)-Tuv(But) ОН а 250 мл диметилформамида добавляют при комнатной температуре 47,4 г (0,109 моля) 2-gExj(OB и) -OS;j и отстаивают в течение 20 час при комнатной температуре. Затем вещество высаживают водой, сушат над пересаживают из смеси уксусный эфир/ петролейный эфир. Выход продукта 75,5 г (77% от теоретического); т.пл. 166-170°; oCjj, + 1,80°(, в диметилформамиде). Г. Н -geij(oBu j-Asn()-Tuv() он 74,7 г (83,9 ммоля) (OBu) -ASn(Mbh) - TyvfBu }OH растворяют в смеси из 400 мл ледяной уксусной кислоты и 400 мл метанола и по примеру Б каталитически гидрируют и перерабатывают. Для очистки вещество один раз кипятят с водой, отсасывают и сушат. С помощью кипения с уксусным эфиром вещество можно очистить лучше. Выход продукта 53,4 г (84% от теоретического); т.пл. 221-223°; d- 33,1° (с 1, в ледяной уксусной кислоте). Пример 7. Синтез Z-gCt( en-Vae-NHj (ряд из секретина). А. Z-Len -Vae - раствору 13 г (66 ммолей)НВУНх KgE- ЫН в 180 мл диметилформамида добавляют 8,91 г 1-гидроксибензотриазола, 8,6 мл М -этилморфолина и 30,8 г (60 ммолей) Z-beti-ОРср . Смесь перемешивают 10 мин при комнатной температуре и затем концентрируют в глубоком вакууме. Остаток размешивают последовательно с 2 н.раствором соды, водой, 2,5%-ным раствором и водой, отсасывают и сушат при 50 над PjOg. Выход продукта 21,3 г (98% от теоретического). Такой же результат получают при применении 3-гидрокси-окси-З,4-дигид рохиназолина, 1-гидрркси-5,6-диметил бензотриазола или 1-гидроксипиридона вместо 1-гидроксибензотриазола. Б.НСе-H-Len-VaE -NHj. К суспензий 21 г (Ь7,8 ммолей) Z-ben-va6 - MHj в смеси из 200 мл диметилформамида и 200 мл метанола добавляютРс1;(ОН)2 B3SQ4 ката лизатор. При перемешивании через реакционную смесь проводят водород, причем прикапыван|4ем 1 н.метанольного раствора НС2 вьвдерживают рП 5 с помощью автотитратора. После того, как, больше не воспринимается НСЕ раствор, отсасывают катализатор и концентрируют фильтрат. Остаток растирают с эфиром, отсасывают и сушат при 50° . Выход продукта 15,4 г (100 от теоретического); т.пл. 138-140°, Продукт по тонкослойной хроматографи однообразный. В. Z-gEy- Ье-п - Vae -NH 15,4 г (57,8 ммолей)HCB-H-Len-Vae-NH растворяют с 7,52 мл N-этилморфолина и 7,88 г 1-гидроксибензотриазола в 120 мл диметилформамида. К этому добавляют 22,5 г Z -gfu - ОТ , смеси дают стоять 5 мин и концентрируют с глубоким вакуумом. Остаток растирают с 2 н.раствором соды, отса сывают и промывают водой. Сушат над Р„О с и затем кипятят с уксусным эфиром. Для очистки можно переосаждать из смеси тетрагидрофуран/петролейный эфир. Выход продукта 21,8 г (90% от теоретического); т.пл. 184-186° ; oi..jj - 12,8 (, в димети ацетамиде). Г. НСЕ - Н -gfiy - Len -Vae - NHj 20,0 г (47,6 ммолей )Z-(g y-uen-VoE - NHj гидрируют в 200 мл смеси метанол/диметилформамид (1:1) и перерабатывают. Вещество несколько гигроскопично и для очистки его переосаждают на. смеси метанол/эфир. Су шат над РЗ-з парафиновыми обрезка ми. Выход продукта 13,5 г (88% от те оретического); т.пл. 209-211°. fl.z-gEu-ge -uen- Vae -ынз К раствору 3,23 г (10 ммолей ) Hte-H-qeu-L,en--vaE - NHj. 1,3 мл К -этилморфолина и 1,35 г (10 ммолей) 1-гидроксибензотриазола в 20 мл диметилформамида добавляют 4 г (10 ммолей)2.- Еи-ONp и позво ляют стоять 10 мин. Выпадает студень Разбавляют с зфиром, высадившееся вещество отсасывают, быстро сушат и перемешивают с 2 н.раствором соды. Промывают водой, раствором и водой, сушат над PjOg и кипятят с ук сусным эфиром. Охлаждают до комнатно температуры, отсасывают и промывают уксусным и петролейным эфирами. При 40-50° сушат над PjO и обрезками парафина. Выход продукта 5 г ( 91% от теоретического); т.пл. 242-244 ; d. - 25,2° (с-1, в ледяной уксусной кислоте). Такой же результат получают при использовании 3-гидрокси-4-окси-3,4дигидрохиназолина, 1-гидрокси-5,6диметил-бензотриазола или 1-гидроксипиридона вместо 1-гидроксибензотриазола. Пример 8. Синтез Z-Pf О- ее-рВу41Н А. iee- gey - NH 44,4 г (0,1 моля)2-1Ее-ОТср и 11 г (0,1 моля) нее - Н -Qey-NfHj растворяют вместе с 1,6 г (10 ммоля) 3-гидрокси-4-окси-З,4-дигидрохиназолина и 130 мл N -этилморфолина в 700 - 800 мл диметилформамида. Затем концентрируют в глубоком вакууме и остаток растирают с раствором бикарбоната натрия, отсасывают, промывают водой, сушат и для дальнейшей очистки растворяют в диметилформамиде и высаживают смесью зфир/петролейный эфир (1:1). Выход продукта 28,5 г; т.пл. 202°; COL jj - 8,1°(с 1, диметилацетамид) . Вычислено, %: С 59,80; Н 7,21; N 13,08 C,.Hj, М О (мол. в. 321,4). Найдено, %: С 59,6; Н 7,2; N 12,8 B.Z-PvO - lee -gSy-NHj.. К раствору 20 г (62,2 моля ) 2-iee-q;Ey- NH и 60 мл метанол/диметилформамид (3:1) добавляют немного pi (ОН)2 ВаЗОд - катализатора. При перемешивании через эту реакционную смесь пропускают водород, причем прикапыванием 1 н.метанольного раствора HCf с помощью автотитратора вьщерживают рН 4,5. После того, как больше не воспринимается НС8 раствор, отсасывают катализатор, и фильтрат концентрируют. Остаток растворяют в 100 мл диметилформамида. К нему добавляют 23 г ( 62 ) Z-PvO-ONio, 8,1 мл N -этилморфолинами, 1,5 г (9,4 ммоля) 3-гидрокси-4-окси-З , 4-дигидрохиназолина.- Смесь перемешивают 15 мин и концентрируют в глубоком вакууме. Остаток поглощают уксусным зфиром и охлаждают. Выпадает осадок, который отсасывают и последовательно растирают с раствором бикарбоната натрия, 2 H.HCf и водой. Сушат и для дальнейшей счистки хсрошо растирают с уксусным эфиром, отсасывают и сушат. Выход продукта 20,7 г (80% от теоретического); т.пл. 182-184°; ot - 63,2 (с 3 1, метанол). Такой же результат получают при применении 1-гидрокси-4-метил-2-пиридона, 1-гидрокси-6-метокси-Вензотриазола или 1-гидрокси-5-метил-бенэстриазола вместо производного хиназолина.
Пример .9. Синтез Z-Asp(Obu j-Phe - Vae-gEu-Tpp-ueu-iEe - Asn-ThvfBu)OBu
CHj СООН.Н -Phe-Vae- eu-Tvp-ueu-jee-ASH-Thv|8u
A.Z-A&n-Tnv()-OBtjt.
42,85 г (161 ммолей) г - Asn -ОН, 43 г (161 ммолей) маслянного НСе-Н-Thv(But)-obtJt , полученного путем каталитичьского гидрирования 2-Thv{But)-OBut, при добавлении метанольного НСЕ при рН 4,5 и 21,75 г (161 ммолей) 1-гидроксибензотриазола растворяют в 325 м диметилформамида. Добавляют 21 мл
N-этилморфолина и при 0° охлажденный раствор 35,45 г дициклогексилкарбодиимида в 80 мл диметилформамида. Перемешивают 1 час при 0° и 1 час при комнатной температуре, отсасывают осадок и концентрируют фильтрат в глубоком вакууме. Остаток распределяют между уксусным эфиррм и растворсм ЫаНСОз. Органическую фазу экстрагируют в делительной воронке с 2,5%ным раствором KHS04 , насыщаемым раст вором HaHOOj и водой, сушат сульфатом натрия и концентрируют. Растворяют с петролейным эфиром и отсасывают. Выход 65,8 г, т.пл. 110-115°. Перекристаллизовывают из скеси уксусный, эфир/петролейный эфир. Выход продукта 52,4 (68% от теоретического); т.пл. 120-122°; С оС д - 7,6°(, метанол).
B.HCEH-ASn-Thv(But)-OBut.
К раствору 44,7 г (93,2 ммоля) 2-Aan-ThV(But)-OBut в 300 мл метанола добавляют немного Pd(ОН),, катализатора. При перемешивании через эту реакционную смесь пропускают водород, причем путем прикапывания 1 н. метанольной соляной кислоты с помощью автотитратора выдер 1:ивают рН 4,5. После отфильтровывают от нерастворимых и на ночь устанавливают в холодильник. На следующий день отсасывают выпавший осадок и промывают эфиром Выход продукта 33,65 г (95,6% от теоретического); т.пл. 110-113°; о( - 2,6°(с-1, метанол).
Вычислено, %: С 50,32; Н 8,45; N 11,01.
CjgHjjNjOjCe (мол.в. 382) .
Найдено, %: С 50,0; Н 9,0; N10,9.
В. Z-iEe--Asn-Thv(flut)-OBufc
К раствору 21,8 г (82 ммоля)г-1Ее-ОН, 31,3 Г (82 ммоля)Hce-J(sh-Tliv(Eiut)OBut гидрокситриазола и 10,7 мл Ы -этилморфолина в 150 мл диметилформамида добавляют при 0° охлажденный раствор 18,1 г дициклогексилкарбодиимида в 70 мл диметилформамида. Перемешивают 1 час при 0°и 1 час при комнатной температуре по примеру А. Конечный продукт растворяют в 150 мп уксусного эфира, отфильтровывают нерастворимые остатки и разманивают в 750 мл петролейного эфира. Выход продукта 42,37 г (87% от теоретического); т.пл. 144-146 ; о(. ,5 (, метанол).
Вычислено, %: С 60,82; Н 8,14; М9,46
Cjo Og (мол. в. 592,75) Найдено, %: С 60,9; Н 8,4; N 9,2. Г .нее н- lee -Asn - Thv (Bu) - Oflu 38,6 г (65,2 ммoлeй)г-iEe-ДSf -Thv () каталитически гидрируют по примеру Б в метаноле. Вещество растворимо в эфире и под высоким вакуумом дает аморфный продукт. Выход продукта 33,2 г (100% от теоретического); oi-p - 5,9 (, метанол).
Вычислено, %: С 53,37; Н 8,76; Ы 11,31.
CjjH., СЖЛ (мол. в. 495,07) Найдено, %: С 53,0; Н 9,0; N10,9 . Д. 2-Len-iee-Asn-Thv(Btj)OB« К раствору 16,4 г (61,8 ммоля) Z- ьеп - он , 30,6 г (61,8 ммоля) нсен-iEe-Asn-TnvfBut)-OBtj , 8,34 г 1-гидроксибензотриазола и 8,1м
N -этилморфолина в 150 мл диметилформамида добавляют при 0° холодный раствор 13,6 г дициклогексилкарбодиимида в 60 мл диметилформаг/шда. Перемешивают 1 час при 0° и 1 час при комнатной температуре и перерабатывают по примеру А. Вещество растирают с петролейным эфиром и отсасывают. Выход 39,3 г; т.пл.173-176°. Высаживают из смеси уксусный эфир/петролейный эфир. Выход продукта 37,5 г (86% от теоретического); т.пл. 173--76° ;
50 В
- 34,3 (, метанол).
Ы
Вычислено, %: С 61,26; Н 8,42; N 9,92
Cj H gNjOg (мол. в. 705,9) Найдено, %: С 61,4; Н 8,7; N9,9. Е. нее - Н -Len-iee- srt -Thv/B-u JOBu
35,2 г (50 ммолей)2-ьеп-)Ее - Asnhv-fBu ; - OHu гидрируют по примеру Б каталитически в метаноле. Вещество кристаллизируется при растирании с эфиром. Выход продукта 28,6 г (94% ОТ теоретического); т.пл. 192-193 (разложение); 9 (с 1, метанол).
Вычислено, %: С 55,26; Н 8,96; N 11,51.
(мол. в. 608). Найдено, %: С 55 , 3; Н 9 , 0; N 11.. 4 Х, Z-Tvp-ьеп - Ite -А5Я-7nv(But)-oeu К раствору 26,2 г ( 43,1 ммоля) ее-H-ben-iBe-А п- Thv fBu)-OBu 14,6 г (43,1 ммолк) Z-Tvp-OH , 5,82 г 1гидроксибензотриазола и 5,6 мл этилморфолина в 150 мл диметилформаида добавляют при О холодный раствор 9,5 г дициклогексилкарбодиимида в 60 мл диметилформамида. Перемешивают 1 час при 0° и 1 час при комнат ной температуре, отсасывают от осадка и фильтрат концентрируют. Остаток растирают с раствором ЫаНСОз , отсасывают и сушат. Перекристаллизовывают из изопрс панала. Выход продукта 33,8 г (88% от теоретического); т.пл. 228-229°; j° - 39,5 (с.1, метанол).
Вычислено, %: С 63,23; Н7,79; Ы10,99
С47 HjjgN O,,, (мол. в. 892,1) Найдено, %: С 63,0; Н 7,8; N10,7. 3. HCe-K-Tvp-be«-iee-Asn-Thv(uut)-oBtj 31,2 г (35 ммолей)2-Гур-иеп-lee-AsiiThv 4 -дай каталитически гидрируют в 200 мл смеси диметилформамид/метанол (1:1) по примеру Б. Остаток растирают с эфиром. Выход продукта 27,2 г (98% от теоретического); т.пл. 215° ( разложение ); с.-28,0 (с 1, метанол).D
Проба переосаждается из смеси метанол/эфир; т.пл. 217 (разлоксение) ; ct - 28,4° (, метанол). Вычислено, %: С 58,97; Н 8,12;
N 12,34
CjgHg M OgCE (мол. в. 794,45) Найдено, %: С57,2; Н 8,2; Н 11,8. И. Z-Phe - vaE-. ОН
10,7 г Z-PVie - VcsE - ОМе растворяют в 200 мл смеси дюксан/вода (68:2). Титруют с 27 мл 1 Н.раствора NaOH .с тимофталеином. Нейтрализуют с 2 н.рас вором нее и раствор концентрируют. Остаток распределяют между уксусным эфиром и 2 Н. ней. Уксусно-эфирную фазу промывают водой, сушат с сульфатом .натрия и концентрируют. Остаток растирают с эфиром и отсасывают. Выход продукта 9,45 г (92% от теоретического); т.пл. 148-149°. Переосаждают из смеси уксусный эфир/пб:Тролейный эфир; выход 9,2 г; т.пл. 148-150 ; с(.д° - 8,8° (, метанол).
Вычислено, %: С 66,32; Н 6,58; N 7,02.
Сгг (мол. в. 398,5) Найдено, %: С 6б;б; Н 6,7; К 7,2 К. 2- Phe-Vae - gEu - OBut К раствору 8,0 г (20 ммолей) г-Рйе-VaE OH 4,8 г нСГН- би-ОБо 2,7 г 1-гидрокситриазола и 2,6 мл
N -этилморфолина в 40 мл диметилформамида добавляют при О холодный раствор 4,2 г дициклогексилкарбодиимида. Перемешивают 1 час при О и 1 час при комнатной температуре, отсасывают от осадка и фильтрат концентрируют. Остаток растирают с раствором ЫаНСОз, отсасывают и промывают . водой.
Выход продукта 11,65 г (100% от теоретического), т.пл. 219-221 (разложение); oi-lj - 35,7 (с 1, метанол).
Вычислено, %: С 63,91; Н 7,27; N 9,60
С5, в. 582,7)
Найдено, %: С 64,2; Н 7,7; N9,7
Л. 2:-Pi e-Va9-geu - ОН
11,1 г (19 ммолей)г-Р е-Уае-§Ег4-0 ирастворяют в 30 мл трифторуксусной кислоты. Через 30 мин при комнатной температуре концентрируют и остаток растирают с эфиром и отсасывают . Продукт для дальнейшей очистки кипятят с уксусным эфиром, смешивают с петролейным эфиром, отсасывают и сушат. Выход продукта 8,45 г (85% от теоретического); т.пл. 225-227°; С Л - 10,7° (, диметилацетамид) .
Вычислено, %: С 61,59; Н 6,51; N 10,64
Hj N О, (мол. в. 526,7).
Найдено, %: С 61,6; Н 6,7; N10,4
M.Z-Phe-Vae - etj-Tvp- ье-n- 1ее-Л5Пт TkvfBu) - OBv .
К раствору 7,95 г (10 ммолей) .HOe-H-Tvp-Len- iEe-Asn-ThvfBu l-OBu ;,. 5,27 г (10 ммолей) Z-PVie-Vae-gEu-QH Е 100 .-мл диметилформамида добавляют
1 час при о и 1 час при комнатной температуре. Осадок отсасывают и фильтрат концентрируют. Остаток растрают с раствором NаНСОз и отсасывают. Осадок фильтрования кипятят с 1 л этанола. Труднораствориь-ий остаток 5,6 г, т.пл.253-255° (разложение); ll° - 15,3° (с 1, диметилацетамид) . Из спирта выкристаллизовывают 2,8 г; т.пл. 251-254° (разложение). Общий выход продукта
Ы 12,16.
(мол. в. 1266,6)
-Бй QS
О
N..
S
Найдено, % : с 62,2; Н 7,9; N11,9.
H.CHjCOOH-H-Phe VaB- Eu-Tvp- ьеэт -iEe-Asn-Tnvfau)-ОВи .
Через раствор 7,6 г (6 ммолей) Z- Phe Vae- gEu - Tvp - uen- iEe -Asn-T}iv( в 250 мл ледяной уксусной кислоты, к которому добавляют катализатор Pd(OH)2baSO , пропускают водород до прекращения образования COj . Катализатор отсасывают, фильтрат концентрируют и остаток растирают с эфиром. Выход 7,4 г, т.пл. 247-250°(разложение) . Продукт кипятят с уксусным эфиром и отсасывают на холоду. Выход продукта 6,78 г (95% от теоретического); т.пл. 248-251 (разложение).
O.Z-Asp(OBut)-Phe-Vote- giEu-Tvp- uen- iEe - Л s« - тмv(Btit) - OBtjt
К суспензии 6,32 г (5,3 ммолей) CHjCCXM-Н-Phe-Vh е-gEu-Tvp - ьеп-1ее-Л5п{Ви)-ОВи 150 мл диметилформамида добавляют 0,86 г (5,3 ммоля) З-гидрокси-4-окси-3,4-дигидрохиназолина в 2,66 г (5,3 ммоля) 2 - AstitoBu) -ОТср. После 5 мин перемешивания концентрируют и остаток растирают с 2 и.содовым раствором, отсасывают и промывают водой. ФильтровальныП остаток отпаривают с метанолом. Труднорастворимый остаток : 5,3 г, т.пл. 246-248(разложение) ; из фильтрата : 0,5 г; т.пл. 244-246 (разложение) ,o (, диметилацетамид). Общий выход продукта 5,8 г (76,4% от теоретического) Вычислено, %: С61,8;Н7,57; N11,69 . 74 «й (мол. в. 1437,7)., Найдено, %: С 61,1; Н 7,6; N11, Такой же результат получают при применении 1-гидрокси-4-метил-2-пиридона, 1-гидрокси-6-метокси-бензотриазола или 1-гидрокси-5-метил-бензотриазола вместо производного хиназолина. Пример 10. Синтез2-РЬе-Уае-ОМе 2 г 2-фенилаланин-поли-4-гидрокси-3-нитростирольной смолы (содержит 3 ммоля Н-фенилаланина) суспендируют в 5 мл диметилформамида и смешивают с 162 мг (1 ммоля) 3-гидрокси-4-окси-З,4-дигидрохиназолина, 168 мг (1 ммоль)Нсе-Н-Уае-Оме и о, 18 мл N -этилморфолина. Перемешивают 15 мин, отсасывают, промывают с диметилформамидом, концентрируют фильтрат и остаток распределяют между уксусным эфиром и раствором бикарбоната натрия. Уксусноэфирную фазу промывают с 2 н.НСе, раствором бикарбоната натрия и водой, сушат с сульфатом натри и концентрируют. Остаток растворяют с петролейным эфиром, отсасывают и сушат. Выход продукта 390 мг (95% от теоретического); т.пл. 115. Пример 11. Z-Tyv -проинсулин5 -(31-63)-триаконтатрипептид. 40 мг (10 ммолеП) триаконтатрипептид - трифторацетата, превращают в 1,8 мл 90%-ного диметилформамида с 26 мг (60 ммолей)2-Jyv-ONp в присутствии 1,35 мг (10 ммолей) 1-гидроксибензотриазола. Через 15 мин высаживают эфиром и отфильтровывают осадок. После промывки с эфиром и метиленхлоридом получают 36 мг реакционного продукта. Содержание тирозина 1. Аминокислотный анализ: 1,1 Moll. Н. 0,72 в н-бутанол(пиридин)уксусная кислота (вода} 30:6:20:24/, хроматография на бумаге, возникающая, Rj триаконтапаптида равен 0,22. .. П-р и м ер 12.N -(Boc-Len-Pn N-W -бис-Вос-инсулин. 120 мг (20 ммолей) Вос -инсулина смешивают с 2 мл диметилформамида с 16,7 мг (30 Мо1) Boc-Leti-Рпе -ОТ и 2,7 мг (20 MOD 1-гидроксибензотриазола. Перемешивают 10 мин при комнатной температуре, высаживают эфиром, отфильтровывают осадок и промывают его эфиром. Выход 117 мг. Вычислено, %: Uen7; Phe 4 . Найдено, %: Len 6 ,98; Phe3,98. Миграционное расстояние в электрофорезе на бумаге при рН 2,2 : 0,76 х инсулин (BoCj - инсулин : 0,84 х инсулин) . После отщепления защитных групп с помощью одночасовой обработки с трифторуксусной кислотой и осаждения с эфиром соединение мигрирует в электрофорезе на бумаге как инсулин. Реакционное время без добавки 1-гидроксибензотриазола составляет 3 часа .и ведет частично к сшивке. Такой же результат получают при применении 1-гидрокси-4-метил-2-пиридона, 1-гидрокси-6-метокси-бензотриазола или 1-гидрокси-5-метил-бензотриазола вместо 1-гидрокси-бензотриазола. Пример 13. Boc-JbA a-Tyv Sev- tet-getj(OBut)-His-Phe-Avg-Tvp- u-OH-4420 5,36 г (4 ммоля) H-Tyv-Sev-Met-gEu-(OBut)-Ht3- Pins - Avo - Tvp- C)ey.-OH превращают в 50 мл диметилформамида с 1,84 г (5 ммолей). Boc-jS- W-OT pB присутствии 540 мг (4 ммоля) 1-гидрокси-бензотриазола. Через 15 мин смесью уксусный эфир/эфир высаживают 5,65 г (94%) почти чистого хроматографически реакционного продукта, который для полной очистки перекристаллизовывают из 400 мл 60%-ного метанола. Выхол продукта 4,92 г (81% от теоретического) . Соединение идентично полученному без добавки 1-гидроксибензотриазола, однако время реакции сократилось с 20 час до 15 мин. ь) Пример 14. - пента ( Uen - рие ) трипсинкалликреинг ингибитор. 90 мг трипсин-калликреин-ингибитора из органов крупного рогатого скота суспендируют в 2 мл диметилформамида. К этому добавляют 56 мг Бос-Leu - Рле - ОТср. , 13 мг 1-гидроксибензотриазола. При перемешивании добавляют воду (всего 0,51 мл) до полного растворения. Перемешивают еще 15 мин, концентрируют в глубоком вакууме и растирают остаток с абсолютным тетрагидрофураном. Осадок отсасывают и сушат. Выход 110 мг. 95,7 мг вещества растворяют в 2 мл трифторуксусной кислоты. Позволяют стоять 30 мин при комнатной температуре, концентрируют и осадок распределяют между водой и эфиром, переме шивают водную фазу с Awbeptite (Й-45
(ацетатная форма) и сушат замораживанием. Выход 86 мг.
Шлчислено, %t Ven 1; Рпе 9,
Найдено, %: Len 7,2;Phe 9,2.
Пример 15. Синтез H-gEy- 4Се- 5 -vaC- u- и - ОН (инсулин А 1-5).
, 1. Получение по методу пептидного синтеза в твердой фазе г; использованием Э-гидрокси-4-окси-3,4-дигидрохиназолина -10
Л. (Mbii) полимерное соедине-ние.
Раствор 12,3 г Мра gCufMbh) и 3,2 мл триэтиламина в 60 мл диметилформамида добавляют к 20 г хлорметилирован- . ,ной по Меррифилду сшитой с 2% дивинилЬензола полистирольной смолы, которая имеет хлорсодержание 1,15 мэкв/г. Смесь встряхивают при 80°в течение 48 час, затем фильтруют и смолу многократно промывают с диметилформамидом, этанолом и метанолом. Выход после сушки в вакууме при 805 над Р О -составляет 19,3 г.
Аминокислотное содержание полученной ациламинокислотной смолы состав- 25 ляет 1,15 ммоля/г.
Б. Boc- ei -iee-vaE- u(oaze)-geu(Mbn)
полимерное соединение.
6 г соединения HpS-gCti (MbVi) искусственной смолы в реакционном сосу 30 де со стеклянной фриттой по Меррифилду подвергают следующим реакционным циклам:
1)промывка тремя порциями по 50 мг ледяной уксусной кислоты;35
2)отщепление N -защитных групп путем получасового встряхивания с
1 н.раствором безводного НСЬ в ледяной уксусной кислоте, фильтрация
3)промывка ледяной уксусной кислотой по п.1;
4)трёхкратная промывка этанолом, каждый раз по 50 мл;
5)трехкратная промывка диметилфор :мамидом,, каждый раз по 50 мл-{ 45
6)нейтрализация имеющейся в освобожденных оС-аминогруппах гидрохлоридной группировки путем встряхивания в течение ДО мин с 50 мл 10%ного раствора, триэтиламина и диметил- у формамида;
7)про1«ывка диметилформамидсм по п. 5;
8)добавка к диметилформамидному раствору 3,6 ммолей соответствующе- gго трихлорфенилового эфира Вос-амино кислоты в 40 мл диметилформамида вместе с 0,57 г (3,6 ммоля) 3-гидрокси-4-окси-3,4-дихлорхинг.золина, и последующее 2-час встряхивание, затем фильтрация;
9) промывка диметилформамидом по п. 5;
, 10) промывка с абсолютным этанолом Ьо п. 4.
Растворитель удаляется путем фильрации под давлением (давление воздуха 0,3 атм ) через стеклянную фритту реакционного сосуда.
Для присоединения аминокислоты описанные циклы проводят, смотря по обстоятельствам, один раз. При этом используют следующие по порядку трихлорфениловые эфиры Вос-аминокислоты по п. 8: (Oufe) -ОТ , Воссо-vae-O , Вое- fee-
ОТ и Восср
ОТ . Выход Boc- fy-tfe-vof «-(O6rfJ- fu() полимерного оовдинения после CSTIIKH над Pj О в глубоком вакууме при 80° .составляет 5,3 г с пептидным содержанием 8,2 (определяют путем кислого гидролиза и количественного определения аминокислоты
В. Выделение пептида.
3 г полученного по примеру Б ацилпептид-полимерного соединения суспендируют в реакционном сосуде с 20 мл безводной трифторуксусной кислоты, затем в течение 90 мин при исключении попадания влаги пропускают медленный поток безводной бромводородной кислоты снизу через стеклянную фритту сосуда и суспензию, находящуюся поверх нее. Затем фильтруют суспензию и смолу трижды промывают трифторуксусной кислотой, каждый раз по 10 мл. Объединенные трифторуксусной кислоты фильтрат и водные растворы концентрируют в вакууме, остаток дважды при цеканиро:вании извлекают настаиванием, каждый раз с 50 мл эфира (абсолютного). Вес после сушки в глубоком вакууме над Р Оg составляет 396 мг т.пл 225 (разложение);
Т . е« дО V
- 51,4 (с 0,25, вода) .
Из 200 мг сырого продукта при помощи распределительной хроматографии на Sephadex LHEB растворителем бутанол/уксусная кислота/вода (2:1:10) получают 114 мг бесцветного аморфного вещества. Т.пл. 240 (разложение)
Cot - 71,4 (,25 моля).
Аминокислотный анализ прив.еден в табл. 4.
АМИНОКИСЛОТНЫЙ 11. Получение по методу пептицидного синтеза в твердой фазе без добавки З-гидрокси-4-оксо-З,4-дигидрохиназолина. Способ получения качественно и количественно идентичен предыдущему, однако реакция проводится без добавки 3-гидрокси-4-оксо-8,4-Дигидроксиназолина согласно п. 8. В отдельности при этом опыте получают следующие результаты. Выход сырсэго продукта: 420 м т.пл. от 96° ; d - 27°(с 0,2м ля) . с помощью распределительной хроматографии Sephadex LH20 получали лишь 84 мг продукта со следующими характеристиками : т.пл. от 165 (разложение); 34,9 (с в О,25, вода). При тонкослойной хроматографии продукт ведет себя ненормально. Аминокислотный анализ приведен в табл. 4 . ; т. Получение по- общепринятым мето дам. А. Вое-§ЕЧ - fe -О СНА. к раствору 35 г (0,2 моля) Восgey -он, 38,4Г (0,2 моля )НСе-Н-1Ее-оме и 27 г (0,2 моля) а-гидроксибензотри азола в 350 мл диметилформамида добавляют 26 мл N -этилморфолина и при 0° раствор 44 г дициклогексилкар боциимида в 50 мл диметилформамида. Перемешивают 1 час при 0° и один час при комнатной температуре, отсасывают осадок и фильтрат концентрируют. Остаток распределяют между уксусным эфиром и раствором бикарбоната натри Уксусно-эфирную фазу экстрагируют пу тем встряхивания с раствором КНйОд, раствором NaHCOj и водой, сушат с
Таблица 4 сульфатом натрия и концентрируют. Выход масляного продукта 61,6 г. Масло растворяют в уксусном эфире и }:роматографируют через колонку со 185 г основного AljOj (WoeErn , активная ступень 1). Элюат уксусного эфира концентрируют, выход 55,8 г. Полученное масло растворяют в 250 мл смеси из диоксана и воды (8:2) и смешивают с небольшим количеством гимолфталеина. Раствор титруют с 1 н. раствором едкого натра до тех пор, пока раствор не станет стойко-голубым. Требуется 179 мл 1 н. раствора едкого натра. Затем нейтрализуют раствором KHSO , и реакционную смесь сгущают. Остаток растворяют в воде, перемешивают с уксусным эфиром, при ледяном охлаждении подкисляют до рН 2 - 3 с помощью 2 н. Hj 5 Од и перемешивают. Уксусноэфирную фазу отделяют, один раз промывают водой, сушат над сульфатом натрия и концентрируют. Остаток растворяют в эфире и смешивают с циклогексиламином до о-новной реакции. Затем ставят в лед, отсасывают, промывают эфиром и сушат. Выход продукта55,6 г (71,8% от теоретического;; т.пл. 198-200 0. Для дальнейшей очистки вещество растворяют в 100 мл метанола и смешивают с 1,5 мл эфира и охлаждают. Через 1 час отсасывают. Выход продукта 45,6 г (59% от теоретического); т.пл. 204-205С; о - 17,4° (с 0 1, метанол) . Б. Z - vae-geu(oBut)-Qeo (МЫ1) - он 65,2 г (81 ммоля)г-уае-§еиГОВи1)-gEu(Mbh)-OMe суспендируют в 400 мл смеси дисксан/вода (8:2), титруют с 1 н.раствором едкого натра в присутствии тимолфталеина в качестве индикатора. После того к;ак раствор стане стойко-голубым.подкисляют раствором KHSOjj и осадок отсасывают, Фильтруемый материал кипятят с ацетоном, отсасывают и пересаживают из диметилформамид/вода. Выход 59 г (92% от теоретического); т.пл. 216-218 . Вычислено, %: С 63,72; Н 6,85; N 7,05. С4гН54 О (мол. в. 790,9). Найдено, %: С 63,3; Н 7,1; Ы 8,1, В. H-vae- tr{OBu)- деи(мьп)он Через суспензию 52 г (65,7 ммолей z-Vae-§eu{oauV§e J( и немного Pcf / Ва Од катализатора в 500 мл ледяной уксусной кислоты пропускают водород до окончания образования СО 2 . Затем отсасывают катализатор и фильтрат концентрируют. Оста ток растирают с эфиром и отсасывают. Осадок примерно 5 час перемешивают с насыщенным раствором ацетата натрия, отсасывают, сушат и кипятят метанолом. Выход 27 г (62,6% от теоретического) ; т.пл. 226-228 0; оС +9,0 (с 1, ледяная уксусная кислота). Вычислено, %: С 62,20; Н 7,35; N 8,53. (мол. в. 656,8). Найдено, %: С 61,4; Н 7,3; N 8,5 Г. Boc- e-u-iEe-vae-§e 4((Mbh)7,8 г (20 ммолей) Boc- ey-iEe ОН-СН размешивают при 0°С с 100 мл эфира и 40 мл 2 н.лимонной кислоты. Эфирную фазу отделяют, промывают водой, суша с сульфатом натрия и концентрируют. Выход 4,6 г масла, К раствору 3,9 г полученного масляного вещества (Воеgty ite - ОН) в 35 мл диметилацетамида добавляют 2,09 г З-гидрокси-4-окси-3,4-дигидро-1,2,3-бензотриазина и при 0°С 2,75 г дициклогексилкарбодиимида. Перемешивают 1 час при 0° и 1 час при комнатной температуре. Выпавший осадок отсасывают и промывают небольшим количеством диметилацетами да. К фильтрату добавляют 5,85 г мел корастертого (ОВи gEtj(Mb1iVOH и перемешивают 5 час при комнатной температуре. При этом осаждается плотный осадок, который выстаивает ночь, и на другой день вещество пол ностью осахедают с 300 мл воды. Beщество отсасывают, промывают водой и кипятят с 200 мл этанола, охлаждают до комнатной температуры, отсасываю и хорошо промывают спиртом. Выход 6,7 г (81,3% от теоретического); т.пл. 253-255С; c.J - 2,1 (, диметилацетамид). Вычислено, %: С 60,90; Н 7,61; N 9,07. С„ Н,п Mg Ojj, (мол. в. 927,1). Найдено, %:С61,0;Н7,6; , Д. H-geti-jee-vae- eu- е-и-он 200 мл Вое-§etJ-lCe-vae- eu(DBu) и 0,5 г анизола растворяют в 5 мл трифторуксусной кислоты и 10 мин кипятят с обратной флегмой. Затем раствор концентрируют, остаток растирают с эфиром. После этого отсасывают и остаток растворяют в воде. Водный раствор смешивают с mbevfite /ЯН5 (ацетатная форма) пока рН не достигт нет 3-4. Ионит отсасывают и фильтрат осветляют с активированным углем. Прозрачный водный раствор сушат вымораживанием. Выход 50 (.j -75°С (с 0,25;вода). При тонкослойной хроматографии продукт однообразный. Приведенные в таблице результаты показывают превосходство предлагаемого способа при методе в твердой фазе. По традиционному методу при применении треххлорфениловых эфиров без добавки катализаторов получение приблизительно однородного материала невозможно. Получение некоторых катализаторов. 3-Гидрокси-4-метил-2,3-дигидротриазол-2-тион. а)5-тиокси-6-окси-5-тио-2-октанон. Раствор 185 г (2 моля) хлорацетона в 300 мл метиленхлорида смешивают с 300 мл воды. При 10-20°С при перемешивании порционно вносят 320,5 г (2 моля) CjHjO - CS3 X. Перемешивают еще 2 часа при комнатной температуре, разделяют слои, органическую фазу еще раз промывают со.100 мл воды, сушат сульфатом натрия и дистиллируют. Т.кип. 92-99° /0,05 торр, выход 305 г; б)5-тиокси-5-окси-4-тио-2-октаноноксим. К раствору 56,0 г гидроксиамингидрохлорида в 400 мл метанола добавляют 65,6 г ацетата натрия и 137 г полученного по п.а) 5-тиокео-6-окса-4-тиа-2-октанола. После 18 час перемешивания при комнатной температуре отгоняют в вакууме растворитель,остаток смешивают с водой, экстрагируют метиленхлоридом, органическую фазу сушат с сульфатом натрия и освобождают от раств ррителя .Остаток поглощают диизогхпопиловым эфиром. Путем охлаждения отсюда можно в несколько фракций получить всего 101 г оксима с т.пл. 64°. с) 3-гидрокси-4-метил-2,3-дигидротиазол-2-тион. К раствору 104,4 г МаОН в 200 мл воды прикапывают при охлаждении и интенсивном перемешивании в течение 15 мин 125,3 г полученного по п.б) оксима, растворенного в 300 мл метиленхлорида, затем еще перемешивают 5 мин., добавляют 500 мл воды, разделяют слои, водную фазу дважды экстрагируют встряхиванием в делительной воронке, каждый раз со 100 мл гексана, н подкисляют концентрирован ное соляной кислотой, до рН2. Перемешивают 1 час в ледяной бане, хоршю отсасывают осадок и дважды основател но прс швают его водой по 300 мл каж дый раз. Выход 61,5 г, т.пл. 90 С. Другие 12 г равного продукта можно получить путем экстракции водного раствора с метиленхлоридом. Пример 18. 1-гидрокси-4,б.диметил-3,5-дихлор-2-пиридон. Растворяют 20 г 1-гидрокси-4,6диметил-2-пиридона в смеси из 75 мл концентрированной соляной кислоты и 60 .мл воды и при 10-15 С пропускают 21,6 г хлора, затем еще перемешивают 1 час, отсасывают, пробивают водой и сушат в вакууме. Выход 22,9 г т.пл. , При кристаллизации из ацетонитрила т.пл. . Формула изобретения Способ получения пептидов общей формулы НУО HYOHYOHYj) V-(N-CH-C)«,i-W-CH-C-M-CH-C-(M-CH-C), (1 где tn - число от О до 10; т, - чксло от О до и более V - аминозащитная группа или пироглютаминовый остаток; Y - низший алкиловый оста ток, который может быть разветвленным и/или замещенным в случае необходимости защищенным -ОН, - N Н, - -СООН, -CONHj , -гуанидик, -арил, -имидазолил, -индолил-остатками, пр чем группа ( -NH-СНУ) также может означать пиролидил-остаток, путем взаимодействия защищенной аминокис лоты или защищенного пептида форму лы НУО н Y о I I II I I U V-(N-CH-ri -hf H-C-0-RСП) и Y имеют указанны где ш, ; V значения. В - представляет собой ди-, ри-, тетра- или пентахлорфенил; нитрофенил или хлор-нитрофенил-осааток с защищенным в случае необхоимости аминокислотами или пептидами бщей формулы H-M-CH-c-(N-cH-c),-w nui иУ ( -NH -СНУ-) остатгдешаУ, и имеют указанные значения; W означает гидрокскльную группу, -алкил, О-аралкил, аминогруппу или фиро- или амино-связанный полимерный оситель, замещенный алкилом, аралилом или арилом, с последующим выделением целевых продуктов известными приемами, о тичающийся тем, что процесо ведут в присутствии соединения общей формулы N - ОН в которой X означает группу С-Ю, С- S или - N - и X и N являются членами 5-6-членного замещенного гетероциклического кольца, анналированного с бензольным ядром и/или содержащего 1 или 2 других гетероатома и значение рК которых 3,7-4,2. Приоритет по признакам: 01.07.71 взаимодействие проводят при добавлении 1-оксибенэ.отриазола; 20.01.72 взаимодействие проводят при добавлении соединения обцей формулы М-ОН где X означает группу С-0, C-S или - N - и в которой X и К являются членами 5-б-членного замещенного гетероцикличе(кого кольца, аннелированного с бензольным кольцом и/или содержащего 2 других гетероатома и значение рК 3,7-4,2.
Авторы
Даты
1976-04-25—Публикация
1972-06-29—Подача