соединение можно превратить при реак- дни с алкилирующим или аралкилирующим реагентом i в соединение общей формулы содержащее алкильную группу, имеющую от 1 до 3 атомов углерода, или алкиль ну группу, содержащую от 1 до 3 атомов углерода и замещенную гидроксильной группой, бенэильную группу или бен3ильную группу, замещенную атомом галогена, как заместитель.
Если полученное соединение общей формулы .1 пр1вдставляет собой основани его можцо -перевести в соль, образующуюся присоединением кислоты путем реакции с кислотой, Кроме того, соль можно известным способом ;превратить в свободное основание при реакции с силным основанием другую соль реакцией ее с другой кислотой.
Свободные основания общей формулы ,1 очищают перед получением из них солей, предпочтительно перекристаллизацией или перегонкой в. вакууме однако для получения соли можно.применять сырое.основание.формулы I.
Если в качестве исходных продуктов применяются соединения формулы И , где R представляет гидроксил, аминогруппу или алкоксигруппу. Имеющую от 1 до 4 атомов углерода, они предпочтительно реагируют с соединениями общей формулы Ш при 140250 0, Реакцию можно вести в отсутствие растворителя или в присутстви таких растворителей, как этиленгликоль, формамид, диметилформамид, бен эиловый спирт, имеющих более высокую температуру.
В случае использования в качестве исходных соединений общей формулы П, содержащих атом галогена в качестве заместителя 1 , реакцию ведут предпочтительно при температуре от О до 100°С в отсутствнё растворителя или в присутствии такого нейтрешьного ра створителя как диэтиловый эфир, диоксан, бензол или четыреххлористый углерод.
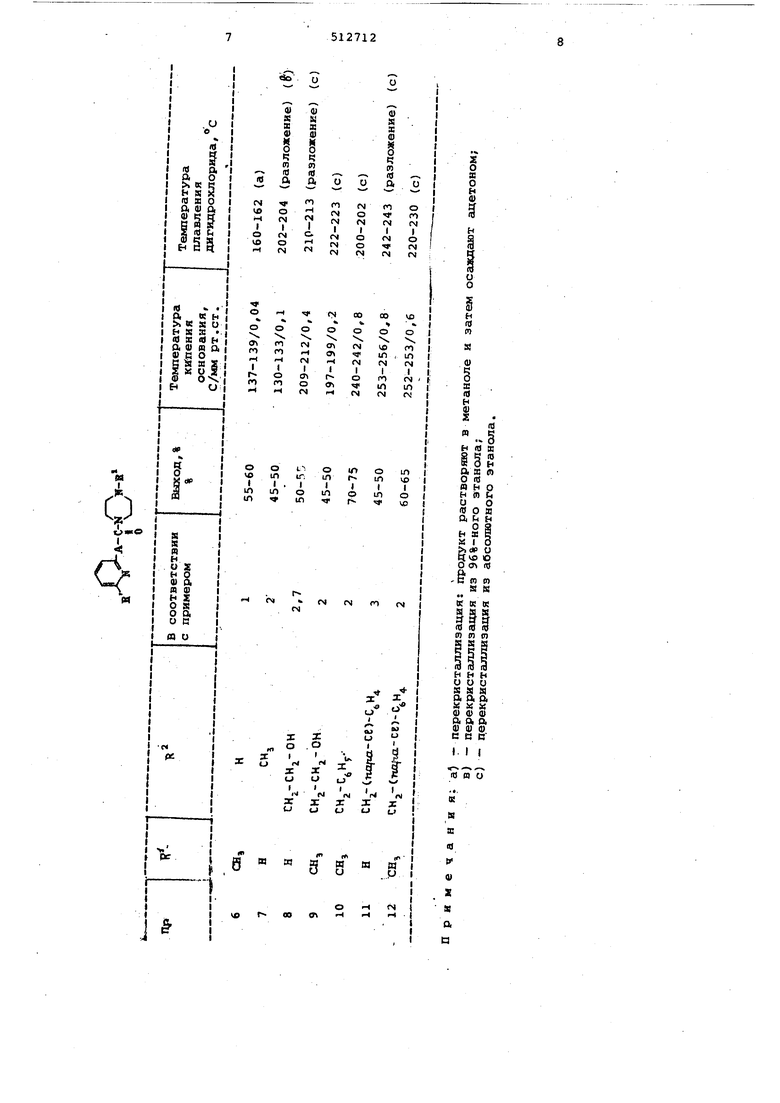
Пример 1. Получение Н-пиколинилпнперазина. ,
Смесь 27,4 г (0,2 моль) метилового зфира пиколиновой кислоты (-или 30,2 г (0,2 моль) этилового эфира пиколнновой кислоты, или 35,8 г (0,6 моль) н-бутилового эфира пилиновой кнслоты и 51,6 г (0,6 моль) безводного пиперазина вьщерживают 25 час при 135-145 с, отгоняя избыток пиперазина на масляной бане при . Остаток подвергают фракционированной перегонке при давленин 0,1 мМ рт.ст. Таким способом получают 21-23 г () N -пиколинилпиперазина с т.пл. 152-155 С (0,1 м рт.ст.). Продукт кристаллизуется при выдержке, т.пл. 72-73 С.
Аналитические данные (М «191,24)
Вычислено, %i ,N21,97,
Найдено, %: Н21,65. Белый кристаллический дихлоргидрат Н -пиколинилпипбразина плавится после перекристаллизации при с разложением.
Аналитические данные (,17)
Вычислено, %: N15,91; Ct 26,34
Найдено, %; N15,95; се 26,35 П р и м е р 2. Получение N -пиколиноилпиперазина.
; Смесь 8,6 г (0,1 моль) безводного пиперазина и 12,2 г (0,1 моль) амида пиколиновой кислоты кипятят с обратны холодильником 20 час в масляной ванне температурой от 150 до , посл чего смесь подвергают фракционной перегонке при давлении 0,1 мм рт,ст, Получают 21 г (55%) .N -пиколиноилпиперазина. Продукт идентичен продукту полученному в примере 1.
Примерз. Получение N -(6-мfeтиJ пикoлинил)- И -метилпиперазина.
Смесь 33,0 г (0,2 моль) этилового зфира бгметилпиколиновой кислоты и 20,0 г (0,2 мрль) N -метилпиперазина Нагревают ;.с- обратным холодильником 20 час на масляной бане при 40-200с и давлении 0,4 мм рт.ст, В качестве главного продукта получают 19f5-22 г (45-50%) маслообразного. N -(6-метилпиколинил)- N-метилпиперазина, светло-желтого цвета.
Аналитические данные (М 219,29) Вычислено, %: N19,16 Найдено, %: N19,10.
После перекристаллизации из этанола дихлоргидрат кристаллического
N -(6-метилпиколинил)- N-метилпиперазина плавится при 247-248 с с разложеннем.
Аналитические данные (М 292,22) Вычислено, %: N14,23; се24,27 Найдено, %: М14,28; Ct 24,57
Прим е р 4. Получение К -пиколинбензилпиперазина.
Смесь, состоящую из 15,95 г (0,1 моль) гидрохлорида пиколиновой кислоты и из 17,6 г (0,1 моль),М-бензилпиперазина выдерживаиот в аппарате 5 час при 160-170 4::. Полученный моногидрохлорид N -пиколинил- N-бензилпиперазина растворяют в 200 мл горячего абсолютного этанола и раствор Подкисляют при температуре 50-70 С абсолютным этанолом, насыщенным хлористым водородом. Величину раствора контролируют, пользуясь индикаторной бумажкой. Смесь выдерживают в течение нескольких час9В ;в холодильнике, после чего выделившиеся кристаллы отфильтровывают, промывают двумя порциями этанола rid 20 мл и сушат. При этом получают 20,3 г (58%) дигндрохлорида ,N -пиколинил-N-бензилпиперазина, плавящегося при 214215 С с разложением. После перекрисТеиплизации из абсолютного этанола температура разложения повышается до 216-217 С. . Результаты анализа ,29) Вычислено, %: N11,86, се20,01. Найдено, %:N11,91, се 19,70, Малеинат N-пиколинйл- N-бензилпиперазина (C,7Hi, ) плавится ври l66-nO°Cf в то время как фумарат .N -пиколйнил - N-бензилпиперазнна tC H NjO-G H O) плавится при . П р и м е р 5, Получение N-пиколинил- М-бензилпиперазина, k горячему раствору 19,1 г (0,1 моль) N-пиколинилпиперазина (приготовленного в соответствии с методом описанным в примере 1) в 150 мл абсолютного диоксана прибавляют в течени 1 час отдельными порциями при переме шивании 2,3 г металлического натрия порошке. Смесь выдержив ают при комна ной температуре один день. В течение 1 час прибавляют при наружном охлаждении по каплям О,1 моль хлористого бензила к полученному ранее N - пикол нилпипера-зиннатрию, после чего смесь нагревают докипения. Выделившийся хлористьй . натри отфильтровывают, растворитель от.гоыяв)т и остаток подвергают фракцй.оняронанной дистилляци в вакууме. При этом подучают 18,2 г (65%) /N -пиколинилг Н- бенэйлпиперазина, плавящегося при 218-220°С под давлением 0,1 мм рт.ст. Продукт иден тичен с, продуктом, полученньом по при меру 4. Пример Ы6-12. Соединения, прЙ зеденнЬ1е в таблице, могут быть по лучены аналогично описанным в предшествующих примерах. Пример 13. Получение N -(пи ридил-(2) -ацетил) - N -метилпиперазина. Смесь, .состоящую из 30,2 г (0,2 моль) метилового эфира пириднл2-уксусной кислоты или из 38 г (0,2 моль) н-бутилового эфира пириил-2-уксусной кислоты и из 20 г (0,2 моль) метилпиперазина нагревают при температуре кипения с обратным холодильником. Результаты анализа (М«402,77) Вычислено, %: 10,48, С 26,41) Найдено, % 10,18, се 26,31 Пример 14. Получение Ы-(пиридил)-(2)-ацетил)- N-бензилпиперазина. Краствору 17,6 г (0,1 моль)Н-бе нзилпиперазина прибавляют отдельными порциями, перемешивая при в течение 0,5-1 час, 19,25 г (0,1 моль) гидрохлорида хлорангидрида пиридИл(2)-уксусной кислоты. Реакционную смесь кипятят 1 час, затем охлаждают и подщелачивают раствором 10 г гидрата окиси натрия в 60 мл воды. Бензольную фазу, содержащую целевой продукт, отделяют, затем бензол отгоняют и остаток подвергают фракцконированной перегонке в вакуум. При этом получают 12,7 г (43%)заленоватр-желтого, маслянистого N -(пиридил-(2)-ацетил)-бензилпиперазина, кипящего при 222225 С под давлением 3 ммрт.ст. Результаты анализа (,39) Вычислено, %:N14,23. Найдено, %: N14, 30. Белый кристаллический дигидрохлорид N-(пиридил-(2)-ацетил- N-бензилпиперазина послеперекристсшлизадии из.этанола плавится при 190-192С с разложением. .Результаты анализа (M 368f32) Вычислено, %:N11,41, СК 19,25 Найдено, %: N11,16, СЕ 18,80 951271 Формула изоОретения Способ получения 1,4-дизамещенных пипераэинов общей формулы I .. 5 |j .Л. чАл-С-М К-В 1 I V-/ где - атом водорода, метил, Ю К -атом водорода, атом щелочного металла, алкил с 1-3 атомами углерода, который.может быть замещен гидроксильной группой, бензил, бензил, замещенШЛ атомом галогена, А представляет is собой группу -(СЦЛпг ,, или их солей, о т л и ч а Ю « и ft с я тем, что соединение общей формулы П x R N i О - где и А имеют указанные значения, К - атом водорода, галогена, гидрокси-, аминогруппа, алкоксигруппа с прямой или разветвленной цепью, содержащей от 1 до 4 атомов углерода, подвергают взаимодей ствию. с соединением общей формулй ВЗ H-ii i ц , у где « имеет указанные выше значе « ° последующим выделением целевого продукта в свободном виде или в виде его соли.



| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ5,П-ДИГИДРО-6Н-ПИРИДО-[2,3-Ь]-[1,4]-БЕНЗО-ДИАЗЕПИН-6-ОНА | 1972 |
|
SU331554A1 |
| Способ получения замещенных в 5-ом положении 5,10-дигидро-11 н-дибензо (в,е) (1,4)диазепин-11-онов | 1969 |
|
SU512704A3 |
| Способ получения амидов пиридинкарбоновой кислоты | 1978 |
|
SU715023A3 |
| СПОСОБ ПОЛУЧЕНИЯ НЕПРЕДЕЛЬНЫХ ХЛОРУГЛЕВОДОРОДОВ | 1998 |
|
RU2149155C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 3-ОКСО-2,3-ДИГИДРОБЕНЗОКСАЗИНА-1,4 | 1971 |
|
SU321004A1 |
| Способ получения производных 1фенокси-3-амино-пропан-2-ола или их солей | 1974 |
|
SU549078A3 |
| Способ получения мета-производных бензойной кислоты | 1972 |
|
SU495828A3 |
| Способ получения оксимэфиров или их солей | 1980 |
|
SU927111A3 |
| ПРОИЗВОДНЫЕ 6-АРИЛПИРИДО[2,3-D]-ПИРИМИДИНЫ И -НАФТИРИДИНЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ИНГИБИРУЮЩИМ ДЕЙСТВИЕМ КЛЕТОЧНОЙ ПРОЛИФЕРАЦИИ, ВЫЗЫВАЕМОЙ ПРОТЕИНОВОЙ ТИРОЗИНКИНАЗОЙ, И СПОСОБ ИНГИБИРОВАНИЯ КЛЕТОЧНОЙ ПРОЛИФЕРАЦИИ | 1995 |
|
RU2191188C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ПИКОЛИНОВОЙКИСЛОТЫ | 1972 |
|
SU436492A3 |


Авторы
Даты
1976-04-30—Публикация
1972-03-30—Подача