(54) СПОСОБ ПОЛУЧЕНИЯ АМИДОВ 1-АМИНОАНТРАХИНОН-2-КАРБОНОВОЙ КИСЛОТЫ
1
Изобретение относится к новому способу получения амидов 1-аминоантрахинон-2-|Карбановой .кислоты, которые являются важными промежуточными продуктами лри получении красителей, причем часть получаемых согласно предлагаемому способу продуктов представляет собой дисперсионные красители, Которые окрашивают синтетические волокнистые материалы, напри-мер линейные сложные полиэфиры, ацетат целлюлозы или полиамиды, в оранжевые или синие цвета.
Известны различные способы получения амидов 1-ами«оантрахинон-2-карбоновой «ИСлоты взаимодействием хлорангидридав антрахинонкарбоновой «ислоты с первичными и вторичными аминами с выходом целевого продукта до 80%.
Однако известные способы предусматривают ИОпользование соответствующих хлорангидридов, которые получают обработкой антрахинонкарбоновых кислот сильнакорродирующими соединениями, такими, как хлористый тионил, трех-, пятихлористый фо-сфор. При этом также образуется большое количество высокоагрессивных газов и других вредных побочных продуктов - хлористый .водород, двуокись серы и т. п.
Эти обстоятельства затрудняют использование известных методов и заставляют искать новые пути синтеза этих соединений.
Цель изобретения - упрощение процесса производства амидов 1-аминоантрахинон-2карбоновой кислоты.
Согласно изобретению предложен новый способ получения амидов 1-аминоантрахинон-2нкарбоновой кислоты общей формулы I
COKHfti
15
где RI означает водород, циклоалкил с 5- 8 атомами углерода или неразветвленный или
разветвленный алкил Ci-Cs, в котором 1 или 2 атома водорода могут быть замещены гидроксилом, ал1коксигруппой Ci-Сб или фенилом, причем последний или алкил, или алкоксигруппа Ci-С могут содержать в качестве заместителей хлор или бром;
R2 - водород, циклогексиламИНО-, хлор, бром или нитрогруппа, взаимодействием 1,2-дигидро-7,8-дифталоил - 3,1,4-Н - бензо.ксазон-4 общей формулы II X О 1Н(0 с аминами фор:мулы III RiNHa где RI и R2 имеют вышеуказанные значения. В качестве ами«а общей формулы 1П могут быть использоваиы соединения, IB которых RI может быть метил, этил, н- или изопропил, н- или изобутил, н- или изоамил, н-гексил, изогексил, н-октил, изооктил,2-этилгексил, |3-0Ксиэтил, у-оксипропил, е-оксипентил, ,р,р-диэтил- или р,|3-дНМетил, уОксипропил, р-метоксиэтил, р-это,ксиэтил, |3-пропоксиэтил, р-бутоксизтил, у-метоксипропил, у-этоксилропил, у-бутоа сипропил, р-((3-о«сиэтокси)-этил, бензил, р-фенилэтил, р-фенилиропил, б- или уфенилбутил, циклопентил, циклогексил, метилциклогексил или диметилциклогексил. Процесс целесообразно осуществлять в избытке амина (III), который одновременно используется В качестве растворителя, или в инертных (IB условиях реакции) растворителях. В качестве растворителей можно применять, например, спирты: метанол, этапол, нили изопропанол, н- или изобутанол; гликоли - этиленгликоль, 1,2- и 1,3-нропиленгли.коль, бутандиол-1,3 и -1,4, этиленгликоль; простые эфиры тликолей - монометиловые, моноэтиловые, монобутило;вые эфиры гликоля, мойометиловые эфиры этилендигликоля и этилентригликоля, диметиловые эфиры этиленгликоля; ароматические углеводороды - бензол, толуол, ксилол, хлорбензол, дихлорбензол или нитробензол; хлорпроизводные углеводородов; 1,2-дихлорэтан, четыреххлористый углерод, треххлористый этилен; лростые эфиры- тетрагидрофуран, кроме того, диметилсульфоксид, тетраметиленсульфон, тетраметилмочевина, пиридин, пвколин, хинолин, а также воду или формамид. Предпочтительными растворителями являются прежде всего сильнополярные, Смешиваемые с водой апротонные растворители, например N,N-димeтилфopмaмид, Ы,1М-диметилацетамид, амид-:Ы,Ы-диметилпропионоеой кислоты, Ы,М-диэтилформа мид, Ы,М-диэтилацетамид, амид-М,Ы-диэтилнропионовой кислоты, N-метилПирролидон, пиридин или их смеси. Количество растворителя зависит от растворяющей способности и точки Кипения применяемого растворителя. Минимальное количест1во определяется тем обстоятельством, что реакционную смесь до, во время и после взаимодействия необходимо перемешивать. Обычно применяют 2-10-кратное количество из расчета на бензоксазон (II). При взаимодейст1вии в избытке амина (III), который одновременно используется в качестве растворителя, обычно применяют 3- 10-1кратное весовое количество амина из расчета на (II). Минимальное количество амина определяется тем обстоятельством, что реакционную смесь до, во время и после взаимодействия необходимо перемешивать. В случае взаимодействия в растворителях и разбавителях применяют но меньшей мере стехиометрическое количество амина (Ш). Целесообразно, однако, применять избыток 2-10, предпочтительно 2-4 молей амина на каждый моль бензоксазона (II). В зависимости от применяемого амина, темиература реакции колеблется в пределах от (-5) до 120, предпочтительно от О до 80°С. Температура реакции зависит от осно вности амина, кроме того, от применяемого растворителя н от заместителя R2 в применяемом бензоксазоне (II). Особенно хорошие выходы продуктов (I) по предлагаемому способу получают, если взаимодействие бензоксазона (II) с амином осуществляют в сильнополярном, смешиваемом с водой апротонном растворителе -в присутствии таких алифатических карбоновых кислот, как муравьиная, уксусная, пропионовая или шавелевая кислоты, поэтому взаимодействие бйнзоксазона (II) с амином предпочтительно проводят в подобных смесях растворителей. Количество карбоновой кислоты может составлять до 40 вес. % из расчета на амин. В случае применения смешиваемых с водой растворителей и разбавителей целевые продукты осаждают вливанием в разбавленные растворы минеральных кислот и отделяют фильтрованием. Из иесмешивающихся с водой реакционных смесей целевые продукты осаждают, например, добавкой разбавителей, «е растворяюш,их амиды (I). Осадок известным способом отделяют от органической фазы и перерабатывают. Растворитель может быть также удален отгонкой с водяным паром. Примесь небольшого количества 1-аминоантрахинон-2-карбонОВОЙ кислоты, если это необходимо, можно удалять при комнатной температуре простым перемешиванием с разбавленными водными растворами едкой щелочи, предпочтительно с разбавленным содовым раствором, при этом карбоновая кислота переходит в растворимое состояние. Следует отметить, что бензоксазон-4 формулы II можно рассматривать как циклический сложный эфир ортооксиметиламинокарбоновой кислоты, а также как циклический полуаминальнолуащилаль, причем кольцо оксазана-4 может размыкаться различными реагентами в двух направлениях: а) с образованием ортоаминокарбоновой кислоты (из полуаминальной структуры) и б) с образованием амида ортоаминоантрахинонкарбоновой
КИСЛОТЫ (из структуры циклического СЛОЖНОго эфира).
При взаимодействии соединеиий II € аминами общей формулы III осуществляется преимущественно налрввление б), и только небольшое количество ортоаминоантрахинонкарбоновой кислоты образуется по направлению а).
Пример 1. 15 г 1,2-дигидро-6-нитро-7,8дифталоил-3,1,4-Н-бензоксазона-4 растворяют в 100 г icyxoro диметилформамида. При 70°С вдувают газообразный аммиак, пока на тонкослойной хроматограмме не исчезнет пятно исходного продукта (примерно в течение 5 ч). Реакционную смесь вливают в разбавленную соляную кислоту, получаемые красновато-коричневые кристаллы отсасывают, промывают до нейтральной реакции и сушат.
Получают 11,2 г (79% от теории) амида 1 -аМино-4-нитроантрахинон-2-карбоновой кислоты, т. пл. 340-343°С.
Найдено, %: С 57,9; Н 3,0; N 13,5.
CisHgO Ns.
Вычислено, %: С 57,9; Н 2,9; N 13,5.
Пример 2. К смеси из 100 г диметилформамида, 18,0 г 1,2-дигидро-7,8-дифталоил3,1,4-Н-бензоксазона-4 (молярное соотношение бензоксазон : амин-1 : 3) и 5 г ледяной уксусной кислоты в течение 1 ч при 35°С по каплям добавляют 10,5 Г н-пропиламина. Перемешивают в течение 4 ч при этой температуре, реакционную смесь охлаждают до комнатной температуры и вливают в разбавленную соляную кислоту. Получаемые коричневые кристаллы отсасывают, осадок промывают до нейтральной реакции. Осадок добавляют к 1,5%-ному содовому раствору и перемешивают в течение 1 ч при комнатной температуре. Затем отсасывают, промывают водой до нейтральной реакции и сушат. Получают 16,4 г (82,5%) N-пропиламида 1-аминоантрахинон-2-карбоновой кислоты, т. пл. 275° С.
Найдено, %: С 70,2; Н 4,9; N 8,8.
CigHifiNaOg.
Вычислено, %: С 70,2; Н 4,55; N 9,1.
Пример 3. К раствору из 24,3 г 1,2-дигидро - 6-бром-7,8-дифталоил-3,1,4-Н-бензоксазона-4 (II), 125 г диметилформамида и 5 г ледяной уксусной кислоты в течение 1 ч при 45°С по каплям добавляют 13,5 г «-бутиламина (III) (молярное соотношение 11:111 1:2,5). Перемешивают в течение 4 ч при этой температуре. Реакционную смесь охлаждают до комнатной температуры и вливают в разбавленную соляную а ислоту. Получаемый осадок светло-красного цвета отсасывают, промывают водой до нейтральной реакции, добавляют к 1,5%-ному содовому раствору и в течение 1 ч перемешивают при комнатной температуре. Затем отсасывают, промывают до нейтральной реакции и сушат.
Получают 22,6 г (83%) N-бутиламида 1-амино-4-бромантрахинон-2-карбоновой кислоты, т. пл. 250--254°С.
Найдено, %: С 57.3; Н 4,2; N 7,3; Вг 19,6. C.gHnOsNBr.
Вычислено, %: С 56,8; Н 4,25; N 6,9; Вг 19,9.
Прнмер 4. Аналогично примеру 3 готовят раствор, состоящий из 18,0 г 1,2-дигидро-7,8дифталоил-3,1,4-Н-бензоксазона-4 (II) и 13,5 г изобутиламина (III) (соотношение 11:111 1:3). Получают 18,3 г (88%) N-изобутиламида 1-аминоантрахинон-2-карбоновой кислоты, т. пл. 220°С. Найдено, %: С 71.1; Н 5,3; N 8.5.
CigHisOsN.
Вычислено, %: С 70,6; Н 5,6; N 8,7. Пример 5. К смеси из 100 г пиридина, 21,2 г 1,2-дигидро-6-нитро-7,8-дифталоил-3,1,4Н-бензоксазона-4 (II) и 5 г ледяной уксусной кислоты в течение 60 мин при 45°С по каплям добавляют 13,6 г н-гексиламина (III). Смесь перемешивают в течение 3 ч при этой температуре, охлаждают и вливают в разбавленную серную кислоту. Осадок отсасывают, промывают водой до нейтральной реакции добавляют к 1,5%-ному содовому раствору и суспензию перемешивают в течение 1 ч при комнатной температуре. Затем отсасывают,
промывают до нейтральной реакции и сушат.
Получают 23,0 г (89%) N-гвксиламнда 1-амино-4-нитроантрахинон-2-кар,бонОВой Кислоты
в виде красного порошка, т. пл. 216-218°С.
Найдено, %: С 63,7; Н 5,1; N 10,8.
C2lH2lO5N3.
Вычислено, %: С 63.8; Н 5.3; N 10.6. Пример 6. К смеси из 100 г К -метилпирролидона-2, 24,3 г 1,2-дип Дро-6-бром-7,8-дифталоил-3,1,4-Н-бензоксазона-4 (II) и 5 г пропионовой кислоты в течение 1 ч при 45°С по каплям добавляют 23,0 г р-этилгексиламина III (Молярное соотношение 11:111 1:2,5). Смесь перемешивают в течение 3 ч при этой температуре, охлаждают и вливают в разбавленную соляную кислоту. Осадок отсасывают, промывают водой до нейтральной реакции,добавляют к 1,5%-ному содовому раствору и суспензию в течение 1 ч перемешивают при комнатной температуре. Затем отсасывают,
промывают до нейтральной реакции и сушат.
Получают 26,6 г (86%) Ы-(р-этилгексил)амида 1-амино-4-бромантрахинон-2-карбоновой кислоты в виде красного порошка, т. пл.
242-246°С.
Найдено, %: С 60,2; Н 5,1; N 6,2; Вг 17,8.
С2зН25Ы2ВгОз.
Вычислено, %: С 60,4; Н 5,5; N 6,1; Вг 17,5.
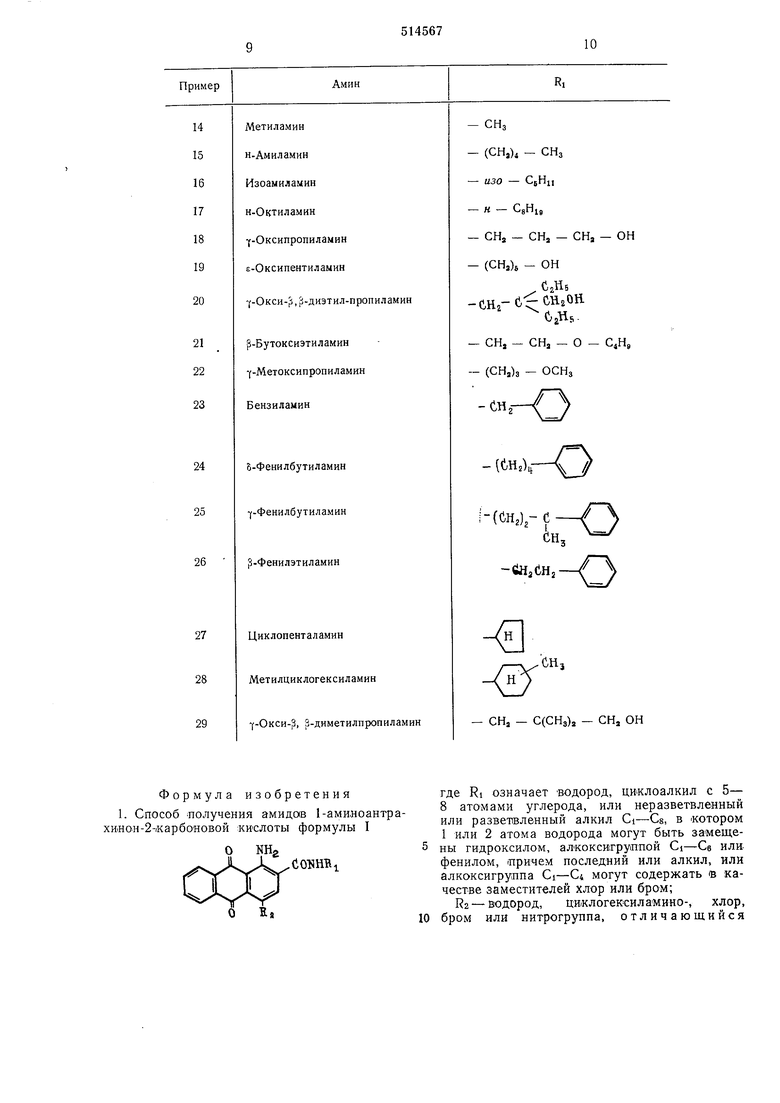
Пример 7. Аналогично примеру 5, нз соответствующего бензоксазона-4 (II) и 12 г у-метоксипропиламина (III) (молярное соотношение II : 111 1 :2) получают 20,6 г (82%) Ы-(у-метоксипропил)-амида 1-амино-4-нитроантрахинон-2-карбоновой кислоты в виде красного порошка, т. пл. 240-244°С. 7 Найдено, %: С 59,1; Н 4,3; N 11,0. CigHnOfiNs. Вычислено, %: С 59,8; Н 4,4; N 10,95. Пример 8. Аналогично примеру 6, из соответствующего бензоксазона-4 (II) и 13,5 г р-этоксиэтиламина (молярное соотношение 11:амин 1:2) получают 22,0 г (78%) N- (р-этокси) -этиламида I-амино-4-брО мантраXHHOiH-2-Kapi6oHOBoft кислоты в виде красного порош:ка, т. пл. 230°С. Найдено, %: С 54,9; Н 4,0; N 6,9; Вг 19,5. Cl9Hl704N2Br. Вычислено, %: С 54,8; Н 4,8; N 6,7; Вг 19,20. Пример 9. Аналогично -примеру 2 яз соответствующего бензоксазона-4 (II) и 11,0 г этаноламина получают 16,2 г М-(р-окси)этиламида 1-амиНоантрахинон-2-карбоновой кислоты .в виде коричневого порошка. Найдено, %: С 66,1; Н 4,5; N 8,7. CiTHuOiNa. Вычислено, %: С 65,9; Н 4,5; N 9,0. Пример 10, К смеси из 100 г диметилформамида, 21,2 г 1,2-дИ1Гидро-6-нитро-7,8дифталоил-3,1,4-Н-бензоксазона-4 (II) и 5 г пропионовой кислоты при перемешивании в течение 1 ч при 45°С добавляют 17,7 г р-(Р-оксиэтокси)-этиламина (III) (11:111 1 :2,5), смесь перемешивают в течение 4 ч при этой температуре, охлаждают и вливают в разбавленную соляную кислоту. Отсасывают осадо1К и промывают водой до нейтральной реакции. Осадо-к « течение 1 ч при комнатной температуре размешивают в 1,5%-ном содовом растворе. Затем отсасывают, промывают до нейтральной реакции и сушат. Получают 24,4 г (93,5%) (|3-оксиэтокси)-этил -амида 1-амино-4-нитроантрахинон2-карбоновой кислоты в виде красного порошка; т. пл. 298-302°С. Найдено, %: С 56,9; Н 4,7; N 10,4. CisHiTOvNs. Вычислено, %: С 57,2; Н 4,3; N 10,5. Пример П. Аналогично примеру 2 из соответствующего бензоксазона-4 (II) и 25,0 г р-фенилпропиламина (молярное соотношение 11:амин 1 :3) получают 21,0 г (85%) К-(р-фенил)-пропиламида 1-аминоантрахинон-2-1карбоновой кислоты в виде коричневого порошка, т. ;пл. 275° С. Найдено, %: С 74,5; Н 5,1; N 7,4. С24Н2оОзМ2. Вычислено, %: С 74,9; Н 5,2; N 7,3. Пример 12. Аналогично примеру 10 из соответствующего бензоксазона-4 (II) и 17,5 г циклогекснлаМина (молярное соотношение И : амин 1 : 3) получают 20,8 г (81%) N-циклогексиламида I -амино-4-нитроантрахинон-2карбоновой КИСЛОТЫ в виде красного норошка, т. пл. 263-267°С. Найдено, %: С 63,8; Н 4,8; N 10,7. CaiHigOsNs. Вычислено, %: С 64,2; Н 4,9; N 10,7. Пример 13. В смесь из 100 г диметилформамида, 20 г 1,2-дигидро-6-циклогексила.мино-7,8-дифталоил-3,1,4-Н - бензоксазона-4 (II) и 5 г .ледяной уксусной кислоты при 0°С вдувают газообразный аммиак до тех пор, пока на тонкослойный хроматограмме не исчезнет пятно исходного продукта (примерно в течение 3 ч). Реакционную смесь вливают в разбавленную соляную кислоту, отсасывают, промывают водой до нейтральной реакции и сушат. Получают 18,9 г (98%) амида 1-амино-4N- (циклогексил) - а.миноантрахинон-2 - карбоновой кислоты, т. пл. 116-120°С. Примеры 14-29. Аналогично примерам 2, 3, 5, 6 или 10 нижеуказанные амины вводят во взаимодействие с бензоксазоном формулы Н. Н О О NOj Получают амиды 1-амино-4-нитроантрахинон2-карбоновой кислоты формулы О N0, где RI имеет указанные в таблице значения, в виде красного порошка.
Формула изобретения
1. Способ Получения амидов 1-ами.ноантрахи«он-2-карбоновой «ислоты формулы I
О NH
,СОШВ1
где RI означает Водород, ци«лоалкил с 5- 8 атомами углерода, или неразветвленный или развет1вленный алкил Ci-Cs, в Котором 1 или 2 атома водорода могут быть замещены гидроксилом, алкоксигруппой Ci-Се илифенилом, причем последний или алкил, или алкоксигруппа Ci-С4 могут содержать (В качестве заместителей хлор или бром; R2 - водород, ци«логек€иламино-, хлор,
бром или нитрогруппа, отличающийся
11
тем, что, с целью повышения порцесса, 1,2-дигидро-7,8 - дифталоил - 3,1,4-Н-бензоксазон-4 II
х
HN- O
где R2 имеет вышеуказанные значения, подвергают взаимодействи-ю с амином формулы III
RiNH2,
где RI имеет вышеуказанные значения.
2. Способ по п. 1, от лич а ю ш;и и ся тем, что процесс осущест1вляют в из-бытке амина, например 2-10 молей на 1 моль исходного продукта общей формулы II.
12
3.Способ по л. 1, отличающийся тем, что процесс О€уш,ествляют в инертном при условиях реакции растворителе, например в сильнотолярлых, смешиваемых с -водой
апротониых растворителях.
4.Способ ПО п. 1, о т л и ч а ю ш, и и с я тем, что в качестве сильнополярных, смешиваемых с водой аПротоННых растворителей используют любое из следуюш.их соединений: N,NдИМетилформамид,М,М-диметилацетамид,
амид-М,Й-диметилпропионовой кислоты, N,Nдиэтилформамид, амид-Ы,М-диэтиЛПропионовой кислоты, Ы,М-диэтилацетаМИд, :М-метилпирролидон, .пиридин или их смеси.
5. Способ 1ПОП. 4, отличающийся тем, что взаимодействие осуществляют в присутствии алифатических (Карбоновых кислот, например уксусной, пропионовой. 6. Способ -по п. 1, отличающийся тем,
что-Процесс ведут при О-80°С.




| название | год | авторы | номер документа |
|---|---|---|---|
| Способ выделения 1-нитроантрахинона | 1973 |
|
SU544365A3 |
| Способ получения 1-амино-5 или 8-нитроантрахинонов | 1975 |
|
SU615851A3 |
| СПОСОБ ПОЛУЧЕНИЯ АМИДА 1-АМИНО-4-МЕТИЛАМИНОАНТ- РАХИНОН-2-КАРБОНОВОЙ КИСЛОТЫ (ДИСПЕРСНОГО СИНЕГО КРАСИТЕЛЯ 3) ИЛИ АМИДА 1-АМИНО-4-ЦИКЛОГЕКСИЛАМИ- НОАНТРАХИНОН-2-КАРБОНОВОЙ КИСЛОТЫ (ДИСПЕРСНОГО | 1965 |
|
SU171059A1 |
| Способ получения аминоантрахинонов | 1979 |
|
SU767089A1 |
| Способ получения 4-аминоантрахинон-1-карбоновой кислоты | 1960 |
|
SU137523A1 |
| Производные 1,4-диаминоантрахинон-2-карбоксамида в качестве дихроичных красителей для жидких кристаллов | 1982 |
|
SU1060654A1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-АМИНО-2,4-ДИХЛОРАНТРАХИНОНА | 1971 |
|
SU289728A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ БЕНЗО(B)НАФТИРИДИНОВ И ПРОИЗВОДНЫЕ БЕНЗО(B)НАФТИРИДИНОВ | 1992 |
|
RU2105007C1 |
| Способ получения 2,5-бис-(1 -аминоантрахинонил-2 )-1,3,4-оксадиазола | 1976 |
|
SU704970A1 |
| Способ получения проивзодных бензимидазола или их солей | 1975 |
|
SU581866A3 |


Авторы
Даты
1976-05-15—Публикация
1973-11-06—Подача