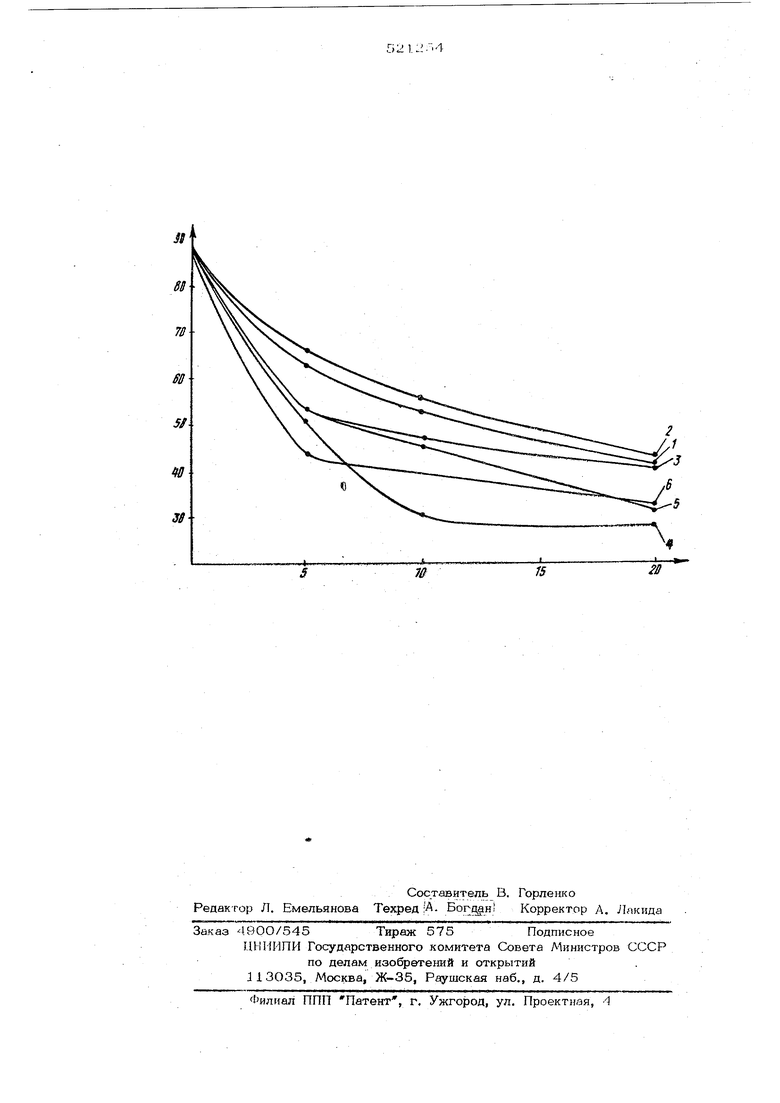
(54) ДИДЛКИЛОВЫЕ ЭФИРЫ 3-ОКСА-2,4-ДИАЛКОКСИ-6,7-БИЦИКЛО13.2,1 -ОКТАНДИКАРБОНОВЫХ КИСЛОТ КАК ПЛАСТИФИКАТОРЫ ПОЛИВИНИЛХЛОРИДА И СПОСОБ ИХ ПОЛУЧЕНИЯ эфир 3-окса-2,4-дибутокси-цис-6,7-бицикло .2. октандикарбоновой кислоты; 4 смешанный метилбутиловый эфир 3-окса- 2,4-дибутокси-цис- 6,7-бицикло 3.2. l октандикарбоновой кислоты; 5 5 - смешанный (5утилдециловый эфир 3-окса-2,4-диметокси -цис-6,7-бицикло з, 2. ij октандикарбоновой кислоты; 6 - диметиловый эфир 3-окса 2,4 -диметокси-транс-6,7-бицикло 3,2.1 J октандикарбоновой кислоты, Пластификатор вводят по методу Воскресенского при механическом перемешивании поливинилхлорида с соответствующим количеством пластификатора (5,1О и 20% от веса полимера). Смесь выдерживают в течение1 ч при 100 С до полного поглощения пластификатора. Прессованием под давлением 30 кг/см и отжигом при 90 С в течение 20 мин изготавливают таблетки размером 6 х 1,5 мм. Термомеханические испытания проводят на динамометрических весах В. А. Каргина при нагрузках 10 кг/мм , времени действи 1,5 ч и скорости нагрева 9О С/ч. Результаты термомеханических испытаний показывают, что предлагаемые соедине ния превосходят по своим пластифицирующи свойствам известные пластификаторы. Лучшим пластификатором оказался диметиловый эфир 3-окса-2,4-дибутокси-6,7-бицикло- Сз.2.Ij-октандикарбоновой кислоты. Заявле/нные соединения получают озонированием производных ЭНДО, ЦИС-, ЭКЗО, цис- или ЭНДО, ЭКЗО- бицикло- 2.2. l -5-гептен-2,3-дикарбоновых кислот в алифат ческом спирте при температуре от О до - 7О С ,с последующим восстановлением полученных при этом перекисных продуктов озонолиза диалкил-илй циклоалкилсульфидами или водородом в присутствии катализатора гидрирования и обработкой продуктов восстановления спиртом в присутствии кислотного катализатора. При этом авторами впервые было обнаружено, что если продукты озонолиза прои водных ЭНДО, ЦИС-, ЭКЗО, ЦИС-, или ЭНДО, ЭКЗО- бицикло- {2.2. l -5-гептен-2,3-дикар боновых кислот подвергают восстановлению а не окислению, как по известному способ то это позволяет получить новые соединения с улучшенными пластифицирующими св ствами по сравнению с известными. Пример 1. Дибутиловый эфир 3-окса-2,4-дибутокси-цис-в,7-бицикло- З, 2.1 -октяндикгорбоновой кислоты. В четырехгорлую колбу, смабженную ме- ; шалкой, обратным холодильником с отводом/ термометром и трубкой для ввода газа, помещают 8,2 г ангидрида эндо, цис-бицикло- 2.2. гепт-5-ен-2,3-,дикарбоновой кислоты и 320 мл метанола. При температуре -70 С черезipacTBOp пропускают озонкислородную смесь (5,5 вес.% озона) со скоростью 25 л/ч до появления голубой окраски раствора (цвет растворенного озона). Реакционную смесь продувают аргоном, приливают 5,2 мл диметилсульфида, размешивают 1 ч и оставляют на ночь при комнатной температуре. Метанол отгоняют, остаток разбавляют fводой и отфильтровывают 5,8 г (48%) син-3,5-бис-(метоксиметил)-1,1 ,2,1 -циклопентандикарболактона; т. пл. 17,8,5-179,5°С (из спирта), ИКспектр (V , см ) : 1780 (С-О в пятичленном лактоне), ПМР-спектр ( d , м.д., число протонов) : 3,48, 3,42, 3,35, 6Н (20СН), 5,2-5,05, 2Н (:.,..,/Oai ) OR( Найдено,%: С 54,23; 54,8О; Н 5,95; 5,69. Г с н Og. Вычислено,%: С 54,54; Н 5,83. 5 г диалктона кипятят 3 ч в 85 мл н-бутанолав присутствии 2 мл концентрированной серной кислоты. Реакционную смесь промывают водой, затем 5%-ным раствором соды, снова водой и сушат над сульфатом магния. После отгонки i н-бутанола под вакуумом получают 8,55 г (90,5%) эфира 1 (RJ -Rj R ), т. кип. 220-221°С/5-мм рт. ст.,п 1,4775. ИК-спектр V см 1740 () широкая полоса с расщеплением при 119О о.с. и 1275 ср.(С-ОН) :L035 ср. и 1О78ср., . . О - i ИЗО ср. ( Q ). ПМР-спектр ( «У , м. д., число Н): Ш11рокие мультиплеты с вершинами при 0,87, 0,95, 12Н (4СН|-С), 1,88, 16H(4C-CHj -CH.-C), сложные мультиплеты в области 3,12-3,5, 4H(SC-0-CHjj-), 3,5-3,88, 4Н(2-С-0-СНд,), 5,9 и 6,25, 2H(2H-Ct°jJ) Найдено,%; С 65,29; 65,58; Н 9,52; 63,46, 63,64. ,. Вычиг;лено,%: С 65,76; Н 9,71; 64,0. Пример 2. 2,05 г ангидрида (а) озонируют в 35О мл н-бутаиола, как описано в примере 1, до появления озона на выходе из реактора (определяют по вытеснению йода из водного р,чст1юра иоанстого калия). Реакционную смесь продувают аргоном, добавляют 2ОО мл метанола и гид руют при комнатной температуре и нормаль ном давлении над катализатором Р( на Ва$0ддо исчезновения перекисей. Метанол отгоняют к остатку добавляют 2 мл конце трированной серной кислоты и кипятят 10 мин. На следующий день реакционную смес промывают водой, затем 5%-ным раствором соды и водой, сушат над сульфатом магния и бутанол отгоняют. Получают 4 г (70%) эфира 1. (R 2. 5 ), идентичного по ИК- и ПМР-спектрам эфир полученному в примере 1, П-р 1,4745. I Пример 3. Зг дибутилового эфира эндо, цис-бицикло- 2.2. lJ-renT-5-ен-2,3-дикарбоновой кислоты озонируют в 1ОО мл Н бутанола и обрабатывают далее, как описано в примере 2. Получают 3,36 (72%) эфира 1 (RJ R ), ЧК и ПМР-спектры которого идентичны спектрам эфира из примера 1, И тр 1,4755 I Пример 4. Зг дибутилового эфира озонируют в 100 мл н-бутанола и дале восстанавливают, как описано в примере 1 К восстановленному продукту добавляют 5О мл воды, экстрагируют эфиром (.3 раза по 30 мл), эфирный экстракт промывают водой (3 раза по 20 мл) и сушат над суль |фатом магния. Растворитель отгоняют, оста ток наносят на окись алюминия в колонке и элюируют эфиром. После упаривания получают 3,0 г (64%) эфира I (Rj R., R, ), ИК- и ПМР-спектры которого идентичны спектрам эфира из примера l,. 1,4753. Пример 5. 4,1г ангидрида, экзо, цис-бицикло- Г2.2.11-гепт-5-ен-2,3-дикарбоновой кислоты озонируют в 7ОО мл н-бутанола и обрабатывают далее, как описа но в примере 2. Получают 8,2 г (72%) эфира 1 (RJ R Rj ,), ИК- и ПМР-спектры которого идентичны спектрам эфира 1 из примера 1, л 1,4750. I Пример 6. Смешанный метилбутиловый эфир З-окса-2,4-дибутокси-цис-6,7- -бицикло- СЗ.2.1 -октапдикарбоновой кислоты. 2,8 г диметилового эфира эндо, цис-бицикло- 2.2.ll-renT-5-eFi-2, 3-дикарбоновой кислоты озонируют в 50 мл н-бутанола как описано в примере 2. К реакционной смеси добавляют 50 мл метанола, гидрируют как в примере 2. Метагюл отгоняют под .вакуумом, добавляют 5 мл концентрированной серной кислоты и кипятят 1 ч. .Обрабатывают как описано с примере 2. Получают 4,4 г эфира 1 (R СИ R,K,x н-С. ), т. кип. 214-216 ,j н-С.1 (j - I (4 мм 1,-172Г5. ИК-спектр рт. ст.; ( V , см ):1740 с (), широкая полоса при 1190 о. с., 1275 ср. (C-OR), 1035 ср. 1075 ср. ИЗО с (С ), ПМР-спектр ((, м. д., число Н) ; широкие мультиплеты с вершинами при 0,875, 0,96 и 1,42, 21Н (3O-CH},-CHj-Cn), мультиплеты в области 3,1-4,1 9Н (, С-О-СН -С), 5,1, 5,88 и 6,1 С-ОСН. и 1н(2СНС Найдено,%: С 63,44; 63,60; Н 8,63; 8,77; OAt к эквивалент 120. Cj,H,gO. Вычислено,%: С 63,74; Н 9,24; OAt к эквивалент 103,5. Пример 7. Смешанный бутилдециловый эфир 3-окса-2,4-диметокси-цис-6,7-бицикло- СЗ. 2. i) -октандикарбоновой кислоты. 4 г бутилдецилового эфира эндо, цис-бицикло- 2.2.1 -гепт--5-еи-2,3-дикарбот. кип. 210-214°С (3 мК1 новой кислоты рт. ст.) 1,4662 Q j.,4662 озонируют в 5О мл метанола и затем гидрируют, как описано в примере 2. Катализатор отфильтровывают, добавляют 5 мл- концентрированной cep-i ной кислоты, кипятят 1 ч и обрабатывают Как в примере 2. Получают 6,3 г (77%) , эфира I (R н-СдН., К н-С,Н. СН),.т. кип. 153-154 (3 ст.), Пд 1,4639; ИК-спектр ( V , ;. 1740 с (), широкая полоса 1185 о. с., 1280 ср. (С-О-Р ), 1045 ср.,. ,1070 ср. и ИЗО ср. (CZolc ), ПМРспектр ( (У , м. д., число Н) : мультиплеты с вершиной при 0,88, 6Н (2С-СН.), 1,2, 20Н (10C-CHJ.-C-), 3,1-4,1, ЮН (2ССоГ, 2C-0-CHj,-C). Найдено,%: С%е,24; 66,61; Н 9,97; 10,06. ,. Вычислено,%: С 65,76; Н 9,71. Пример 8. Диметиловый эфир 3-окса-2,4-диметокси-цис-6,7-бицикло- 3. 2.1 -октандикарбоновой кислоты. 3 г диметилового эфира эндо, цис-биШ1КЛО- 2.2. l -гепт-5-ен-2,3-дик ар боковой кислоты озонируют в 6О мл метанола, как описано в примере 1, приливают 1,7 мл диметилсульфида и оставляют на ночь при комнатной температуре, затем добавляют 4О мл воды, экстрагируют эфиром (3 раа по 25 мл), эфирный экстракт промыват водой (3 раза по 2О мл-) и сушат над g5Од.-Растворитель отгоняют, остаток аносят на Окись алюминия в колонке и люируют эфиром. После упаривания полуают 3,2 г (70%) эфира 1 (R Rj К :.Uj) т. кип. 129° (2 мм рт. ст.),п ( V , см ): 1740 1,4712. ИК-спекгр с (COiCHj), 1180 с, 122О с 127.0 ср. (C-0-CHj), 1070ср. 1125 ср. э ). ПМР-спектр ( d f м. м., число Н) : 3,20, 6Н (20СН), 3,54, 6Н (29-Cx3Hj), 4,34 (tQreneT. Гц), 2Н (2GHZi ). Найдено,%: С 54,56; 54,58; Н 7,1О; .7,21; OCHj 42,6; 42,8, С,,Н,оО|. Вычислено,%: С 54,16; Н 6,99; ОСН 43,0. Пример 9. Диметиловый эфир 3-окса-2,4-диметокси-транс-6,7-бицикло- .2. ij - октавдикарбоновой | кислоты. 3 г эндо, экзo-бициклo-t2.2.i7-гeпт-5-eн-2,3-дикapбoнoвoй кислоты озонируют в 150 мл метанола, как описано в при мере 1, приливают 1,6 мл диметилсульфид размешивают 1 ч и оставляют на ночь при комнатной температуре, затем добавляют 15 мл концентрированной серной кислоты и кипятят 3 ч. После охлаждения к реакпионной сйеси приливают 5О мл эфира, .промывают водой (2 раза по 5О мл) 5%.ным раствором соды (2 раза по 50 мл), из водных растворов экстрагируют эфиром (3 раза по 70 мл); объединенный эфирный раствор промывают водой (5О мл), сушат ,над сульфатом магния и эфир отгоняют. .Получают 4,22 г (75%) эфиоа 1 (R ,), т. кип. 156-158 С/5 мм рт. fn 1,4715. ИК-спектр (V , смМ:174 9 (, ИЗО с., 1220 с., 127О ср (С-О-СН Г, 1075 с 1120 с. (СС р. . ПМР-спектр ( , м. д., число Н): 3,20, 6Н (20CHJ, 3,52 и 3,55, 6Н {2C-OCH . . 4,21 {дублет, 8 Гц), 2Н{2СН: Найдено,%: С 54,80; 54,88; Н 7,21; ОСН.41,8; 42,2. 5 4 Вычислено,%: С 54,16; Н 6,99; ОСИ,, 43,0. Пример 10. Я,® г диметилового эфира эндо, экзо-бицнкло-(2.2.1 -гепт-5-ен-2,3-дикарбоновой кислоты озонируют в 50 мл метанола, как описано в примере 1, приливают 1,1 мл диметилсульфида, размешивают 1 ч и оставляют на ночь при комнатной температуре, затем добавляют 5 мл концентрированной серной кислоты и кипятят 3 ч. Далее обрабатывают, как в примере 9. Выход эфира I () 2,4 г (8О,5%), т. кип. 153° 5 мм рт. ст.) nj 1,4718, ИК- и ПМР-спектры идентичны спектрам эфира из опыта 9. Формула изобретения 1. Диалкиловые эфйры 3-окса-2,4-диалкокси-6,7-бицикло- 3.2.1 -октандикарбоновых кислот общей формулы /Ч Пз«-исС,...;;сн-ояз Чг Ri и R, означают алкильные радикалы с числом атомов углерода 1-10, как пластификаторы поливинилхлорида. 2. Способ получения соединений по п. 1, отличающийся тем, что производные эндо, цис-, экзо, цис - или эндо N-J экзо-бицикло- 2.2. ij-5-гептен-2,3-дикарбоновых кислот подвергают озонированию в алифатическом спирте при температуре от О до -7О С с последующим восстанов;}енкем полученных перекисных продуктов озонолиза диалкил- или циклоалкилсульфидами :или водородом в присутствии катализатора -гидрирования и обработкой продуктов восста1новления спиртом в присутствии кислого катализатора..
7В SB 5/
ts
38
5
I .
20
15
W



| название | год | авторы | номер документа |
|---|---|---|---|
| Эфиры бис-(диалкоксиметил)-циклопентанмоно-или-дикарбоновых кислот как пластификаторы поливинилхлорида и способ их получения | 1974 |
|
SU521255A1 |
| Макроциклические гексаперекиси в качестве инициаторов радикальной полимеризации и структурирования полимерных систем и способ их получения | 1976 |
|
SU586169A1 |
| Способ получения производных бициклических карбоновых кислот или их аддативных солей с кислотами | 1973 |
|
SU583749A3 |
| Способ получения 9-дезокси-9 @ -метиленизостеров @ или их лактонов или их солей | 1979 |
|
SU1053745A3 |
| Способ получения бициклических простагландинов или их солей | 1977 |
|
SU978725A3 |
| Способ получения 1-формил-2-ацил3-оксициклопентанов | 1976 |
|
SU639854A1 |
| Способ получения 9-деокси-9а-метилен-изостеров ПГJ @ или их лактонов | 1980 |
|
SU1360582A3 |
| Способ получения алкилпроизводных простановой кислоты | 1974 |
|
SU649311A3 |
| Способ получения производных 2-имидазолидинона | 1988 |
|
SU1653542A3 |
| Способ получения амидов ряда 1,4,7,7-тетраметилбицикло[2.2.11]гептана | 1988 |
|
SU1631058A1 |


Авторы
Даты
1976-07-15—Публикация
1974-08-27—Подача