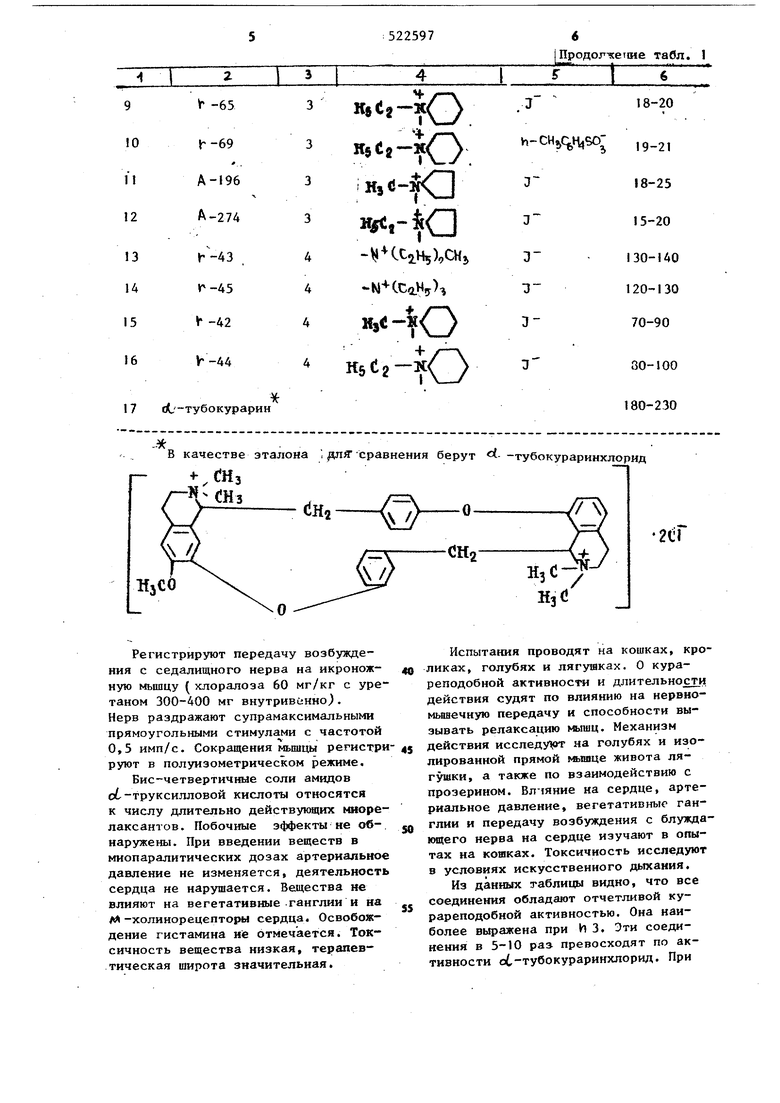
Изобретение касается получения иовой группы соединений, обладающих высокой курареподобной активносr-tХллгТ {clH2) где R - водород, алкил; R - алкил или совместно с атомом азота образует гетерощ|клический радикал, например пирролйдил, пиперидил; X - остаток неорганической или органической кислоты, например йод, хлор, (-Sft СН ), СбНэ W / Эти соединения представляют собой соли или четвертичные соли бисi( диалкиламиноалкиламидов) d, -труксилловой кислоты общей формулы l 1Щ(СН2) d н (,); .И- целое число 2-5. Известно, что курареподобную активность проявляют также другие типы соединений, например в6-тубокурарии и некоторые бис-четвертичные соли биc-aлкa €инoвыx Jфиpoв 1,3-дифенилциклобутан-2,4-дикарбоновых 352 кислот.Два из наиболее активных соединений последнего типа прошли экспериментальное и клиническое изучение и предложены для анестезиологии в качестве недеполяризующих миорелаксантов непродолжительного действия - анатруксония L13 циклобутония 2 J. Однако наряду с положительными качествами анатруксоний и циклобутоНИИ в миопаралитических дозах обладают нежелательным дл-холинолитичесКИМ действием, что затрудняет в некоторых случаях их практическое использование. Поэтому вмявление соединений подобной активности, но не Курареподобная актив сС-труксилло
CfrHl
н
н (JgHg
((jH)
2х 4 обладающих М-холинолитическим действием, имеет важное практическое и теоретическое значения. Впервые было обнаружено, что замена с.ложнозфирнбй группы в известных соединениях на имидную для некоторых производных бис-алкаминовых эфиров 1,З-дифенилциклобутан-2,4дикарбоновых кислот приводит в ряде случаев к активным миорелаксантам (см. структурную формулу I). В табл. приведены зкспериментальные данные показывающие эффективные недеполяризующие свойства соединений формулы U ). -, Таблица 1 ь производных амидов кислоты




| название | год | авторы | номер документа |
|---|---|---|---|
| Ди-(пара-толуолсульфонат) бис метил- - (1-адамантил)аминоэтилового эфира янтарной кислоты,как недеполяризующий миорелаксант кратковременного действия | 1975 |
|
SU539435A1 |
| СПОСОБ ПОЛУЧЕНИЯ ЧЕТВЕРТИЧНЫХ СОЛЕЙ Л^-МЕТИЛ--Л'- | 1970 |
|
SU287926A1 |
| Способ получения производных изохинолиния | 1985 |
|
SU1468414A3 |
| Бис-(4,5-оксиметил-2-метил-3-окси)пиридиниевая соль 2-нитрокси-бутан-1,4-диовой кислоты и способ его получения | 2018 |
|
RU2712914C2 |
| Способ получения производных 2-фенил-3-ароилбензотиофена или их солей | 1976 |
|
SU701539A3 |
| 5-( ω - АМИНОАЦИЛ)-5,10-ДИГИДРО-11H-ДИБЕНЗО[B, E] [1,4]-ДИАЗЕПИН-11-ОНЫ ИЛИ ИХ СОЛИ, ОБЛАДАЮЩИЕ ПРОТИВОАРИТМИЧЕСКОЙ АКТИВНОСТЬЮ | 1989 |
|
RU2026862C1 |
| Соли мезидидов @ -пиперидинкарбоновых кислот, обладающие местноанестезирующей, антиаритмической и антифибрилляторной активностью, и мезидиды @ -пиперидинкарбоновых кислот в качестве промежуточных продуктов для синтеза солей мезидидов @ -пиперидинкарбоновых кислот | 1983 |
|
SU1120654A1 |
| Способ получения олигодиметилсилоксанов,блокированных триалкиламмониометильными группами | 1977 |
|
SU745905A1 |
| Способ получения производных 2-ароил-3-фенилбензотиофенов или их солей | 1976 |
|
SU764610A3 |
| Способ получения солей арилсульфониламидоалкиламинов | 1975 |
|
SU622399A3 |

-М(.0,Ц5)2СИз
-M CCiHy)
«-Ю
220-240
200-220 А5-50
25-30 18-20
16
V--44
7 oL-тубокурарин В качестве эталона , .Я сравнения Г- -.енз . (jHa(,-) «зсо Регистрируют передачу возбуждения с седалищного нерва на икроножную мышцу (хлоралоза 60 мг/кг с уре таном 300-400 мг внутривенно). Нерв раздражают супрамаксимальными прямоугольными стимулами с частотой 0,5 имп/с. Сокращения мьпицы регистр руют в полуизометрическом режиме. Бис-четвертичные соли амидов о -труксилловой кислоты относятся к числу длительно действунйцих миоре лаксантов. Побочные эффекты не обнаружены. При введении веществ в миопаралитических дозах артериальное давление не изменяется, деятельность сердца не нарушается. Вещества не влияют на вегетативные-ганглии и на АЛ -холинорецепторы сердца4 Освобождение гистамина ни отмечается. Токсичность вещества низкая, терапевтическая широта значительная.
ea-iQ
80-100 180-230 берут - -тубокураринхлорид о-V/ Испытания проводят на кошках, кроликах, голубях и лягушках. О курареподобной активносга и длительности действия судят по влиянию на нервномьанечную передачу и способности вызывать релаксацию к&шц. Механизм действия исследу т на голубях и изолированной прямой живота лягушки, а также по взаимодействию с прозерином. Влчяние на сердце, артериальное давление, вегетативные ганглии и передачу возбуждения с блужданицего нерва на сердце изучают в опытах на кошках. Токсичность исследуют в условиях искусственного дыхания. Из данных таблицы видно, что все соединения обладают отчетливой курареподобной активностью. Она наиболее выражена при И 3. Эти соединения в 5-10 pas превосходят по активности ot-тубокураринхлорид. При 7 увеличении длины цепи до И 4 блок рующее влияние на нервно-мьппечную передачу снижается в 3-5 раз. Наиме нее эффективны соли с И 2. По мех низму действия все эти вещества отн сятся к недеполяризующим средствам, бни вызывают вялый паралич у голу-, бей, не вызывают контрактуры изолированной прямой мышцы живота лягушки и устраняют стимулирунщее действие на нее ацетилхолина и карбохолина. Антагонистом соединений формулы (I ) является прозерин. Предложенные соединения могут бы получены реакцией об - труксилловой кислоты или ее производных (галоИдангидриды, эфиры и т.п.) с первичiHO-третичными аминами NHj (CH2)iNR2. и последующим превращением образующихся аминоамидов в соли действием кислот НХ или в бис-четвертичные соли действием алкилирующих агентов Выделение ведут известными приемами Пример I. К раствору 6,6 г дихлорангидрида сС-труксилловой кис лоты в 40 мл дихлорэтана прибавляют раствор 6,2 г 1,4гМ-пиперидилбутиламина в 30 МП дихлорэтана при 3 С, выдерживают 16-18 ч при 20 С, затем прибавляют 20 мл воды, отделяют органический слой и последовательно извлекают 3 раза (по 10 мл) 5%-ным раствором серной кислоты и 1 раз 10 мл воды. Водные экстракты объединяют, обрабатывают активированным углем, фильтрат подщелачивают раствором аммиака до рН 9 при 3-5 С. Выделяется масло, которое при стоянии закристаллизовывается. Получают 5,7 г бис-(1,4-Н-пиперидилбутилами да) об-труксилловой кислоты, т.пл. 152-153 С (из ацетона). Найдено,%: С 75,48; Н 9,15; Н 9,78. о Сз6 %0 Вычислено,%: С 75,15; Н 9,01; N 9,74. Смесь 4 г а П1Ноамида, 40 мл метанола и 4 МП йодистого этила нагревают 1 ч при до исчезновени щелочной реакции, выпадает осадок, который перекристаллизовывают из метанола. Получают дийодэтилат бис(1,4-Ы-пиперидилбутиламида) о -груксилловой кислоты. Т.пл. 236-238 С (с разложением). Найдено,%: а 28,78 Вычислено,%: 328,68 (см.табл.1, соединение 16), 8 Пример 2. Аналогично получают бис-( (Г-диэтиламинопропиламид) «--труксшшовой кислоты, т.пл. 135Пб С. Найдено,%: С 73, 58; Н 9,23; N 10,51. 4-°г Вычислено,%: С 73, 84; Н 9,23; N 10,67. Дихлоргидрат, Т.пл. 150 С. Найдено,%: С1 11,64. Вычислено,%: СЕ 11,95, Дийодзтилат, Т.пл. 246-248 С (с разложением). Найдено,%: 3 30,80 Вычислено,%: D 30,65 (см.табл.1, соединение 7). Пример 3. Смесь 6,5 г диметилового эфира « -труксилловой кислоты и 4,64 г р)-диэтиламинозтиламина нагревают в круглодонной колбе при I40-150 С в течение 12ч. Реакционную массу растирают с 50 мл воды и подкисляют концентрированной соляной кислотой,оставщийся осадок не вошедшего в реакцию эфира отфильтровывают, промывают водой, соединенные фильтраты подщелачивают 25%-ным водным аммиаком. Выделившийся осадок отфильтровывают, промывают водой, сущат и перекристаллизовывают из ацетона. Получают 4,7 г аминоамида. Т.пл. 137-138 С. Найдено,%: С 72,76; Н 8, 94; N 11,15. 3o4l2U 2Вычислено,%: С 73, 14; Н 9,00; М 11,36. Дийодэтилат. Смесь 2 г основания растворяют в 30 мл метанола, прибавляют 2 мл йодистого этила и кипятят смесь 6 ч до исчезновения в пробе щелочной реакции. После испарения Метанола осадок растирают с ацетоном и перекристаллизовывают из спирта. Получают 2,1 г бис-четвертичной соли. Т.пл. 254-256 С (с разложением) . Найдено,%: ,37. Вычислено,%: 3 31,59 (см.табл.1, соединение З). Пример4. К раствору 5,2 г 1,3-у- (N-пирролидил) пропиламина в 40 мл дихлорэтана прибавляют раствор 6,6 г дихлорангидрида с(.-труксилловой кислоты в 30 мл дихлорэтана, выдерживают смесь 16 ч при 20 С,прибавляют 20 мл воды, отделяют органический слой и последовательно экстр; 9 гируют его 3 раза по 10 мл 5%-ной серной кислотой и 1 раз 10 ип воды. Экстракты объединяют, обрабатывают активированным углем, к 4 льтрату прибавляют при раствор аммиака Образуется масло, которое при стояг НИИ закристаллизовывается. Получают 6,3 г бис- ,(4-пирротщ л) про пиламид о.-труксилловой кислоты. Т.пл. 135-137С (из зтилацетата). Найдено,%: С 74,33; Н 8,28; N 11,10. С НддМлЯгВь1числено,%: С 74,33; Н 8,58; N 10,85. Смесь из 0,5 г основания, 5 мл метанола и 0,5 мл этилового эфира
Формула изобретения Бис-(диалкиламиноалкиламиды) ci
Н
Н +
УВК2Т«((5Нг)МН- Н
труксиловой кислоты общей формулы
V
(JiHs Н J - 2ffl{(iH8) KIlRiif
Н 710 h-толуолсульфокислоты нагревают до ,исчезновения щелочной реакции, по охлаждении реакционную смесь растворяют в воде, обрабатывают активированным углем, фильтрат испаряют, в остатке получают И -толуолсульфонат в виде стекловидной массы. Найдено,%: М 6,43; S 7,60. 46 69 4 Вычислено,%: N 6,44; S 7,38 (см. табл.1, соединение Ю). Аналогично получают и другие соединения общей формулы (Г), в которыхзначения -NR , XR, П ja также температуры плавлен йя основания, соли или четвертичной соли представлены в табл.2. Таблица 2 ,где R R X п и52259712водород, алкил;проявляющие курареподобную активалкил или совместно сность. атомом азота образует гетероциклический радикал.Источники информации, например пирролидил, пипе- 5принятые во внимание при экспертизе ридил;1. Авторское свидетельство СССР остаток неорганической или 360343, Бюллетень изобретений органической кислоты, на-р 36, 1972. пример йод, хлор,(-ЗОдСН), 2. Авторское свидетельство СССР (n-CH,);to№360849, Бюллетень изобретений целое число 2-5,f, 27, 1973.
Авторы
Даты
1982-03-07—Публикация
1973-09-27—Подача