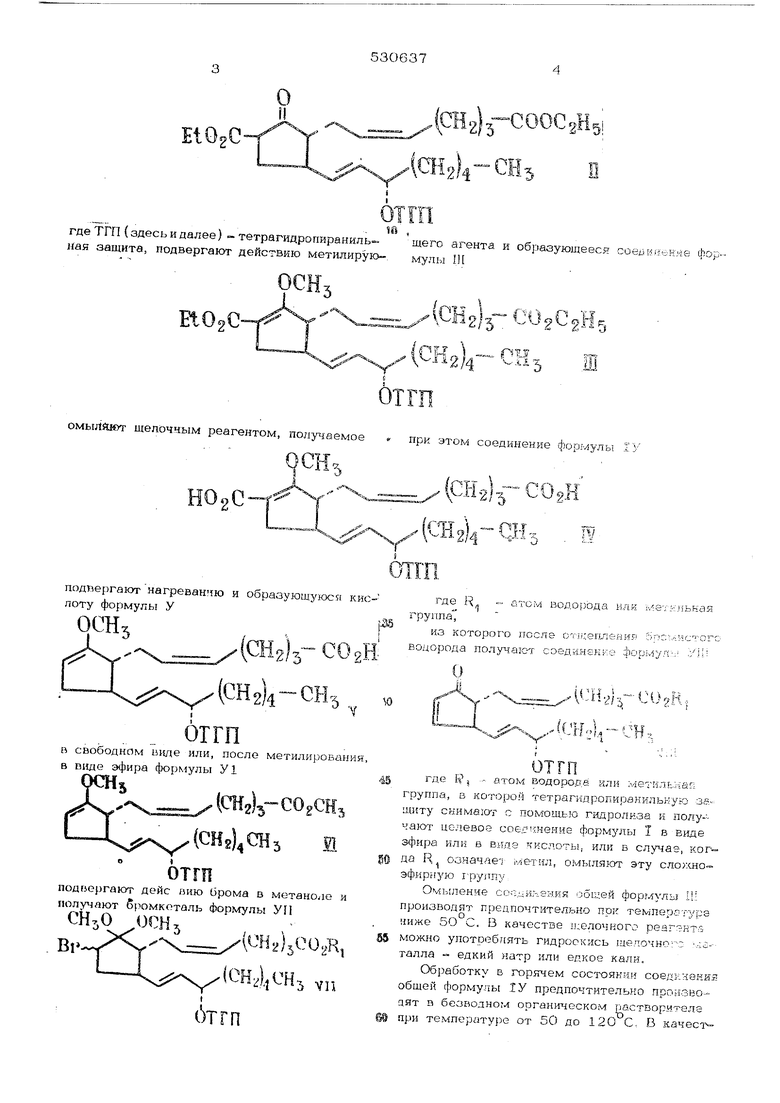
где К означает атом водорода или мётильная. г руппа, заключающийся в том что со-1 25 единения формулы II
где ТГП{ здесь и далее)-тетрагидропиранильИая защита, подвергают действию метилирую-,
EtOgC омыЛйют щелочным реагентом, получаемое . подпергают нагреванию и образующуюся к лоту формулы У 2)з-С0 (CHsk-CH, ,„ отгп в свободном виде или, после метилировани в виде эфира формулы У1 2/3 ( И подвергают дейс аию брома в метаноле и получают бромкоталь Формулы CHjO OPHj , , X.-- : i - 5C02R, (CH,).jCH3 уп бтгп
gl -COOCgH i
(Cli2)C05pC5 Hn
- I
„ pOIJ
ш
12/4 V..AA3
у ™„. рГ ТГ
1.121 5 g.n
(.
V щего агента и образующееся соенкккле фо мулы IJ при этом соединение формулы группа, из которого после отпгегшенив бп::лисчог воцорода получают соедннекке фор уЛ: ./il: :Но; -с02«| .- CIIoj.. где J - атом водорода или Me-isabHEK группа, в которой тетрагидропиранилькуьз зв щиту скимагот с помощью пщролиаа и получают целевое сое,с мнение формулы I в виде эфира или в виде кислоты, И71К в случае, когда R ооначлет 1ле-тил, омыляют эту эфирную группу Омьгление сс Хииьэння обшей формулы производят П едпочтительно при температ-урэ ниже 5О С. В качестве и;елочкого реагэнтй можно употреблять гидроокись шелочно: ; .-laталла - едкий натр или едкое кали. Обработку в горят1ем состоянии соедичекия общей формулы 1У предпочтительно производят и безводном органическом растворителе при температуре от 50 до 120 С, В качес - :ве органического растворителя можно исполь зовать ксилол. I - Для превращения 1простатриеновЬй кисло;ты обшей формулы У в сложный эфирГпроста |триеновой кислоты обш:ей формулы VI ис- : пользуют диазоалкан, соответствуюищй целе;вому сложному эфиру, и работают в среде органического растворителя, например в хло;ристом метилене, хлороформе и дихлорэтане. 1 В качестве,реагентаэтерификации можно также употреблять соответствующий галоид- ный алкил или диалкилсульфат. : Избирательное бромметоксилирование слож ного эфира простатриеновой кислоты общей формулы VI производят в особо мягких ус ловиях, предотвращающих фиксацию брома на других двойных связях С Д U ) и миграцию этого брома и приводящих к получению бромкеталя формулы уП причем процесс проводят в интервале температур -70 до -30 С. Для того чтобы нейтрализовать кислую среду, прибавляют щелочную соль сла бой кислоты - уксуснокислый натрий или однокислотный фосфорнокислый натрий. Для отщепления 6pONfflCToro водорода от бромкеталя общей формулы V i I предпочтительно используют диазабициклоалкен, и Б особенности диаза -1,5-бицикло- 4,3-0 -нон-5-ен и проводят реакцию в биполярном ianpOTOHHOM растворителе диметилсульфоксиде, диметилформамиде, диметилацетамвде, ил гексаметилфосфотриамид е. Для гидролиза тетрагидропиранилового эфи ра общей формулы Vm употребляют в качестве кислотного реагента предпочтительно щавелевую кислоту и реакцию проводят в ор ганическом растворителе, например в этаноле. При желании эфир формулы VIИ можно омылить с помощью мягкого щелочного реагента: кислого углекислого натрия. Для приготовления пpoJ IЗвoдныx про.становой кислоты общей формулы ; I можно также бромметоксилировать производное самой ;Простатриеновой , кислоты общей формуЛЫ V и после отшепления бппмигтпгч- по после отщепления бромистого водорода из образовашегося бромистогх производного, подвергнуть полученное производное кислому гидролизу. Благодаря этому можно упразднить ста5аию этерификации пpoизвoднoJгo простатриеновой кислоты общей формулы V и таким образом исключить стадию конечного омыления, что значительно улучшает выход целевого продукта. Описанные ниже примеры иллюстрируют данное изобретение а также получение исходных соединений, Опыт 1. Приготовленпо этилового эфира 7-бром-5-гог тоас)Вой кислоты. Стадия А. 6-( dL-тетрагидропиранилокси)-1-хлор-4-гексин. Охлаждают до -35 С 15О см аммиака, .прибавляют 0,77 г лития в присутствии неiбольше го количества азотнокислого окисного I железа в качестве катализатора и оставдя- jioTiB контакте в течение одного часа, при|бавляк т при перемешивании 14 г пиранило;вого эфира пропаргилового спирта в растворе 150 см и продолжают перемешивание в теучение двух часов. Затем прибавляют раствор 15,7 г хлорбромпропана в 25 см эфира и перемешивают в течение 3 час при -35°С нейтрализуют прибавлением 5,25 г хлористого аммония, упаривают аммиак, обрабатывают остаток эфиром, насьпценным водой, а |3атем водой, экстрагируют эфиром, промы|Вают эфирные слои водой, сушат их и упари|вают досуха. 13 г 6-( cj тетра|гидропиранипоксн)-1 хлор 6 гексин в виде j бесцветного лагдкого продукта, растворимого IB спиртах, эфире, бензоле и хлороформе, ки пяшего при 100 С (0,6 мм рт.ст.); г 1,485. Исходный продукт - пнраинловый эфир Iпропаргилового спирта получают описанным способом. Стадия Б. Нитрил-7-{ о1 -тетрагидропи:ранилокси)-5--гептина. I Вводят 34,174 г б-( (J -тетрапщропи ранилокси)1 Хлор-4-гексина в 75 диметилфюрма изда, прибавляют водный раствор :13,б г цианистого калия н перемешивакп реакционную смесь в течение восьми часов :при 8О С, затем охлаждают, прибавляют ДОО см воды и экстрагируют эфиром, эфир:Ный слой промывают водой до нейтральности шромывных вод, сушат над сернокислым и упаривают досуха, при этом получают 23 г нитрила 7-{ d -тетрагидропиранилокси)-5-гептнна в ввде.бесдветной жидкости, растворимой в спиртах, )ире, бензоле и хлороформе, нерастворимой в воде, кипящей 115с (0,1 мм рт.ст.); П 1,481. I ИК-спектр показывает присутствие тетрагидропираннлокси групп. : Стадия В. 7-( d-тeтpaгIIдpoпиpaнилoкcli)-6-гeптинoвaя кислота групп. Смесь, состоящую из 22,5 г нГггрила 7-( сА. -тетрагидропнранилокси)-5-гептина, .9,5 г едкого каля и 12О см 5О%-ного эта;нола нагревают при 80 С в теченио .18 час ь атмосфере азота н при псремещивгигин, затем удаляют этанол в вакуук е, П11пбаилякгг 50 см воды, охлаждают, npiteaanHKra 15(см эфира н доводят pli cNtecu до 4 ntiiin.-iB/ioitiiем ледяной 0,5 и. соляной кислоты, ;).|, |ный с.юн промьшают водой, ..:уш,Г1 a.i c.-purjкислом MaTHHSj ; фильтруют и упаривают в ва- и кууме. Получают 21,3 г 7-( d -тетрагидропиранилокси)-5-гвптиновой кислоты в виде бесцветной жидкости, растворимой в спиртах эфире, бензоле и хлороформе, нерастворимой в воде; п 1,485, Стадия Г. Этиловый эфир 7-(OL -тетрагидропиранилокси)-5-гептиновой кислоты. Смесь, состоящую на 2О г 7-{сК-тетрагидропиранилокси)-5-гептиновой кислоты, 100 см метанола и 5,4 г метилата натрия перемешивают в течение 1 час при комнатной температуре упаривают метанол в вакууме и получают 22 г натриевого эфира 7-{ d -тетрагидропиранилокси)-5-гептиновой кислоты. Смешивают 21 г полученной таким образом соли с 70 см диметилформамида, прибавляют 27,2 г бромистого этила и нагревают реакционную смесь при 80 С в, течение 2 час. при перемешивании, выливают в воду, экстрагируют эфиром, промывают водой эфирный слой, после чего сушат над сернокислым магнием, упаривают растворитель и фракционируют остаток. Получают 13 г этилового эфира 7-( Л -тетрагидропиранилокси)-5-гептиновой кислоты в виде бесцветной жидкости, растворимой в спиртах, эфире, бен золе и хлороформе, нерастворимой в воде, кипящей при 122 С (О,1 мм рт.ст); пЗ 1,47. Стадия Д. Этиловый эфир 7-окси-5-гептиновой кислоты. Перемешивают один час 10 г этилово1Х1 эфира 7-( d -тетрагидропиранилокси)-5-гептиновой кислоты, 20 см эфира, 5 см 25%(Гьи серной кислоты и 20 см метанола, при бавляют ЗО см воды, экстрагируют эфиром, промывают водой эфирный слой; сушат над углекислым натрием и упаривают эфир в вакууме. Получают 4,3 г этилового эфира 7-окси-5-гептиновой кислоты в виде бесцветной жидкости, растворимой в спиртах, эфире, Зензоле и хлороформе, нерастворимой в воде липяшей при 91 С (0,5 мм рт.ст.); пj| - « 1,465. Этиловый эфир 7-окси-5-гептиновой кислоты может быть также получен следующим образом. Нагревают с обратным холодильником в атмосфере азота в течение 3 час смесь 20 г 7-(с1.-тетрагидропиранилокси)-5-гоптиновой кислоты, 12 г этанола, 5О см бензола и две капли концентрированной серной кислоты Затем дают температуре дойти до комнатной и прибавляют 2О см 12,5%-ной серной кис лоты, ЗО CNr этанола и следы лаурнсульфата натрия. Перемсш)1вают в течонп одной ночи при 20 С, а затом HuiiTpannoyjOT углекислым натрием, 3iccT ani iyic-T эф11|н-м, сушат, упаривают растворитель под уменьшенным давлением и ректифицируют остаток. Таким образом получают 8,5 г этилового эфира 7-окси-5-гептиновой кислоты, идентич HQ с описанным выше. Стадия Е. Этиловый эфир 7-окси-5-гептеновой кислоты. Вводят 300 мг 5%-ного палладия на сернокислом барие в 20 см этилового эфира уксусной кислоты, продувают и пропускают ток водорода. После поглощения 6 см водорода прибавляют раствор 4 г этилового эфира 7-окси-5-гептйновой кислоты в 7 см этилового эфира уксусной кислоты, хгодеБжашего 0,4 см хинолина и споласкивают 14см этилового эфира уксусной кислоты, затем продувают и пропускают ток водорода. После поглощения 570 см водорода фильтруют спосласкивают фильтр этиловым эфиром уксусной кислоты, промывают органические сло 0,5 н. соляной кислотой, а затем водой, сушат над сернокислым магнием, обрабатывают активированным углем, фильтруют и упаривают досуха. Получают 2,6 г этилового эфира 7-окси-5-гептеновой кислоты в виде бесцветной жидкости, растворимой в спиртах, эфире, бензоле и хлороформе, нерастворимой в воде; f п 1 1,453. Стадия Ж: Этиловый эфир 7-бром-5-гептеновой кислоты. Смешивают при перемешивании Юг этилового эфира 7-окси-5-гептеновой кислоты и 120 см петролейного эфира, охлаждают до -10 С и прибавляют раствор 2,9 г трибромида фосфора в 30 см петролейного эфира, перемешивают в течение тридцати ми-v нут при -10 С и в течение 1 час при О С, выливают реакционную смесь в воду, экстрагируют эфиром, промывают водой эфирные слои до нейтральности промывных вод, сушат над сернокислым магнием и упаривают под уменьшенным давлением. Собирают 11,55 г маслянистого продукта, который очишают пропусканием через, двуокись кремния и элюиpoBaHHeNT смесью циклогексан-этиловый эфир уксусной кислоты (85-15). Получают 9,73 г этилового эфира 7-бром-5-гептеновой кислоты в тще бесцветного жидкого продукта, растворимого в спиртах, эфире, бензоле и хлороформе, нерастворимого в воде; |л г. 1,4825. Опыт П. Приготовление этилового эфира (1, -тетрагидропиранилокси-транс-октеннл-13 -циклопентанон-2-карбоновой кислоты. Стадия А. Этиловый эфир З-оксо-6-гептиновой кислоты. 1) Енолят кислого магнийэтилового эфира малоновой кислоты. В атмосфере азота раст9530637
воряют 7,3 г кислого этилового эфира мало-Этиловый эфир 3-этокси-6-ин-2-гептеноновой кислоты в 50 см тетрагидрофурана,вой кислоты может быть еще приготовлен
прибавляют 0,10 моль бромистого изопропил-следующим образом.
магния в тетрагид}хх|)урановом растворе, слег-: В атмосферу азота перемешивают 10,1 г
:ка нагревают, доводят заново до комнатной j|этилового эфира 3-кето-б-гептиновой кйсло|температуры и сохраняют в атмосфере азота.|ты, 1ОО см этанола, 20 см этилового эфи2)NI N -тионилдиимидазола.;Раст-|ра ортомуравьиной кислоты и 1 г п- толуворяют 15 г имидазола в 100 см тетрагид-1олсульфокислоты и нагревают с обратным хорофурана, прибавляют раствор 6 г хлористо- лодильником в течение одного часа и 2Омин. :го тионила в ЗО см тетрагидрофурана при юЗатем охлаждают, прибавляют хлористый ме перемешивании в течение 15 мин, фильтруют,|тилен, вылтзают реакционную смесьвЮОсм
промывают фильтр;тетрагидрофураном и полу- ледяного 1 н. едкого натра, промывают орчают раствор Ы,ы-тионилдиимидазола.;ганйчёский слой ледяным 1 н. едким натром,
3)Пропаргилацетилимидазол. К получен- а затем водным раствором хлористого нат|ному выше раствору N, И-тионилдиимидазона|рия, заново экстрагируют промывные раствола прибавляют 5 г пропаргилуксусной кисло--ры хлористым метиленом, сушат объединенты, растворенной в 5О см тетрагидрофура- ные слои над сернокислым натрием, фильтруна и перемешивают в течение 15 мин придот и упаривают досуха в вакууме. Остаток комнатной температуре, при этом получают;хроматографируют на силикагеле, злюируют раствор пропаргилацетилимидазола, который 20 хлористым метиленом и получают 6,716 г
:употребляют в данном виде.|этилового эфира 3-этокси-6-ин-2-гептеновой
4)Конденсация. Этот раствор прибавля-|К {слоты, одинакового с предыдущим.
ют к еноляту магнийорганического соедине-I Стадия В. Этиловый эфир З-этокси-8-окния, полученного по способу 1 и перемешива-|си-9-хлор-6-ин-2-тетрадеценовой кислоты. ют при комнатной температуре в течение Охлаждают до -25 С смесь 2 г этиловоной ночи, подкисляют прибавлением 4%-нойjго эфира 3-этокси-6-1ш-2-гептеновой кислосоляной кислоты, экстрагируют эфиром, про-|ты и 15 см тетрагидрофурана и прибавляют мывают эфирный слой водным раствором кис--0,25 см 1,О85 н. эфирного растйора бутиллого углекислого натрия, сушат, обрабатыва-:лития, оставляют в контакте в течение 1 час ют активированным углем, фильтруют и мин. при -25°С, охлаждают до -30°С и ривают досуха. Остаток пропускают черезприбавляют 3 г dL -хлоргептаналя, оставглинозем, элюируют хлористым метиленом .|ляют в контакте в течение 30 мин при-20- С, и Получают 6,03 г этилового эфира 3-оксо-;затем в течение 30 мин при 0°С и дают -6-гептиновой кислоты, которые употребля-/дойти докомнатной температуры. Реакционют в данном виде вСледующей фазе. Соеди- ную смесь выливают в ледяной водный раст- нение имеет вид светло-желтых призм, раст-;вор монофосфата натрия, экстрагируют эфи- воримых в спиртах, эфире, бензоле и хлоро-;ром, промывают органический слой водным форме, нерастворимых в воде, плавящихся;раствором кислого углекислого натрия, а запри 25 С. водой и наконец водным раствором хлоСтадия Б. Этиловый эфир З-этокси-6-ин-|ристого натрия, сушат над сернокислым нат-2.гептеноъой кислоты., обрабатывают активированным углем,
Растворяют Юг этилового эфира 3-ок-:фильтруют и упаривают досуха. Остаток хро,со-6-гептиновой кислоты в ВО см этанола,матографируют на силикагеле, элюируют хлоприбавляют 30 см этилового эфира opTOMy- j|ристым метиленом, содержащим 0.5% ацето:равьиновой кислоты и 0,35 смз серной кисло-|на, остаток очищают {повторно хроматр графиты и перегоняют 25 см растворителя приg на силмкагеле и элюированием хлористым
пропускании азота в течение сорока 5 мин,метиленом, содержащим 0,25% ацетона, а
Затем охлаждают, прибавляют хлористый ме-|затем хлористым метиленом, содержащим
тилен, промывают 2 н. едким натром, экст- ,50% ацетона. Получают 1,85 г этилового
рагируют хлористым метиленом, сушат орга- эфира 3-этокси-8-окси-9-хлор-6-ин-2-тетраническ ий слой над сернокислым натрием, об-1деценовой кислоты в виде аморфного, светлорабатывают животным углем, фильтруют иЖелтого продукта, раствэримого в спиртах,
упаривают досуха в вакууме. Остаток хрома-j, эфире, нерастворимого в воде. тографируют на силикагеле, элюируют хлорис-я ,п/ -, -, ,
тым метиленом и получакл- 7,О5 г этилово- °Д йл я4
го эфира 3-этокси-6-ин-2-гептеновой кисло-18 29 4 344,Ь7.
ты в виде светло-желтой жидкости, раствори-Найдено, % : С1 10,3.
мой в спиртах, эфире, бензоле и хлороформе,УФ-спектр (этанол): макс, при 237 нм,
(нерастворимой в воде.gQЕ 35 7. Стадия Г. Этиловый эфир 3-ч)ксо-8-окси-9-хлор-6-тетрадешюновой кислоты. Нагревают при 50 С в течение 1 час ЗО МИН;, смесь 6,95 г этилового эфира 3-этокси 8-окси-9-хлор-6-ин-2-тетрадеаеновой кислоты 70 см® этанола и 35 см 2 н. СОЛ5ШОЙ кислоты, при перемешивании и в ат мосфереазота, охлаждают, выливают реаккионную смесь в воду, экстрагируют хлористым метиленом, промывают органический слойвод ным раствором кислого углекислого натрия, а затем водой до нейтральности промывных вод, сушат над сернокислым натрием, фильтруют и упаривают досуха в вакууме. Получа ют 6 г сырого этилового эфира З-оксо-8-окси-9-хлоро-6-тетрадециновой кислоты, которые очищают хроматографией на силикагеле и элюированием смесью 1шклогесан-этнповый эфир уксусной кислоты (70-30). Соединение имеет вид светло-желтых крис галлов, растворимых в спиртах и эфире и нерастворимых в воде. Вычислено, %: С1 11,2. Найдено, %: Се|11,4. УФ-спектр. 1) Этанол. Макс при 2 44TIM . Перегиб у 279 пм 2) Этанол, О,1 н. Макс, при 275 пм. . Можно также получить этиловый эфир 3-оксо-8-окси-9-хлор-6-тетрадециновой кислоты исходя из этилового эфира 3-этокси-6-ин-2-гептеновой кислоты (полученного в .стадии Б), и работая следующим образом. 1) Конденсация. Охлаждают до смесь состоящую из 6,5 г этилового эфира 3-этокси-6-ин-2-гептеновой кислоты и тетрагидрофурана и прибавляют 29 см 1,6н. раствора бутиллития в гексане, при перемешивании в тече1ше 3 час. Затем прибавляют .раствор 9,7 oi; -хлоргептаналя в 25 см тетрагидрофурана и перемешивают в течение 1 час при -60 С, затем дают температуре дойти до О С, выливают реакш1онную смесь в ледяной,насыщенный водный раствор первичного фосфата, экстрагируют эфиром, прок ывают эфирный слой насыщенным, водным
раствором кислого углекислого натрия, а затем водой до нейтральности промывных вод, сушат над сернокислым магнием и упаривают досуха.
2).Г1Вдрол113. Остаток растворяют в 1 ООсм этанола и 56,5 см 2 н. соляной кислоты.
нагрепая при 5О-6О С в течение 1 часЗОмин шат над сернокислым натрием, обрабатывают при персмещивани и в атмосфере азота, ох- активированным углем, фильтруют и упарива|лаждают- и выливают раствор в смесь воды €0 ют досуха в вакууме. Получают 3 г этилг эфира уксусной кислоты, продувают, пропускают ток водорода в течение 2 час. После поглощения 223 см водорода фильтруют, поласкивают фильтр этиловым эфиром уксусной кислоты, промывают органический слой 0,5 н. соляной кислотой, а затем водой, сусо льдом, затем экстрагируют эфиром, промьтают эфирный слой водой до нейтральности промывных вод, сушат над серноксилым магнием и упаривают досуха. Получают 16 г сырого этилового эфира 3-оксо-8-окси-9-хлор-б-тетрадеционовой кислоты. З) Очистка. Летучие вещества, находящиеся в 16 г сырого соединения, удаляются перегонкой под уменьшенным давлением, по окончании перегонки охлаждают, забирают остаток эфиром, обрабатьшают животным угяем, фильтруют и упаривают досуха. Остаток растворяют в изопропилового эфира, прибавляют при перемешивании 4 объема цетролейного-эфира, охлаждают раствор до -60 С, прибавляют петролейный эфир до образования осадка и декантируют.Остаток смешивают с 22 см этанола и 113 см насьшхенного раствора уксусномедной соли, перемешивают смесь в течение одной ночи, декантируют, промьюают образовавшийся медный комплекс водой и фильтруют под уменьшенным давлением. , (Вводят комплекс в суспензию пётролейно- го эфира, перемешивают в течение 1 час в бане лед-вода, фильтруют, промывают фильтр ледяным петролейным эфиром, а затем ледяной смесью петролейного эфира и эфира (21); осадок растворяют в хлористом метилене, подкисляют прибавлением разбавленной у1ссусной кислоты, прибавляют хлористый метияен, промывают водой хлористометиленовые слои, а затем водным раствором кислого углексилого натрия и наконец водой до ней ральности промывных вод, сушат над сернокислым магнием и упаривают досуха. Получают этиловый эфир 3-оксо-8-окси-9 хлор-6-тетрадеш1новой кислоты, одинаковый предьщущим. Стадия Д. Этиловый эфир З-оксо-8-окси-9-хлор-цис-6-тетра-децено ой кислоты, Вводят 240 мг 5%-ного палладия на сернокислом барие в 15 см этилового эфира уксусной кислоты, продувают и пропускают ток водорода в течение ЗО мин. После поглощения 6 см водорюда прибавляют раствор 3,03г этилового эфира 3-оксо-8-окси-9-хлор-6-тетрадециновой кислоты в 5 см этилового эфира уксусной кислоты, содержащего 0,3см хинодина и прополаскивают 15 см этилового вого эфира 3-оксо-8-окси-9-хлор-иис-6-тетрадеценовон кислоты в виде светло-желтого амо тфного продукта, растворимого в спиртах и эфире и нерастворимого в воде. Вычислено, %: С 60,27; Н 8,54; С1 11,12 318,84. Найдено,%: С 60,0; Н 8,4; С1 10,8. .УФ-спектр (этанол): ЕУ 25 Перегиб у 226 пм Е % QO макс при 243 пм Стадия Е. Этиловый эфир 3-оксо-транс-8,9-эпокси-цис-6-тетрадеценовой кислоты. Растворяют 5 г этилового эфира З-оксо|-8-окси-9-хлор-цис-6-тетрадеценоврй кислоты в 50 см третичного бутанола и прибавляют в атмосфере азота 32 см 1 н. раствора третичного бутипата калия в третичном бутаноле при перемешивании в течение сорока пяти минут. Прибавляют хлористый метилен, выливают в насыщенный водный раствор монофосфата натрия, экстрагируют хлористым метиленом, промьшают органический слой водой, сушат над сернокислым натрием, обрабатывают активированным углем, фильтруют и упаривают досуха, в вакууме. Остаток хроматографируют на силикагеле, элюируютсмесью циклогексанэтиловый эфир уксусной кис- лоты (1-1) и получают 3,4 г этилового эфи ра 3-оксо-транс-8,9-эпокси-цис-6-тетрадеценовой кислоты в виде светло-желтой жидкости, растворимой в большинстве обычных органических растворителей и нерастворимой в воде. Вычислено, %: С 68,05; Н 9,28. 2 2 Найдено, %: С 68,3; Н 9,4.УФ-спектр (этанол): Макс, при 246 пм. Стадия Ж. Этиловый эфир 3- N -пирролидил-транс-8,9-эпокси-2-цис-6-тетрадекадиеновой кислоты. Смешивают 1,5 г этилового эфира 3-оксо-транс-8,9-эпокси-цис-6-тетрадеценовой кислоты, 15 см бензола 1,5 см пирроли- дина и 75 мг Tij- толуолсульфокислоты, про дувают азотом и- ставляют реакционную смесь в течение 4 дней при перемешивании и при комнатной температуре. По истечении |этогб времени упаривают досуха в вакууме, прибавляют-толуол для удаления избытка пиррю- лидина, забирают хлористым метиленом, про- мывают органический слой водой, заново экстрагируют хлористым метиленом, сушат объединенные органические слои на сернокис- лом магяие, обрабатывают активированным углем, фильтруют, и упаривают досуха, в ва|кууме. Получают 1,9 г этилового эфира 3- N -пирролидил-транс-8,9-эпокси-2-цис-6-тетрадекадиеновой кислоты в виде темножелтого аморфного продукта, растворимого в спиртах и хлороформе, и нерастворимого в воде. N 4,17. Вычислено, % : 335.,47. Найдено, %: N 4,9. УФ-спектр (этанол): перегиб 230 пм . :макс. при 289-290 пм Е ;;,740. полосы в ИК-спектре присутствуют: полосы при 1,671, 1 565, 1 446, и 1 143см Отсутствует полоса - ОН. Стадия 3. Этиловый эфир 3-(з-окси-транс-1-октенил)-( циклопентанон)-2 -карбо|новой кислоты. Вводят 9,3 г этилового эфира 3- N-пирролидил-транс-8,9-эпокси-2-цис-6-тетр здекадиеновой кислоты в 110 см тетрагидрофурана и прибавляют в атмосфере азота 4,3г амида натрия. Реакционную смесь оставляют на одну ночь при перемешивании при комна- ной температуре, выливают смесь в лед-чой водный раствор монофосфата натрия, экстрагируют хлористым метиленом, промываГот водои органический слой сушат над сернокис„ым магнием, обрабатьтают животным углем,: фильтруют и упаривают досуха под уменьшенным давлением. Остаток с сроматографируют на силикагеле и получают 3,4 г этилового эфира 3-{ 3-окси-транс-1-октенил)-циклопентанон-2- карбоновой кислоты, в виде желтой жидкости, растворимой , р спиртах, эфире, бензоле и хлороформе, нерастворимой в воде. Вычислено,%: С 57,98; Н 5,88; М 5,86. 2 (Динитробензоат). Найдено, %: С 57,8; Н 6,0; N6,1. Стадия И. Этиловый эфир3-(3- (JL-тетрагидропиранилокси-транс-1 -октенил)-цикло|пентанон-2-карбЬновой кислоты. Растворяют 3 г этилового эфира 3-(3-окси-транс-1-октенил)-циклопентанон-2- -карбоновой кислоты в 10 см эфира, охлаждают до О Си прибавляют 4 кристалла п, -толуолсульфоксилоты, затем 4 см дитащропирана, дают дойти реакционной смеси до комнтаной температуры, прибавляют безводный углекислый натрий и перемешивают в течение одного часа в атмосфере азота, фильтруют, упаривают при пониженном давлении растворитель и избыток дигидропирана. и получают 3,89 г этилового эфира 3-(3-вС« етрагидропиранилокси- -октенил)-цикло иентанон-2-карбоновой кислоты в виде бес15;16
цветной жидкости, растворимой в спиртах,перемешивании, экстрагируют эфиром, промыэфире и хлороформе, нерастворимой в воде.вают водой органический спой, сушат над
Вычислено, %: С 68,85; Н 9,29.сернокислым магнием и упаривают раствориCp-jH,, .0 366.тель под уменьшенным давлением. Остаток
Найдено, %: С 68,9; Н 9 О роматографируют на сшшкагеле и элюируют
Опыт Ш. Пригх)товление этилового эфира f ° .опТпТ эфир уксус15d.-( с1-тетрагидрошфанилокси)-10-карбо-1 ° (90-10), содержащей 1% триэтокси-9-оксс.5-цис-13-транс:-простадиено. ° г этилового эфира
вой кислоты - -твтрагидрош1ранилокси)-10-карбСтадия А/Этиловый эфир 15 «i-тет-f этокси-9 ксо-5-цис-13-транс.прост адиенорагидропирашшокси)9-оксо-8-карбэтокси-5- кислоты в ввде бесцветной жвдкости.
-цис-13-гранс-простадиеновой кислоты.растворимой в органических растворителях и
К раствору 3,3 г этилового эфира 3-(3-« растворимой в воде - U -тетрагидропиранш10кси-транс-1 -окте-1 Вычислено, %: С 69,23; Н 9,23. |нш1)-1Щклопентанон-2-карбоноврй кислоты в ЗО 48 7
15 см бензола прибавляют 1,165 г третич-Найдено, %: С 69,4; Н 8,9.
ного бутилата калия в атмосфере азота иПример 1. Метиловый эфир 15 ck -оксиперемешивают в течение 1 час при комнат--9-оксо-5-цис-1а,аЗ-транс-простатриеновой
ной температуре, затем прибавляют 1,.кислоты.
2,76 г этилового эфира 7-бром-5-гептено-Стадия А. Этиловый эфир 15d-( d -тетвой кислоты в 5 см бензола и оставляютрагидропиранилокси)-10-карбэтокси-9-метокреакционнуф смесь .в течение 24 час приси-5-1щс-9,13- ранс-простатриеновой кислокомнатной температуре. Выливают смесь а ч.
ледяной, водный раствор монофосфата натрия,,/«j Растворяют 420 мг этилового фира 15 экстрагируют хлористым метиленом, промы-j«э1,-( ot -тетрагидрошфанилокси)-1О-карбвают водой органический слой до нейтраль-этокси-9-оксо-5-цис -13- ранс-простадиеноности промывных вод, экстрагируют промыв-вой кислоты в 10 см эфира, прибавляют при 0& Hbie воды хлористым метиленом, сушат объ-40 см хлористометиленового раствора диаединенные органические слои над сернокис- , у зометана, содержащего 1,5 г на 1ОО см лым магнием и упаривают досуха. Остаток перемешивают, дают реакционной смеси хроматографируют на силикагеле, элюируютдойти до комнатной температуры и продолжасмесью циклогексан-этиловый эфир уксуснойJQT перемешивание в течение 8 час, упарива кислоты {8О-2О) и получают 3,9 г этило- избыток диаэометана под разреженным вого эфира 15ck.-( Ck-тетрагвдропиранилок-85давлением, и вьщерживают температуру ниси)-9-оксо-8-карбэтокси--5-цис-13-транс- 40°С, экстрагируют эфиром, сушат на -простадиеновой кислоты в виде бесцветнойсернокислом магние и упаривают досуха.Осжидкости, растворимой в органических раст хроматографкрукуг на силикагеле иэлюворителях и нерастворимой в.воде. диклогексан-этиловый эфир
Вычислен ; % 69,23; Н 9.23.40уксусной кислоты - триэтиламин (8О-2О-0,3).
ЗО 48 7 После испарения элюанта получают 295 мг
,,.,о/г- ог ипоэтилового эфира 15 ck-( ck.-гтетрагидропираНайдено,%: С 68,9; Н 9,2.ii/-; ос
-спектре:-9,13-транс-простатриеновой кислоты в виприсутствуют полосы карбонилов при 1 727 «де светло-желтой жидкости, растворимой в
большинстве органических растворителей и
Стадия Б. Этиловый эфир 15 oL -( ot. -нерастворимой в воде. -тетрагидропиранилокси)-10-карбэтокси-9-Вычислено,%: С 68,5; Н 9,4.
-оксо-5-цис-13-транс-простадиеновой кисло- С Н О 534
ты. 5О 7
Смешивают 2,8 г этилового эфира 15oL-Найдено, %: С 68,3; Н 9,0.
-( (i.-тетрагидропиранилокси)-9-оксо-10-карб-В ИК-спектре (в хлороформе) имеется полоэтокси-5-цис-13-транс-простадиеновой кис-са несопряженного сложного эфира при
лоты и 5,6 см 1,02 Н. раствора этилата1 729 , сопряженного сложного эфира
натрия и нагревают с обратным холодильни- Wпри 1 б93 , сопряженный при
кэм в течение 7 час, охлаждают, прибавля-1 627 съ.т и С-О-С.
ют 20см толуола, перегоняют азеотропнчес-УФ-спектр.
кн спирт до поднятия темпе1)атуры до 11ОС,макс, при 254 пм Е 1О,вОО сильно охлаждают роакинониую смесь, В1,ианна-Насколько известно, это соединение в пводиы) растиор моиэ4.ф;1та naTiJiiH iii.ni тературе не спнсано.
330637
нилокси)-1О-карбэтокси-9-метокси-5-цис1718
Стадия Б, 15 (k -( d -тетрагвдропиранил-ируют смесью циклогексан - этиловый эфир
окси)-10-карбокси-9-метокси-5нцис-9,13-уксусной кислоты - триэтиламин (90-10-1)
-транс-простатриеновая кислота.после упаривания элюента получают 125 мг
Нагревают в течение.6 час-при 70 Сметилового эфира 15ck-{ d -тетрагидропи190 мг этилового эфира 156 - (с1-тетра- бранилокси)-9-метокси-5-цис-9,13-трансгидропиранилокси)-10-карбэтокси-9- 1етокси--простатриеновой кислоты в виде светло-жел-5-9,13-транс-лростатриеновой кислоты,той жидкости, растворимой в большинстве ор1,065 см 1 н. едкого натра и 1 см сме-ганических растворителей и нерастворимой в
си диоксан-метанол /1-1/ отгоняют раство-воде.
ритель под уменьшенным давлением при тем-ЮВычислено, %: С 72,38; Н 9,9.
перат ре, не превьшающей 40°С, прибавлякп- с Н О 448.
3 см воды и экстрагируют эфиром, чтобыи лпс %. г -79 . н in 1
удалить нейтральные фракции, охлаждают вод-.найдено, л,, /,, п j.u,i.
ный раствор, насыщакл- хлористым натрием ° омыления: вьиисланное 125.
и подкисляют прибавкой 1 н. соляной кисло- ISнайденное 125.
ты, экстрагируют эфиром водный слой, про-; В ИК-спектре (в хлороформе) имеются помьгаают водой до нейтральности промывных лосы. i
вод, сушат на сернокислом машие и упари- Р « сложного эфира.,
ьают досуха под уменьшенным давлением. Насколько известно, это соединение в лиПолучакэт 170 мг 15d. -( dl-тетрагидропи-20 тературё не описано.
ранилокси)-10-карбокси-9-метокси-5-цис-. Стадия Г. Метиловый эфир 15d-(d-TeT-9,13-транс-простатриеновой кислоты в ви-:рагидропиранилокси)-10-бром 9,9-диметокси
де светло-желтой жидкости, растворимой 13-транс-простадиеновой кислоты,
большинстве органи-геских растворителей иj Охлаждают до -60 С смесь 836 мг метинерастворимой в воде. 25:лового эфира 15d. -( cL -тетрагидропираниВычислено, %: С 65,38; Н 8,94.;локси)-9-метокси-5-цис-9,13-транс-простаС Н О 478|триеновой кислоты, 50 см метилового спир27 42 7|та и 690 мг ацетата натрия, затем прибавНайдено, : С 65,7; Н 8,8.:ляют 9,5 см метанолового раствора брома,
В ИК-спектре (хлороформе) имеются полосы 30содержащего 3,3 г на 100 см дают реакциС-О-С, кислоты, комплексного приошюй смеси дойти до комнатной температу1 726 и 1 713 см и комплексного , прибавляют 5ОО мг кислого углекислого
при 1 634 и 1 615 см .натрия и оставляют на один час при комнатУФ-спектр. температуре, упаривают досуха подуменьмакс. при 250 пм, Е 8 95О. 35шенным давлением, забирают остаток смесью
Насколько известно, это соединение в ли-эфир-вода (3-1), промывают водой эфирные
тературе не описано.слои до нейтральности промывных вод, сушат
Стадия В. Метиловый эфир 9-метокси-jj сернокислом магние и кислом углекислом
-15 с -( cL-тетрагидропиранилокси)-5-цис-.натрие, и фильтруют. К эфирному раствору
-9,13-транс-простатриеновой кислоты. 0прибавляют 2-3 капли триэтиламина, упариНагревают с обратным холодильником ввают растворитель под уменьшенным давлетечение 3 час смесь 478 мг 15tk-( ck-нием и получают 1 гметилового эфира 15-тетрагидропиранилокси)-1О-карбокси-9-ме-- ( -( 0 -тетрагидропиранилокси)-10 токси-5-цис-9,13-транс-простатриеновой 45-бром-9,9-диметокси-5-цис-13-транс-простакислоты и 12 см ксилола, а затем упари-диеновой кислоты, который употребляют в
вают ксилол под уменьшенным давлениемданном виде в следующей стадии,
при температуре, не превышающей 60 С HIНасколько известно, это соед1шение в липолучают 15сК-( di.-тетрагидроплранилокси)-тературе не описано.
-9-метркси-5-иис-9,13-транс-простатриено-50Стадия Д. Метиловый эфир 15 ck-(ck. вую кислоту. 15с1-( 6 -тетрагидропиранил--тетрагидропиранилокси)-9-оксо-5-цис-1О,
окси)-9-метокси-5-цис-9,13-транс-проста-13-транс-простатриеновой кислоты.
триеновая кислота может быть очищена хро-Нагревают в течение 15 час при 85 С
матографически на силикагеле (элюент-эти-смесь 1 г метилового эфира 10 -бромловый эфир уксусной кислоты), и забранаэфи-55-15 Ck-( ck-тетрагидропира1П Локси)-9,9-диром, затем прибавляют при О С хлористоме-метдкси-5-цис-13-транс-просталие11опой кистиленовый раствор диазомптана, содержащийлоты, 15 смз диметнлсульфоксида и 1,15 г
1,5 г последнего на 1ОО см , упарива1 эт1,5-диазаб1 иикло-(4-3-О)- он-5-ена. Затем
растворитель при уменьшенном лавлении, хро-перегоняют диметнлсульфоксид и 1,5 д.а:шматографируют остаток ка снликагеле и элю-601бицикло-()-iiOH-5-of) при ВО С и npvi
530637
19 давлении ртути в 0,5 мм, забирают остаток этиловым эфиром уксусной кислоты, вылива ют в насыщенный раствор монофосфата натрия и перемешивают в течение 15 мин, тем декантируют, промьшают органический слой водой, экстрагируют хлористым метиле ном водные слои, сушат соединенные органические слои на сернокислом магние и уваривают досуха. Остаток хроматографируют на силикагеле и элюируют смесью циклогексаи этиловый эфир уксусной кислоты ); после упаривания элюента получают 38О мг метилового эфира 15 ck-( i. -тетрападропкрарилокси)-9-оксо-5-аис-10,13 тр5йс- -й ростатриеновой кислоты в виде желтого маспа( растворимого в большинстве органических растворителей и нерастворимого в воде. Вычислено, %: С 72.22; Н 9,25. 432. Найдено, %: С 72,5; К 9,3, В ИК-спектре IB хлороформе) имеются полосы сложного эфира при 1 730 см 1иклопентенона1 при 1 705 см и CsC при 1 588 . / УФ-спектр (этанол); макс, при 217 пм, Е 10 05О. Насколько известно, это соединение в литературе не описано. Стадия Е, Метиловый эфир 15 ck.OKCH-0-ОКСО-5-ЦИС-10,13-транс-простатриеновой кислоты. Смесь 360 мг метилового эфира 15 ck-( ck -тетрагидропиранилокси)9-оксо-5-цис-10,13-транс-простатриеновой кислоты, Юсм метанола, 21 мг щавелевой кислоты с 2Н„0 и 1 см воды нагревают при 45°С при пере мешивании и в течение 8 час, затем упаривают растворители под уменьшенным давлением за бирают остаток хлороформом, промывают хлороформный слой водой до нейтральности прот мывных вод, сушат на сернокислом магние и упаривают досуха. Остаток хроматографируют на силнкагеле и элюируют смесью циклогексан-этиловый эфир уксусной кислоты {5О-5О). После упаривания элюента получают 220 мг метилового эфира 15ci -окси-9-оксо-5-цис-10,13 транс-простатриеновой кислоты в виде бесцветной жидкости, раство римой в большинстве органических растворителей и нерастп римой в воде. Вычислено, %: С 72,37; Н 9,26. Sl 32°4 ®Найдено, %: С 72,7; Н 9,4. УФ-спектр (этанол): макс, при 211} пм 10 10О Пример 2. 15 d-ОКСН-9-ОКСО-5-ЦИС-10, 13-Т1(1Ис-п{юстг1трионовпя кислота.
20 Стадия А, 15 tk-( ft-тетрагидропиранилокси)--10 ),9-диметокси-5 цисс-13-транс-простадиеновая кислота. Охлаждакуг до -70°С 2,45 г 15cl-(ck-тетрагидропираннлокси)-9-метокси-5-цис 9,13-транс-простатриеновой кислоты, полученной по способу, описанному в стадии В примера 1, или по способу, описанному ниже,, 200 см метилового спирта и 2,13 г ацетата иатрия, а затем прибавляют по каплям, в течение 1 час, 18,5 см метанолового pscTBopa бромаt содержащего 5,5 г на ЮОсм, дают реакционной смеси дойти до комнатной температуры и перемешивают в течение час, упаривают досуха под уменьшенным давлением,, забирают смесью эфир-этиловый эфир уксусной кислоты {1-1), сущат, прибавляют несколько капель 1,5 диазаби1Шкло-(4-3-0)-нон-5 ена до появления щелочной реакции, а затем упаривают досуха. Таким образом получают 3,1Ь г 15 (с1ч Тетрагидропиранилокси)-10 -бром-9,9 диметокси-5-цис-13-транс-простадиено вой кислоты в виде желтого масла. Насколько известно, это соединение в литературе не описано. Стадия Б. 15 (Х-((.-тетрагидропиранилокси ) -9-ОКСО-5-ЦИС- 10,13 -транс-простатриековая кислота. Нагревают при 80 С в течение 15 час смесь 3,16 г 10 бром-15 dii-( с ц-тетрагкдропиранилокси )-9,8 диметилокси-5-цис-13-транс-простадиеновой кислоты, 5Осм диметилсульфоксида и 4,5 г 1,5-диазабицикло-{4-3-О)-нон-5-ена, затем перегоняют диметилсульфоксид. и 1,5-диазабицикло-(4-3-Cj)- нон-5-ен при 8О С и под давлением в ОДм рт.ст. Остаток забирают этиловым эфиром ук- сусной кислоты, выливают в насыщенный раст- вор монофосфата натрия, и перемешивают в течение 1 час, декантируют, сушат органический слой над сернокислым магнием и упаривают досуха. Таким образом получают 2,1 г 15 d.-( с -тетрагидропиранилокси)-9-оксо-5-цис-10,13-тран с-простатрненовой кислоты в виде желтого масла. Насколько известно, это соединение s литературе не описано, Стадия В. 15 Ьч.-окси-9-оксо-5-цис-1-0, 13-транс-простатриеновая кислота. Смесь 2,1 г 15 Л.-( сА.-тетрагидропиранилокси) - 9-оксо- 5-цис-10,13 -транс-проста риеновой кислоты, 60 см метанола и 126 мг шавелевой кислоты, нагревают при 40 С при перемешивании и в течение 3 час, затем упаривают растворитель под уменьшенным давленном, забирают остаток хлорофор)мом, промывают водой хлороформный слой
|ДО нейтральности ПрОМЬШИЫХ ::;ОД,
:сериокислым магнием и упёрьЕзка ;под уменьшенным давлением,
Таким образом, пол:уча: от -.,6 г-окси 9-оксо 5-.ЦИС 10,13 --г ра:аС Меновой кислоты в виде ; -1асла I Это соединение идеьпгчко .литературе.
Исходный продукт 13
,пиpaниnoкcи)9- дeтc:fc 6 -:;: f-простатриековая :.i-:iOv..
|4ена омылением ,-- ;
i™тeтpaгидpcпиpa l:vл кc i. -9- -:-.: 1.9ДЗ Тргакс-;фа :тсгтр; екогпг образом.
Смесь 2; с г- ме:-;-:/1:Епго i -тэтрагицропираиил:.;:;;-:)- Э- г-л . 9ДЗ-транс-лросй :-а :::№ ;с:;пй нормального аякого к;:.. :
3
по::1:-.епгзют действию метилирующего агенIL: :-i образующееся соед5шенпе формулы 111
()з 2С2Н5
HOgC-f -x rs:::: « :
L™J ...,-..,((2)4-СНз
1
отт
01 - ыпяют щелочным реагентом, получаемо лрн з::ом соединение формулы IV
(СН2)
f Т э
(CH2)
шт
:;Г;ан;1ю и обоазующуюся кис










акционную сг L
ной сол ч г-о
декный р I i
X. .-....-. Zlb .::-.-.,.,)
Oirii
FTie гтп. посля лгетилпрования,
:г.
х v,С1
-pg ,- озпг ; г :- -i-vU b :a(i .
о т л и ч а :о ИГ :; ;: о целью упро1це{пя прзг.эсса. мулы Ii
fetOvC..ptglrCOgCHj
...(),
О Т ГЦ
: ;..,.,,x(cii2)5co2Ri . ,-....-,,
--.--ч -4 21|СИ5 I
6тгп ,
: и 1 ..-. aj-r:M водородл НЛ1 ,етплы1ая
которого после отщеплоияя бромисто:рп;:ч1 пол- чяютсоепннеяие (fiopMyjibi (И
,.--4 ; ;:.r:.,),-C02R
-..)i-CH,
отгп
- : ::. i ::;м :;а ил;, :.; rii/i.Hriii групп;. - ; i:uiiv: i;iip. .jnuUi„„ 53063724
«soi
|Ту снимают с помощью гидролиза и получаютлы 1, где F - атом водороцелевое соединение формулы I в ввде мети-Д® метильная группа, че
лоЕого эфира или в виде кислоты, или реа: эфир формулы Vl чае, когда означает метил, омьшяютэту 30.11,70 - получение соединений формусложноэфирную группу. 9 . ® водороПриоритет по признакам:Да. через кислоту форму04.09.70 - получение соединений форму-j 
Авторы
Даты
1976-09-30—Публикация
1971-09-03—Подача