подвергают взаимодействию с водой в кислой среде при нагревании в присутствии сернокислойртути в качестве катализатора с последующей обработкой реакционной смеси водным раствором щелочи и нереводом полученного основания в гидрохлорид. Процесс предпочтительно проводят вереде 10%-ной серной кислоты при 60-70°С. В качестве водного щелочного раствора используют предпочтительно 25%-ный раствор аммиака. Хроматографированием полученной смеси на колонке и последующей кристаллизацией выделяют целевые продукты в виде основания IV и V. Гидрохлориды последних получают обработкой их эфирного раствора хлористым водородом. Далее приводится пример получения оснований IV, V и их гидрохлоридов формул (1а) и (16). Пример. Гидрохлориды эпимеров 1,2едиметил-тракс-декагидрохинолин - 4-спиро2-: 5 - оксиметил-Дз - дигидрофурана. Смесь 5 г (0,021 моль) 1,2е-диметил-4авинилэтинил - транс - декагидрохинолола-4 (2), 5 г (0,016 моль) сернокислой ртути и 3 мл (0,056 моль) концентрированной серной кислоты в 45 мл воды перемешивают при 60-70°С 12 ч. Катализатор отфильтровывают, в реакционную массу, предварительно охлажденную до 0°С приливают небольшими порциями предпочтительно 25%-ный водный раствор аммиака (до рН 7-8), всплывшее основание экстрагируют серным эфиром, высушивают над сернокислым магнием, удаляют растворитель и получают 3 г смеси продуктов реакции. При хроматографировании последней в тонком слое окиси алюминия (хлороформ- этанол, 1:0,1) обнаруживают одно пятно (Rf 0,46). Хроматографированием смеси на колонке (, 2-я степень активности, элюент - серный эфир) и последующей кристаллизацией из ацетона выделяют 0,33 г (11%) 1,2е-диметил-транс-декагидрохинолин-4-спиро-2- 5-окснметил - Д -дигидрофурана (IV) с температурой плавления 123-133°С, Ri 0,46. Найдено, %: С 71,9; Н 9,9; N 5,7. CisHzsOaN. Вычислено, %: С 71,7; Н 10,0; N 5,6. А также получают 0,21 г (7%) 1,2е - диметил-транс - декагидрохинолин - 4-спиро-2 - 5 - оксиметил-Д -дигидрофурана (V) с температурой плавления 156-158°С, Rf 0,46. Найдено, %: С 71,8; Н 10,1; N 5,7. CisHssOaN. Вычислено, %: С 71,7; Н 10,0; N 5,6. ИК спектр соединений IV и V: 1625 (70 С), 3600 см-1 (уО-Н). Спектр НМР соединений V и IV: 3,28 (СНгОН), 4,80 .(5-Н), 5,94 (3-Н), 6,14 (4-Н), б, м.д. Соединения IV и V имеют одинаковые спектральные характеристики, но резко отличаются друг от друга по температуре плавления. Изомеризация по С2 - центру и сочленению колец по данным спектров ПМР не имеет места, поэтому сделан вывод, что соединения IV и V являются эпимерами по Сб - центру: в одном случае оксиметальная группа занимает нсевдоэкваториальную ориентацию, а в другом - псевдоаксиальную. Для получения гидрохлоридов эпимерных 1,2е-диметил-гранс-декагидрохинолии4-спиро-2- 5-оксиметил-Дз - дигидрофуранов основания IV и V в количестве 0,5 г растворяют в 50 мл абсолютированного эфира, фильтруют, добавляют насыщенный эфириый раствор хлористого водорода до рН 5-6, осадок промывают 3-5 порциями (по 20 мл) абсолютированного эфира и высушивают в вакууме. Выход гидрохлоридов (1а) и (16) составляет 0,52-0,53 г (93%). Они сильно гигроскопичны. Спектральные характеристики (ИК-спектры, спектры ПМР) их тождественны спектральным характеристикам соответствующих оснований .и V. Соединения la и 16 проявляют противоаритмическую активность. При изучении фармакологических свойств в качестве эталонного соединения взят нрепарат хинидин, являющийся одним из наиболее активных и широко применяемых нротивоаритмических средств. Сравнительное изучение гидрохлоридов и хинидина показало, что указанные гидрохлориды проявляют высокую противоаритмическую активность на аконитииовой и хлоркальциевой моделях. Соединенне (а) в },6 раза активнее хинидина при аритмии, вызванной хлоридом кальция, а в эквивалентной дозе в 1,3 раза активнее хинидин а на модели аконитиновой аритмии. Соединение (16) на хлоркальциевой модели в 3,3 раза активнее хинидина и проявляет равный защитный эффект при аритмии, вызываемой аконитином. Токсичность гидрохлоридов (1а) и (16) в 3,2 и 2,5 раза соответственно ниже токсичности хинидина, а широта тераневтического действия в несколько раз больше, чем у хинидина. Данные испытания представлены в табице. Таким образом, гидрохлориды энимеров о положению 5 1,2е-диметил-тракс-декаидрохинолин-4-спиро-2- 5 - оксиметил -дигидрофуранов (1а) и (16) по силе ротивоаритмического действия на изученых моделях аритмии но широте терапевического действия и токсическим свойстам не уступают или превосходят эталоное соединение хинидин.
Фармакологические свойства и токсичность эпимгров 1,е-диметил-траяс-декагидрохинолин4-спиро-2- 5-оксиметил-Л -дигидрофурана гидрохлоридов

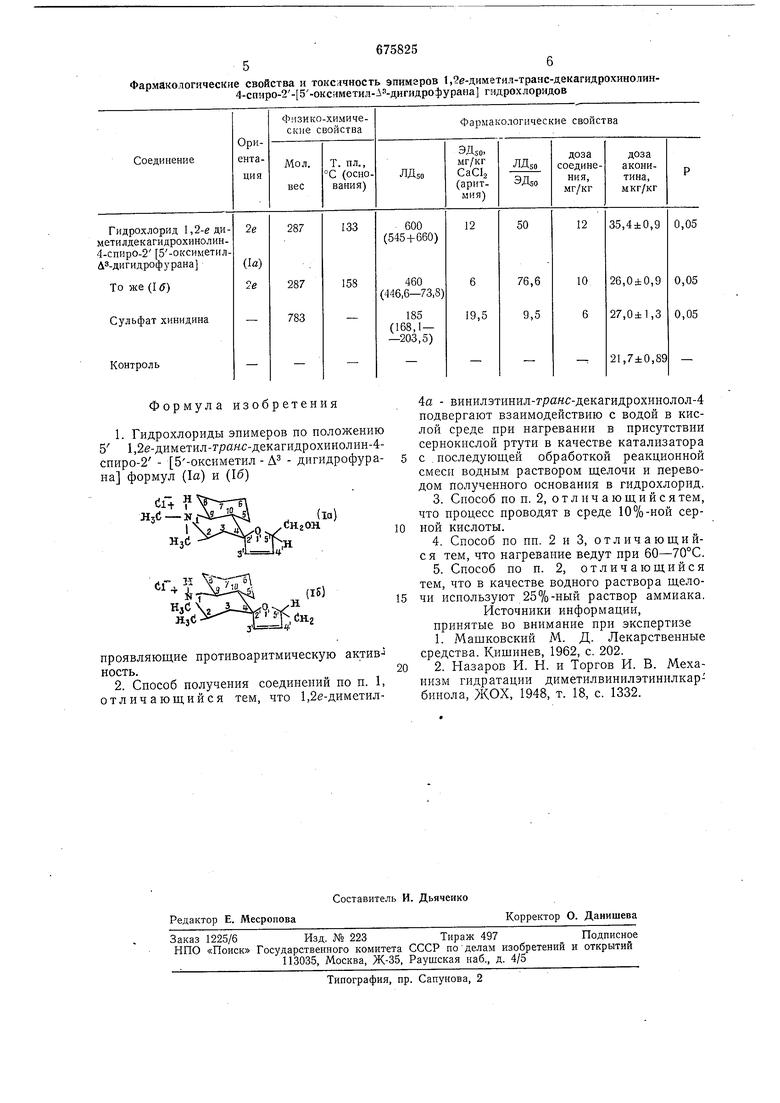

Формула изобретения 1. Гидрохлориды эиимеров по положению 5 1,2е-диметил-гранс-декагидрохинолин-4спиро-2 - 5-оксиметил - Л - дигидрофурана формул (1а) и (16) проявляющие противоаритмическую активкость. 2. Способ получения соединений по п. 1, отличающийся тем, что 1,2е-диметил4а - винилэтинил-транс-декагидрохинолол-4 подвергают взаимодействию с водой в кислой среде при нагревании в присутствии сернокислой ртути в качестве катализатора с последующей обработкой реакционной смеси водным раствором щелочи и переводом полученного основания в гидрохлорид. 3.Способ по п. 2, отличающийся тем, что процесс проводят в среде 10%-ной серной кислоты. 4.Способ по пп. 2 и 3, отличающийс я тем, что нагревание ведут при 60-70°С. 5.Способ по п. 2, отличающийся тем, что в качестве водного раствора щелочи используют 25%-ный раствор аммиака. Источники информации, принятые во внимание при эксиертизе 1.Машковский М. Д. Лекарственные средства. Кишинев, 1962, с. 202. 2.Назаров И. Н. и Торгов И. В. Механизм гидратации диметилвинилэтинилкарбинола, ЖОХ, 1948, т. 18, с. 1332.
Авторы
Даты
1980-02-29—Публикация
1977-01-10—Подача