/Н,.Н
группы ORi .в N-Xили , .и в
случае необходимости восстаиавливают М-оксогруппу для получения соединений,
.Н
где М - или , а для поЮН ОН
лучения соединений, где N-оксогрупла, продукт гидролиза окисляют, причем во время окисления для получения соединений, где М- оксипрупиа, группу М защищают и в случае необходимости 9- или 15-оксигруппы ацилируют и делевые иродукты выделяют в свободном виде или iB виде магниевых солей.
Для получения целевых соединений формулы I снятие защитной тетрагидропиральной группы проводят кислотно катализируемЫМ гидролизом. В качестве кислоты можно использовать любую кислоту, которая не вызывает деструкции молекулы в ходе удаления защитной группы, однако наиболее часто используют |65%-;ную водную уксусную (Кислоту, в альтернативном варианте диметил-т/ ет-бутилсилильную группу удаляют действием тетраалкиламмонийфторида Б растворителе, таком как тетрагидрофуран. М-оксогруппу желательно (восстанавливать с помощью борГидрида натрия для иолучбния -соедилеввй, где
/НхН
М-NИЛИ группа; М-0КСигруп ОН ОН
иу желательно окислять в оксогруппу действием реагента Джонса (трехокись xipOMa в пиридине).
П р и М е р 1. (тетразол-5-пл) t{Mc-2-гексен-1-ил -Зр - (За-окси-4 - фенил7/занс-1-бутен-1-ил)-циклопентанон.
Раствор 566 мг (тетразол-5-ил)цас - 2-гексен-1-ил - (тетрагидропирап-2-илокси)-4-фенил - транс - 1-бутеи-1ил -циклопентанона в 5,6 мл (65 : 35) смеси ледяной уксусной кислоты и воды перемешивают в атмосфере азота при 25°С в течение 18 ч, после чего -концентрируют на роторном испарителе. Полученное сырое 1.масло очищают хроматографированием на колонке ;на силикагеле (Вакег, 60-200 меш, используя хлороформ и этилацетат как элюенты. После элюирования менее полярных нримесей был собран маслянистый продукт с веоо.м 89 мг. В ИК-спектре (СНС1з) наблюдают сильное поглощение при 1730 для карбонила циклопентанона и среднее поглощение при 973 для транс-двойной связи. Удельное вращение (С 0,89, СНСЬ) измеряют при трех длинах волп:
9П S 74 h i
239,9°.
zu,ci aj.jg /o,J a
365
Пример 2. 5а-окси-2р- За-окси-4-фенил|бут-1-ил -1а- 6-(тетразол-5-ил)-гекс - 1ил -ЦИклопентан и 5р-окси-2|3- 3а - окси - 4феиилбут-1 -кл -1 (тетразол-5-ил) -гекс1-ил -циклопентан.
К раствору, охлажденному до 0° С, 100 мг (тетразол-5-ил) - гекс-1-ил -Зр За-0:К.ои-4-ф,енилбут- -ил - циклоиентанона в 10 мл метаиола добавляют охлажденный раствор 300 мг боргидрида натрия в 35 мл метанола. Смесь перемешивают при О-5° С в течение 30 мин, затем добавляют 2 мл воды. После удаления метанола на рото.рном испарителе водный слой покрывают этилацетатом я подкисляют до значения рН 3-10%-ной HCL Водный слой экстрагируют этилацетатом и объединенные органические экстракты промывают водой и насыщенным рассоло,м, сушат (безводным MgS04) и концентрируют. Очистка сырого продукта хроматографироваиием на колонке приводит к получению требуемого 5а-окси-2р- За-окси-4 - фенил-бут-Ьил - (тет1разол-5-ил) -гекс-1-ил -циклопентана и 5р-окси-2р- За-окои-4-фепилбут - 1 -ил -1а 6-тетразол-5-ил)-гекс-1-ил -диклопентана.
Пример 3. (тетразол-5 - ил)гекс-1-ил -Зр- За-о.кси-4-фенилтранс - 1-бутен-1-ил -циклопентаноп.
Раствор 46 мг (тетразол-5-ил)1{нс-2-гексен-1-ил -Зр- За - окси - 4-феиилгранс-1-бутен-1-ил -циклопентанона в 5 мл сухого эфира обрабатывают 448 мг (3,6 ммоль диметилизопропилхлорсилана и 360 мг (3,6 унлго./гб)триэтиламина при 25° С в течение 48 ч. Реакционную смесь охлаждают до 0°С, добавляют метанол и конечный раствор промывают водой (3x2 мл), MgSO4 и выпаривают до остатка 67 мг. Сырой остаток затем вносят в 6 мл метанола и 30 мг 5% Pd/C и образовавшуюся суспензию гидрируют в течение 4 ч при -22° С (ССЦ, сухой лед). После фильтрования через высококачественную ячейку и выпаривания продукт гидрирования гидролизуют в 2 мл амеси уксусной кислоты с водой (3:1) в течение 10 мин, разбавляют водой (20 мл и экстрагируют э-пилацетатом (4Х15лл). Объединенные органические экстракты промывают водой (2x10 мл), сушат MgSO4 и выпаривают с получением (тетразол-5-ил)-гекс-1ил -Зр- За-окси-4-ф енил-гранс-1-бутен - 1ил -днклопантанона иосле хроматографирования на колонке.
П р и М е р 4. 5а-Ацетокси-2|3-бензило.ксиметил-1а-6-(тетразол - 5-ил-г{мс-2-гексен1-ил -диклопентан.
Смесь 5,32 г (Q,Q ммоль) 5а-окси-2рбензилоксиметил - 1 (тетразол - 5-илt(U(;-2-reKcen-l-ил -циклопентанона, 30,0 мл пиридина и 4,43 мл (46,8 ммоль) уксусного ангидрида перемешивают под азотом при 50° С в течение 5,5 ч. Смесь выливают в 200 мл холодной 6 н. соляной кислоты. Водный слой экстрагируют этиладетатом. Органические экстракты промывают водой и ,насыщенньм рассолом, сушат безводным сульфатом малвия и кондентрйруют. Очистка сы(рого продукта хро.матографированием на силикагеле с и-спользованнгм смеси бензола с этилацетатом в качестве элю ентов прашодит к получению желаемого 5аацетокси - 2р-бензилоксиМехил - (тетразол-5-ил)-цыс-2-гексен-1-ил - циклопентала € весом 2,78 г (70%-ный выход). Пример 5. 5а-Ацетакси-2р- Зое- (тетрагидропиран-2-илокси)-4-фенил - транс-1бут€н-1-ил -1а - 6-(тетразол-5-ил)-гекс- 1ил -циклопентая. Раствор 250 мл 5сс-ацетокои-2|3-{3а-окси4-фенлЛ-транс-бутен-1-ил) - - (тетразол-5-ил-гекс-1-.ил - циклолентал, 0,250 мл дигидропирана, 2,5 мл хлористого метилена и 2,5 мг л-толуолсульфокислоты (моногидрата) .перемешивают при комлатной температуре под азотом в течение 15 мин. Реакционную смесь затем разбавляют эфиром, промывают водой, сушат безводным сульфатом магния и концентрируют для получевия желаемого 5а-ацетоксн-2((тетрагидропиран - 2-;Илоксн)-4-фен1ИЛ-г/7анс-1-бутен-1 - (тетразол - 5-ил)-гекс - 1ил -циклопентана. П .р и м е р 6. 5а-окси-2р- 3а - (тетрагид;роп.ира«-2-1Илокои)-4 - фенил-транс-1-бутен-;ил -1а - (6-(тетразол-5-ил)-гекс - 1-ил циклонентан. Однородный раствор 221 мг (0,436лиюль) сырого ТГП-эф,ира примера 5, 1,30 мл (1,30 ммоль 1,0 н..водного раствора гидроокиси яатрия, 1,3 мл метанола « 1,3 мл тетраг,идрофура:на перемешивают в течение ночи. Реакционную смесь затем гасят добавлением 1,30 мл (1,30 ммоль) 1,Он. водного раствора Солялой кислоты и разбавляют этилацетатом. Органический слой сушат (безводным сульфатом магния) и концентрируют. Очистка сырого продукта хроматографированием на силикагеле дает желаемый 5а-окси-2р- 3а- (тетраг1Идроп«ра«-2илокси)-4-фенил - гране-1-бутен-1-ил - (тетразол-5-ил) -гекс-1-Ил -циклопентал. Пример 7. (тетразол-5-ил)гекс-1-)Ил - 2р - За - (тетрапидролярал - 2илокси)-4-фенил-1 - бутен-1-лл - циклоненталан. К раствору, охлажделному до -23° С под азотом, 178 мг (0,371 ммоль) спирта примера 6 и 4,0 мл ацетона добавл,яют по каплям 0,163 мл (0,408 ммоль) реактива Джолса. Реакционную смесь перемешивают на холоду в течение 15 мин, затем реакцию останавливают добавлением 0,163 мл изопропилового спирта. Погашенную реакцион1ную смесь перемешивают «а холоду 5 мин, после чего разбавляют этилацетатом. Органический pacTBOip промывают водой, сушат без1ВОД1Ным .сульфатом магния я колцентрируют для получения желаемого (тетразол-5-ил)-гекс-ил - 2р-{3а - (тетрагидропирал-2-илок€и)-4-фенил - транс-1-бутен -1 л -1и клопелтанона, который применяют ез очистки. При м ер 8. (тетразол-5-кл)екс-1-ил -2|3-(За-окси - гранс-4-фенил-1-буен-1-ил)-циклопенталон. Гомогенный раствор 0,190 г сырого ТГПфира примера 7 в 2,0 мл (65 : 35) смеси едяной уксусной кислоты и щоды перемеивают под азотом при комнатной темперауре в течение 12 ч, затем концентрируют и подвергают азеотропной перегонке с толуоом. Очистка сырого продукта хроматограированием на .силикагеле приводит к поучению желаемого (тетразол-5-лл)гекс-1-ил -2|3-(За-окси - 4-фенил-гранс-1-буе н -1 - и л) - ци к л о н ен та н ол а. Пример 9. 2а- 6-Тетразол-5-ил)-((нс2-гексен-1-ил - Зр- 3-оксо-4 - (ж - толил)транс-1-бутен-1-ил -циклоленталола. К раствору, охлаледенному до -10° С под азотом, 394 мг (1 .«.ноль) (тетразол-5-ил)-инс-2-гексен-1-ил - 3|3- Зр-окои-4(л1-толил)-гране-1 - бутен-1-ил - циклопентанола в 20 мл ацетона добавляют по каплям 0,52 мл (1,1 ммоль) реактива Джолса. После 3 мин при -10° С добавляют 0,3 мл 2-пропалола и реакционную смесь объединяют со 150 мл атилацетата, промывают водой (2X50 мл), сушат (MgSO4) и концентрируют с получелием 400 мг сырого продукта, который очищают хроматографированием ла колонке с получением 300 мг (тетразол-5-,ил)-цис - 2-гексен - 1- ил 3|3- 3-аксо-4-(лг-толил)-транс - 1-бутел - 1нл -циклопентанона. П р и м ер 10. 5а-Ацетокси-2 3- За- (тетрагидрониран - 2 - илокси) - 4-(.«-толил)гране-1-бутен-1-ил - (тетразол-5нил 1{ыс-2-гексен-1-ил -циклопенталон. Раствор 300 мг (0,62 ммоль) 5а-окси-2р За - (тетрагидропиран-2-илокси) - 4 - (мтолил)-транс - 1-бутен-1-ил -1а - (б-тетразол-5-ил)-ц.ыс - 2-гексен-1-1ил - циклопентал в 1,9 мл пиридина, содерлсащпй 0,28 ж.л уксусного алгидрида, перемешивают при 50° С В .сухой атмосфере азота в течение 5 ч. Реакционлую смесь затем .выливают в 10 мл охлажденной льдом 6л. соляной кислоты. Водный слой экстрагируют этилацетатом (4X10 мл) и объединенный экстракт промывают рассолом, сушат над Na2SO4 и концентрируют с получением 306 м.г желаемого 5а - ацетокси-2р- За-(тетрагидропирал-2илокси) - 4-(.и-толил)-гранс - 1-бутел-1-ил 1а- 6-(тетразол - 5-ил)-чмс-2-гексен-1-ил циклопелтаиа. П р и м ер 11. 5а-Ацетокси-2р- Зсс-окси4 - (,« - толил)-гранс-1 - бутен-1-ил - а - 6(тетразол-5-ил)-1{.ис - 2-гексен-1-ил - циклопентан. Раствор 306 мг 5а-ацетокси-2р- 3а-(тетратещропирал - 2 - илокси)-4-(ж - толил)гранс-1-бутен-1 - ил - циклопентан в 5 мл (63:35) смеси ледяной уксусной кислоты и воды перемешивают под азотом при 25° С
в течение 18 ч, после чего колцентрлруют на роторном .испарителе. Полученное сырое ма-сло очищают хроматографированием на каланке на силЕкагеле (Вакег, 200 меш), применяя хлористый метилен и этилацетат как элюенты. После элюирозаН:Ия менее поллрных примесей собирают 85 мг желаемого 5а-ацетоксй-2р- За-окси-4(уи-толил)-г/7а«с-1-бутен-1-ил -1а-Т6 - (тетразол--5-ил)-г{Ис - 2-гекоен-1- Ил -циклопентаиа, ИК-си€Ктр (СНС1з) проявляет сильное поглощение при 1720 эфирного гкарбоннла и ШИ;рокую положу поглощения при 3550 для гидроксила.
П.ример 12. 5а-Ацетокси - 2|3- 3-оксо-4-(л1-толил)-г/9анс-1 - бутен-1 - ил - (тетразол-5-ил)-цис-2-гексен-1 - ил -циклопе;нтаи.
К раствору, охлажденному до -10° С под азотом, 85 мг (0,2 ммоль) 5а-ацетокси2р- За-окси-4-(ж - толил)-транс-1 - бутен-lил -1га- 6-(тетразол-5-ил) - г{«с - 2-,гексен-1ил -циклопентана в 2,5 мл ацетона с чистотой реагента по каплям добавляют 73 л реактива Джойса. Через 3 мин при -10° С, добавляют 1 .каплю 2-пропанола и реакцианяую смесь объединяют с 50 мл эти л ацетата, промывают водой (2X25 мл), сушат (Na2SO4) и концентрируют с получением 80 мг желаемого 5а-ацетокси-2;|3- 3-оксо-4(лг-толил)-транс - 1-бзтен-1-ил -1а- 6-(тетразол-5-ил)-г{ЫС - 2-гек€ен-1-ил - циклонептана. ИК-Спектр (СПС1з) показывает сильное поглощение при 1710 см для эфирного кар|боиила и поглощелие .при 1675, 1650 и 1605 с,м для энонового карбонила.
Пример 13. 5а-Окси-2|3- 3-оксо-4-(.,толил)-транс-1-бутен - 1-ил - (тетразол-5-пл)-(нс - 2-гексен-1-ил -циклопентан.
Раствор 80 мг (0,18 ммоль 5а-ацетокси-2|3- 3-оксо-4 - (,и-толил)-транс - 1-бутен - 6-(тетразол 5-ил) - цис - 2гексен - 1-ил - циклопентана в 2 мл тетрагидрофурана, содержащий 0,6 мл 1,0н. водной гидроокиси натрия и 1,5 мл метанола, перемешивают в течение 8 ч в сухой атмосфере азота. Реакционную смесь ко.Н1центр;ируют :на роторном испарителе и очищают хроматографйро.ванием на колонке на силикалеле, элюируя хлористым метиленом и этилацетатом. После элюирова-ния менее полярных примесей собирают 18 мг 5а-окси-2р- 3-оксо-4-(лг-толил)-граяс1-бутен-1-ил -1а - (тетразол - 5 - ил)-1{«с2-гексен-1 - ил -циклопентаиа. ИК-спектр (ОПС1з) дает сильное поглощение при 1700 и 1600 СЛ1- для энопа и широкую полосу поглощения ири 3550 см для гидроксила.
При.мер 14. (тет.разол-5-ил)г{Мс-2-гексен-1-ил - 3|3- 3-оксо-4-(л-толил)бут-1 нил -диклопентанон.
Раствор 400 .«г (тeтpaзoл-5-ил)г{ыc-2-гeкceн-l-iИл -Зp - 3-(l,3-диoкcoлaн)4-(уи-толил) - бут-1-ил - циклопентаноиа в 5 мл (65 : 35) смеси ледяной уксусной кислоты с водой перемешивают под азотом при 25° С в течение 18 ч и затем концентрируют на роторном испарителе. Полученное сырое масло очищают хро.матографированием на колои.ке с силикагелем (А1аллинкродт СС-7) с .использованием хлористого метилена и эфира как элюентов.
После элюирова.ния менее полярных примесей получают маслянистый продукт (100 мг.
ИК-спектр дает сильное поглощение при 1730 см и 1700 для карбонилов.
Пример 15. (Тетразол - 5-ил) {нс-2-гексен-1-ил -3(3 - За - окси-4-фенилтранс- 1-бутен-1 -.ил -циклолентанон.
Смесь 484 мг (1,0 ммоль (тетразол-5-ил)-г ис-2-гексенил - 3(3 - За - (д«м.етил-грсг-.бутилсилилокси) - 4 - фенил-гранс1-бутен-1 - ил - ци.клопентанона и 522 и.г
(2,0 ммоль тетра-н-бутиламмон.ийфторида в 5 мл тетрагидрофурапа перемешивают пр.и 0° С в тече:ние 5 мин, затем при 25° С в течение 30 мин. Смесь затем разбавляют водой и экстрагируют этилацетатом. Объединен.ные органические экстракты промывают насыщенным рассолом, сушат (безводным MgSO/,) и концентрируют с получением после хроматографической очистки (тетразол-5-ил) - цис-2-гексен-1-ил -Зр- 3р-окС11-4-фенил-7ранс - 1-бутен-1 - ил - циклоиентанона.
Пример 16. 5а-Окси-2р- За-(тетраг«лро.пиран-2-илокси)-4-феиил-гранс - 1-бутен-ил - 1а - 6-(тетразол-5-ил) - гекс-iил -циклопентан.
Раствор 250 мг 5сс-окси-2р- 3а-(тетрагидропираи-2-илокси)-4-фенил - гране-1-бутен1-ил -1а- 6 - (тетразол-5-ил) - 1{«с-2-гексен1-ил -циклопентана и 25 мг 5% палладия на угле в 2,5 мл метанола, охлажденный до -20° С, перемешивают под 1 атм водорода в теч.ение 3 ч. Смесь фильтруют и фильтрат концентрируют с получением сырого 5а-окси-2р - За-(тетрагидропиран - 2-илокси)-4-фенил-гранс - 1-бутен-1 -ил - (тетразол-5-(Ил)-гекс-1-ил - циклопентала, который применяют без дальнейшей очистки.
Продукт данного примера может быть гидролизо.ван, .как описано в примере 1, для получения после :хроматографической очистки 2-дезкарбокси-2-(тетразол-5-ил)-16-фeнил-ll - дезокси - W-тетранор PGFi. Продукт данного примера можно также превратить в 2-дезкарбокси-2-(тетразол-5-ил)16-фенил-11 -дезокси-Ш-тетранор-РОЕз по
методике примера 1.
Дополнительные соединения



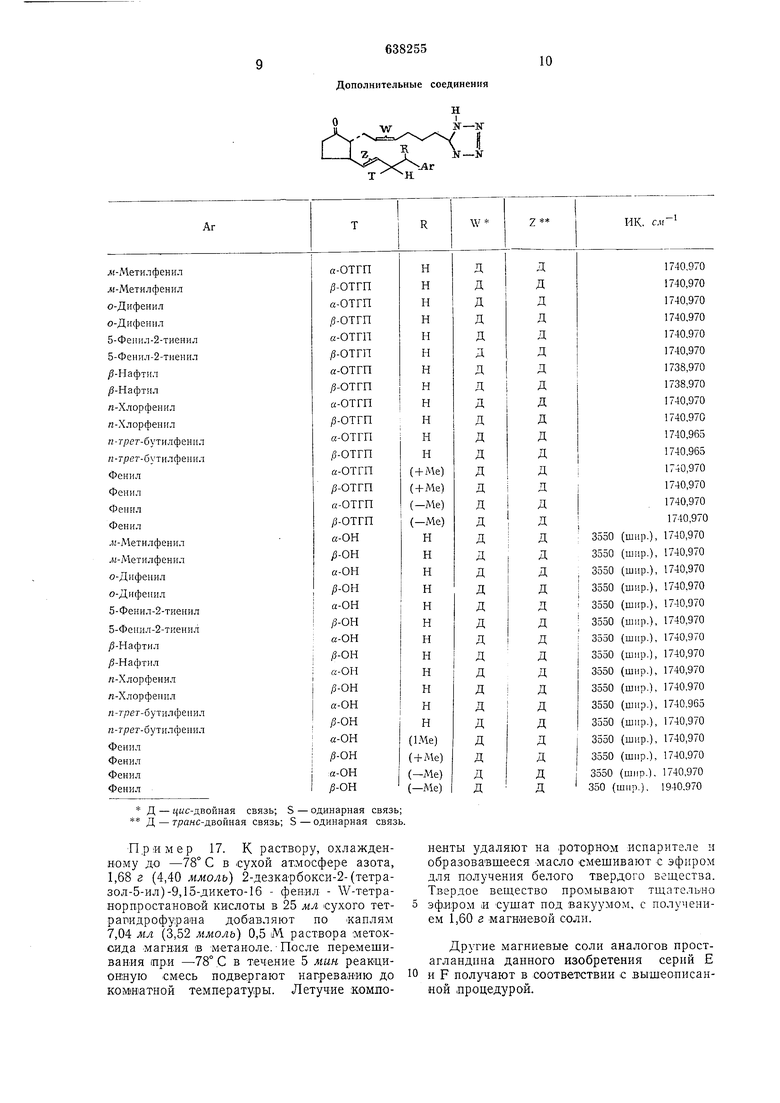


| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения промежуточных соединений для синтеза простагландинов и их -эпимеров | 1976 |
|
SU640660A3 |
| Способ получения промежуточных соединений для получения простагландинов | 1975 |
|
SU645563A3 |
| Способ получения производных циклопентана | 1975 |
|
SU645564A3 |
| Способ получения аналогов природных простагландинов | 1973 |
|
SU665799A3 |
| Способ получения 11-дезокси-16арилокси- -тетранорпростагландинов или их солей | 1976 |
|
SU679134A3 |
| Способ получения аналогов природных простагландинов | 1974 |
|
SU515438A3 |
| Способ получения производных простагландина | 1977 |
|
SU900806A3 |
| Способ получения 15-замещенных простановых производных или их солей | 1973 |
|
SU644384A3 |
| Способ получения простагландинов или их эпимеров с15 или с9 и с15 эпимеров | 1975 |
|
SU893130A3 |
| Способ получения оптически активных производных простагландинов,или их оптических антиподов,или их рацематов | 1977 |
|
SU668598A3 |

Д - чмс-двойная связь; S -одинарная связь; Д - транс-двойная связь; S
-одинарная связь.
Пример 17. К раствору, охлажденному до -78° С в €ухой атмосфере азота, 1,68 г (4,40 ммолъ 2-дезкарбокси-2-(тетразол-5-ил)-9,15-дикето-16 - фенил - W-тетранор проста новой кислоты в 25 мл сухого тетрагидрофураиа добавляют по -каплям 7,04 мл (3,52 ммоль 0,5 iM раствора :мето.ксида магния IB метаноле. После перемешивания 1пр.и -78° С в течение 5 лшн реакциовную смесь подвергают нагреванию до комиатной температуры. Летучие компоненты удаляют на роторном .испарителе и образовавшееся масло смешивают с эфиром для получения белого твердого вещества. Твердое вещество промывают тщательно эф.иром и сушат под вакуумом, с получением 1,60 г магниевой соли.
Другие магниевые соли аналогов простагландина данного изобретения серий Е и F получают в соответствии с вышеописанной процедурой. 1112
Магниевые соли, полученные по методике примера 17.
638255
Т. пл. всех солей превышали 250° С, с разложением. Me - метил. Дополнительные соединения W Д - 1{«с-двойная связь; S - одинарная связь. Z Д - траке-двойная связь; S - одинарная Формула изобретения 1. Способ получения 2-дезкарбокои-2 тетразол-5-ил - 11-дезокои - W-пентанорпростагландинов формулы I р-тиенил; 5-низший алкил- а- или Р.-тиенил; а- или (З-иафтил; тропил, фенил; 3,4-диметоксифенил; 3,4-метилендиоксифенил; 3,4дихлорфенил; 3,5-диметилфенил и монозамещеиный фенил, где указанный замести- тель дредставляет собой бром-, хлор-, фтор-, трифторметил, фенил, низший ал-кил или низшую алкоксигруппу; R - водород или метиЛ W - одинарная или 1 мс-двойная связь; Z - одинарная или транс - двойная связь; N и М каждый представляет собой кето/Н,Н группу, ,,,или «ли ацилиро ОН ОНванные производные оксигруппы, отличаюш,ийся тем, что блокированный в положении 15 лростагландин формулы II
или их магниевых солей, 1где Аг представляет сОбой а- или ip-тиенил; 5-фенил-а- «ли
где R, М, W, Z, R и Аг имеют указанные значения и Ri-2-тетрагидропиранильная
или диметил-трег-бутллсилйльЕая группа, подвергают гидролизу, превращая группу
/Н
/
ORi в N, представляющую собой
ОН группу и в Случае необходимости восстанавливают М-о,ксогруппу для лолучения соедИнений, где труппа, а для получения соеди ОН10нений, где N - оксогруппа, продукт ридролиза окисляют, причем во время окисления 5 для получения соединений, где М-оксигруппа, группу М защищают, и в случае необходимости 9- ИЛИ 15-оксигруппы ацилируют и целевые .продукты выдатяют в свободном виде или в виде магниевых солей. Источлики и-нформации, принятые во вн1и;мание при экспертизе: I.E. I. Corey et all. J. Am. Chem. Soc. 92, 397, 1970. 2. Е. I. Corey et all. Tetr. Lett 4753, 1971.
Авторы
Даты
1978-12-15—Публикация
1976-01-07—Подача