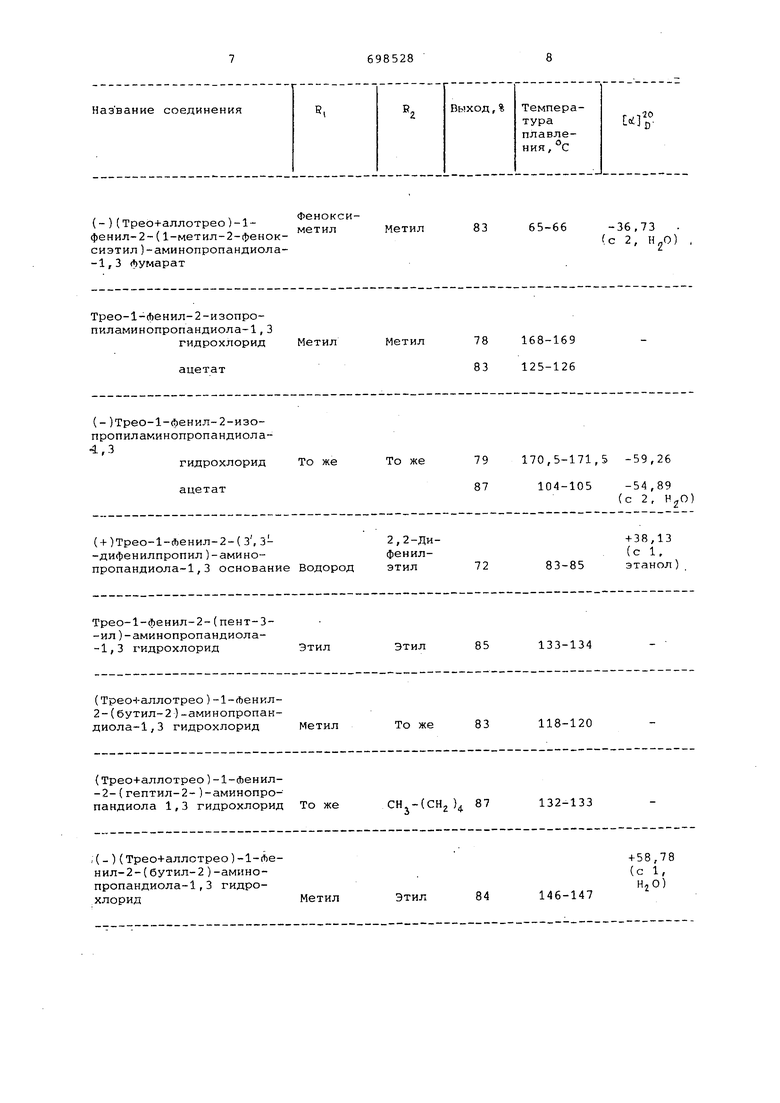
Изобретение относится к способу |Пблучения новых, не описанных в лиIJ. у , J ri i ti- J Mi-rv f v-- . аьал тературе N -алкилированных 11-фенилсолейамино-l, 3-пропандиола или их рацематов или оптически активных антиподов, которые обладают биологической активностью и могут поэтом найти применение в медицине. В патентной и технической литера туре описано восстановительное алки лирование аминов с помощью альдегидов или кетонов. Процесс проводят в присутствии восстановителя, в качестве которого применяют глaвны образом каталитически возбужденный водород с использованием в качестве катализатора платины, палладия, ни келя Ренея iJ , Целью изобретения является разр ботка способа получения новых N алкилпроизводных 1-фенил-2-амино1,3-пропандиола, которые бы облада ли высокой биологической активност Предлагается основанный на извес ной реакции ij способ получения новых N-алкилпроизводных 1-Ленил-2амино-1,3-пропандиола общей формулы -СН-СН-СНг I I I ,г. он NH ОН fi) I СИ Т RI Kg. где R - водород, C -Cg-алкил или феноксиметил; 2 - водород, С -Сд-алкил или 2,2-дифенилэтил, причем Д, и R одновременно не мог означать водород, или их солей, ра цематов или оптически активных антиподов , заключающийся в том, что рацемат или оптически активный антипод 1фенил-2-амино-1,3-пропандиола форм лы УКСН-СН-СН, он NHgOH подвергают восстановительному алки лированию соответствующим гльрдагидом или кетоном общей формулрл где R, и 2 имеют вышеуказанные зн чения, в слабокислой спиртовой ере де при 10-40°С с последующим выдел нием целевого продукта в свободном виде или в виде соли, в виде рацем .та или оптически активного антипода. Полученные соединения формулы f могут быть подвергнуты взаимодействию с неорганическими или органическими кислотами до их Физиологически совместимых солей. В восстановительной конденсации предпочтительно используют известные водородоактивные катализаторы (платина, палладий, никель Ренея, железосодержащий никель Ренея), В лабораторных масштабах целесообразно применение окиси платины, в то время как для технических масштабов следует использовать никель Ренея под давлением. Реакцию проводят в спирте, водном спирте или в других способных смешиваться с водой органических растворителях, которые слег ка подкисляют органической кислотой. В качестве спирта предпочтительно используют этанол, а в качестве кислоты - уксусную кислоту. процесс в некоторых случаях проводят в присутствии ацетона. Под новЕ.те N-алкильнне производные пропандиола формулы I следует понимать такие возможные стереоизомеры этих соединений. Как известно, 1-фенил-2-амино-1,3-пропандиол существует в виде трео- и эритроизомеров, которые образуют оба оптических изомера. Это относится также к их алкильным производным. Если алкильная группа у атома азота содержит дополнительный асимметричный атом углерода, то соединение существует с тремя асимдгетричными центрами и количество возможных диастереомеров становится вдвое больше. В данном описании наряду с употребительной номенклатурой применяются обозначения для четырех рацематов; трео, аллотрео, зритро и аллоэритро. Целевой продукт можно выделять также в виде соли, используя для перевода такие кислоты как соляная, фумаровая. Пример 1. Гидрохлорид L(+) -трео-1-Ленил-2-изопропиламино-1, 3-пропандиола. Раствор 3,36 г (0,05 моль) L (+)трео-1-Ленил-2-амино-1,3-пропандиола, 5,8 г (0,2 моль) ацетона и 3,1 мл уксусной кислоты в абсолютном этаноле в присутствии 0,5 г предварительно гидрированной оккси платины гидрируют до поглощения теоретического количества водорода (2400 мл водорода, продолжительность около 16 ч) . Во время гидрирования в реакционную смесь еще три раза добавляют по 0,2 г окиси платины.. Катализатор отфильтровывают и фильтрат испаряют в вакууме. Получают 14,7 вязкого масла. Его вновь испаряют в вакууме вместе с 20 ил этанола и 10 глл 20%-ного солянокисл го спирта (рН 3-4). Полученный гидрохлорид, окрашенный в розовый цвет растворяют в 40 мл смеси этанола и этилацетата, взятых в соотношении 2:3, раствор ()ильтруют, смешивают с 30 мл этилацетата и оставляют сто ять в холодильнике для кристаллизации. После отЛильтровывания кристал лов получают 5,5 г гидрохлорида {,(+ -тpeo-l-f)eнил-2-изoпpoпилa ИHO1,3-пропандиола, который плавится при 162-1б5°С, вращение +59,11 (с 2, Н,0). В результате испарения маточника и обработки остатка смесью этанола и этилацетата, взятых в соотношении 2:3, получают дополнительно 2,83 г гидрохлорида. Обгдий выход составляет 8,35 г (68% от теории . I Пример 2. Фумарат (трео+ал лотрео) -1-фенил-2-гТ)еноксиизопропиламино-i,3-пропандиола. 17,3 г (0,103 моль) трео-1 фенил 2-амино-1,3-пропандиола и 31,0 г (0,026 моль) свежеперегнанного леноксиацетона растворяют в 150 мл этанола. Раствор подкисляют 6,2 ь-ш уксусной кислоты в присутствии 0,91 предварительно гидрированной в 15 МП этанола окиси платины и гидри руют до поглощения теоретического количества водорода (при 20°С 450 м продолжительность гидрирования около 18-20 ч). Катализатор отлильтровывают и Лильтрат испаряют в вакууме. Из остатка удаляют следы растворителя и ледяную уксусную кислоту в результа те азеотропной перегонки с бензолом Затем остаток растворяют в 100 мл абсолютного спирта и к раствору добавляют 12 г (Ьумаровой кислоты в 300 мл спирта.Смесь вьщерживают в точение ночи и затем отЛильтровывают выпавший продукт. Маточник испаряют на треть его объема и таким об разом получают дополнительную фракцию. Соединенные Лракции продукта (30,2 г) перекристаллизовывают из 185 мл этанола. Получают 24,75 г (57,5 %) фумарата (трео+аллотрео)l-фeнил-2-фeнoкcиизoпpoпилaминo-l , 3-пропандиола, который плавится при 145--147°С. Пример 3. лумарат ( + )-(тре аллотрео) -1-гЬенил-2-феноксиизопропиламино-1,3-пропандиола. Раствор 13,0 г (+)-трео-1-фенил2-амино-1,3-пропандиола и 23,2 г свежеперегнанного Леноксиацетона в 124 МП этанола подкисляют 4,66 г уксусной кислоты и в присутствии 1 окиси платины, которую предваритель но гидрируют в 30 мл этанола, гидри руют до поглощения теоретического количества водорода {3700 NUT, продолжительность гидрирования 17 ч). Катализатор отфильтровывают, фильтрат испаряют и под конец дистилляции остаток растворителя отгоняют с бензолом. Получают 37,1 г маслянистого продукта. Его растворяют в 100 мл этанола и раствор смешивают в 8,6 г лумаровой кислоты в 200 мл этанола. После испарения в вакууме получают желтоватое масло, которое кристаллизуется при растирании с этилацетатом. Смесь оставляют стоять в холодильнике в течение ночи, а затем фильтруют. Получают 17,8 г (55%) Лумарата (-Г)-(трео+аллотрео )-1-Ленил-2-Леноксиизопропиламино-1,3-пропандиола, который плавится при 62-67°С, вращение +37,93 (С 2, И2О). Пример 4 . (Ьумарат ( эритро+ аллоэритро)-1-Ленил-2-15еноксиизопропиламино-1,3-пропандиола. Раствор 17,3 г (0,13 моль) (эритро-1-Фенил-2-амино-1,3-пропандиола и 31,0 г (0,206 моль) Леноксиацетона в 350 абсолютного этанола подкисляют 6,2 fui уксусной кислоты и в присутствии 1,0 г окиси платины, которую предварительно гидрируют в 30 этанола, гидрируют до поглощения теоретического количества водорода (4960 мл). Затем катализатор отфильтровывают и фильтрат испаряют в вакууме. Получают 51,0 г вязкого продукта. Его растворяют в 100 мл этанола и раствор смешивают с нагретым до 60°С раствором 5,61 г фумаровой кислоты в 120 глп этанола. Смесь оставляют стоять в течение ночи в холодильнике, затем продукт отфильтровывают и высушивают. Получают 31,2 г продукта, который плавится при 170-179°С. Его перекристаллизовывают из 1100 мл этанола, при этом получают 18,7 г (50,5%) гЬумарата {эритро+аллоэритро )-1-фенил-2-Т)еноксиизопропиламино-1,3-пропандиола, котор 1,1й плавится при 189-190°С. Пример 5. Гидрохлорид (рацемат) трео-1-фенил-2- (З ,3-диЛенилпропил )-аминс5 -1,3-пропандиола. Раствор 5,01 г (0,03 моль) рацематного трео-1-(Т)енил-2-амино-1, 3пропандиола, 6,3 г 0,03 моль) 3,3дифенилпропинового альдегида и 2,7 г (о,045 моль) уксусной кислоты в 100-мл этанола в присутствии 0,5 г окиси платины, предварительно гидрированной в 30 мл этанола, при комнатной температуре и атмосферном давлении гидрируют до поглощения теоретического количества водорода (720 мг, что продолжается предварительно 16 ч. Затем катализатор отфильтровывают и устанавливают значение рН фильтрата равным 3 добавлением пpиблизитeль o 20%-ного соляно кислого этанола. Раствор испаряют .в вакууме до 60 мл. После выдержива ния в холодильнике в течение ночи продукт отфильтровывают. В результа те испарения фильтрата ло 15 мл получают дополнительную Фракпию. Объединенные фракции продукта около 8,2 г) растворяют в 350 мп абсолютн го этанола, раствор после фильтрова ния испаряют до 60 мл и отфильтроБывают,выпавший продукт. Получают 5,5 г (46,5%) гидрохлорида трео 1фенил-2- (3 , З -дифенилпропил) -амино -1, 3-пропандиола в виде рацема-та, т.пл. 217-221°С. Получение свободного основания. Полученные 5,5 г гидрохлорида растворяют в 40 г«ш 80%-ного водного метанола. Раствор перемешивают с 66 г аминообменной смолы. Довекс (основная Форма) в течение 2 ч, пос ле чего его фильтруют и анионообмен ную смолу промывают сначала 250 /ш 70%-ного метанола два раза, а потом 250 мл чистого метанола один раз. Фильтрат смешивают с промывной жидкостью и испаряют в вакууме, в результате чего получают 4,97 г сырог основания. Его растирают с 30 мл н-гексана и выдерживают в течение 5 ч в холодильнике, а затем отфильтровывают. Получают 4,28 г (85%) основания, которое плавится при 79- . . Пример 6 . Гидрохлорид D СЬ трео-1- енил-2-( з, з -дифенилпропил амино -, 3-пропандиола. Смесь 10,3(О, О 6 моль)} С- -трео -1-фенил-2-амкно-1,3-пропандиола и 12,6 г (0,06 моль) 3,3-дифенилпропинового альдегида вьщерживают 30 мин при ЮО-с. Полученный продук растворяют в 200 мл абсолютного эта нола и в присутствии 0,5 г окиси платины, которую предварительно гид рируют в этаноле, после добавления 5,4 г уксусной кислоты гидрируют до поглощения теоретического количества водорода (1440 мл). Катализатор отфильтровывают и устанавливают зна чение рН фильтрата равным 3 добавле нием 20%-ного солянокислого этанола Затем раствор испаряют в вакууме. Оставшийся гидрохлорид растворяют горячим в 1400 мл абсолютного этано ла, раствор лильтруют и испаряют . приблизительно до 300 мл. Раствор оставляют стоять в течение ночи в XOJX.,--.ильнике и затем фильтруют. Пер вичный выход гидрохлорида составляет13,1 г, т.пл. 233-234 0, разлага ется при 238°0. В результате испарения маточника получают дополнительно 2,7 г продукта. Объединенные 15,8 г гидрохлорида растворяют в 1500 мл абсолютного метанола, раствор фильтруют, Лильтрат испаряют до 250 МП. Выпавшие из раствора в результате охлаждения кристаллы отфильтровывают. Получают 9,8 г (41%) гидрохлорида D(-)-трео-1-фенил-2-(3,3-дифенилпропил)-амино-1,3-пропандиола . Продукт плавится при 235-237,5°С, разложение наступает при . В результате испарения маточника до 60 мл получают дополнительно 3,34 г гидрохлорида, т.пл. 237,52390с,Dt;|2j° -36,68°(этанол, С 2.48). Общий выход составляет, таким образом, 55%. Получение свободного основания. 13,14 г полученного гидрохлорида в 800 MJI 80%-ного водного метанола обрабатывают 90 г анионообменной смолы Довекс 1. После фильтрации смолу дважды промывают порциями по 500 мл 70%-ного метанола и один раз 500 мл абсолютного метанола. Фильтрат соединяют с проладвной жидкостью и испаряют в вакууме, причем перед концом дистилляции добавляют бензол и испаряют. Остаток кристаллизуется при добавлении н-гексана на холоде. Получают 9,1 г (76,25%)(-)-трео-1-Ленил-2-(3 ,3 -диЛенилпропил)-амино 1,3-пропандиола, который плавится при 79-82,5С. Пример 7. Эритро-1-фенил2- (з ,3 -дифенилпропил) -амино -2,3пропандиола. Зритро-1-фенил-2-Г( 3 , 3 -дифенилпропил) -амино -1, 3-пропандиола, 12,6 г (0,06 моль) 3,3-ди|фенилпропионового альдегида и 5,4 г 1УКСУСНОЙ кислоты в 250 мл абсолютного этанола в присутствии 0,3 г окиси платины, которую предварительно гидрировали, и 30 мл этанола гидрируют до поглощения теоретического количества водорода (1440 мл). Катализатор отфильтровывают, фильтрат испаряют и остаток в 200 метанола обрабатывают 200 г анионообменной смолы Довекс 1. После отФильтровывания смолы растворитель испаряют. Оставшийся вязкий продукт (21,5 г)растворяют в 30 мл этанола и раствор смешивают с н-гексаном, пока он не станет мутным (около 400 мл). Смесь ставят в холодильник и позднее отфильтровывают. Полученные 14,3 г кристаллического сырого продукта перекристаллизовывают из 250 мл (1:1) этанола и дистиллированной воды. Получают 10,85 г (50,02%) эритро-1фенил-2-(3 , з -диЛенилпропил)-амино -2 ,3-пропандиола, который плавится при 108-109°С., Аналогично получают соединения формулы I, приведенные в таблице. Название соединения Н. В (-)(Трео+аллотрео)-1- Феноксифенил-2-(1-метил-2-фенок- сиэтил)-аминопропандиола-1,3 Лумарат Трео-1-Фенил-2-изопропиламинопропандиола-1,3 гидрохлорид Метил Метил ацетат (-)Трео-1-фенил-2-изопропилакинопропандиолагидрохлорид То же То же ацетат (+)Трео-1-Ленил-2-( З, 3-2,2-Ди -дифенилпропил)-амино-фенилпропандиола-1,3 основание Водород этил |.««.,....-....|.- --...-.-..«.-.....«Трео-1-фенил-2-(пeнт-3-ил )-аминопропандиола-1,3 гидрохлоридЭтил Этил (Треон-аллотрео) -1-Ленил2-(бутил-2)-аминопропандиола-1,3 гидрохлорид Метил То же (Трео+аллотрео)-1-фенил-2- (гептил-2- )-аминопро-пандиола 1,3 гидрохлорид То же СН.-СС
; (-)(Трео+аллотрео)-1-Ленил-2-(бутил-2)-аминопропандиола-1,3 гидрохлорид
+58,78
(с 1,
HjO)
146-147
84 од,% Температура . плавления, °С ) 2 78 168-169 83 125-126 79 170,5-171,5 -59,26 87 104-105 -54,89 (с 2, «20) +38,13 (с 1, 72 83-85 этанол) .- , 85 133-134 83 118-120 87 132-133
.Продолжение таблицы



. 1 .Способ пол учения ц -алкилпро- изводных 1-фенил-2-амино-1,3-пропан- диола общей формулыO-Cft-СН-СНгОН нн он I снR,'^ ^"Rz;где Д, - водород, C^-Cg-апкил илифеноксиметил;^2 ~ водород, С,-Се-алкил или 2,2-дифенилэтил,причем 5^ и Д^ одновременно не могут означать водород,или их солей, рацематов или оптически активный антиподов, отличающийся тем, что рацемат или оптически активный антипод 1-фенил-2-амино-1,3-пропан- диола формулы•си-сн-снг I I I он ки^онподвергают восстановительному алкили- :рованию соответствующим альдегидом или кетоном общей формулы0=0/RIс 9R.г>&(Лсгде R, и ^2 имеют вышеуказанные зна-а чения, в с.лабокислой спиртовой ере- " де при 10-40°С с последующим выделением целевого продукта в свободном виде или в виде соли, в виде рацемата тлл-л оптически активн.ого антипода.2.Способ ПОП.1, отличающийся тем, что в качестве спирта используют этанол, а в качестве кислоты - уксусную кислоту.3.Способ по ПП.1 - 2, о т л и- чающийся тем, что процесс проводят в присутствии ацетона.^;оХ>&::л t^ эо>&
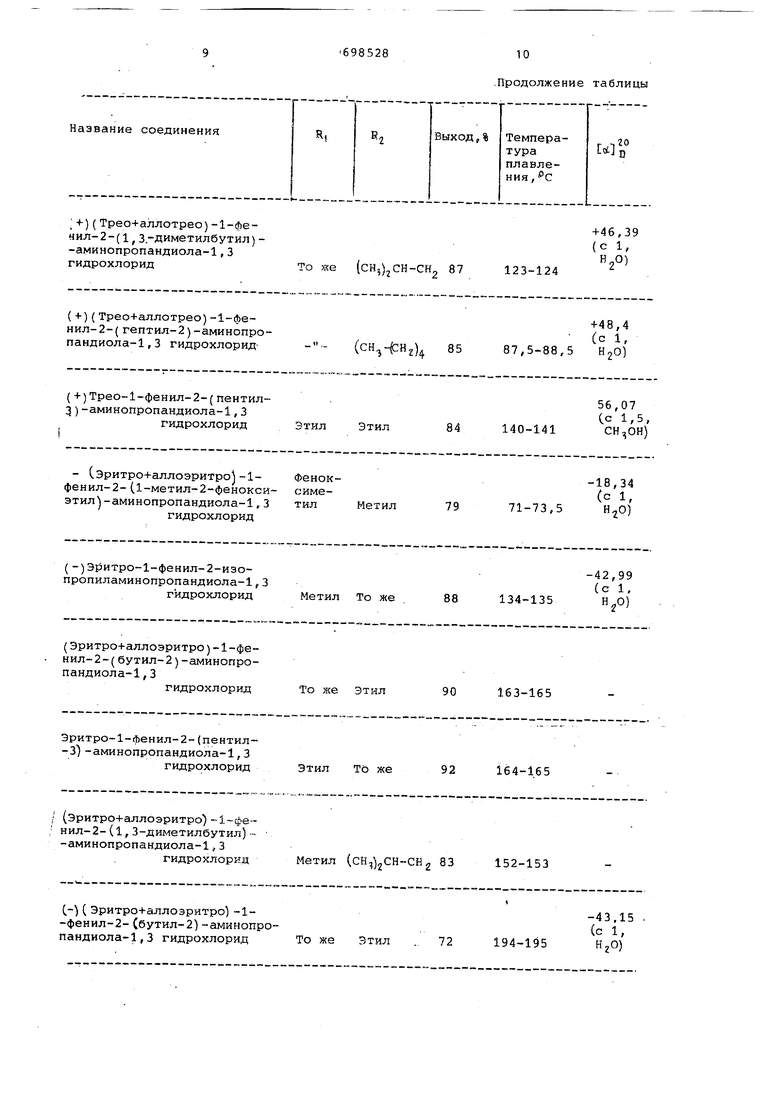
Название соединенияR, R +)(Трео+аллотрео)-1-фечил-2-(1, З.-Диметилбутил) -аминопропандиола-1,3 гидрохлоридТо же (сН,)2СН (+)(Трео+аллотрео)-1-фенил-2-(гептил-2)-аминопропандиола-1,3 гидрохлорид- - - ( (+)Трео-1-фенил-2-(пентил3)-аминопропандиола-1,3 гидрохлорид Этил Этил - Сэритро+аллоэритро -1-Фенокфенил-2-(1-метил-2-фенокси симеэтил -аминопропандиола-1,3тилМетил гидрохлорид (-)Эритро-1-фенил-2-изопропиламинопропандиола-1,3 гидрохлорид Метил То же (Эритро+аллоэритро)-1-фенил-2-(бутил-2)-аминопропандиола-1, 3 гидрохлорид То же Этил Эритро-1-фенил-2-(пентил-3)-аминопропандиола-1, 3 гидрохлорид Этил То же ; (Эритро+аллоэритро) нил-2-(1, 3 диметилбутил) - -аминопропандиола-1,3 гидрохлоряд Метил (СН,)2СН
(-) ( Эритро+аллоэритро) -1-фенил-2-Сбутил-2)-аминопроТо же Зтил пандиола-1, 3 гидрохлорид
-43,15
(с 1,
194-195 ) ход,% Темпера- JQ тура toi. и плавления ,С +46,39 (с 1, Н О) 87 123-124 +48,4 (с 1, 85 87,5-88,5 HjO) 56,07 (с 1,5, 84 140-141 ) -18,34 (с 1, 79 71-73,5 ) -42,99 (с 1, 88 134-135 НО) 90 163-165 92 164-165 83 152-153 Название соединения R. (-) Эритро-1-гЬенил-2-(З , 3-дифенилпропил) -аминопро- Водород пандиола-1,3 гидрохлорид .Эритро-1-фенил-2-йзопропил-аминопропандиола-1,3 гидрохлорид Метил (Трео+аллотрео) -1-Л1енил-2-(1,3-диметилбутил)-аминопропандиола-1,3 гидрохлорид То же
Продолжение таблицы R, Выход.% Темпера- оо тура Li3.u плавления , с 2 , 2-Ди- 1 Ч 59 фенил-((, т этил 82 175-176 с litOH) Метил 72 194-195 СН,) CH-CHj 84 172-173
Авторы
Даты
1979-11-15—Публикация
1978-03-10—Подача