(54) СПОСОБ ПОЛУЧЕНИЯ СУЛЬФОНИЛБЕНЗИМИДАЗОЛОВ Изобретение относится к способу получения новых производных сульфонилбензимидазола, обладающих ценными фармакологическими свойствами. Цель изобретения - получение новых, полезньох соединений, расширяющих арсенал средств воздействия на живой организм - достигается путем синтеза последних, основанного на известной реакции взаимодействия амина с сульфохлоридами 1 . Предлагается способ получения сульфонилбензимидазолов общей форму лыS02Ki TVfx f«2,a) где R - С -С5-алкил, Cj-Cf-ииклоалкил, фенил, фурил, тиенил, тиазол -2-ил, 2-ацетамидо-4-метилтиазол-5-ил, 1,3,4-тиадиазол-2-ил, 2-метил-1,.3,4-тиадиазол-5-ил, 2-метиламино-1,3,4-тиадиазол-5-ил или радикал формулы котором R и не зависимо друг от друга - С -Сд -алки или RA и R вместе с атомом азота, к которому они присоединены, образуют пирролидино-, пиперидино- или морфолиногруппу; R2 - водород, метил, аминогруппа, ацетамидогруппа или метиламиногруппа;R3 - C -Cg-алкоксикарбонил, аллилоксикарбонил, пропаргилоксикарбонил, (с -С -циклоалкил)-оксикарбонил, (С -С-у-Циклоалкил) -метилоксикарбонил, 1-(Сз-С7-циклоалкил)-этилоксикарбонил, бензилоксикарбонил, еб-метилбензилоксикарбонил, феноксикарбонил, С -Cg-алкоксикарбонилметил, 1-(С -Сд-алкоксикарбонил)-этил, гидразинокарбонил, карбоксигруппа, карбоксамидогруппа, -(С -С4-алкил)-карбоксамидогруппа,М -(С -С4-алкокси)-карбоксамидогруппа, оксиметил-, цианогруппа, метилсульфонил или трифторметил, причем R находится в 5 или 6 положении, отличающийся тем, что таутомерное бензимидазольчое соединение общей формулы где R2 и R имеют значения, указанные выше , подвергают взаимодействию с сул1)Фохлоридным соединением общей формулы R S02C1 , где R имеет значения, указанные выше, в среде инертного органического растворителя при температуре от комнатной до температуры кипения реакционной смеси с последующим выделением целевогопродукта в. индивидуальном виде или в виде смес1 5- и б-изомеров. Предпочтительно в качестве инертного органического растворителя применяют ацетон или, тетрагидрофуран и процесс ведут в присутствии основания.
1Таутомерными бензимидазолами на- , зываются такие соединения, в которых атом водорода может находиться у любого атома азота. Незамещенным у атома азота исходным бензимидазолам, имеющим заместитель в положении 5 в бензольной части молекулы, соответствует таутомерная форма с заместителем в положении 6.
Изомерная смесь может быть указана цифрами взаимоисключающих положений, а именно 5(6). Как следствие такого таутомеризма, реакция 5 (6)-замещенного бензимидазола с сульфохлоридом дает смесь изомеров 5(6)-замещенных сульфонилбензимидазолов.
Кроме того, в тексте описания изобретения используется следующая терминология: фуран означает радикал фурана, присоединенный в положении 2 или 3. Тиенилом называется радикал тиофена, присоединенный в положении
2и 3. Тиазол-2-ил или -2-тиазол относится к радикалу тиазола, присоединенному ко второму углеродному атому. Термином 1,3,4-тиадиазол-2-ил или тиадиазол-2-ил обозначают радикал 1,3,4-тиадиазола, связанный со вторым атомом углерода. 2-Метил-1,3,4-тиадиаЗОЛ-5-ИЛ или 2-метиламино-1,3,4-тиадиазол-5-ил означает замещенный в положении 2 радикал 1,3,4-тиадиазола, присоединенный в положении 5.
В качестве реагентов предпочтение отдается бензимидазолам, несущим в положении 5 или 6 заместители, которые химически инертны к сульфохлоридному реагенту. Производное бензимидазола и сульфохлорид, как правило, используются в эквимолярных количествах, -хотя при необходимости допустим избыток любого из исходных реагентов без снижения выхода продукта Реакция может проводиться в любом нере кционноспособном растворителе, BKjtao4aH и такие, как ацетон, тетрагийрофуран (ТГФ), третичные амиды, например N,N-диметилформамид (ДМФ) и хлорированные углеводороды, например дихлорметан, дихлорэтан и хлороформ. В состав реакционной среды может включаться основание для связывания кислоты. В- качестве примера основания можно указать такие соединения, как пиридин, триэтиламин, N-метилформалик, бикарбонат или гидрид натрия. В качестве растворяющей среды для реакции предпочтение отдается ацетону, содержащему триэтиламин или тетрагидрофуран с диметилформамидом и гидрид натрия в качестве основания. Реакцию осуществляют при температуре от комнатной до температуры ки пения с обратным холодильником системы растворителей. Предпочтительно вести реакцию при температуре кипе|ния, причем при осуществлении реакции Ьри указанной температуре она практи О чески завершается в течение 1-48 ч.
Продуктом реакции является 1-сульфонилбензимидазол, именуег ый в дальнейшем производным сульфонилбензимидазола. Продукт может быть вьщелен фильтрованием реакционной смеси и концентрированием фильтрата, при котором происходит кристаллизация продукта. С другой стороны, реакционная смесь может упариваться досуха, и
0 остаток обрабатывается приемлемым растворителем, таким как ацетон или метиловый спирт, что позволяет отделить и удалить любые нерастворимые соединения. Раствор, содержащий производное сульфонилбензимидазола, концентрируется с целью выделения кристаллического продукта либо упаривается, давая второй остаток, который, йапример, растворяется в метилоn BOM спирте. Производное сульфонилбензимидазола извлекается из метилового спирта кристаллизацией продукта.
При взаимодействии таутомерн.ого производного бензимидазола с сульфос хлоридом обычно .получается смесь 1:1 изомеров сульфонилбензимидазола, замещенных в положении 5 и 6. Изомеры разделяются фракционной кристаллизацией либо хроматографированием на колонке. Обычно сначала из раствора смеси кристаллизуется 6-изомер. Например, в случае, когда этиловый эфир 2-амино-5-бензимидазолкарбоновой кислоты вводят в реакцию с диметилсульфамоилхлоридом в ацетоне, содержащем
5 триэтиламин, сначала из реакционной смеси кристаллизуется этиловый эфир 1-диметиламиносульфонил-2-амино-6-бензимидазолкарбоновой кислоты. Ацетоновый маточный раствор преимущестQ венно содержит этиловый эфйр-1-диметиламиносульфонил-2-амино-5-бензимидазолкарбоновой кислоты и остаток 6-изомера. Изомеры могут быть идентифицированы по их ЯМР-спектру в области фенил-протона (7,0-8,.3 ппм) .
Смеси изомерных сложных эфиров сульфонилбензимидазолов могут быть разделены селективным гидролизом более лабильных эфирных групп. Например, смесь изомеров этилового эфира
Q 1-диэтиламиносульфонил-2-амино-5(6)бензимидазолкарбоновой кислоты может гидролизоваться в водной гидроокиси калия. -Нерастворимый непрореагировавший 6-изомер отфильтровывается. Щелочной водный фильтрат преимущественно содержит калиевую соль 1-диэтиламиносульфонил-2-амино-5-бензимидазолкарбоновой кислоты и небольшое количество Ьоли б-иэомера. Фильтрат нейтрализуется разбавленной кислотой, при этом 1-диэтиламиносульфонил-2-амино-5-бензимидазолкарбоноваякислота осаждается и извлекается. Сульфонилбензимидазолкарбоновые кис(1оты могут быть превращены в их слож|ные эфиры реакцией с тионилхлоридом в присутствии С -Со-спиртов в качестве растворителей либо иными способами этерификации, хорошо известными специалистам данной области. Эфирные гидролизаты с аминогруппой в положении 2 способны осаждаться при рН в пределах 5,0-7,0.
Примерами сложных эфиров и амидов сульфонилбензимидазолкарбоновых кислот формулы Т служат следующие соединения:
1-циклопропилсульфонил-2-метил-5(6)-бензимидазолкарбоноваи кислота, циклопропиловый сложный эфир этой кислоты;
1-(2-фуран)-сульфонил-2-амино-5(6)-бензимидазолкарбоновая кислота циклопентиловый эфир этой кислоты;
1-(2-тиофен)-сульфонил-2-метилами- но-5(6)-бензимидазолкарбоновая кислота, циклогексиловый эфир этой кислоты;
1-{2-тиазол)-сульфонил-2-ацетамид -5(6)-бензимидазол-карбоновая кислота циклогексиловый эфир этой кислоты;
1-циклопентилсульфониЛ-2-амино-5(6)-бензимидазолкарбоновая кислота, циклопропилметиловый эфир этой кислоты;
1, 3 ,4-тиадиазол -сульфонилД-2-амино-5(6)-бензимидазолкарбоновая кислота, циклобутилметиловый сложный эфир этой кислоты,
1-циклогексилсульфонил-2-метиламино-5(6)-бензимидазолкарбоновая кислота, циклопентилметиловый сложный эфир этой кислоты;
1-изопропилсульфонил-2-амино-5 6)-бензимидазолкарбоновая кислота, циклогептилметиловый сложный эфир этой кислоты;
1-диметиламиносульфонил-2-амино-5 (б) -бензимидазолкарбоновая к.ислота, 1-(циклопропил)-этиловый сложный спирт;
1-пиперидиносульфонил-2-ацетамиДО--5 (6) -бенэимидазолкарбоновая кислота ;
1-(циклобутил)-этиловый сложный эфир кислоты;
1-пирролидиносульфонил-2-амино- 5(6)-бензимидазолкарбоновая кислота;
1-(циклопентил)-этиловый сложный эфир этой кислоты;
1-диэтиламиносульфонил-2-метил5(6)-бензимидазолкарбоновая кислота;
1-(циклогексил)-этиловый эфир этой кислоты;
1-дипропиламиносульфонил-2-метил-5{6)-бензимидазолкарбоновая кислота;
1-(циклогептил)-этиловеЗй эфир этой КИСЛОТЫ;
1-диметиламиносульфонил-2-амино5 -5 (6 )-бензимидазолкарбоновая кислота/;
2-метилциклогексиловый сложный
эфир этой КИСЛОТЫ;
1-диэтиламиносульфонил-2-амино-5(6)-бензимидазолкарбоновая кислота, 3-метилциклогексиловый эфир этой
КИСЛОТЫ;
изопропиловый эфир 1-(2-фуран)-сульфонил-2-ацетамидо-5(6)-бензимидазолкарбоновой кислоты; 5 неопентиловый эфир 1-(2-тиазол)-сульфонил-2-амино-5 (6) -бензимидазолКарбОНОВОЙ КИСЛОТЫ;
гексиловый эфир 1-(2-ацетамидо-) -4-метилтиазол-5-ил}-сульфонил-2-меQ тил-5(6)-бензимидазолкарбоновой кислоты;
1-(2-метиламино-1,3,4-тиазол-5-ил)-сульфонил-2-метиламино-5(6)-бензимидазолкарбоновая кислота, 1-(циклопропил ) -этиловый эфир этой КИСЛОТЫ;
5
неопентиловый эфир 1-диметиламиносульфонил-2-ацетамидо-5(6)-бензимидазолкарбоновой КИСЛОТЫ;
изопропиловый эфир 1-изопропилсульфонил-2-амино-5(6)-бензимидазол0 карбоновой КИСЛОТЫ;
неопентиловый эфир 1-бензолсульфонил-2-метил-5(6)-бензимидазолкарбоновой КИСЛОТЫ;
циклобутиловый эфир 1-(2-тиофен)5 -сульфонид-5(6)-бензимидазолкарбоновой КИСЛОТЫ;
циклогексиловый эфир 1-(2-тиазол)-сульфонил-2-амино-5(6)-бензимидазолкарбоновой кислоты ;
0
1-диметиламиносульфонил-2-амино-5(6)-бензимидазолкарбоновая кислота, 1-{циклопропил)-Этиловый эфир
этой КИСЛОТЫ;
5 неопентиловый эфир 1-диметиламиносульфонил-2-амино-5(6)-бензимидазолкарбоновой кислоты;
циклобутиловый эфир 1-(М-метил-N-этиламиносульфонил)-2-амино-5(6)Q -бензимидазолкарбоновой кислоты;
изопропиловый эфир 1-(N-мeтил-N-пpoпилaминocyльфoнил) -2-ацетамидо-5(6)-бензимидазолкарбоновой кислоты;
циклогексиловый эфир 1-дипропил аминосульфонил-2-метил-5(6)-бензимидазолкарбоновой кислоты;
изопропиловый эфир 1-пирролидин сульфонил-2-амино-5(6)-бензимидазолкарбоновой КИСЛОТЫ;
0 неопентиловый эфир 1.-пиперидиносульфонил-2-ацетамидо-5(6)-бенэимидазолкарбоновой кислоты;
циклобутиловый эфир 1-пиперидиносульфонил-2-метил-5(6)-бензимидазол5 карбоновой КИСЛОТЫ;
1-изопропилсульфонил-2-ацетамидо-5(6)-бензимидазолкарбоновая кислота, 4-метилциклогексиловый эфир этой кислоты;
1-диметиламиносульфонил-2-амино-5(6) -бензимидазолкарбоновая кислота, 1-метилцикло.гексиловый сложнУй эфир этой кислоты;
амид 1-диметиламиносульфонил-2-ацетамидо-5(6)-N-метилбензимидазолкарбоновой КИСЛОТЫ;
амид 1-(2-метил-1,3,4-тиадиазол-5-ил|7сульфонил-2-метил-5 (61 -этилбензимидазолкарбоновой кислоты;
амид-1-пирроЛидиносульфонил-М-метиламино-5 (6) - N-пропилбензимидазолкарбоновой кислоты;
амид 1-морфолинсульфонил-2-метиламино-5(6)-N-иэопропилбензимидазолкарбоновой кислоты;
амид 1-дипропиламиносульфонил-5(6 -N-бутилбензимидазолкарбоновой кислоты;
амид 1- Q 3-фуран) -сульфонил -5 ( 6) -N-втор-бутилбензимидазолкарбойовой кислоты;
амид 1-пирролидиносульфонил-5(6)-N-изобутилбензимидазолкарбоновойкислоты;
амид 1-фенилсульфонил-2-амино-5(6)-N-трет-бутилбензимидазолкарбоновой кислоты;
амид 1-бутилсульфонил-2-ацетамидо5(6)-N-метоксибензимидазолкарбоновой кислоты;
амид 1-изобутилсульфонил-2-метиламино-5(6)-N-этоксибензимидазолкарбоновой кислоты;
амид 1-диизопропиламиносульфонил-2-метил-5(6)-N-пропоксибензимидазолкарбоновой кислоты;
амид 1-диэтиламиносульфонил-2-ацетамидо-5(6)-N-изопропоксибензимидазолкарбоновой кислоты;
амид 1-диметиламиносульфонил-2-амино-5(6)-N-бутоксибензимидазолкарбоновой кислоты;
амид 1-пиперидиносульфонил-5(б)-N-изобутоксибензимидазолкарбоновойкислоты;
амид 1- ( 2-метил-1, 3 , 4-тиадиазол-5-ил)-сульфонилД-2-метиламино-5(б)-N-йтор-бутоксибензимидазолкарбоновойкислоты и амид 1-циклопропилсульфонил-2-ацетамидо-5(6)-N-трет-бутоксибензимидазолкарбоновой кислоты.
(Для получения-бензимидазолов, являгащихся реагентами, необходимы соотйеТствующим образом замещенные о-фенилендиамины. З-Нитро-4-хлорбензотрифториды могут аммонироваться и восстанавливаться, давая 3 ,4-диаминобензотрифториды. 2-(3,4-Диаминофенил)-уксусная кислота может быть получена ацетилированием 2-(4-аминофенил)-ацетонитрила с уксусным ангидридом в пиридине. Полученный 2-(4-ацетамидофенил)-ацетонитрил нитруется в уксусном ангидриде, давая 2-(3-нитро-4-ацетамидофенил)-ацетонитрил. Нитрил гидролизуется концентрированной соляной кислотой, -давая 2-(З-нитро-4-аминофенил) -уксусНую кислоту после нейтрализации. Нитрокислота гищроге- Дивуется под давлением 60 фунтов на i кв.. дюйм (42 атм) при комнатной температуре над палладием на угле (катализатор), давая 2-(3,4-диаминофенил)--уксусную кислоту.
. Кислота С -Cg-карбинолом в при сутствии кислотнЕлх катализаторов превращается в сложный эфир. Аналогично синтез 2-(4-аминофенил)-пропионовой кислоты начинается с 2-(4-аминофенил) -пропиононитрила, как описано выtS ше для синтеза диаминофенилуксусной кислоты.
4-Циано-о-фенилендиамин может быть приготовлен из 4-аминобензонитрила: а) ацетилированием, в результате которого получается 4-ацетамидобензонитрил, б) нитрованием, приводящим к образованию З-нитро-4-ацетамидобензонитрила, в) .отщеплением ацетилгруппы пятихлористым фосфором
|ie в пиридине с образованием З-нитро-4-: -аминобензонитрила и г) гидроген-изацией нитрогруппы при давлении 42 атм (60 фунтов на 1 кв. дюйм) .на никеле Ренея, давая 3,4-диаминобёнзонитрил (4-циано-о-фенилендиамин).
0 4-Метилсульфонил-о-фенилендиамин может быть получен в результате следующей последовательности реакцией: а) нитрования (4-хлорфенил -метилсульфона с получением (З-нит5 ро-4-хлорфенил)-метйлсульфона, б)
замещения хлорной группы, приводящего к образованию (3-нйТро,-4-аминофенил)-метйлсульфона и в) гидрогенизации нитросульфона на катализаторе :
0 рутений на угле, в результате чего получается нужный 4-мэтилсульфонил-о-фенилендиамин.
Исходные бензимидазолы для описанного выше способа готовятся в
5 соответствии с любым из методов. Требуемые 2-(Н)- и 2-метилбензимидаэолы получаются циклизацией соответствующих о-фенилендиаминов муравьиной или уксусной кислотой. 2-АминобензимиQ дазолы получаются циклизацией о-фенилендиаминов бромцианом; циклодесульфированием соответствующих l- 2-a инофенил}-3-метил-2-тиомочевин окисью ртути могут быть получены 2-метилами нобенэимидазолы. Ацилированием соответствующего 2-аминобензимидаэола может быть приготовлен 2-ацетамидобензимидазол. Примерами таких бензимидазолов , которые могут реагировать с соответствующими сульфохлори0 дами, являются 2-(н), 2-амино , 2-метил, 2-метиламино, 2-ацетамидобензимидазолы, замещенные в положениях 5 или & С -С -алкоксикарбонилоМ, С |-С2-алкоксикарбонилметилом, 1- ( -Cfj-алкоксикарбонил) этилом, цианогруппой, метилсульфонилом или трифторметилом.
Из числа сульфохлоридов, используемых в качестве исходных реагентов, промышленностью выпускаются метансульфохлорид, изопропилсульфохлорид, хлорангидрид диметилсульфоаминовой кислоты,, бензолсульфохлорид, 2-тио;фенсульфохлорид и 2-ацетамидо-4-метил-5-тиазолсульфохлорид. Окислением тиольной группы бромом или хлором в водном растворе из 2-тиазолтиола, 2-тиадиазолтиола, 2-метил-5-тиадиазолтиола и 2-метиламино-5-тиадиазолтиола могут быть получены 2-тиазолсульфохлорид, 2-тиадиазолсульфохлорид-, 2-метил-5-тиадиазолсульфохлорид и 2-метиламино-5-тиадиазолсульфохлорид соответственно. Другие C -CQ aJlKил и Сз-С7 Циклоалкилсульфохлориды могут быть приготовлены хлорированием соответствующего алкилтиола или реакцией сульфурилхлорида с алкилсульфонатами натрия, приготовленными из соответствующих : Карбинолов и серной кислоты. Хлорангидриды N , N-диалкилсульфаминовой кислоты могут быть получены взаимодействием сОли вторичного амина с сульфурилхлоридом. С другой стороны, они могут быть получены взаимодействием хлорамина формулы R RgN-Cl с двуокисью серы при температуре от -5 до +30°С. Сами хлорамины синтезируются по реакции соответствующих вторичных аминов с пятихлористой сурьмой, хлорноватистокислым натрием или сульфурилхлоридом.
Примерами других сульфохлоридов, способных вступать в реакцию с бенэимидаэолами, являются такие соединения, как этил-, пропил-, изопроПИЛ-, бутил-, изобутил-, втор-бутил,трет-бутил-, амил-1, изоамил-, втор-изоамил- и трет-амилсульфохлориды.
Примерами иных хлорангидридов сульфаминовых кислот могут служить хлорангидриды диэтил-, дипропил-, М-метил-М-этил, N-метил-N-пропил, N-этил-N-пропил, N-метил-N-изопропилЫ-этил-М-изопропил-, М-пропил-М-изопропил-, диизопропил-, пирролидино-, пиперидино- и морфолиносульфаминовых кислот.
Для удобства номенклатуры сульфонилбензимидазолы в дальнешем будут именоваться сульфонилпроизводными. Например, продукт реакции хлорангидрида диметилсульфаминовой кислоты и этилового эфира 2-амино-5-бензимидазолкарбоновой кислоты именуется этиловым эфиром 1-диметиламиносульфонил-2-амино-5(б) -бензимидазолкарбоновой кислоты, а не этиловым эфиром 1-диметилсульфонил-2-амино-5 (6)-бензимидазолкарбоновой кислоты.
Пример 1. Синтез этилового эфира 1-диметиламииосульфонил-5 (6) -бензимидазолкарбоновой кислоты.
В 100 мл тетрагидрофурана при -перемешивании растворяют 4,8 г (25,0 -..моля) этилового эфира 5(6) -бензимидазолкарбоновсгй К1 слоты. Отдельными порциями с соблюдением осторожности добавляют 1,3 г (27 .моля) гидрида натрия в виде 50%-ной дисперсии в минеральном масле, а затем 5 мл безводного диметилформамида. Добавлено также 25 молей (3,6 г) хлорангидрида диметилсульфаминовой
кислоты в 10 мл безводного тетрагидрофурана и реакцию проводят при кипячении с обратным холодильником в течение 16 ч. Реакционную смесь упаривают досуха, в результате чего
получают маслянистый продукт. Последний обрабатывают 200 мл воды и выливают в воду равного объема. После выдержки масло отвердевает, а воду декантируют. Воскообразное вещество
поглощают этиловым эфиром уксусной кислоты и раствор обесцвечивают углем. Уголь отфильтровывают и фильтрат концентрируют до 1/3 первоначального объема. Продукт -кристаллизуют вьвдержкой в течение ночи. Кристаллический продукт промывают малым количеством четыреххлористого углерода и собирают. Выход составляет 5,0 г этилового эфира 1-(диметиламиносульфонйл)-5(6)-бензимидазолкарбоновой
кислоты.
Вычислено,%: С 48,8) Н 5,09; . N 14,14.
(мол.вес, 297) . Найдено,%: С 48,48; Н 5,20/ N 14,4.
Пример 2. Синтез этилового эфира 1-диметиламиносульфонил-2-метил-6-бензимидазолкарбоновой кислоты.
В 100 мл безводного тетрагидрофурана при перемешивании добавляют 5,1 г этилового эфира 2-метилбензимидазол-5-карбоновой кислоты (25 ). К реакционной смеси добавляют 1,3 г гидрида натрия в виде 50%-ной суспензии в минеральном масле, а затем 5 мл диметилформамида и 25 .-.молей
(3,6 г), хлорангидрида диметилсульфаминовой кислоты в 10 мл тетрагидрофурана и реакционную смесь кипятят с обратным холодильником при перемешивании в течение 6 ч. Смесь досуха упаривают в вакууме. Затем остаток обрабатывают н-гексаном с целью удаления минерального масла и гексан декантируют. Остаток растирают с ме.тиловым спиртом. Вьщеляющийся из метилового спирта кристаллический продукт собирают, получая 300 мг этилового эфира 1-диметиламиносульфонил-2-метил-6-бензимидазолкарбоновойкислоты с т.пл. 124-126°С. Структура бесцветного 6-изомера подтвержд.ена
методом ЯМР в диметилсульфоксиде.
Вычислено,: С 50,15/ Н 5,50/ N и,50.
(мол. вес 311)
Найдено,: С 49,97/ Н 5,67/ N 13,23.
Пример 3. Синтез этилового эфира 1-изопропилсульфонил-2-амино-5(6)-бензимидазолкарбоновой кислоты
В 150 мл ацетона перемешивают 5 г (25,0 -молей) этилового эфира 2-амиио-5-бензимидаэолкарбоновой кислоты и 3 мл триэтиламина. К Перемешиваемой реакционной смеси по каплям добавляют 3,6 г (25 молей) изопропилсульфонилхлорида, растворенных в 10 мл ацетона. Смесь кипятят с обратным холодильником 20 ч. После охлаждения смесь фильтруют и фильтрат упаривают досуха в вакууме. Остаток растворяют в минимальном количестве метилового спирта и вьодерживают при комнатной температуре в течение ночи. Кристаллический продукт отфильтровывают и вещество промывают малым количеством холодного метилового спирта и эфира. Дополнительно продукт был получен из объединенных промывочных жидкостей. Выход - 280 м этилового эфира 1-(изопропилсульфонил)-2амино-6-бензимидазолкарбоновой кислоты с т.пл. 165-167 -с в виде бесцветных кристаллов. По ЯМР-спектру в диметилсульфоксиде установлено, что продукт представляет собой 6-изомер.
б-Иэомер выделен из первоначального метанольного Фильтрата с выходом 365 мг этилового эфира 1-изопропилсу фонил-2-амино-5-бензимидазолкарбоно вой кислоты с т.пл. примерно 166168 С в виде оранжевых кристаллов. Структура соединения подтверждена ЯМР-спектром в диметилсульфоксиде.
Элементный анализ для 5- изомера; С 49,86; Н 5,48; N 13,24%; для изомера: С 49,92; Н 5,26; N 13,44%. Теоретическое содержание в продукте формулы C,jHnN}04S (мол. вес 311): С 50,15; Н 5,50; N 13,50%.
Пример 4. Синтез этилового эфира 1-(N-метил-N-этиламиносульфонил)-2-амино-6-бензимидазолкарбоново
кислоты.
В 40 мл безводного ацетона перемешивают 10 г (50,0 молей) этилового эфира. 2-амино-6-бензимидазолкарбоновой кислоты и 10 мл триэтиламина Доб|авляют 8 г (50,0 молей) хлоран1 дрида м-метил-М-этилсульфаминовой кислоты и смесь кипятят с обратным холодильником в течение 48 ч. После охлаждения реакционную смесь фильтруют и фильтрат концентрируют до половины первоначального объема в вакууме. При выдержке в течение ночи .из раствора выделяют смесь изомеров в виде кристаллов. Смесь собирают и промывают малым количеством спирта.
Вычислено,%: С 47,87/ Н 5,56; N 17,17.
(мол. вес 326)
Найдено, %: С 48,09; Н 5,49, N 16,97.
Выход 4,6 г, т.пл. 170-171 С.
Пример 5. Иллюстрируют разделение 5- и 6-замешенных изомеров сульфонилбенэимидазолаv
4,6 г (14 молей) смеси изомеров этиловых эфиров l-(N-мeтил-N-этиламиносульфонил-2-амино-5(6)-бензимидазолкарбоновых кислот, 1,7 г (30 : молей) гидроокиси калия и 50 мл воды кипятят с обратным холодильником в течение 45 мин. После охлаждения нерастворимый 6-изомер этилового сложного эфира отфильтровывают. Выход этилового эфира 1--N-метил-Н-этиламиносульфонил -2-амино-6-бензимидазолкарбоновой кислоты составляет 450 мг, т.пл. 170-171°С.
Вычислено,%: С 47,84/ Н 5,56; N 17,17.
С(зН|дМдОд,5 (мол. вес 326)
Найдено, %: С 47,76; Н 5,66/ N 16,95.
Основной фильтрат нейтрализуют
1Н. соляной кислотой.,Выделившийся в осадок продукт собирают, получая
2г 1-(N-мeтил-N-этилaминocyльфoнил)-2-aминo-5-бeнзимидaзoлкapбoнoвo кислоты в виде моногидрата с т.пл.. 197-199с.
Вычислено,%: С 41,77; Н 5,07; N 17,72.
«° (мол. вес 316)
Найдено, %: С 42,62; Н 4,49; N .17,98.
Дальнейшее подкисление нейтрального фильтрата приводит к получению малог количества смеси 5- и 6-изомеров карбоновых кислот.
Пример 6. Синтез 1-диметиламиносульфонил-2-амино-5 (6)-оксиметилбензимидазола.
30 ммолей (4,9 г) 2-амино-5(6)-оксиметилбензимидазола растворяют в 40 мл ацетона . Добавляют к раствору в ацетоне 30 молей (3,03 г) триэтиламина, а затем 4,32 г (3,0 молей хлорангидрида диметилсульфаминовой кислоты. Смесь в течение 1-7 ч кипятят с обратным холодильником, после чего вливают в 25 мл воды. Водную смесь экстрагируют хлороформом. Хлороформовый экстракт последовательно промывают водой и насыщенным раствором хлористого натрия, Хлороформовый раствор фильтруют и сушат. Хлороформ упаривают досуха в вакууме получая, 5,5 г (66%) неочищенного продукта в виде смеси изомеров.
7 г сырой смеси изомеров пропускают через хромат-ографическую колонку с силикагелем Воэльма, используя в качестзе растворителя этиловый эфир уксусной кислоты. После пропускания через колонку б л элюирующего
растворителя получают 1,02 г 6-изо ера 1-диметиламиносульфонид-2-аминf-6-оксиметилбензимидазола с т.пл. 182-183 С (этилацетат-метанол).
Вычислено, %: С 44,43; Н 5,22, N 20,73.
C,oH, (мол. вес 270)
Найдено, %: С 44,37; Н 5,18; N 20,44.
Описанными в примерах 1-6 спосо6с1ми, используя в качестве исходных реагентов соответствующие бензимидазолы, получают следующие соединени
Пример 7. Гидразид 1-диметиламиносульфонил-2-амино-5-бензимидазолкарбоновой кислоты, т.пл. 229-230 0 (с разложением).
Вычислено, %: С 40,30, Н 4,70; N 28,20.
Найдено, %: С 40,21; Н 4,54; N 28,33.
Пример 8. Гидрат гидразида 1-диметиламиносульфонил-2-амино-6-бензимидазолкарбоновой кислоты, т.пл. 205-20600.
Вычислено, %: С 37,97; Н 5,06 N 26,58.
Найдено, %: С 38,40, Н 4,41; N 26,15.
Пример 9. Гидрат амида 1 дметиламиносульфонил-2-амино-5-бензимидазолкарбоновой кислоты с т.пл. 208-209С.
Вычислено,%: С 39,87; Н 4,98,N 23,25.
Найдено,%: С 40,05; Н 4,78; N 22,81.
Пример 10. Амид 1-диметиламиносульфонил-2-амино-6-бензимидазолкарбоновой кислоты с т.пл. 206208 0.
Вычислено,%: С 42,40; Н 4,63; N 24,72.
Найдено,%: С 43,56} Н 4,53; N 24,60.
Прим ер 11. Амид 1-диметиламнocyльфoнил-2-aминo-5-N-этилбeнзимиазолкарбоновой кислоты с т.пл. 155160 0.
Вычислено,%: С 46,29; Н 5,50; N22,49.
Найдено,%: С 46,54; Н 5,24; N21,93.
Пример 12. Амид 1-диметиламинЬсульфонил-2-амино-6-М-зтилбенЭфкрм
аимидазолкарбоновой кислоты с т.пл. 215-216®С.
Вычислено, %: С 46,29; Н 5,50; N 22,49.
Найдено,%: С 46,11; Н 5,35; N 22,25.
Пример 13. Этиловый эфир 1-{2-тиофен)-сульфонил-2-амино-5(6)-бензимидазолкарбоновой кислоты.
Вычислено,%: С 47,85; Н 3,73, N 11,96.
o
Найдено, %: С 47,67; Н 3,84;
N 11,76.
Пример 14. Этиловый эфир 1-(2-ацетамидо-4-метилтиазол-5-ил)-сульфонил-2-амино-5(6)-бензимидазол5 карбоновой кислоты с т.пл. 190-202с (с разложением).
Вычислено,%: С 45,39; Н 4,02; il 16,54.
Найдено,%: С 45,52; Н 4,43; 0 N 15,94.
Пример 15. Этиловый эфир 1-(2-метиламино-1,3,4-тиадиазол-5-ил) -сульфонил-2-амино-5(6)-бензимидазолкарбоновой кислоты.
Вычислено,%: С 40,83; Н 3,69; N 21,98.
Найдено,% С 40,59; Н 3,94; N 21,78.
Пример 16. Этиловый эфир 1- (N-мeтил-N- пpoпилaминocyльфoнил) 0 -2-амино-5(6)-бензимидазолкарбоновой кислоты с т.пл. 140-148°С.
Вычислено,%: С 49,40; Н 5,92/ N 16,46.
Найдено,%: С 49,30; Н 6,13/ 5 N 16,37.
Пример 17. Этиловый эфир 1-диэтиламиносульфонил-2-амино-6-бензимидазолкарбоновой кислоты с т.пл. 142-143с.
0 Вычислено,%: С 49,40; Н 5,92; N 16,46.
Найдено,%: С 49,73; Н 5,90; N 16,18.
Пример 18. Этиловый эфир 1-бензосульфонил-2-амино-5(6)-бензи5 мидазолкарбоновой кислоты.
Вычислено,%: С 55,64; Н 4,38; N 12,17.
Найдено,%: С 55,86; Н 4,48; N 12,22.
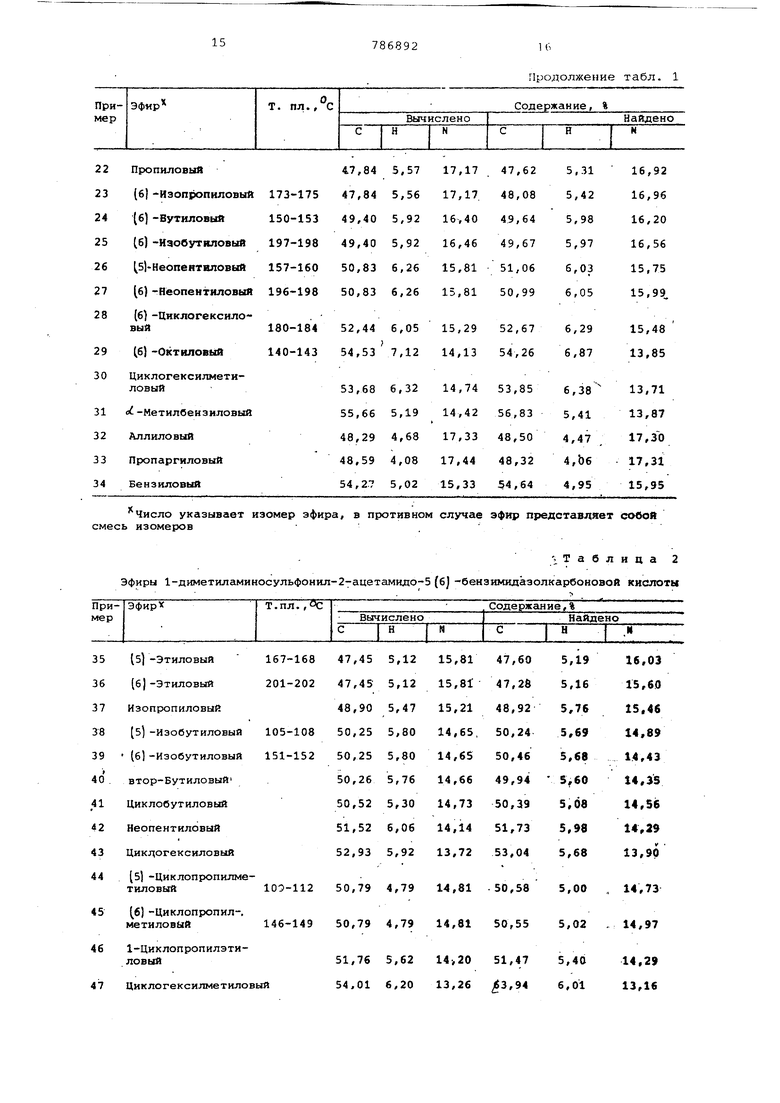
0 Аналогичным образом получены соединения, приведенные в табл. 1 и 2. 1-днметилги4иносульфои1сл-2-аивыо-5 (6)-бенэимидаэолкарбоновоя кмслотн Таблица 1
Продолжение табл. 1










| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения карбонилзамещенных 1-сульфонилбензимидазолов | 1976 |
|
SU691089A3 |
| Способ получения карбонилзамещенных 1-сульфонилбензимидазолов | 1977 |
|
SU679140A3 |
| Способ получения производных тиазолинил или тиазинилбензимидазола | 1976 |
|
SU721003A3 |
| Способ получения карбонилзамещенных 1-сульфонилбензимидазолов | 1977 |
|
SU685151A3 |
| Способ получения замещенных 1-сульфонилбензимидазолов | 1978 |
|
SU727142A3 |
| Способ получения производных тиазолинил-кетобензимидазола | 1977 |
|
SU701540A3 |
| Способ получения карбонилзамещенных 1-сульфонилбензимидазолов | 1977 |
|
SU884570A3 |
| Способ получения производных тиазолинилкетобензимидазола | 1977 |
|
SU685154A3 |
| Способ получения карбонилзамещенных 1-сульфонилбензимидазолов | 1978 |
|
SU919593A3 |
| Способ получения замещенных 1-сульфонилбензимидазолов | 1978 |
|
SU730301A3 |

50,79 4,79 тиловый10 -112 (6) -Циклопропил-, 146-149 50,79 4,79 метиловый 1-Циклопропилэти51,76 5,62 ловый 54,01 6,20 Циклогексилметиловый 14,81 -50,58 14,81 50,55 5,02 , 14,97 14,20 51,47 5,40 14,29 3,94 6,01 13,16 13,26
48 (З-Метилциклогексил)-метилосмесь изомеров.
Пример 51. Получение трет- i-бутил-1-диметилсульфамоиламино-2-амино-5(б)-бенэимидаэолкарбоксилата,
А) трет-Бутил-3,4-динитрйбёнзоат (мол. вес 351).
53 г (0,25 моля) 3,4-динитррбензойной кислоты, 500 мл бензола, 20 65 г (0,51 моль) оксалилхлорида и 1 мл пиридина перемешивают йри комнатной температуре около 1 ч. Смесь подогревают до 55®С с целью получения .гомогенного раствора. Реакцией- 25 ную смесь выпаривают в вакууме, получая 3,4-динитробензоилхлорид в ви-де маслообразного продукта.
Сырой по степени чистоты 3,4-динитробензоилхлорид растворяют в jfi 500 мл бензола; последовательно добавляют 25 мл пиридина к реакционной смеси и 22 г (0,3 моля) трет-бутанола. Реакционную смесь нагревают с обратным холодильником 4 ч и фильтруют. ,Бензольный фильтрат промывают последовательно разбавленной кислотой, разбавленной щёлочью и водой.
Пролитый бензольный раствор высущивают и выпаривают в вакууме, получая 33 г (49%)трет-бутил-3,4-динитробен - 40 Ьоата.
Вычислено, %: С 49,26 Н 4,51} N 10,44.
Найдено, %: С 48,95; Н 4,30) 45 N 10.14.
вТ трет-Бутил-2-амино-5 (б))-бейэимидазолкарбоксилат.
4,2 г (0,02 моля) трет-бутил-3,4-динитробензоата гидрируют в 25 мл JQ этанола в присутствии 1 г 5%-ного палладия, нанесенного на уголь, в течение 1 ч при комнатной температуре. В ходе экзотермической.реакции температура достигает максимальной величины , причем поглощение водорода достигает 85% от теоретического. Катализатор отфильтровывают и фильтрат выпаривают в вакууме до получения остаточного маслообразного продукта. Сырой трет-бутил-3,4-ди- 0 аминобензоат (0,017 моля) растворяют в смеси 20 мл метанола и 200 мл воды и добавляют 1,8 г (0,017 моля) цианогенбромида и оставляют на ночь. Водную смесь подщелачивают 1 н. раст- 5
Продолжение табл. 2
вором гидрата окиси натрия и экстрагируют этилацетатом. Этилацетатовый ... экстракт обеспечивают углем и фильтруют. Этилацетатный раствор выпаривают в вакууме, получая 1,5 г (38%) трет-бутил-2-амино-5.(б) -бензимидазолкарбоксилата.
в) трет-Бутил-1-диметиламиносульфонил-2-амино-5(б)-бензимидазолкарбоксилат.
3 г (0,013 моля) трет-бутил-2-амино-5{6)-бензимидазолкарбоксилата 50 мл диметоксиэтана, 0,7 г 50%-ного гидрида натрия и 1,9 г диметилсульфанилхлорида нагревают с обратным холодильником 3 ч. Реакционную смесь фильтруют и фильтрат выпаривают досуха в вакууме. Остаток обрабатывают водой и смесь экстрагируют этилацетатом. Экстракт высушивают над сульфатом магния и концентрируют кипячением на паровой бане до начинающейся кристаллизации. Этилацетатную смесь охлаждают в ледяной ванне и отфильтровывают кристаллический продукт трет-бутил-1 -диметйламиносульфонил- -2-амино-5(б;-бензимидазолкарбоксилат.
Пример 52. Получение 1-циклогексилсульфонил-2-амино-5(б)-этилбензимидазолкарбоксилата.
К суспензии 2,5 г (0,012 моля) 2-амино-5-этокснкарбонилбензимидазолав 100 мл ацетона добавляют 2 мл триэтиламина при перемешивании. К реакционной смеси добавляют 2,3 г (0,013 моля)циклогексилсульфонилхлорида в 5 мл ацетона при перемешивании. .Реакционную смесь нагревают при действии обратного холодильника 18 ч, фильтруют и концентрируют, получая маслообразный продукт. Этот продукт оставляют стоять под метанолом, он выкристаллизовывается, давая 1 г 1-циклогексилсульфонил-2-амино-5(6)-этилбензимидазолкарбоксилата.
Вычислено;%; С 54,70; Н 5,98; N 11,96.
Cj-Hj N O (мол. вес 351)
Найдено,%: С 54,33; Н 5,86; N 11,88.
Пример 53, Получение 1-циклопентилсульфонил-2-амино-5(6)-этилбензимидазолкарбоксилата .
Аналогично примеру 52 из 3,7 г (о,018 моля) 2-амино-5-этоксикарбонилбензимидазола, 2,5 г триэтиламина, 3,1 г (0,018 моля) циклопентилсульфонилхлорида и 100 мл ацетона получают 1-циклопентилсульфонил-2-амино-5(б)-этилбензимидазолкарбоксилат. К этому сырому по степени чистоты, концентрированному продукту добавляют этилацетат. Образовавшиеся кристаллы отфильтровывают, проьвлвают водой и эфиром и высушивают, получая 1 г 1-циклопе нтилсульфонил- 2-амино-6 -этилбен зимидазолкарбоксилата, т.пл. 179-181°С (с разложением).
Вычислено,%: С 53,40; Н 5,68; N 12,45.
CigHiqN iO S (мол. вес 337)
Найдено, %: С 53,51; Н 5,86Г N 12,18.
Из маточного раствора выделен 1 г 1-циклопе-нтилсульфонил-2-амино-5-этилбензимидазолкарбоксилата.
Вычислено, %: С 53,40; Н 5,92; N 11,83.
гО (мол. вес 355)
Найдено, %: С 50,78; Н 5,92;N 11,78.
Пример 54. Получение 1-циклогексилсульфонил-2-амино-5(б)-этилбен зимидазолкарбоксилата.
Аналогично примеру 52 из 3,7 г (0,018 моля) 2-амино-5-этоксикарбонилбензимидазола в 100 мл ацетона, 2,5 г триэтиламина и 3,6 г (0,018 моля) циклогептилсульфонилхлорида получают 1-циклогептилсульфонил-2-амино-5(6)-этилбензимидазолкарбоксилат. Соль отфильтровывают, концентрируют на паровой бане и охлаждают, получая выход 750 мг.
Вычислено,%: С 55,87Г Н 6,34; N 11,48.
(мол. вес 365)
С 55,98; Н 6,10;
Найдено,%
N 11,43.
ролидилсульфаноил-2-с1Мино-5 (6) -этилбензимидазодкарбоксилата.
К суспензии 10 г (0,05 моля) 2-амино-5-этоксикарбонилбензимидазолав 40 мл ацетона и 10 мл триэтиламина добавляют 8,5 г пирролидилсульфамоилклорйда в 10 мл ацетона. Реакционную рмесь нагревают при действии обратно го холодильника 48 ч и фильтруют. Продукт промывают водой и высушивают.ПолуЧают 12 г (ч65%) 1-пирролидилсульфамо1|1л-2-амино-5( 6) -этилбензимидазолкарбоксилата, т.пл. 189-192 С.
П Р и м е р 56. Получение 1-пиперидинсульфамоил-2-амино-5-этилбензимидазолкарбоксилата.
К 10 г ( моля) 2-амино-5-этоксикарбонилбензимидазола в 300 мл ацетона добавляют 10 мл триэтиламина при перемешивании. Затем к раствору добавляют 9,2 г (0,05 моля) пиперидинсульфамоилхлорида.Реакдйейную смес
нагревают с обратным холодильником 72 ч, охлаждают и фильтруют. Фильтрат концентрируют в вакууме, остаток растирают с метанолом и промывают |Метанолом. Получают 6,2 г 1-пиперидин сульфамоил-2-амино-5-этилбензимид азолкарбоксилата.
Вычислено,%: С 51,27, Н 5,45, N 15,94.
C|5H|gN O |S (мол. вес 351).
Найдено, %: С 51,04, Н 5,25; to N 15,72.
П р и м е р 57. Получение 1-морфолинсульфамоил-2-амино-5(6)-этилбен зимидазолкарбоксилата.
Согласно методике примера 56 проt5 водят реакцию 10 г (0,05 моля) 2-амино-5-этоксикарбонилбензимидазолав 300 мл ацетона, 9,2 г (0,05 моля) морфолинсульфамоилхлорида и 10 мл триэтиламина. Получают 1,7 г 1-мор20 фолинсульфамоил-2-амино-5(6)-этилбензимидазолкарбоксилата. М/е 354, 309, 203.
Вычислено,%: С 47,45; Н 5,12; N 15,81.
4 ОБ .(мол. вес 354) . Найдено,%: С 48,00; Н 5,00, N 14,06.
Пример 58. Получение 1-диметилсульфамоил-2-метиламино-(6)-этилбензимидазолкарбоксилата. 0 500 мл 50%-ного гидрида натрия добавляют к суспензии 2,2 г (0,01 моля) 2-метиламино-6-этоксикарбонилбензимидазола в 50 мл сухого тетрагидро фурана и 1 мл сухого диметилформами5 да. Реакционную смесь перемешивают при комнатной температуре в. атмосфере азота 20 мин. К раствору добавляют 1,5 г диметилсульфамоилхлорида в 10 мл тетрагидрофурана. Смесь нагре- п вают при действии обратного холодильника 16 ч, охлаждают и добавляют 5 мл воды. Смесь концентрируют в вакууме, маслообразный продукт растирают с водой, декантируют, промывают н-гексаном и райтирают с метанолом. После 5 фильтрования получают 700 мл 1-диметилсульфамоил-2-метиламино-(6)-этилбензимидазолкарбоксилата, т.пл. 127132°С.
Вычислено,%: С 47,84; Н5,56, 0 N 17,17.
C jH|gN O4S (мол. вес 326)
Найдено,%: С 48,09; Н 5,39 N 16,91.
Пример 59. Получение 1-ди метилсульфамоил-2-амино-5(б)-этоксикарбонилметил ензимидазола.
Согласно методике примера 52 проводят реакцию 5 г (0,023 моля) 2-амино-5-этоксикарбонилметилбензимидазо0 ла, 50 мл ацетона, 3,5 мл триэтиламина и 3,3 г диметилсульфамоилхлорида. Смесь нагревают при действии обратного холодильника 16 ч, фильтруют в теплом виде, а осадок промывают водой, получают 1,4 г 1-диметилсульфамоил-2-амино-5-это: сйкарбонилметилбелзимидаэола, т.пл. IBS-lBV c.
Вычислено,%: С 47,85; Н 5,52 N 17,18.
C,iH|gN4 045 (мол., вес 326)
Найдено,%: С 48,34; Н 5,50 N 16,92.
Затем концентрируют фильтрат в вакууме, получая 1,8. г 1-диметилсульфамоил-2-амино-5(б)-этоксикарбонилметилбенэимидаэола.
Вычислено,%: С 47,85; Н 5,52; N 17,18.
C(H|jN4O4S (мол. вес 326)
Найдено, %: С 47,92; Н 5,31; N 17,28.
Общий выход для всех продуктов составляет 79%.
Пример 60. Получение 1-диметилсульфамоил-2-амино-5(6)-метоксикарбонилэтилбенэимидазола.
Сырой по степени чистоты, маслообразный 2-амино-5-(1-метоксикарбонилэтил)-бензимидазол растворяют в 20 мл ацетона. К раствору добавляют 0,6 мл триэтиламина и 0,7 мл диметилсульфамоилхлорида. Смесь нагревают с обратным холодильником 24 ч, охлаждают до комнатной температуры, фильтруют для удаления триэтиламинагидрохлорида, концентрируют с ацетоном и фильтруют в вакууме до получения твердого продукта. Продукт перекристаллизовывают из метанола. Получают 600 мг (25%) 1-диметилсульфамоил-2-амино-5(6)-1-(-метоксикарбонилэтил)-бензимидазола, т.пл. 155-159®С.
Вычислено,%: С 47,84; Н 5,56/ N 17,17.
C|3Hl8 4 04 (мол. вес 326)
Найдено, %: С 47,58, Н 5,53; N 16,91.ч
Пример 61. Получение 1-диметилсульфамоил-2-амино-5-гидразинокарбонилбензимидазола (и соответствующего 6-изомера).
К раствору 3 г 1-диметилсульфамоил-2-амино-5(6)-этоксикарбонилбензимидазола в 50 мл метанола добавляют 6 мл 85%-ного гидразина-моногидрата. Раствор перемешивают при комнатной температуре всю ночь, затем кипятят с обратным холодильником (4 сут. Раствор фильтруют еще горячим Получают 200 мг 1-диметилсульфамоил-2-амино-5-гидразинокарбонилбензимидазола, т.пл. 229-230®С (с разложением).
Затем раствору дают остыть, собирают продукт фильтрованием и из фильтрата последовательно выделяют осадки. Получают 550 мг 1-диметилсульфамоил-2-амино-6-гидразинкарбонилбензимидазола, т.пл. 205-206®С (с разложением).
Пример 62. Получение 1-диметилсульфамоил-2-амино-5 (6)-(N-метоксикарбоксамидо)-бензимидазола.
К 6 г (0,018 моля) 1-лнметилсульфамоил-2-ацетамидо-5(6)-бензимидазолкарбоновой кислоты в 10 мл диметилформамида добавляют 3,6 г -карбонилдиимидазола и смесь перемешивают 15 мин. К раствору добавляют 1,6 г К-метоксиамида-гидрохлорида в 5 мл диметилформамида. Смесь перемешивают при комнатной температуре всю ночь. Затем раствор концентрируют путем выливания в воду и экстрагируют этилацетатом до получения маслообразного продукта. Этот продукт помещают на 200 г силикагеля и отмывают с адсорбента этилацетатом. Получен 1-диметилсульфамоил-2-амино-5(6)-(N-метоксикарбоксамидо)бензимидазол. Соединение, по-видимому, содержит некоторое количество воды и легко утрачивает ацетильную группу. М/е 313, 298, 267.
Пример 63. Получение 1-диметилсульфамоил-г2-амино-5 ( 6 ) -цианобензимидазола.
К растору 4 г (0,025 моля) 2-амино-5(6)-цианобензимидазола в 50 мл
тетрагидрофурана добавляют 50%-ную
дисперсию гидрида натрия при перемешивании. К раствору добавляют 3,6 г диметилсульфамоилхлорида и нагревают раствор 20 ч с обратным холо дильником. Реакционную смесь охлаждают, фильтруют, концентрируют в вакууме. В фильтрате - смолистая масса. Раствор растирают с н-гексаном, суспендируют в 100 мл горячего метанола, перекристаллизовывают из 350 мл метанола и затем концентрируют до объема 100 мл. Получают 3,5 г (53%) 1-диметилсульфамоил-2-амино-5(6)-цианобензимидазола, т.пл. 265-267С. Вычислено,%: С 45,27) Н 4,
N 26,40.
C|QH| N 2S (мол. вес 265) : Найдено, %: С 45,46; Н 4,45, N 26,12.
Пример 64. Получение 1-диметилсульфамоил-2-амино-5-метил|сульфонилбензимидазола.
10,5 г (0,05 моля) 2-амино-4-ме;тилсульфонилбензимидазола в 300 мл (ацетона, 7,2 г диметилсульфамоилхлорида и 10 мл триэтиламина применяют для проведения реакции согласно методике примера 56. Раствор нагревают с обратным холодильником 120 ч, охлаждают и фильтруют. По.пучают 5,5 г 1-диметилсульфамоил-2-амино-5-метилсульфонилбензимидазола, т.пл. 205206°С.
Вычислено, %: С 37,737 Н 4,43, N 17,60.
C(QH,4N4 О45(мол. вес 318). . Найдено,%: с 38,00; Н 4,41; N 17,34.
Пример 65. Получение 1-лиметилсульфамоил-2-амино-5-трифторметилбензимидазола.
f, -....
,.;.. .-
786892
10 г (0,05 моля) 2-амнно-5-три,фторметилбензимидазола в 300 мл ацетона,7,2 г диметилсульфамоилхлорида и 10 мл триэтиламииа применют для проведения реакции согласно методике примера 56. Раствор нагревают с обратным холодильником 42 ч и фильтруют. Получают 3,4 г 1-диметилсульфамоил-2-амино-5-трифторметилбензимидазола, т.пл. 203-205®С (с разложением).
Вычислено, %: С 38,96; Н 3,60, F 18,17; N 10,40.
Рз07.5 (мол. вес 308 .
Найдено, %: С 39,10; Н 3,80, F 18,04; N 10,20.
Формула изобретения
Е,
где R - С -С -алкил, Сj-C-f-циклоалкил, фенил, фурил, тиенил, тиаЗОЛ-2-ИЛ, 2-ацетамидо-4-метилтиаЗОЛ-5-ИЛ, 1, 3 ,4-тиадиазол-2-ил/ 2-метил-1, 3 , 4-тиадиазол-5-ИЛ, 2-метиламино-1,3-4-тиадиазол-5-ил или радикал формулы Кд Rg-N, в котором Вд и R независимо друг от друга - С/-Ст,-алкил или R4 и R вместе с атомом азота, к которому они присоединены, образуют пирролидинопиперидино- или морфолиногруппу/
R,2 водород, метил, аминогруппа, ацетамидогруппа или метиламиногруппа;
R.}-C(-CQ-aлкoкcикapбoнил, аллилоксикарбонил, пропаргилоксикарбонил, (С -С7-ЦИК-лоалкил) -оксикарбонил, (Сз-С -Циклоалкил)-метилоксикарбонил, 1- (Сз-С-у-Циклоалкил) -этилоксикарбонил, бензилоксикарбонил,-о6 -метилбензилоксикарбонил, феноксикарбонил, С1-С8-алкоксикарб6нилметил, 1--(С|-Сп-алкоксикарбонил) -этил, гидразинокарбонил, карбоксигруппа, карбоксамидогруппа, N-(С -С4-алкил)-карб(эксамидогруппа, - (С -С|-алкокси) :арбоксамидогруппа, оксиметил-, циан группа, метилсульфонил или трифторметил, причем Rj находится в 5 или 6 положении, отличающийся тем, что, таутомерное бензимидазольное соединение общей формулы
Авторы
Даты
1980-12-07—Публикация
1975-07-01—Подача