или более высоких температурах, целесообразно При 50-120С. Эти реакции можно вести при атмосферном дав лении или же в закрытом реакторе при повышенном давлении с нагревом до указанного температурного диапазона В частности,при работе с легколетуч ми аминами HgNR может оказаться выгодным вести реакцию взаимодействия в замкнутой системе, т.е. в автокла ве. Исходные соединения можно подвергать взаимодействию непосредственно т.е. без добавления разбавителя, или растворителя. Целесообразно, однако вести взаимодействие в присутствии низшего спирта с числом атомов С от 1 до 4 как метанол, этанол или пропанол, предпочтительно, изопропанол или этанол, низшего насыщенного прос того диалкилового эфира, как диалкил гликолевого эфира или циклического простого эфира, как диэтиловый эфир 1, 2-диметоксиэтан, тетрагидрофур.ан или диоксан, бензола или алкилбензо ла, так толуол или ксилол, или алифатического углеводорода, как гексан гептан или октан, низшего алифатичес кого кетона,-как ацетон, метилэтилпк кетон илд метилизобутилкетон, диалкилформамида, .как диметил- или диэтилформамид, диметилсульфоксида или же в присутствии воды, а также солей приведенных растворителей. В качестве разбавителя или раство рителя может найти применение в избытке амин формулы HjNRК предпочтительным растворителям для реакции взаимодействия 2-метил-5-2 (2-3-эпоксипропокси)-стирил 1,3,4-тиадиазола с амином R-NH относится низшие спирты/ в частности этанол или изопропанол, причем реакцию взаимодействия ведут при температурах от 50 до и при атмосферном давлении.. В качестве исходного продукта формулы (II) также применяется смесь эпоксида с галогидрином, поскольку при. техническом масштабе производства исходных продуктов формулы II могут образоваться такого рода смеси. При осуществлении-варианта нуклео фильного замещения применяемым амином реакцию взаимодействия следует вести в присутствии основания в качестве связывающего кислоту средства. К предпочтительным основаниям следует отнести гидроокиси, карбона .ты, гидрокарбонаты и алкоголяты щелочных металлов, равно так и третичные органические или три.этиламин. И соединений щелочных металлов, в част ности, пригодны таковые натрия и калия. При этом основание применяют в стехиометрических или незначитель ных избыточных количествах. В соответствующем случае может оказаться целесообразным применение в иэ.бытке используемого амина формулы HgNR также и в качестве связываквдего кислоту средства. Полное взаимодействие зависит от реакционной температуры в течение 215 ч. Продукт реакции получают обычным способом, например фильтрацией или отгонкой разбавителя или растворителя из реакционной смеси. Очистку полученного соединения производят обычным способом, например перекристаллизацией из растворителя, переводом в кислотно-аддитивное соединение или с применением хроматографии на колонне. Исходные соединения формулы (И) получают алкилированием 2-метил-5-(2-оксистирил)-1,3,4-тиадиазола,получаемого конденсацией салицилальдёгида с 2,5-димети-1,3,4-тиадиазолом согласно примеру I, соединение 1 с применением эпигалогидрина илиоС,(« -дигалоген-2-пропанола. В качестве эпигалогидрина пригодны: эпихлоргидрин, эпибромгидрин и эпийодгидрин, а в качествес. ,ОУ-дигалоген-2-пропанола, в частности, 1,3-дихлор-2-пропанол и 2,З-дибром-2-пропанол. Соединения формулы (I) за счет наличия двойной связи С-С могут быть получены в виде смесей транс-цис-изомеров. Однако, по осуществлении обычных физических очистных операций, как-то фракционирующая кристаллизация, хроматография или сублимация, получают транс-изомеры. Соединения формулы (И) имеют при атоме углерода 2 алифатической боковой цепи центр хиральности и получаются в виде рацематов, которые известными cnoco6aivM, например, путем образования диастереомерных солей с оптически активными вспомогательными кислотами, как дибензоилвинная,камФаро-10-сульфоновая,дитолуилвинная,. или 3-бром-камфаро-З-сульфоновая, можно разделить на оптически активные антиподы. Полученные соединения переводят в кислотнотадцитивную соль, физиологически совместимой кислотой. В качестве обыкновенно применяемых физиологически совместимых органических-или неорганических кислот используют, например соляную, бромистоводородную, фосфорную иЗш серную кислоту, а в качестве органических кислот - винную, яблочную, лимонную, салиуиловую, щавелевую, малеиновую, фумаровую, молочную, адипиновую или бензойную Кислотно-аддитивные соли получают ойцеизвестным способом путем смещё- ния свободного основания или ее растворов с соответствующей кислотой или ее растворами в органическом растворителе, например низшем спирте, как метанол, этанол или пропанол, или., низшем кетоне как ацетон, метилгэтштетон, или метилизобутилкетон, или простом эфире как диэтиловый эфир.те рагидрофуран или диоксан. в целях лу шего вьщеления кристаллов можно применять также и смеси указанных растворителей Путем растворения свободных оснований общей структурной формулы (1), в кислотном ргКтворе могут быть получены фармацевтичес ки приемлемые водные растворы кислот но-аддитивных соединений аминопропаноловых производных общей структурной формулы (I). Соединения согласно предлагаемому изобретению и их физиологически совмести1уие кислотно-аддитивные соли отличаются ценными фармакологическими свойствами. В качестве фармакологических средств, оказывающих симпатолитическое действие, они находят применение при лечении коронарных заболеваний сердца, гипертонии и нарушении сердечного ритма. р-симпатолитическое действие проверяют на кошках. В качестве сопоста вительного соединения применяют известное р-симпатолитическое средство пропранолол. Действие проверяют следующими способами: 1. i-симпатолитическое действие. Изопротеренол (1 мкг/кг, внутривенно) вызывает у находящихся под наркозом кошек (вес 2-4 кг) повышение сердечной частоты в среднем на 40%. Р -симпатолитические средства ингибируют эти явления. Изопротеренол вводят за 10 и 40 мин до внутривенно обработки испытуемыми средствами,а так же и по их введении, тоже через 10 и 40 мин. Между логарифмами вводимых доз (мг/кг) испытуемых средств и ингибированием вызва.нной изопротеренолом тахикардии (%) существуют линейные соотношения, из которых выводят в качестве ЭД „ дозы, ингибируюиие вызванную изопротеренолом тахикардию на 50%.. 2.Острая токсичность. в целях определения средней летательной дозы (ЛДур) вещества вводят мышам-самкам (NMRI весом 19-26 г) внутрибрюшинным путем. Данные таблицы показывают, что предлагаемые вещества отличаются необычно сильным р -симпатолитическим действием. Ib-1-рецепторы, играю щие важную роль для фармакотерапевтического применения, уже блокируются дозами, меньшими таковых сопоставительного медикамента пропранолол от 12 (соединение, пример 2) до 25 раз (соединение, пример 3). Из этого сильного действия и летательных доз того же порядка,что у пропра нолола,вытекает увеличение терапевтического спектра действия сравнительно с TaKOBqro пропранолояа от 7,6 (соединение, пример 2) до 30,7 раз (соединение, пример 7). Предметом предлагаемого изобретения также являются терапевтические средства или препараты, содержащие наряду с обычными носителями и разбавителями соединение формулы (I) в качестве действующего начала, равно как и применение новых соединений в терапевтических целях. Терапевтические средства или препараты получают известным образом с применением обычных носителей или разбавителей и обычно добавляемых фармацевтически-технических вспомогательных средств в соответствии с назначением при соответствующей дозировке. Предпочтительные препараты получают в пригодном для орального введения виде. К таковым относятся, например таблетки, покрытые тонким слоем, драже, капсулы, пилюли, порошки, растворы или взвеси, а также препараты продленного действия. Оральная форма введения является предпочтительной. Естественно, применение находят и парентервальные препараты. Затем следует упомянуть в качестве препаратов и суппозитории. Соответствукяцие таблетки могут быть получены, например, путем смещения действующего начала с известными вспомогательными средствами,например инертными разбавителями, как декстроза, сахар, сорбит, маннит, поливинилпирролидон карбонат кальция, фосфат кальция или молочный сахар, средства набухания-как кукуруза, крахмал или альгиновая кислота, связующие как крахмал или желатина, пластификаторы как стеарат магния или тальк и/или средства достижения продленного действия как карбоксиполиметилен, карбоксиметилцеллюлоза, ацетатфталат целлюлозы или поливинилацетат. Таблетки могут состоять также и из нескольких слоев. Соответствующим образом могут Сыть получены драже tiyтем покрытия ядер, изготовленньтх аналогично таблеткам, средствами, обыкновенно используемыми для этого, как коллидон или шеллак, гуммиарабик, тальк, двуокись титана или сахар. При этом и оболочка драже может состоять из нескольких слоев, причем применение могут найти указанные при получении таблеток вспомогательные средства. Растворы или суспензии действующих начал могут дополнительно содержать улучшающие вкус вещества как сахарин цикламат или сахар, а также, например ароматические вещества как ванилин или апельсиновый экстракт.Они сверх этого могут содержать суспендирующие агенты как натрийкарбоксиметилцеллюлоэа, или консервирующие средства как и оксибенэоат. Капсулы содержащие действующие начала, получают, например, путем смешения дейст вующего начсша с инертным носителем как молочный сахар или сорбит с последующей капсуляцией в капсулы из желатины. Соответствукидие суппозитории полу чают, например, путем смешения надле жащих носителей, как нейтральные жиры или полиэтиленгликоль или их производные. В качестве индивидуальной дозы в человеческий организм вводят 1100 мг, предпочтительно 2-50 мг, сое динений; 2-метил-5- - (2-окси-4-изопропиламино-пропокси) -стирил 7-1 / 3, 4-тиа- диазол 2-метиЛ-5/-(2-2-oкcи-3-циклoпpoпцлaминo-пpoпoкcи)-cтиpил7-l /3,4-тиа диазол 2-метил-5-(2-(2-окси-4-изопропиламино-пропокси)-стирилЗ -1,3,4-тиадиазол , 2-метил-р-/2-{2-окси-З-(1-бутин-3-иламино)-пропокси)-стирил7-1,3,4-тиадиазол. 1. Получение исходных соединений. Пример 1. 2-Метил- 5-(2-окси -стирил)-1,3,4-тиадиазол. 570 г (5 моль) 2,5-диметил-1,3,4-тиадиазола смешивают с 275 г (2,5 моль) салицилальдегида, нагревая все с пропусканием азота медленно до 150 С. Смесь выдерживают 30 ч при 150° С, затем охлаждают и по отгонке избыточного 2,5-диметил-1,3, 4-тиадиазола перекристаллизовывают из метилгликоля. Получают 304 г желтых кристаллов (56% от теории) и т.пл. 253-254С. Найдено: С 59,8, Н 4,6, N 12,4. С N205 (218) . Вычислено: С 60,6, Н 4,6, N 12,8. П р и м е р 2. 2-Метил-5-/2-(2, 3 -эпоксипропокси) cтиpилJ7-l, 3 , 4-тиадиа зол . 3,72 г (0,085 моль) 55%-ного гидрида натрия в парафиновом масле взве шивают в 150 мл абсолютного тетрагид рофурана, после чего по каплям добав ляют 18,6 г (0,085 моль) 2-(2-оксистирил)-5-метил-1,3,4-тиадиазола в 200 мл абсолютного гексаметилфосфор триамида при 0-З.С в течение полутора часов. При комнатной температуре домешивают еще 1ч, после чего по каплям добавляют 11,7 г (0,085 моль) дибромгидрина. Затем выдерживают 16 ч при комнатной температуре. После этого раствор выливают на 1,5 л ледяной воды, добавляя 0,5 л насыщен ного раствора хлористого натрия. Выпавший твердый продукт отсасывают и перекристаллизовывают из ацетона,полу чая 11,8 г (51% от теории) желтых кристаллов, т.пл. 134-135с. Н 5,4, О 13,5, Найдено: С 61,3, S 10,5, N 8,4. (274). Н 5,1, О 11,7, Вычислено: С 61,3, S 11,7, N 10,2. Пример 3. 2-Метил-5-/ -(2-окси-3-хлор-пропокси)-стирил7-1,3,4-тиадиазол. 1 г 2-метил- /2-(2,3-эпоксипропокси)-стирилу-1,3,4-тиадиазола 12 ч вьщерживают в смеси 100 мл этанола и 5 мл 3 Н. эфирного хлористоводородного раствора. Образовавшийя осадок отсасывают, промывают эфиом до нейтральной реакции и хромаографируют с применением хЛорофора на силикагеле. По выпарке досуха элюаты продуктов дают спект оскопически чистый 2-метил-5-/2-(2-окси-3-хлор-пропскси) -стирил 7-1, 3,4-тиаиазол, т.пл. 168-170с. 1Н-ЯМР-спектр (COCl3f ТМС внутр.) 2,5-3,3 (мультиплет.бН), 4,8.(синглет, 1Н), 5,5-6,0 (мультиплет; ЗН и он) 6,1-6,3 (мельтиплет, 2Н) 7,3 (синглет, ЗН). М . Получение предлагаемых соединений. Пример 4. 2-Метил-5-/2-(2-окси-3-изопропиламино-пропокси)-стирил7 1/3,4-тиадиазол. 7 г (0,025 моль) 2-метил-5 /5-(2-6(эпокси-пропокси)-стирил7-1,3,4-тиадиазола и 2,9 г (0,05 моль) изопропиламина смешивают с 100 мл изопропанола и 7 ч нагревают с обратным холодильником. По охлаждении растворитель отгоняют, полученный остаток перекристаллизовывают в толуоле. Выход 5,1 г (61% от теории), т.пл.156157С. Найдено: С 60,8, Н 6,8, N 12,1 ,,N-S (333). Вычислено: С 61,2, Н 7,0, N 12,6. Пример 5. 2-Метил-5-/2-(2-окси-3-циклопропиламино-пропокси)-стирил 7-1,3,4-тиадиазол. 3,8 г (0,014 моль) 2-метил-5/2-(2,3-эпокси-пропокси)-старил/-1,3, 4-тиадиазола 1,0 г (0,018 моль) циклопропил-амина аналогично примеру 3 подвергают взаимодействию. Из толуола получают 2,2 г (48% ojr теории) желтых кристаллов, т.пл. 144-145°С. Найдено: С 60,8, Н 6,1, N 12,3. С тН2 Ы-0„5 (331). Вычислено: С 61,6, Н 6,4, N 12,7, П р и р 6. 2-Метил-5-/2-(2-окси-3-трет-бутиламино-пропокси)-стирил7 1г 3,4-тиадиазол. Аналогично примеру 3 подвергают взаимодействию 7 г (0,025 моль) 2-метил-5-/ -(2,3-эпокси-пропокси)-стири1;7 1 3,4-тиадиазола с 2,1 г (0,028 моль) трет-бутиламина. Из толуола получают 3,8 г (44% от теории) желтых кристаллов, т.пл. 110112 С. Найдено: С 62,3, Н 7,3, N 11,6. . Вычислено: С 62,2, Н 7,2, N 12,1 Пример 7. 2-Метил-5-/2-(2-окси-3- (бутил-2-амино)-про.покси)-стирил/-,3,4-тиадиазол. Из 6 г (0,022 моль) 2-метил-5-/2 - (2 3-эпокси-пропокси)-стирил -1,3, -тиадиазола и 1,6г (0,022 моль)2-б гиламина аналогично.примеру 3 получают 3,5 г (4,5% от теории) желтых кристаллов, т.пл. 135-136С. Найдено: С 62,5, Н 7,1, N 11,7. (347). Вычислено: С 62,2, Н 7,2, N 12,1 Пример 8. 2-Метил-5-/2-(2окси-3-(пентил-2-амино)-пропокси)-стирил 7-1/ 3, 4-тиадиазол. Аналогично примеру 3 взаимодейст вию подвергают 6 г (0,022 моль) 2-метил-5-(2,3-эпокси-пропокси)-стйрил/-,3,4-тиадиазола с 1,9 г (0,022 моль) 2-амино-пентана. Получают 2,6 г (33% от теории) желтых кристаллов, т.пл. 112-113 с. Найдено: С 63,3, Н 7,2, N 11,7. (362). Вычислено: С 61,3, Н 7,5, N 11,6 Пример 9. 2-Метил-5/ 2-(2-окси-3-(1-циклопропил-этил-1-амино -пропокси)стирил 7-1, 3,4-тиадиазол. 6 г (0,22 моль) 2-метил-5-/2-(2, -эпокси-пропокси)-стирил/-,3,4-тиа диазола и 2,2 г (0,022 моль) 1-цикло пропил-1-амино-этана 30 ч нагревают с обратным холодильником в 100 мл изопропанола. Реакционную смесь кон центрируют на ротационном испарител и очищают от загрязнений на колонне (45 X 5см) силикагеля 60 (0,0630,200 мм). Элюент представляет co6o смесь из хлороформа и метанола в соотношении 4:1. Фракции проверяют на чистоту посредством тонкослойной хроматографии. Получают 2,6 г (33% от теории) желтых кристаллов, т.пл. 114-11бс. Найдено: С 62,6, Н 6,8, N 11,4. С, Н уНзОзЗ (359) . Вычислено: С 63,5, Н 7,0, N 11,7 Пример 10. 2-Метил-5-/2-(2окси-3-(1-бутин-З-иламино)-пропокси -стирил/-1,3,4-тиадиазол. Аналогично примеру 3 взаимодействию подвергают 6 г (-0,022 моль) 2-метил-5-/2-(2,3-эпокси-пропокси)-стирил7 1 3,4-тиадиазола с 1,5 г (0,022 моль) 1-бутинил-амина-З. Реак ционный раствор отфильтровывают от нерастворимых компонентов и концентрируют на ротационном испарителе.Образуется 6,2 г масла, которое хрОматографически очищают на силикагеле 60 (0,062-0,200 мм): хлороформ/метанол всоотношении 4:1. Очищенное мас ло можно довести до кристаллизации изопропанолом/эфиром. Получают 2,1 г (28% от теории), т.пл. 143-145®С. Найдено: С 61,6, Н 6,2, N 12,3. (343). Вычислено: С 62,9, Н 6,2, N 12,1. Пример 11. 2-Метил-5-/2-12-окси-3-(З-метил-1-бутин-З-иламиио)-пропокси)-стирил7-1,3,4-тиадиазол. Аналогично примеру 9 взаимодействию подвергают 6 г (0,022 моль)-2-метил-5-/2-(2,3-эпокси-пропокси)-стирил/- 3,4-тиадиазола с 1,8 г (0,022 моль) 3-метил-З-амино-бутина-1. Получают 5,8 г желтого масла, которое растворяют в 100 мл изопропанола . Затем добавляют эфирную соляную кислоту до кислой реакции и за-тем еще добавляют 100 мл эфира. Остаток отсасывают, промывают эфиром и сушат, получая 4,3 г (42% от теории) ,. продукта, т.пл. 132-133с. Найдено: С 50,0, Н 5,8, N 8,5, 2Н2.0 (466) . С, 2НС1 Вычисле но, С 50,8, Н 6,0, N 9,3, 15,8. Пример 12. 2-Метил-5-/2(-2-окси-3-(З-этил-1-пентин-З-иламино)-пропокси)-стирил/-1,3,4-тиадиазин. Аналогично примеру 10 из 7 г (0,025 моль) 2-метил-5-/2-(-2,3-эпокси-пропокси)-стирил7-1/3,4-тиадиазола и 2,8 г (0,025 моль) 3-этил-З-амино-пентина-1 получают 3,7 г (32% от теории) гидрохлорида, т.пл. . Найдено: С 53,4, Н 6,5, N 8,9, С1 11,8. 1,5 О S -1,5 НС1 (4677. 2L Вычислено: С 53,9, Н 6,7, N 8,9, С) 11,5. Пример 13. 2-Метил-5-/2-(2-окси-3-трет-бутиламино-пропокси)-стири117-1,3,4 -тиадиазол. В автоклаве в течение 10 ч до нагревают 1,6 г 2-метил-/ 2-(2-окси-3-хлор-пропокси)-стирил71,3,4-тиадиазола и 10 мл трет-бутиламина в 50 мл диоксана. После отгонки в вакууме летучих высоковязкий С1ФОЙ продукт хроматографируют с применением хлороформа иа сухой силикагелевов колонне. Остаток от выпарки элюатов продуктов дает 2-метил-5-/2-(2-окси-З-трет-бутиламино-проnoKCH)-cTHpiuj7-l 3,4-тиадиазол. Выделенлое соединение тождественно соединению по примеру 5. Таким же образом, получают соединения 3, 4 и 6-11 путем взаимодействия 2-метил-5-/2г-( 2-окси-3-хлор-пропокси) -cTHpHJi7-l 3,4-тиадиаэола с соответствующим амином. Пример 14. 2-Метил-5-/ -(2окси-З-трет-бутиламино-пропокси)стирил7-1 3,4-тиадиазал.
7 г 10,025 моль) 2-метил-5-/Й-(2,3-эпокси-пропокси)-стирил7-1,3,4-тиадиазола ,1 г (0,028 моль) трет-бутиламика выдерживают в 100 мл изопропанола в течение 3 дней при комнатной температуре и обрабатывают аналогично примеру 3. Из толуола получают 3,3 г (38% от теории) желтых кристаллов, т.пл. 110-112 с (пример5
Примеры препаратов, полученных обычным способом. 1. Таблетки, мг а) Действующее нача5ло формулы I
200 15 Лактоза Метилцеллюлоза Крахмал кукуруз50ный
11 Тальк
4 Стеарат магния
285
Итого:
)Действующее нача1ло формулы I
178 Лактоза
80 Авицель
20
Воск
2
Стеарат магния
300
Итого:
)Действующее нача50ло формулы I Поливинилпирролидон (средний
170 мол.вес. 25000) Полиэтиленгликоль (средний
14 мол.вес. 4000) Оксипропилметил40 4 2 целлюл 03 а
Тальк
Стеарат магния
280
ИТОГО
Действующее начало вместе с поливинилпирролидоном смачивают в 10%-ном водном растворе, пропускают через сито с отверстиями 1,0 мм (в свету) и сушат при . Этот гранулят смешивают с полиэтилгликолем (среднего мол.вес. 4000),оксипропилметилцеллюлозой, тальком и старатом магния, после чего прессуют таблетки по 280 мг. 2. Драже, мг
Действующее начало формулы I60 Лактоза90 Крахмал кукурузный 60 Поливинилпирролидон 6 Стеарат магния1
217
Итого:
Смесь действующего начала с лактозой и кукурузным крахмалом г 4нулируют с 8%-ным водным раствором поливинилпирролидона, пропуская через сито (1,5 мм) , сушат при 50с н снова пропускают через сито с отверстиями 1,0 мм. Полученный гранулят смешивают со стеаратом магния, после чего прессуют драже-ядра. Полученные ядра покрывают обычным образом оболочкой, состоящей, в основном, из сахара и талька 1.
3. Препарат-капсула,мг Действующее начаг
5,0 ло формулы I
2,0 Стеарат магния
19,3 Сахар молочный 4 . Инъекционный раствор Действующее нача10 9 ло формулы I Хлористый натрий Вода дистиллированДо 1,0 ная




| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения аминопроизводных3-АлКил-5-(2-ОКСиСТиРил)-изОКСАзОлАили иХ СОлЕй | 1979 |
|
SU814275A3 |
| Способ получения аминопропанолпроизводных 6-окси-2,3,4,5-тетрагидро-1н-1-бензазепин-2-она или их солей | 1979 |
|
SU900808A3 |
| Способ получения 3,4-дигидрокарбостирильных производных или их солей | 1973 |
|
SU580835A3 |
| Способ получения пиримидинонов или их кислотно-аддитивных солей | 1981 |
|
SU1056900A3 |
| Способ получения производных -(1,3,4-тиадиазол-2-ил)бензамида | 1978 |
|
SU725558A3 |
| Способ получения гетероциклических соединений или их фармацевтически приемлемых солей щелочного металла | 1986 |
|
SU1454249A3 |
| Способ получения производных @ -арилбензамида или их солей | 1982 |
|
SU1160932A3 |
| Способ получения сульфонилбензимидазолов | 1975 |
|
SU786892A3 |
| Способ получения гетероциклических соединений | 1986 |
|
SU1491337A3 |
| Способ получения производных бензоксазин-2-она | 1983 |
|
SU1138025A3 |

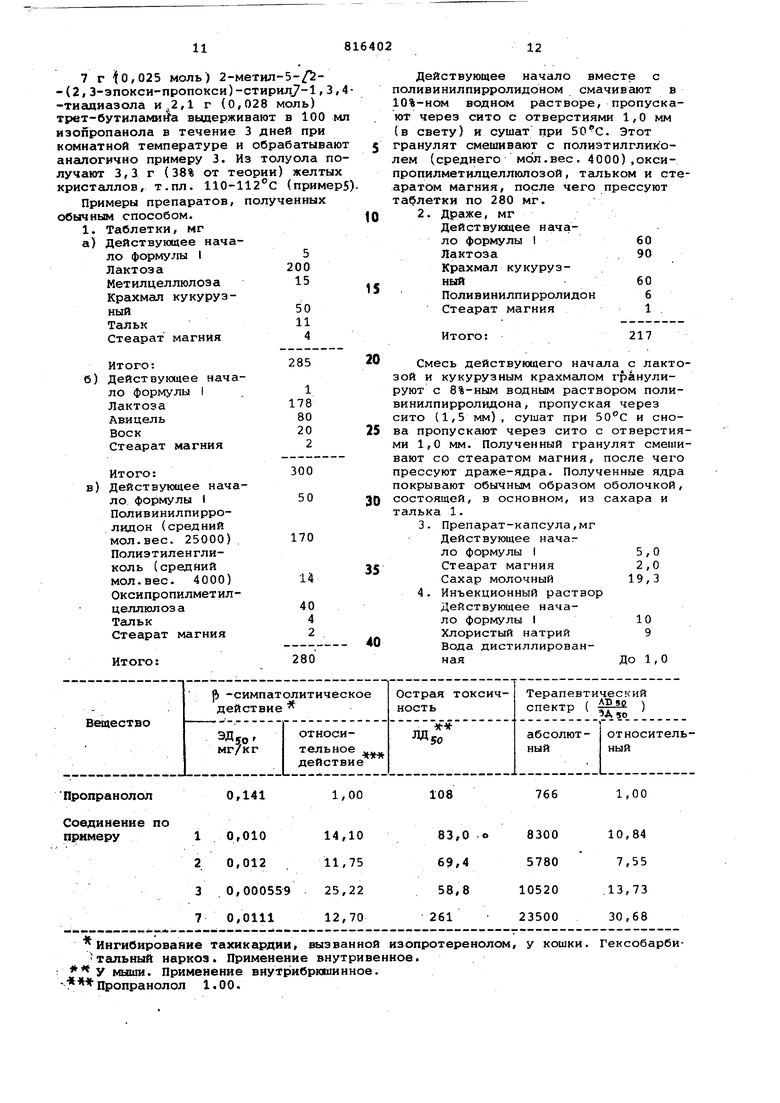
ОД41
1,00
Пропранолол
Ингибирование тахикардии, вызванной из опрот ере иолом, у кошки. Гексобарбитгшьный наркоз. Применение внутривенное. У мьшш. Применение внутрибрюшинное. Пропранолол 1.00.
1,00
766
108 Формула изобретения
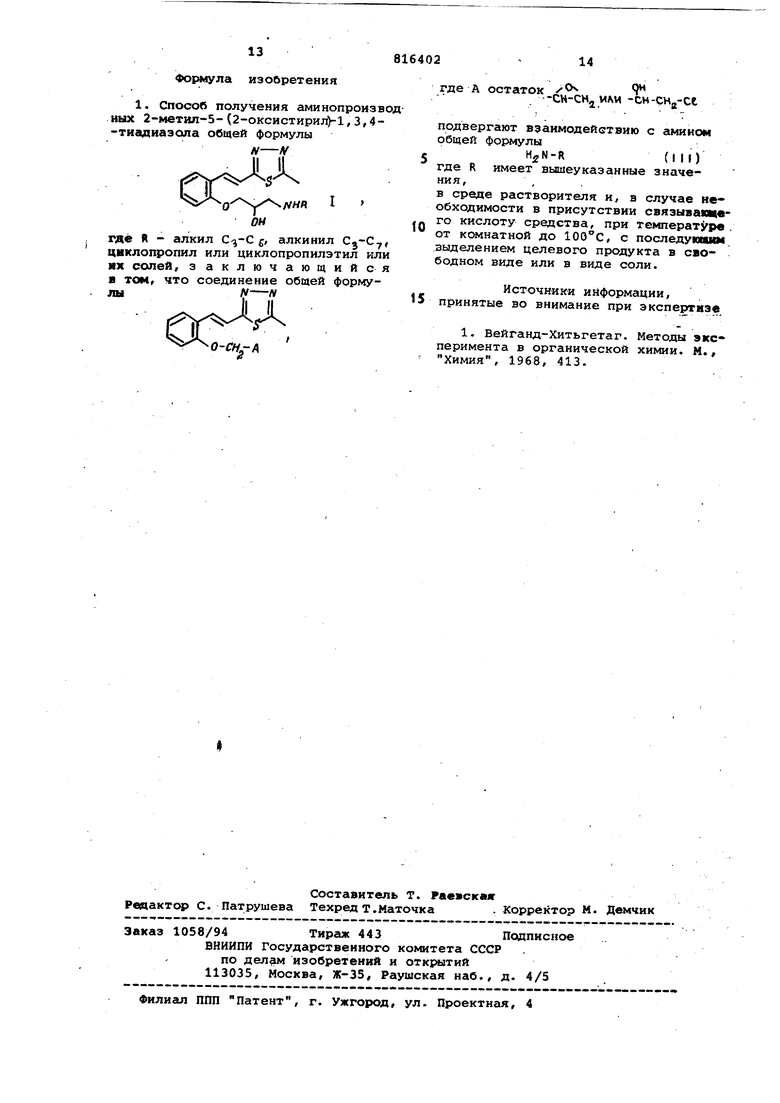
N-Л
ЦНЛ
где R - алкил , алкинил Cj-C, ЦИКЛО1ФОПИЛ или циклопропилэтил или их солей, 3 аключаюадийся том, что соединение общей формулы -N
14
816402
где А остаток
-сн-сн МАИ -си-сНд-се
подвергают взаимодействию с амином общей формулы
H,jN-R(III)
где R имеет вышеуказанные значения, , .
в среде растворителя и, в случае необходимости в присутствии связыванцего кислоту средства, при температуре . от комнатной до , с последующим выделением целевого продукта в свободном виде или в виде соли.
Источники информации, принятые во внимание при экспертизе

Авторы
Даты
1981-03-23—Публикация
1979-04-26—Подача