(54) СПОСОБ ПОЛУЧЕНИЯ ПРОСТЫХ ПИРИДИНИЛАМИНОЛЛКИЛОВЫХ ЭФИРОВ или их ФИЗИОЛОГИЧЕСКИ ПРИЕМЛЕМЫХ Изобретение относится к способу получения новых производных пиридина а именно к способу получения простых пиридиниламиноалкиловых эфиров общей формулы R К- 0-А-( (Г) К V; в которой R означает атом водорода. -алкил, бензил; R - R - одинаковые или различны и означают атом водорода, метил, замещенный окси, метокси, диметиламино группами, алкоксикарбонил с 1-2 атомами С в алкиле; R и R вместе озна чают остаток -CHg-B-CH -, в котором В - атом кислорода, -N- или -О-СН-ОСН„,cH(CHj)2 R - атом водорода, фенил - С -алкил, фенильное кольцо которого может быть замещено окси, атомом хлора, трифтор метилом, метилом; илиоС -тиенил или ct-тиенилметил; СО.ПЕЙ А - разветвленная или неразветвленная С/ -С -с1лкилен6вая цепь, ненасыщенная алкиленовая цепь с 4 атомами С или Л-тиенильный остаток; RS - атом водорода, С -алкил, в соответствующем случае замещенный окси, метокси, фенилом или фенил, в соответствующем случае замещенный метоксигруппой, -алкинил, Cj..-циклоалкил, всоответствующем случае замещенный метилом; R - атом водорода или С -алКил) R и R вместе с атомом N означают 6-членное кольцо, содержащее в соответствующем случае атом N, свободное или замещенное алкилом, бензилом или свободным или замещенным метоксигруппой фенилом, или их физиологически приемлемых солей, которые могут найти применение в химикофармацевтической промышленности. известно алкилирование 3-пиридинола галоидными алкилами fl} . Цель изобретения - разработка на основе известного метода способа получения новых соединений, обладгиоцих ценными фармакологическими свойствами. Поставленная цель достигаетсяпредлагаемом способом получения простых пиридиниламиноалкиловых эфиров формулы (I), который заключается в том, что пиридинол общей формулы
К R V-.
Ч-Ьсокращенно Р-ОН, в которой К , R, R и R имеют вышеуказанные значения подвергают взаимодействию с соединением общей формулы Х-А-У, в которой X и У означают хлор, бром или иод, а А имеет вышеуказанное значение, при температуре от О до , в присутствии основания в среде органического растворителя, и полученное соединение общей формулы
Р-О-Д-У
подвергают взаимодействию с амином формулы R -NH-R, в которой R и R имеют указанные выше значения, при температуре 60-120 0, и полученный целевой продукт выделяют в свободном виде или в виде физиологически приемлемых солей.
Взаимодействие соединения общей формулы (II) с соединением общей формулы Х-А-У осуществляют предпочтительно при температуре от 20 до .
При взаимодействии соединения общей формулы (II) с Х-А-У в качестве органического растворителя применяют низшие спирты, содержащие 1-4 атома С, в частности метанол или этанол низшие алифатические кетоны, бензолуглеводороды, как например, бензол как таковой или алкил- или галогенбензолы, как например, хлорбензол или толуол, простые ашифатические ил циклические эфиры, например дизтиловый эфир, тетрагидрофуран или диоксан, диметилформамид или диметилсульфоксид. Если в качестве растворителя применяют простой эфир, то к этому эфиру можно прибавлять в качестве дополнительного растворителя триамид гексаметилфосфорнойкислоты.
В случае, когда не имеется легко омыляемых функциональных групп в пиридиноле, применяют двухфазные смеси растворителей, в частности смеси воды с хлорированным углеводородом, например дихлорметаном, или бензолуглеводородом, например бензолом или толуолом, в качестве оснований применяют смесь оснований, состоящую из гидроокиси щелочного металла, например гидроокиси натрия, и четвертичного аммониевого основания или фосфониевого основания, которые прикюняют в каталитическом количестве, IrlO мол.% в расчете на соединение (1I), в виде соли, например хлорида триэтилбензиламмония, тетрабутиламмоний-гидросульфата, трибутилгексадедил-фосфонийбромида.
Промежуточный продукт формулы(III выделяют и затем подвергают реакции взаимодействия с амином R -NH-R, или же, не выделяя, непосредственно подвергают ВЕлшеуказанной реакции, причем целесообразно перед этим удалять непрореагировавшее алкилирующее средство.
Для получения кислотно-аддитивных солей применяют, в частности, такие кислоты, которые пригодны для образования терапевтически применяемых солей. Из них следует назвать, например, гапогенводородные кислоты, серную кислоту, фосфорную кислоту, азотную кислоту, фумаровую кислоту, алифатические, ациклические, ароматические или гетероциклические карбоновые или сульфоновые кислоты, такие как муравьиную, уксусную, пропионовую, янтарную, гликолевую, молочную, яблочную, винную, лимонную, аскорбиновую, малеиновую или пировиноградную кислоту, бензойную, антраниловую, п-оксибензойную или салициловую кислоту, метансульфоновую, этансульфоновую, оксиэтансульфоновую, этиленсульфоновую кислоту, галогенбензолсульфоновую, толуолсульфоновую, циклогексиламиносульфоновую кислоту или сульфаниловую кислоту.
Перевод в кислотно-адцитивную сол может в соответствующем случае служить для очистки полученных соединений с последующим переводом их затем в свободные основания.
Соединения общей формулы () вьаделяют также в виде оптических антиподов или рацематов или же в виде смесей диастере.омеров. Полученные смеси диастереомеров можно разделить общеизвестным методом на диастереомеры, например путем хроматографии и/или фракционированной кристаллизации .
Полученные рацематы можно разделить известными методами на оптические антиподы, например путем реакции взаимодействия с оптически активной кислотой и путем разделения на диастреомеры, или с помощью микроорганизмов или путем перекристаллизации из оптически активного растворителя. Особенно пригодными оптически активными кислотами являются, например, D- или L-формы винной кислоты, яблочной кислоты, миндальной кислоты или камфорсульфоновой кислоты.
Исходные соединения формулы (It) получают из оксазола формулы
U у,
где R и R имеют указанные для формулы (II) значения и R означает водород, алкокси с 1-5 атомами С или нитрил, подвергают реакции взаимодействия с олефином формулы Ii -ciH c: где R и R имеют указанные для фор мулы (I) значения и R означает водород, алкилсульфонил с 1-5 атомами С или фенилсульфонил, при температу рах от 20 до с тем условием, что по меньшей мере один из остатко R и R0 означает водород, или если оба остатка R и R® означают водоро реакцию проводят в присутствии дегидрирующего средства, и в соответствунвдем случае полученное соединен обычным образом переводят в кислотн аддитивную соль. Соединения общей формулы (I) отличаются сильным противоаритмически и/или местноанестезирующим действие Они, в частности, могут быть исполь зованы для лечения нарушений сердеч ного ритма. Получение исходных соединений фо мулы (II) иллюстрируется примерами. Пример- 1. 4-бензил-6-метил -1,3-дигидро-фуро(3,4-с)-пиридин-7-ол. . Смесь, состоящую из 296 г (2 мол З-метилсульфонил-2,5-дигидрофурана и 692 г (4 моль) 2-бензил-4-метилоксазола нагревают в течение 20 ч до 150С. После охлаждения полученну смесь суспендируют в 1 л метиленхлорида. Раствор содержит непрореагировавший оксазол. Нерастворимая часть это смесь, состоящая из 4-бензил-6-метил-1,3-дигидро-фуро(3,4-с)-пиридин-7-ола и 3,4-димeтилcyльфoнил-тeтpaгидpoфypaнa, которую разделяют с помощью 1,35 л нитрометана. Нерастворенным остается 186 г 4-бензил -5-метил-1,3-дигидро-фуро(3,4-с)-пиридиН-7-ола с т.пл. 212-214с, после перекристаллизации из метанола, т.пл. 2150с. Найдено,%: С 74,4, Н 6,2, N 6,2 C. .. (Молекулярный вес 241) Вычислено,%: С 74,7, Н 6,2, N 5,8 Гидрохлорид, перекристаллизованный из воды, плавится при . Взаимодействие проводят также с З-этилсульфонил-2,5-дигидрофураном или З-фенилсульфонил-2,5-дигидрофура ном. Пример 2. 4-бензил-6-этил-1,3-дигидро-фуро(3,4-с)пиридин-7-ол 2-бензиЛ-4-этилоксазол. а) 128 г (0,5 моль) гидрохлорида фенилацетамид-циклогексилового эфира вносят в смесь 23 г (0,25 моль) 2-кетобутанола и 100 г N,N-димeтиламина. Реакционную массу нагревают в течение 2,5 ч до , после.охлаждения добавляют 250 мл 10%-го раствора едкого натра и экстрагируют метиленхлоридом. После отгонки растворителя остаток подвергают фракционной перегонке. Получают 9,5 г 2-бензил-4-этилоксазола с т.кип. 74 - 76°С/О,2 мм. б) 9,4 г (50 ммоль) 2-бензил-4-этилоксазола и 29,6 г (200 ммоль) З-метилсульфонил-2,5-дигидрофурана нагревают в течение 15 ч до 150°С. Непрореагировавший сульфон отгоняют в высоком вакууме. Остаток извлекают метиленхлоридом, отсасывают нерастворенную часть и экстрагируют фильтрат 150 мл 10%-ного раствора едкого натра. Щелочной раствор нейтрализуют и экстрагируют метиленхлоридом. При концентрировании метиленхлоридного раствора остается 6,2 г 4-бензил-6-этил-1,3-дигидро-фуро(3,4-с)пиридин-7-ол с т.пл. после перекристаллизации из нитрометана 148С. Найдено,%: С 75,2, Н 6,7, N 5,6, .(Молекулярный вес 255) Вычислено,%: С 75,3 Н 6,7; N 5,5. Пример 3. 4,6-дибензил-1,3-дигидро-фуро(3,4-с)пиридин-7-ол. 44 г (150 моль) 2,4-дибензил-5-этоксиоксазола и 210 г (3 моль) 2,5-дигидрофурана нагревают в течение 8 ч до 180С. избыточный 2,5-дигидрофуран отгоняют и осадок извлекают эфиром. Нерастворившуюся часть перекристаллизовывают из этанола. Получают 17,6 г 4,6-дибензил-1,3-дигидро-фуро(3,4-с)пиридин-7-ола с т.пл. 204-205 С. Найдено,%: С 79,4, Н.6,2, N 4,5 . Cj-H-NOj . (Молекулярный вес 317) Вычислено,%: С 79,5, Н 6,0, N 4,4. Получение соединений общей форму(I) иллюстрируется следующими прилымерами . Пример 1. а) Смесь 24,2 г (100 моль) 4-бензил-6-метил-1,3-дигидро-фуро(3,4-с)пиридина-7-ола, 113 г (1 моль) 1,3-дихлорпропана, 2 г лорида бензилтриэтиламмония,100 мл олуола и 100 г 50%-го раствора едого натра нагревают до 90с при еремешивании в течение 3 ч. Органиескую фазу отделяют и промывают 0 л воды. После отгонки растворитея и избыточного 1, 3-дихлорпропана стается 30,7 г простого (4-бензил6-метил-1,3-дигидро-фуро(3,4-с)пиидин-7-ил)-3-хлорпропилового эфира небольшой частью 1,3-бис-(4-бензил6-метил-1,3-дигидро-фуро(3,4-с)пириин-7-окси- /-пропана, которая не лияет на последукяцее взаимодействие. б) Смесь из 24,2 г (100 моль) -бензил-6-метил-1,3-дигидро-фуро (3,4-с)пиридин-7-ола, 226 г (2 моль) ,3-дихлор-пропана, 2 г хлорида бенилтриэтиламмония и 100 г 50%-иого аствора едкого натра нагревают до 0c в течение 3 ч при перемешивании.
рганическую фазу отделяют и прома-. ают 50 МП воды. После отгонки избыта 1,3-дихлорпропана остается 30,7 г ростого (4-бензил-6-метил-1,3-диидро-фуро(3,4-с)пиридйн-7-ил)-3хлорпропилового эфира с небольшой астью 1,3-бис-(4-бензил-б-метил1,3-дигидро-фуро(3,4-с)пиридин-7-окси)-пропана, который не мешает последующему взаимодействию..
в) 24,2 г (100 моль) 4-бензил-6-метил-1,3-дигидро-фуро(3,4-с)пириин-7-ола суспендируют в 80 мл сухого диметилсульфоксид 1а и путем добавления 3,5 г (120 моль) гидрохлорида натрия (85%-го в масле),, при переводят в натриевую соль. Затем добавляют по каплям при температуре от О до ЮОс, ИЗ г (1 моль) 1,3-дихлорпропана и перемешивают в течение 15 ч при . Диметилсульфоксид и избыток 1,3-дихлорпропана отгоняют в высоком вакууме. Остаток растворяют в 250 мл метиленхлорида, экстрагируют 2 раза по 50 мл 10%-ного раствора едкого натра и промывают 10 л воды. После отгонки растворителя остается 30,7 г простого (4-бенэил-б-метил-1,3-дигидро-фуро(3,4-с)пириДИЛ-7-ИЛ)-3-хлорпропилового эфира с небольшой частью 1,3-бнс-(4-бензил-б-метил-1,3-дигидро-фуро(3,4-с)-пиридин-7-оксо)пропана.
г) 8,0 г (25 моль) полученного по а), б) или в) продукта нагревают до ЮОСС с 15 г (250 моль) изопропиламина в автоклаве в течение 7 ч. Избыточный с1мин отгоняют под пониженным, давлением. Для очистки остатка его хроматографируют на силикагеле (уксусный эфир,метанол). Образовавшийся простой (4-бензил-6-метил-1,3-дигидро-фуро(3,4-с)пиридин-7-ил)-3-йзопропиламино-пропиловый эфир переводят в помощью разбавленной соляной кислоты в бис-гидрохлорид, который перекристаллизовывают из изопропанола (7,8 г, т.пл. ).
Для очистки продукта вместо хроматографии может служить и экстракция посредством разбавленной соляной кислоты, причем к раствору сырого продукта прибавляют при взбалтывании столько 1 н соляной кислоты, чтобы водная фаза имела значение рН 6,7. Путем отделения и концентрирования
водной фазы получают простой (4-бензил-б-метил-1,3-дигидро-фуро(3,4-с)-пиридин-7-ил)-3-изопропиламино-пропиловый эфир в виде монохлорида, в то время как менее загрязненные остаются в толуоловой фазе.
Аналогичным путем получают соединения, указанные в табл. 1, причем при аминах с высокой точкой кипения (выше 100-120°С) применение автоклава излишне.
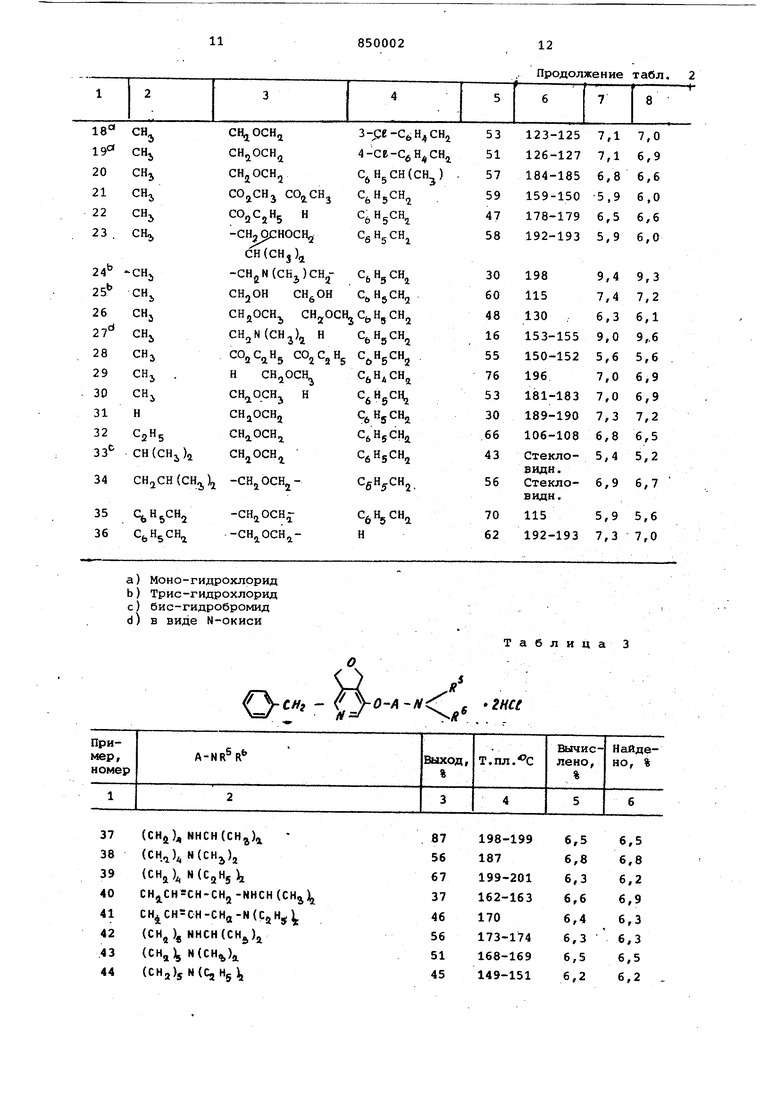
Примеры 37-58. Аналогично примеру 1 а), б) или в) получают соответствукиций галогеналкиловый эфир путем взаимодействия с 1,4-дихлорбутаном, 1,4-дибром-бутеном-(2),1,5-дихлорпентаном или 1,5-дихлор-З-метилпентаном вместо 1,3-дихлорпропана. Полученный эфир при помощи амина, аналогично примеру 1 г), переводят в соединения, указанные в табл.3
Пример 59. 4,б-Дибензил-1,3-дигидро-фуро(3,4-с)пиридин-7-ола, синтезируют аналогично примеру 1а), путем взаимодействия с 1,4-дихлорбутаном, переводят в Б -хлорбутиловый эфир. При этом получают, ангшогично примеру 1г) бис гидрохлорид 4,6-дибензил-1,3-дигидро-фуро(3,4гс)пиридин -7-ил-5-изопропиламино-бутилового эфлра, стеклообразный продукт.
Найдено,%: N 5,5
Вычислено,; N 5,6
(Выход 42%).
Пример 60. Аналогично примеру 1 путем взаимодействия с l,4-диxлopбyтaнoм, 2-метил-4,5-дикарбэтокси-6-бензил-пиридин-3-ол переводят в б-хлорбутиловый эфир. При этом получают бис-гидрохлорид 2-метил-4,5-дикарбэтокси-6-бензил-пиридин-З-ил-б-изопропиламинбутилового эфира (аналогично примеру 1) с т.пл.1б5166° С.
Найдено,%: N 5,4
Вычислено,%: N 5,3 (ВЫХОД 35%).
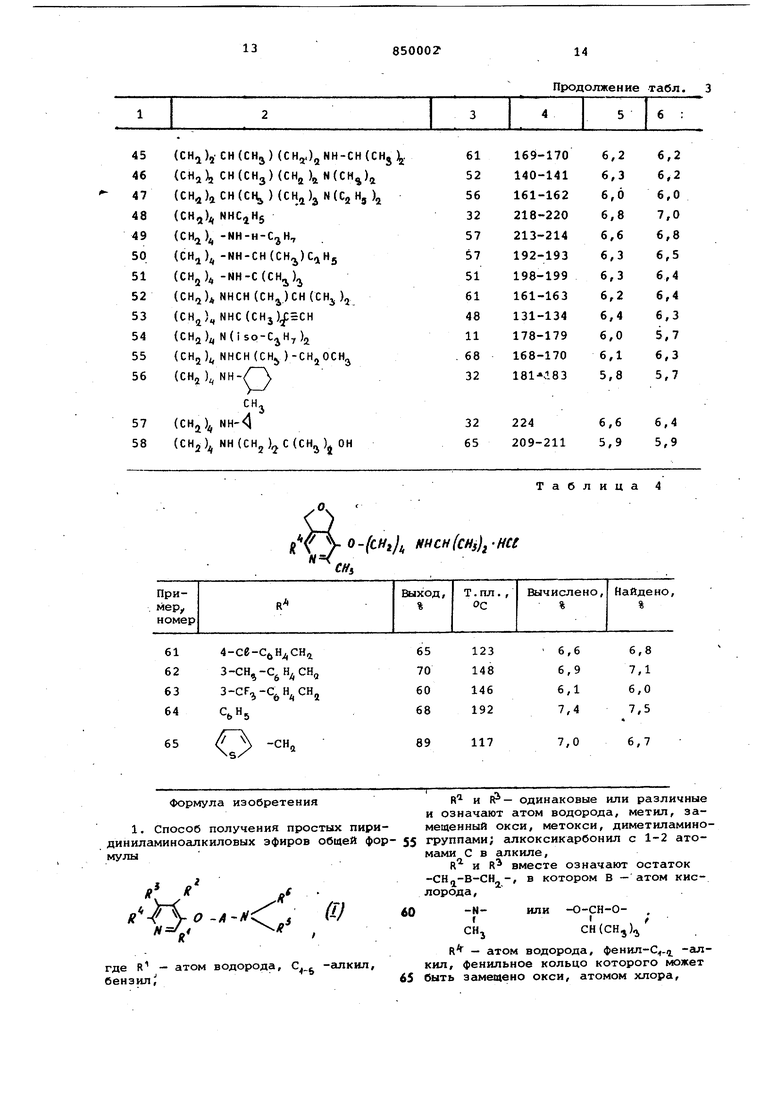
Примеры 61-65. Аналогично примеру 1а) путем взаимодействия с 1/4-дихлорбутаном вместо 1,3-дихлорпропана получают соответствующий 4-хлорбутиловый эфир, который согласно примеру 1 г) переводят в соединения, указанные в табл. 4.
Таблица 1



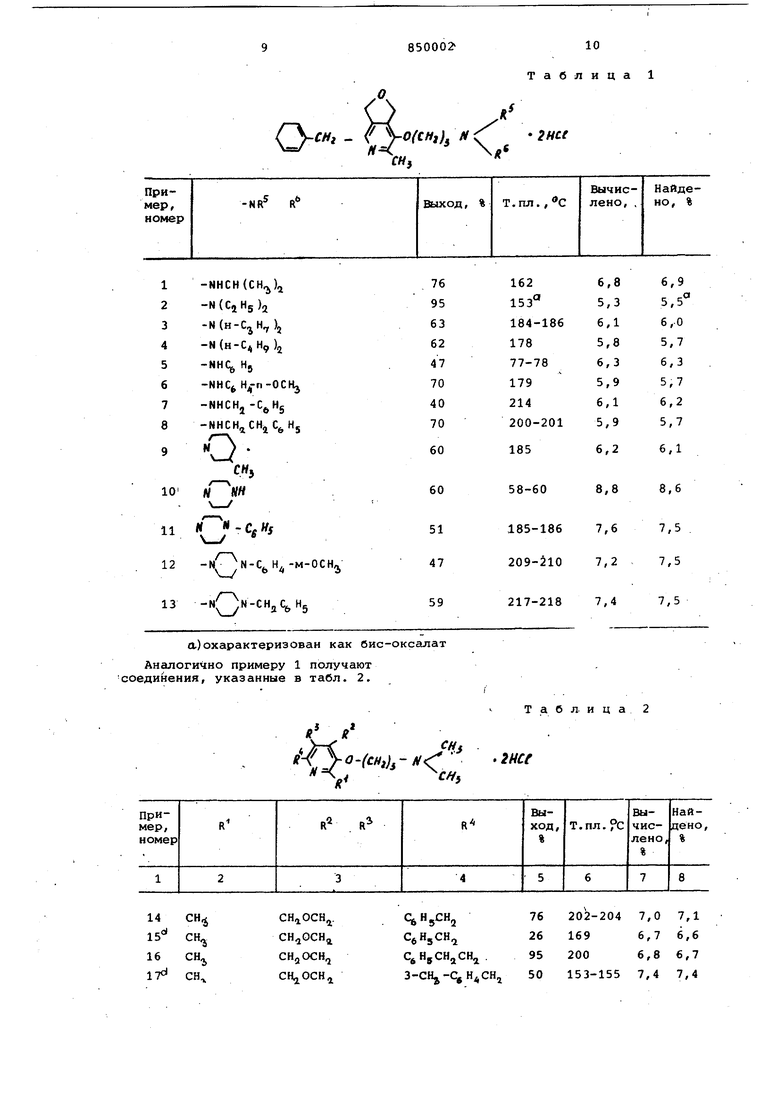


(CH,)N(
/
,. CH,iOCH5 CHjOCH
f
«
76
202-2047,07,1
26
1696,76,6
95
2006,86,7
153-1557,47,4
50
Продолже н ие т абл.
Продолжение табл.
формула изобретения
-И&
i;j /--
где R - атом водорода, С -алкил, бензил
R и одинаковые или различные и означают атом водорода, метил, замещенный окси, метокси, диметиламино55 группами; алкоксикарбонил с 1-2 атоМс1ми С в алкиле,
R и R вместе означают остаток -СНп-В-СН -, в котором В - атом кис2лорода,
-О-СН-0-NИЛИ
I t
f ЧСН(СН5) СН,
атом водорода, фенил-С;,. -гшкил, фенильное кольцо которого может быть замещено окси, атомом хлора. трифторметилом, метилом; или cai;-т иен и или а-тиенилметил, А - разветвленная или неразветвленная Сту-С(,-алкиленовая цепь, ненасыщенная алкиленовая цепь с 4 атомами С или ct-тиенильный остаток; R5 - атом водорода, С -алкил, в соответствующем случае замещенный окси, метокси, фенилом или фенил, в соответствующем случае замещенный ме оксигруппой, Сл,-алкинил, С, -циклоалкил в соответствующем случае замещенный метилом) ць - атом водорода или С,. -алкил вместе с атомом N означаю 6-членное кольцо, содержащее в соот ветствующем случае атом N, свободное или замещенное алкилом, бензилом или свободным или замещенным метоксигруппой фенилом, или их физиологически приемлемых солей, отличающийся тем, что, с целью получения новых соединений, пиридииол общей формулы /-Ту (7// .сокращенно Р-ОН, в которой R , R , ( и R имеют вышеуказанные значения. подвергёиот взаимодействию с соеди- нением общей формулы Х-А-У, в которой X и У означают хлор, бром или йод, а А имеет вышеуказанное значение, при температуре от О до , в присутствии основания в среде органического растворителя, и полученное соединение общей формулы Р-О-А-У(III) подвергают взаимодействию с амином формулы R -NH-R, в которой Я и R имеют указанные выше значения, при температуре eO-lZO C, и полученный целевой продукт выделяют в свободном виде или в виде физиологически приемлемых солей. 2. Способ по п. 1отличающ и и с я тем, что взаимодействие соединения общейформулы (II) с соединением общей формулы Х-А-У осуществляют предпочтительно при температуре от 20 -до . Источники информации, принятые во внимание при экспертизе 1. Эльдерфильд Р. Гетероциклические соединения. Т. 1. М., 1953, с. 413.
Авторы
Даты
1981-07-23—Публикация
1978-12-19—Подача