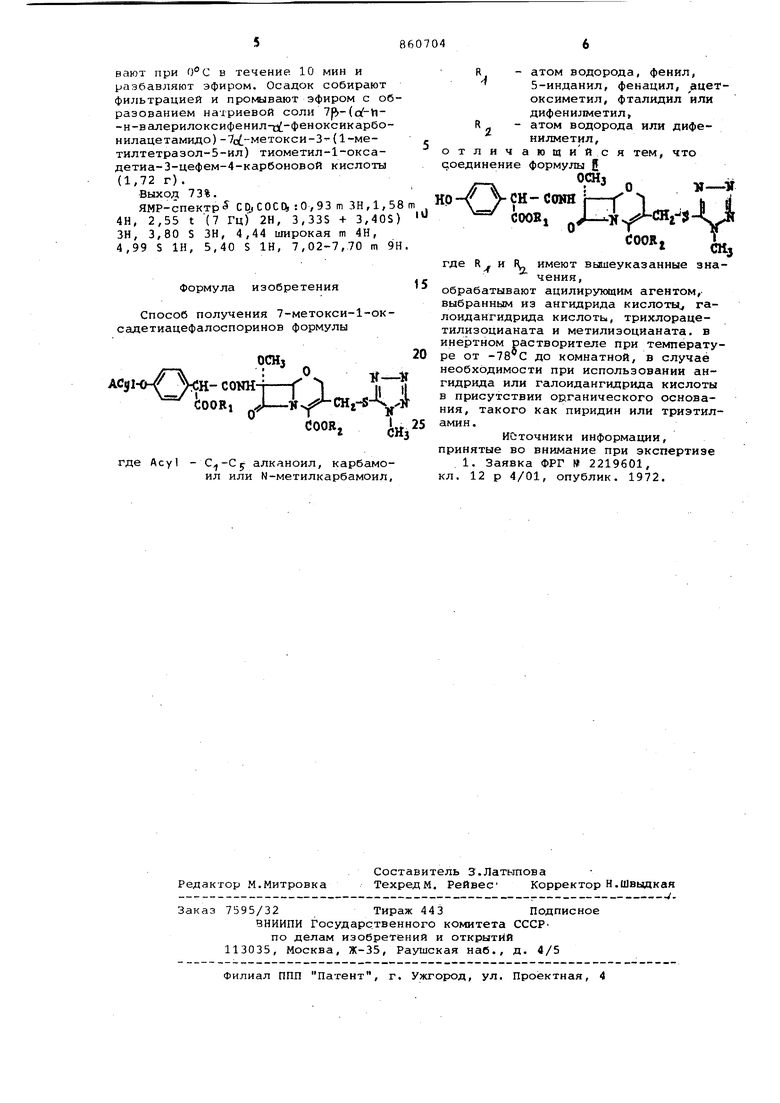
Изобретение относится к способу получения новых антибиотиков 7-метсжси-1-окссддетиацефалоспоринов формулыО -.г :iH-coNH-if 1Л ..-# -СНг-fe-Sjj COORi - COOR, где Асу) - алканоил, карбамоя или N-метилкарбамоил, атом водорода, фенил, 5-инданил, фенацил, ацетоксиметил, фталидил или дифенилметил, R 2 - атом водорода или дифенилметил. Известен способ получения аналогов цефсшоспорина, имеющих в ядре кислород вместо серы, в частности 7-галоид-(или азидо- или амино) 1-оксадетиа-3-цефем-4-карбоновьискислот, взаимодействием М-(с,о1-Дигалоидацетил)-4-алкоксикарбонил-1,3 -оксазина с фенилртутьгалогенидом с последующим термическим разложени ем N-((-фенилмеркурио-о{,йС Дигалокдацетил)-4-алкоксикарбонил-1,3-оксазина с образованием эфира 7-гошоид-1-оксадетиа-3-цефем-4-карбоновойкислоты и, в случае необходимости, с последующим переводом 7-галоидв 7-азидо- или 7-амино-производное или эфира в свободную кислоту Эти соединения обладают физиологически активными свойствами. Цель изобретения - синтез новых производных 1-оксадетиацефалоспоринов, расширяющих арсенал средств воздействия на живой организм. Указанная цель достигается Предлагаемым способом, который заключается в том, что соединение ОСНз CH-CONH COOR,где R. и Rj вышеуказанные значелия, обрабатывают ацелирующим агентом, выбранным из ангидрида кислоты, галоидангидрида кислоты, особенно хлор ангидрида, трихлорацетилизоцианата и метилизоцианата, в случае галоидангидрида или ангидрида кислоты пррдпочтительно в присутствии органичйСкого основания, такого как пиридин или триэтиламин, в среде инертного растворителя, например галоидуглеводорода, простого эфира, сложного эфира, кетона, кислоты, нитрила или их водно-растворимой смеси, при температуре от до комнатной
Обычно реакция завершается за 0,2-5 ч.
Данные элементарного анализа и физические константы продуктов в каждом примере не противоречат- приведенным структурам, В последующих примерах продукты обычно содержат почти равное количество изомеров при альфа-асимметричном атоме углерода в амидной боковой цепи. Оба эти предлагаемые изомера, если это необходимо, можно разделить при помощи хроматографии или других способов .
Пример 1, В раствор дифенилметил (oL- М-оксифенил-с(-дифенилметоксикарбонилацетамидо) -1-oL-метокси-3-(1-метилтетразол-5-ил)-тиометил-1-оксадетиа-3-цефем-4-карбоксилата (286 мг) в метиленхлориде (2 мл) добавляют трихлорацетилизоцианид (0,5 мл) с охлаждением до -78°С, После перемешивания при -78с в течение 30 мин и при в течение 1 ч смесь разбавляют бензолом (20 мл) и этилацетатом (20 мл), промывают водой, сушат и концентрируют. Полученный в результате остаток очищают хроматографией на силикагеле (30 г), содержащем 10% воды, и элюируют смесью бензола и этилацетата (в пропорции 1:1). В результате получают дифенилметил (о -Ь-карбамоилоксифенил-о -цифенилметоксикарбонилацетамидо) -7о -метокси-3- (1 -метилтетразол-5-ил)-тиометил-1-оксадетиа-З-цефем-4-карбоксилат (l79,9 мг) в виде бесцветной пены.
Выход 59,5%. . .
ИК-спектрЛ Нзсм : 3530, 3425, 3325, 1790, 1750, 1728 и 1700 Sh.
ЯМР-спектрсГ СОС1,: (3,425 + + 3,455) ЗН, 3,73 5 ЗН, 4,22 5 2Н, 4,42 5 2Н, 4,80 5 1Н, 5,03 5 1Н и 5,33 S 2Н.
Пример 2, Аналогично примеру 1 дифеиилметил 7р-(с1-й-оксифенил-ot-дифенилметоксикарбонилацетамидо)-7с1-метокси-3-(1-метилтетразол-5-ил)-тиометил-1-оксадетиа-3-цефем-4-карбоксилат (100 мл) обрабатывают метилизоцианатом (0,2 мл) в тетрагидрофуране (1 мл) в присутствии 1,5-диазабицикло 3, 5,0 ундецена при ОС в течение 4,5 ч. В результате получают дифенилметил 7 (о -П-М-метилкарбамоилоксифенил-с дифб5нилметоксикарбонилацетамндо)-7с -метокси-3-(1-метилтетразол-5-ил)-гиометил-1-оксадетиа-З-цефем-4-карбоксилат(52 мг).
Выход 49%. .
ИК-спектрАГ -- см : 3460, 1785, 1725 и 1700.
ЯМР-спектр сГ СОС1з: 2,87d (5Н) ЗН, 3,45 brS ЗН, 3,80 S ЗН, 4,23 brS 2Н, 4,47 brS 2Н, 4,77 brSlH, 5,0 S IH, 4,95-5,40 m IH и 6,97 S 2H.
Пример 3. К охлаждаемому на льду раствору дифенилметилового эфира (c -ili-оксифенил-с -фталидилоксикарбонилацетамидо) -7(.-метокси-3-(1-метилтетразол-5-ил) тиометил-1-оксадетиа-З-цефем-4-карбоновой кислоты (170 мг) в дихлорметане (2 мл) добавляют уксусный ангидрид (180 мл) и пиридин(9О мкл при перемешивании. Через 2 ч реакционную смесь переливают в смесь этилацетата и ледяной воды и отделившийся органический слой промывают разбавленной соляной кислотой, водным раствором бикарбоната натрия, водой и рассолом, сушат над сульфатом магния и концентрируют с образованием дифенилметиловог эфира 7р)-((-и-ацетоксифенил-(-фталидилоксйкарбонилацетамидо) -7с6-метокси-3-(1-метилтетразол-5-ил) тиометил-1-оксадетиа-3-цефем-4-карбоновой кислоты (144 мг) в виде аморфного вещества.
Выход 80,4%.
Пример 4. К раствору дифенилметилового эфира (о -11-оксифенил-с -дифенилметоксикарбонилацетамидо) -7о -метокси-3-( 1-метилтетразол-5-ил) тиометил-1-оксадетиа-З-цефем-4-карбоновой кислоты (600 мг) в дихлорметане (10 мл) добавляют пиридин (280 мкл) и пропионилхлорид (304 мкл) при перемешивании и охлаждении льдом. После перемешивания 40 мин при охлаждении льдом реакционную смесь переливают в воду и экстрагируют этилацетатом. Экстрактный раствор проьЫвают 2 н. раствором соляной кислоты, 5%-ным водным раствором бикарбоната натрия и водой, сушат над сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток хроматографируют на силикагеле при использовании в качестве элюирующего растворителя смеси бензол:этилацетат (9:1) с образованием вспененного дифенилметилового эфира (о(, -пропилоксифенил-о -дифенилметоксикарбонилацетамидо) -7oi-MeTOKcH-3-( 1-метилтетразол-5-ил) тиометил-1-оксадетиа-З-цефем-4-карбоновой кислоты (600 мг). Выход 94%. °
Пример 5. К раствору (о -Л -н-валерилоксифенил-в -феноксикарбонилацетамидо) -7а1-метокси-3-(1-метилтетраэол-5-ил)-тиометил-1-оксадетиа-З-цефем-4-карбоновой кислоты (2,3 г) в этилацетате (5 мл)добавляют 2,0 М раствор д -этилгексаноата натрия в изопропаноле (3,38 мл при , полученную смесь перемешивают при в течение 10 мин и разбавляют эфиром. Осадок собирают фильтрацией и проь«лвают эфиром с образованием натриевой соли lp-(o -н-валерилоксифенил-х -феноксикарбонилацетамидо)-7с.-метокси-3-(1-метилтетразол-5-ил) тиометил-1-оксадетиа-З-цефем-4-карбоновой кислоты (1,72 г).
Выход 73%.
ЯМР-спектр5 CD, COCO, :0,93 m ЗН, 1,58 4Н, 2,55 t (7 Гц) 2Н, 3,335 + 3,405) ЗН, 3,80 5 ЗН, 4,44 широкая m 4Н, 4,99 S 1Н, 5,40 S 1Н, 7,02-7,70 m 9Н.
R - атом водорода, фенил, 5-инданил, фекацил, ацетоксиметил, фталидил или дифенилметил,
R - - атом водорода или дифенилметил,
тличающийся тем, что единение формулы 5
ОСНЗ
СИ- соня i-г 1
С008,

| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения 1-оксадетиацефалоспоринов или их солей | 1977 |
|
SU1056903A3 |
| Способ получения производного 7-метокси-1-оксадетиацефалоспо-РиНА | 1978 |
|
SU833161A3 |
| Способ получения 7-метокси-1- ОКСАдЕТиАцЕфАлОСпОРиНОВ или иХСОлЕй | 1978 |
|
SU812182A3 |
| Способ получения 1-оксадетиацефалоспоринов | 1982 |
|
SU1039444A3 |
| Способ получения производных 7 -галоидарилмалонамидо-7 -метокси-3-гетероциклилтиометил-1-детиа1-окса-3-цефем-4-карбоновой кислоты или их солей с органическими или неорганическими основаниями | 1978 |
|
SU784779A3 |
| Способ получения 7-замещенныхАМиНОАцЕТАМидО-1-ОКСАдЕТиАцЕфАл-ОСпОРиНОВ | 1978 |
|
SU799665A3 |
| Способ получения 7-замещенных аминоацетамидооксадетиацефалоспоринов | 1977 |
|
SU786901A3 |
| Способ получения сложных эфиров @ -эпимера 7 @ -малонамидо-7 @ -метокси-3-(1-метилтетразол-5-илтиометил)-1-детиа-1-окса-3-цефем-4-карбоновой кислоты | 1983 |
|
SU1225488A3 |
| Способ получения 7-замещенныхАМиНОАцЕТАМидО-1-ОКСАдЕТиАцЕфАлО-СпОРиНОВ | 1978 |
|
SU812183A3 |
| Способ получения производных цефалоспорина или их солей с щелочными металлами | 1981 |
|
SU1128838A3 |


Авторы
Даты
1981-08-30—Публикация
1978-07-25—Подача