394 обработкой дигидропираном превращают в бис-тетрагидропираниловый эфир, который восстанавливают диизобутил-. алюминий гидридом в соответствующий лактол и затем подвергают конденсации с реактивом Виттига, полученным из 5 трифенилфосфониопентановой кислоты и димсилнатрия, с последующим гидролизом разбавленной уксусной кислотой CT . Однако отстутствуют сведения о способе получения фармакологически активных простагландинов общей формулы I. Цель изобретения - расширение ассортимента фармакологически активных простагландинов. Цель достигается тем, что простагландин ПГФ, или ПГЕ,, Д серебряной соли или соли щелочного металла со свободными или ацетилированными оксигруппами подвергают взаимодейстВИЮ с или С(1 -оксигруппой соответствующего стероида в присутствии. связывающего агента оС-бромацетилброМИДа или пятибромистого фосфора с последующим, в случае необходимости . ацетилированием свободных гидроксильных групп, после чего полученные целевые продукты выделяют. Процесс проводят в растворителе. предпочтительно апротонном, например в безводном тетрагидрофуране, дяметил сульфоксиде, и при температурах, близких к комнатной и ниже. Для ацетилирования свободных гидроксильных групп в соединении общей формулы I используют уксусный ангидрид, предпочтительно в присутствии пиридина. Производные простагландина общей формулы I могут найти эффективное применение для преждевременного прерывания беременности, стимулирования родов, улучшения процесса оплодотворения, восстановления нарушений менс руального цикла, а также в качестве противозачаточных средств. Пример 1. Получение экстра1,3,6(10)-триен-3-окси-17-оксикарбонилметил-9с, Hd, 15с6-триокси-5-(цис -13(транс)-простадиеноата (ПГФЕ) и соли калия или серебра 9Ы, llol, 15с1,-триоксит5-(цис)-13 (транс)-простадие новой кислоты (ПГФп): Получение соли калия ПГф, 1 мл воды добавляют в 0,1053 г (2,97 X ) ПГФ|2 1 и смесь пере4мешивают при (:+1) - (, при этом в смесь медленно добавляют 1 мл водного раствора, содержащего 0,0205 г едкого кали, образуется прозрачный раствор после перемешивания 1 ч, при этом значение рН раствора 7,5-8,5. Получение соли серебра ПГФ|2. 0,05301 г азотнокислого серебра растворяют в небольшом количестве BOды и полученный раствор добавляют в водный раствор соли калия ПГФ(,( в темноте. Раствор перемешивают 15 мин, в результате чего соль серебра ПГФ белого цвета выпадает в осадок. После фильтрации белого осадка, .собранный материал промывают водой, а затем простым эфиром, после сушки при комнатной температуре при пониженном давлении получают соль серебра белоfo цвета .( г), выход 79., 1. Получение эстра-1,3,5(10)-триен-З/Ь-ол-1 7ft-6pOMaijieTaTa. Ш. г эстрадиола растворяют в 400 мл обезвоженного тетрагидрофура з (ТГф), а затем в смесь добавляют 8,8 .г безводного пиридина и при (-5)(,по каплям добавляют раствор, содержащий 7 Г четыреххлористого углеродаи 22,5 rct-бромацетилбромидз. Смесь оставляют на ночь, после завершения реакции,. осадок отделяют фильтрацией и отгоняют растворитель из фильтрата. Остаток растворяют в,простом эфире и перекристаллизрвывают, получают эстра-1,3,5С10)-триен-3,17/5-дибромацетат. Затем 2 г полученного продукта растворяют а 900 мл метанола и раствор охлаждают до -5С, после чего в смесь по каплям добавляют 20 мл водного раствора, содержащего 0,2 г поташа. Спустя 30 мин, в раствор добавляют 1000 мл воды, полученный осадок отделяют, и сушат, получают эстрад,3,5- (10}-триен-З/Ь-ол-1 7|%-бромаметат. Реакция соли серебра ПГФ(2о(с эстра-1,3,5(10) -триен-3|(-ол-17р -бромацетатом. 0,1085 г (2,35 х 10 моль) соли серебра ПГФ растворяют в 2 «л диметилсульфоксйда (ДМСО) в темноте, добавляют 0,1 г эстра-1 ,3,5(10)-3| -ол-17р)-бромацетата и смесь перемешивают при комнатной температуре в течение 2 дней. Осадок бромида серебра отделяют, а оставшийся раствор превращают в эмульсию в охлажденном состоянии
при добавлении 20 мл воды. .В результате отделения при помощи центрифугирования получают из эмульсии бледножелтый маслянистый продукт.
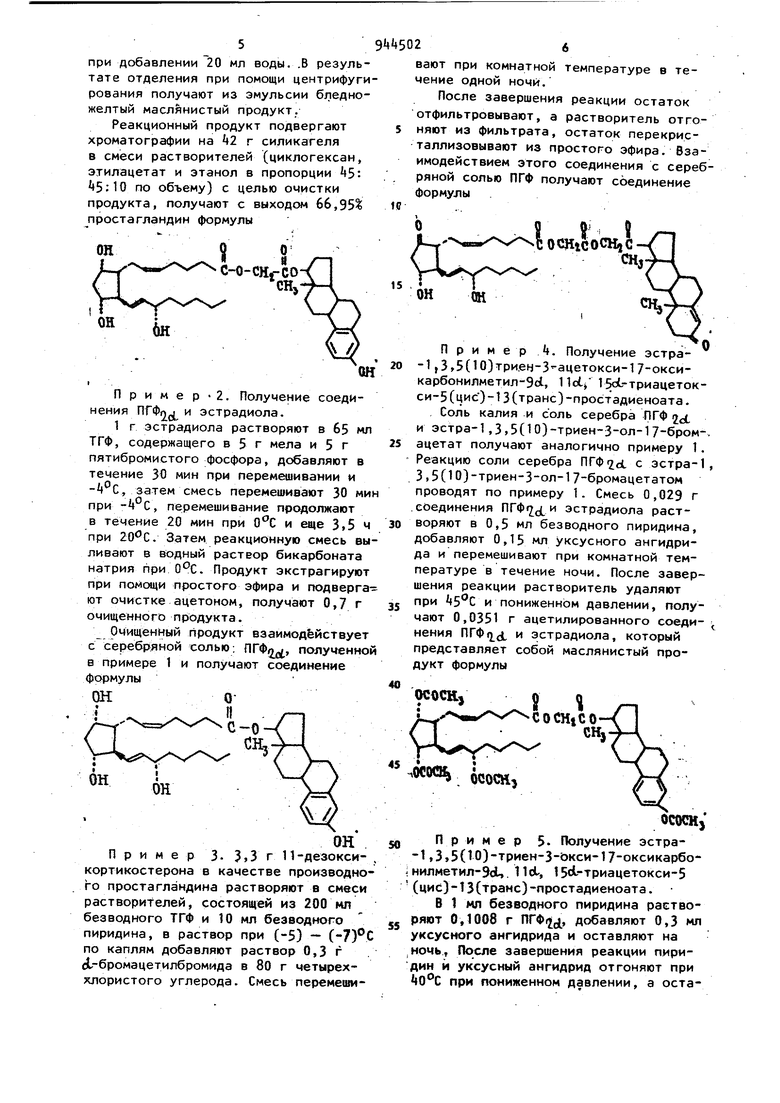
Реакционный продукт подвергают хроматографии на 2 г силикагеля 8 смеси растворителей (циклогексан, этилацетат и этанол в пропорции 5 по объему) с целью очистки продукта, получают с выходом 66,95% простагландин формулы
C-O-CHfCO
сн
П р и м е р 2. Получение соединения ПГФл и эстрадиола.
1 г эстрадиола растворяют в 65 мл ТГФ, содержащего в 5 г мела и 5 г пятибромистого фосфора, добавляют в течение 30 мин при перемешивании и , затем смесь перемешивают 30 мин при - С, перемешивание продолжают в течение 20 мин при и еще ч при . Затем реакционную смесь выливают в раствор бикарбоната натрия при Ос. Продукт экстрагируют при помсяци простого эфира и подверга- ют очистка ацетоном, получают 0,7 г очищенного продукта.
Очищенмый продукт взаимодействует с серебряной солью. ЛГФ|, полученной в примере 1 и получают соединение формулы
ОН о . и .
С-0
сн,
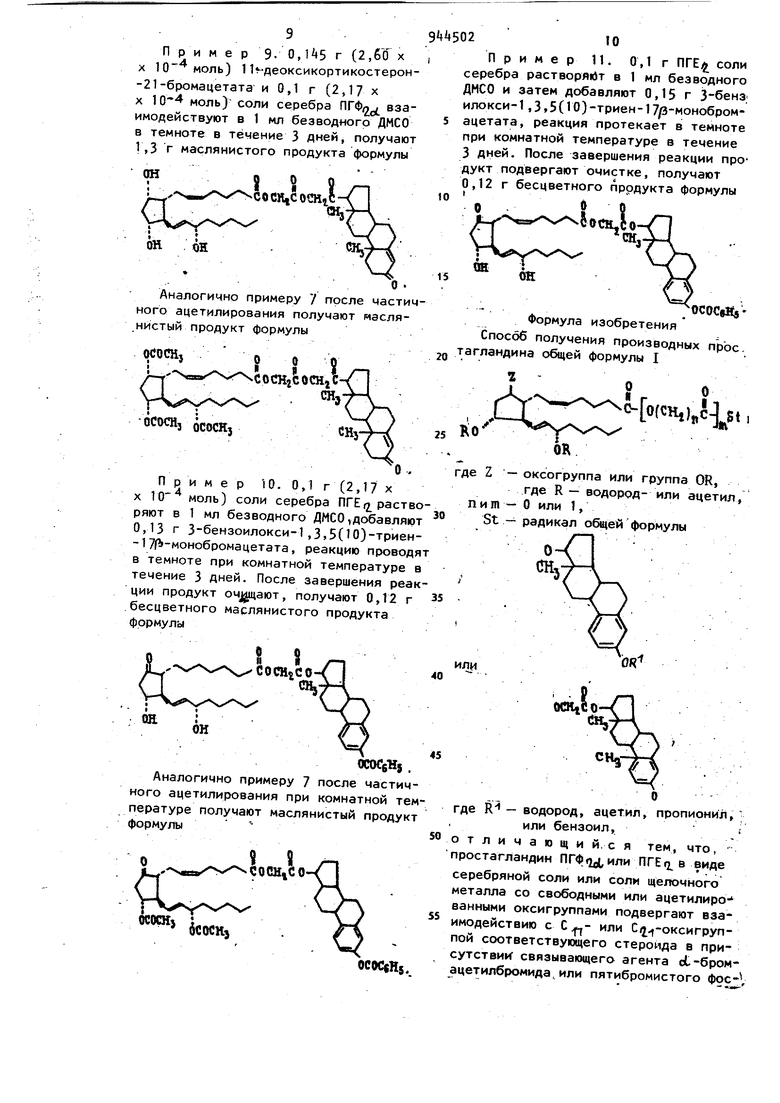
Пример 3- г 11-дезокси- , кортикостерона в качестве прокзводного простагландина растворяют в смеси растворителей, состоящей из 200 мл безводного ТГФ и 10 мл безводного пиридина, в раствор при (-5) - С) по каплям добавляют раствор 0,3 г еС-бромацетилбромида в 80 г четыреххлористого углерода. Смесь перемешивают при комнатной температуре в течение одной ночи.
После завершения реакции остаток отфильтровывают, а растворитель отгоняют из фильтрата, остаток перекристаллизовывают из простого эфира, взаимодействием этого соединения с серебряной солью ПГФ получают соединение формулы
i OCHtCOCHjC
сн,
15 ,
%
Пример л. Получение эстра-1,3,5(10)три.еч-3 ацетокси-17-оксикарбонилметил-9о1, 15о1--триацетокси-5Сцис)-13(транс)-прост адиеноата.
Соль калия и соль серебра ПГФ jcL и эстра-1,3,5(10)-триен-3-ол-17-бромацетат получают аналогично примеру 1. Реакцию соли серебра с эстра-1 3,5(10)-триен-3-ол-17-бромацетатом проводят по примеру 1. Смесь 0,029 г .соединения ПГФ и эстрадиола растворяют в 0,5 мл безводного пиридина, добавляют 0,15 мл уксусного ангидрида и перемешивают при комнатной температуре в течение ночи. После завершения реакции растворитель удаляют при и пониженном давлении, получают 0,0351 г ацетилироваиного соединения ПГФ(, и эстрадиола, который представляет собой маслянистый продукт формулы
ососк.
S
COCHtCO CHj
.X 0000%
ОСОСЯ)
OCOCKj
Пример 5. Получение эстра 1,(10)-триен-3-Ькси-17-оксикарбоJ нилметил-Эои .lid, 15 -триацетокси-5 (цис)-13(транс)-простадиеноата.
В 1 мл безводного пиридина растворяют 0,1008 г nr0(jf, добавляют 0,3 мл уксусного ангидрида и оставляют на .ночь, Ibcne завершения реакции пиридин и уксусный ангидрид отгоняют при при пониженном давлении, а остаток промывают водой. Полученный маслянистый продукт отделяют. Затем к нему добавляют 2 мл воды и 3 мл этанола, 0,0186 г гидрата окиси калия при охлаждении водой в течение 1 ч. Затем в реакционную смесь добавляют раствор 0,051 г нитрата серебра в 2 мл воды, реакцию продолжают 1 ч в темноте, получают 0,11 г соли серебра ацетилированного 2 мл ДМСО растворяют 0,11 г соли серебра ацетилированного а затем добавляют 0,1 г эстра-1,3,5 (10)-3 Ол-17 бромацетата, оставляют на А8 ч в темноте. После завершения реакции бромид серебра отделяют, фильтрат смешивают с 20 мл холодной воды, полученный маслянистый продукт отделяют при помощи центробежного сепаратора. Продукт подвергают хрома тографии на 2 г силикагеля при помощи смеси растворителей (циклогексан, этилацетат и этанол в объемных отношениях Очищенный продукт представляет собой маслянистую жидкость. При помощи элементарного анализа и ИК-спектроскопии установлено, что продукт имеет следующую структуру Щ ОСОСК} ОСОСН, При м е р 6. 0,1 -г (2,17 X X 10 моль) соли серебра ПГФ|2 растворяют в 1 мл безводного ДМСО ив раствор добавляют 0,15 г (2,60 х X ) З-бензоилокси-1 ,3.5(10) -тpиeн- 1 7(Ь монобромацетата, оставляю в темноте при комнатной температуре. После заверй ения реакции бромид серебра отделяют, ф1 льтрат охлаждают и смешивают с водой j продукт отделяю в маслянистом виде в нижней части це тробежного сепаратора. Маслянистый продукт сушат в вакууме в эксикаторе, затем растворяют в смеси растворителей (этилацетат, циклогексаи и этанол в объемных пропорциях S.r+SilO) и раствор пропуска ют через колонку с силикагелем, полу чают 0,12 г вещества формулы ОСОСбН, Пример 7. 21 мг (2,73 х X ) вещества, полученного в примере 6, растворяют в 0,5 мл без- водного пиридина и в смесь добавляют 0,15 мл уксусного ангидрида, смесь охлаждают льдом, выдерживают в течение ночи. После завершения реакции, растворитель отгоняют в вакууме при , а остаток растворяют в смеси растворителей (этилацетат и циклогексан в объемных про.порциях 50:30), полученный раствор пропускают через воронку с силикагелем, получают с выходом 96,31% вещества формулы OCOCRj .0.0 L.. сосн.с о п % ,XN., «« icocHj ОСОСбКз прим е р 8. 0,1 г (2,17 X X 10 моль) соли серебра ПГФ,растворяют в 1 мл безводного ДМСО, добавляют 0,114 г (2,6 X Ю моль), 3-пропионилокси-1,3 ,5-(10)-триен-17/ -моноацетата, реакция протекает в темноте при комнат;ной температуре в течение 3 дней. После завершения реакции бромид серебра отделяют, а фильтрат смешивают с водой, продукт отделяют в маслянистом виде при комнатной температуре при помощи центробежного сепа- ратора. Маслянистый продукт растворяют в смеси растворителей (этилацетат, циклогексан, и этанол в объемных пропорциях ), раствор пропускают через колонку с силикагелем, получают 0,12 г маслянистого продукта формулы р 9. 0,Й5 г (2,бО X при м е 1-4 X ) 11«-деоксикортикостерон-21-бромацетата и 0,1 г (2,17 х X 10 моль) соли серебра ГФ взаимодействуют в 1 мл безводного ДМСО в темноте в течение 3 дней, получают 1,3 г маслянистого продукта формулы i S J COCK,CO€HiC Аналогично примеру 7 гтосле частич ного ацетилирования получают маслянистый продукт формулы о NseXv xcocHjc оси OCOCHj oCOCHj Пример 10. 0,1 г (2,17 X X 10 моль) соли серебра ПГЕ(2 раств ряют в 1 мл безводного ДМСО,добавляю 0,13 г 3 бензоилокси-1,3,5(10)-тpиeн -17f -мoнoбpoмaцeтaтa, реакцию провод в темноте при комнатной температуре течение 3 дней. После завершения реа ции продукт oчJgu aют, получают 0,12 г бесцветного маслянистого продукта формула Аналогично примеру 7 после части ного ацетилирования при комнатной т пературе получают маслянистый проду формулы « 9 И , С О CHjC О .ЦхХвй V VvxS x OCOCsHj OCOCeH 210 П р и м 6 р п. 0,1 г ПГЕ; соли серебра растворяет в 1 мл безводного ДМСО и затем добавляют 0,15 г Збенз илокси-1,3,5(10)-триен-17/3-монобромацетата, реакция протекает в темноте при комнатной температуре в течение 3 дней. После завершения реакции продукт подвергают очистке, получают 0,12 г бесцветного продукта формулы J /ОСОСвВ Формула изобретения Способ получения производных прос. тагландина общей формулы I OfCHj)C где Z - оксогруппа или группа OR, где R - водород- или ацетил, пит - О или 1, St - радикал ойдей формулы где R - водород, ацетил, пропионил, ; или бензоил, отличающи и. с я тем, что, простагландин ПГФг2д1,или ПГЕг; в виде серебряной соли или соли щелочного металла со свободными или ацетилированными оксигруппами подвергают ваз имодействию с С - или С(j -оксигруппой соответствующего стероида в присутствии связывающего агента о1-бромацетилбромида,или пятибромистого фос-V
11Э. 50212
фора с последу1рщим в случае необходи- Источники информации, мости, ацетилированием свободных гид- принятые во внимание при экспертизе роксильных групп, после чего по- Е- J. et. al. Synthesis лученные целевые продукты вьшеля- о Prostaglandin and Е„ (dl). ют.... 5 J- Am. Chem. Soc. 91, 5675 0969).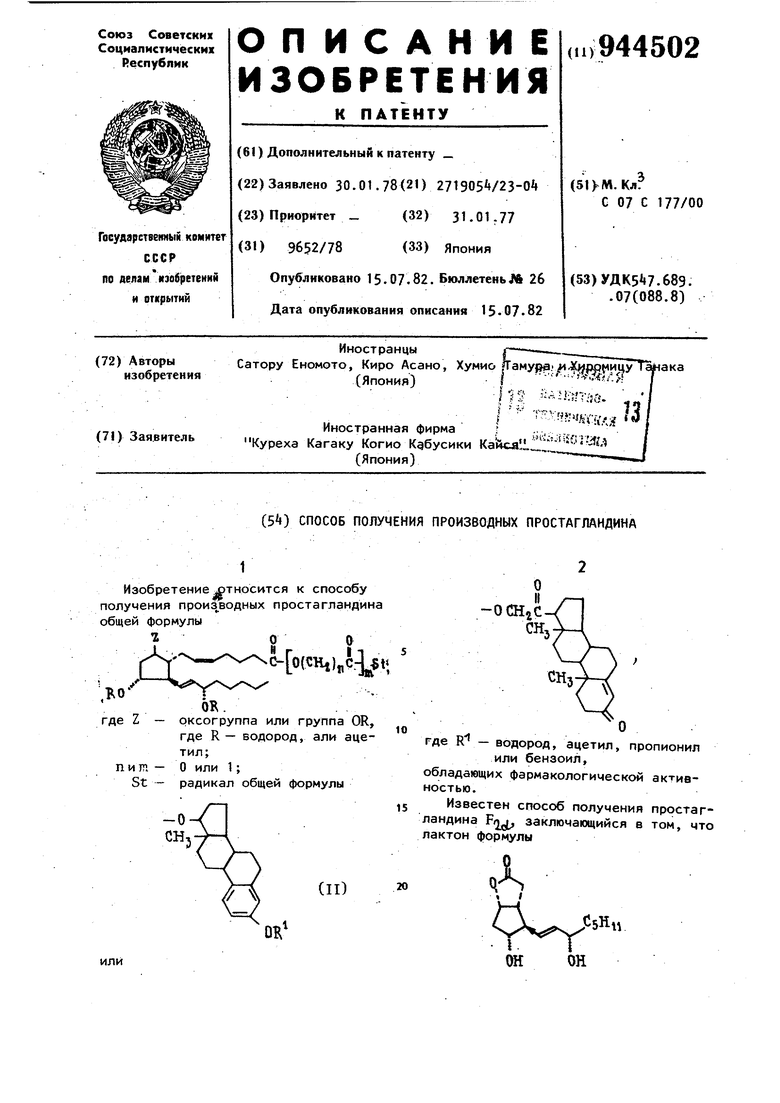



| название | год | авторы | номер документа |
|---|---|---|---|
| СТЕРОИДНОЕ СОЕДИНЕНИЕ | 1995 |
|
RU2160279C2 |
| Способ получения производных угольной кислоты эстранового ряда | 1972 |
|
SU515462A3 |
| ПРОИЗВОДНЫЕ ЭСТРА-1,3,5(10)-ТРИЕНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1995 |
|
RU2139885C1 |
| Способ получения производных хлорамбуцила (его варианты) | 1979 |
|
SU1001860A3 |
| ПРОИЗВОДНЫЕ СУЛЬФАМАТА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ СОСТАВЫ | 1996 |
|
RU2159774C2 |
| СОЕДИНЕНИЯ С ГИДРОКСИКАРБОНИЛЬНЫМИ-ГАЛОГЕНАЛКИЛЬНЫМИ БОКОВЫМИ ЦЕПЯМИ | 2000 |
|
RU2247106C2 |
| СПОСОБ ПОЛУЧЕНИЯ (15α,16α,17β)-ЭСТРА-1,3,5(10)-ТРИЕН-3,15,16,17-ТЕТРОЛА (ЭСТЕТРОЛА) И ИНТЕРМЕДИАТЫ В ЭТОМ СПОСОБЕ | 2020 |
|
RU2818561C1 |
| СТЕРОИДНОЕ СОЕДИНЕНИЕ, СПОСОБЫ ЕГО ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1998 |
|
RU2182153C2 |
| ЭСТРАТРИЕНЫ, СОДЕРЖАЩИЕ МОСТИК | 1990 |
|
RU2087479C1 |
| Способ получения 8 -эстратриенов,окисленных в положении 1,3,17 | 1974 |
|
SU626705A3 |


Авторы
Даты
1982-07-15—Публикация
1978-01-30—Подача