(54) СПОСОБ ПОЛУЧЕНИЯ 8 Сб-ЭСТРАТРИЕНОВ, ОКИСЛЕННЫХ В ПОЛОЖЕНИИ 1,3,17. 0,3 г ра11-1,3-аиметокси-1,3,5( 10), 8,14 эстрапентаен-17-она в 5О мл ТГФ .гидрируют 17 ч над 0,15 г катализатора палладий/карбонат кальция (5%) при комнатной температуре и давлении водорода 50 ат, катализатор затем отфильтровывают, фильтрат упаривают и остаток кристаллизуют из изопропилового эфира. Получают 4О мг целевого продукта, т. пл. 158-16О°С. П р И м е р 2. Рац-1,3-аиметокси-17 р -ацетокси-8 Сб -эстра-1,3,5(10)-триен, А. 61 г рац-1,3-ДИметокси-17/3-аде окси-1,3,5(10), 8Д4-эстрапентаена в 400 мл бензола гидрируют 17 ч в присутствии 14 г катализатора никеля Рене при комнатной температуре и давлении водорода 5О ат, катализатор отфильтровьгоают, фильтрат упаривают и остаток кристаллизуют из метанола над углем. Получают 5О г целевого вещества, т. пл. 136 138°С. Б. 100 мг рац-1,3-диметокси-17 --ацетокси-1,3,5(1О), 8-эстратетраена в 1,4 мл дистиллированного ТГФ гидрируют над 30 мг катализатора палладий/ карбонат кальция (5%) при нормальном давлении, комнатной температуре до пре кращения поглощения водорода. После фильтрования и .упаривания получают кри таллизацией из метанола 44 мг целевого вещества, т. пл. 126/130-131°С. Аналогично получают рац-1,3-диметоксй-17 9-ацетокси-18- «eтш -8oi-эcтpa-l,3,5(10)-тpиeн и рац-1,3-диметокс -17 J5 -ацетокси- 8-этш1 8 ой-эстра- -1,3,5(1О)-гриен. Пример 3. Рац-1,3,17;3-триаце окси-8а:т стра-1,3,5 (1О )-триен. Смесь, состоящую из 1 г рац-1,3-ди мeтoкcи-17j6 -ацетокси-8 6 -эстра-1,3,5{10)-триена и 10 г гидрохлорида пиридина, в атмосфере азота, перемешивая, нагревают 3 ч до 2ОО°С. После охлаждения расплав растворяют в 50 мл пиридина и с 5 мл уксусного ангидрида перемешивают 1 ч в атмосфере азота при комнатной температуре. После осаж дения в ледяной воде фильтруют и перерабатывают. Сырой продукт очищают при помощи градиентной хроматографии (метиленхлориц-ацетон; 9:1). Получают, 93О мг целевого вещества, т. пл. 146/1 148°С.„. Аналогично получают рац-1,3,17у0-триадетокои-. 18-метил- Bof. -acTpai-1«3,5(1О).-триенира№.1,3,17 -триаце OKCffi -18-.этил-8е встра-1,3,5 (10)-тр Применяя вместо уксусного ангидрида нгидрид капроновой кислоты и ангидрид априловой кислоты, получают рац- 1,3, 17/0 -трис-гексанотшокси-8об -эстра1,3,5(10)-триен и рац-1,3,17р -трисоктаноилокси-8 Л -эстра-1,3,5( 10)риен. П р и м 9 р 4. Рац-1,3-аиметокси8 06 -эстра-1,3,5(10)-триен-17/Э -ол, 4,5 г рац-1,3-диметокси-17 |/& -ацетакси-8{1Й-эстра-1,3,5(10)-триена JB 100 мл метанола с 13 мл водного раствора поташа {1О%) омыляют, нагревая 1,5 ч с обратным холодильником в атмосфере кислоты. После охлаждения осторожно нейтрализуют ледяной уксусной кислотой, упаривают, сокращая объем в два раза,, осаждают в растворе поваренной соли.в ледяной воде и перерабатывают. Получают 4,1 г сырого продукта. Перекристаллизацией 50О мг вещества из метанола получают 330 мг чистого целевого вещества, т. пл. 153/153,5-154°С. , Аналогично получают рац-1,3-диметокси-18-метш1-8а:-эстра-1,3,5 (10) -триен-17р -ол и рац-1,3 диметокси-18-этил-8 й -эстра-1,3,5 (10)-триен-17 Р -ол.. П р и м е р 5. ,3-диметокся 17 ft -ацетокси-8 af -эстра-1,3,5(1О)триен.. В раствор 60 мг рац-1,3-димет бкси-8оС эстра.1,3,5 (1О)-триен-17-она,; 3 мл метанола и 1,0 мл ТГФ- при комнатной температуре осторожно добавляют 60 мг боргидрида натрия и перемеши вают ЗО мин при комнатной температуре в атмосфере азота. Смесь нейтрализуют ледяной уксусной кислотой, упаривают, растворяют в эфире, промывают насыщенным раствором поваренной соли до нейтральной реакции, сушат и .упаривают. Остаток растворяют в 1 мл пиридина, добавляют 0,5 мл уксусного ангидрида и выдерживают 1 ч при 80 С в атмосфере азота. После охлаждения сливают в ле;дяную воду, осадок фильтруют и расрворяют в эфире. раствор промывают насыщенным раствором поваренной соли до нейтральной реакции, сушат и упаривают. Пере1фисталлизацией из метанола над углем получают 42 мг целевого вещества, т. пл. 131-134°С. Примере, Рац-1,3-диацетокси -8а;-эстра-1,3,5(10)-триен-17-он. Смесь из 25 г гидрохлорида пиридина и 2,5 г 1,3-диметокси-8с6 -эстра-1,3,5(10)-триен-17-она нагревают 3 ч в атмосфере азота, перемешивая, до 200°С. После охлаждения, цобавки 120 мл пири дина и 12 мл уксусного ангидрида при перемешивании в течение 1 ч при комна ной температуре вливают в раствор пова ренной соли в ледяной воде, перемешива 0,5 ч, фильтруют и перерабатывают. Сьь , рой продукт 2,5 г очищают при помоши градиентной хроматографии бО г окис кремния, метилеихлорид-ацетон (1О%), Перекристаллизацией из метанола получают 71О мл целевого вещества, т. пл. 178-180,5°С. Пример. 1,3-Диацетокси-8«;-эстра-1,3,5 (10 ).-триеи-17-он. К суспензии из 42 г З-оксн-Sot-эстра-1,3,5(10)-триен-17-она в БОО ледяной уксусной кислоты добавляют 12О г тетрацетата свинца, перемешивают 3 мин защищенную от влаги смесь и выливают ее в 60О мл ледяной воды. Осадок отжимают, промывают водой, растворяют в метиленхлориде, промывают раствором бикарбоната натрия и водой до нейтральной реакции, сушат и сокра-в щают объем. Концентрат с метиленхлорядом фильтруют над 4ОО г сипикагеля (+1О% воды). Фракция, содержащая вещество, уменьшается в объеме и освобождается от растворителя. Получают 7 г ЮуО -ацетокси-Зоб -эстра-1,4-диен-3,17-диона в виде масла. К суспензии из 13,0 г полученного масла в 125 мл уксусного ангидрида по каплям доливают 0,7 мл концентрированной серной кислоты и перемешивают 3 ч при комнатной температ эе, переводя вещество постепенно в раствор. Затем смесь выливают в 1О-кратный объем ледяной воды, к которой добавлено 7 г карбоната натрия, перемешивают 1 ч и затем фильтруют. Промытый и высушенный остаток перекристаллизовывают из метанола. Получают 7 г целевого вещества, т. пл. 208-211°С, oi +89°(СО,5; ). Аналогично получают 1,3-диацетокси- -18-метил-8с :-1,3,5(1О)-триен-17-он. Примерз. 1,3,17/3 -Триадетокси-8а:-эстра-1,3,5 (1О )-триен. В раствор из 6 г 1,3-диацетокси-8 зС-эстра-1,3,5(10)-триен-17-юна в 240мя меганопа и 10О мл ТГФ при комнатной темп ра туре постепенно добавляют 6 ОО мр боргид рида натрия и перемешивают 30 мин в атмоофере азота при. комнатной температуре, Смесь нейтрализуют ледяной уксусной КИСУ1ОТОЙ и аналогично примеру 6 ацетилируют и перерабатывают. Получают 4,8 г целевого вещества, т. пл. 149-150151°С,М20+4,2° (С 0,5; CHCg ) 056 Аналогично получают 1,3,17/3 -триа«етокси-18-метил-8с6 -эстра-1,3,5(.10) -триен. П р и м в р 9. 1,3-Бис-циклопвнт1 .окси- -8л -экстра-,3,5(l()-TpHeH-17ju-ОЛ.-: Раствор из 85 О мг ЗйС -эстра-1,3,5 (10)-триен-1,3,17 р триола в ЗО мл этанола в атмосфере азота вместе с 2,5 мл циклопентилбромида и 2,5 г карбоната калия нагревают 5 ч до кипения, смесь сливают в ледяную воду и экстрагируют э4жром. Органическую фазу прог мьгоают, сушат и упаривают. После хром)зтографической : очистки на силккагеле получают 265 г целевого вещества. Пример 1О. 1,3-Бис-бутилокси-8 сб-эстра-1,3,5(10)-триен-17|0 -ол. Аналогично примеру 6 подвергают реакции 5ОО мл 8о,-эстра-1,3,) -триен-1,3,17/Э -триол с 1,5 мл Н -бутилбромида и пер абатывают. Получают 23О мг целевого вещества. П р и м е р 11. 1,3,17р -Трис-тетрагидропираннпоксн 8 об -эстра-1,3,5(10)-тривн. К раствору из ЗОО мг 8 с6 -эстра-1,3,)-триеи-1,3,17/Э -триола в 4О МЛ абсолютного бензола добавляют 1,4 мл дистиллированного дигидропирала и 1О мг п толуолсупьфоновой кислоты. Раствор перемешивают 1,5 ч при комнатной температуре, промывают раствором бикарбоната натрия и воаой до нейтральной реакции, сушат и упаривают. Получают 70О мг сырого целевого про|дукта. Пример 12. 1,3,17-Трис-гвксаноилокси-8 Сб -эстра-1,3,5 (1О)-триен. В раствор из 45О мг 8 сС -эстра- -1,з,5(10)-триен-1,3,17 р -триола в 3 мл пиридина добавляют 1,5 мл ангидрида капроновой кислоты, нагревают 5 ч до 90 С в атмосфере азота, выпивают в ледянуюводу, добавив немного метанола, и перемешивают 1 ч, разлагая избыточный ангидрид. Экстрагируют эфиром, эфирный раствор с разбавленной серной кислотой промывают до ейтральной реакции раствором бикарбоата натрия и водой, сушат и упаривают. олучают после хроматографической чистки над силикагелем 32О мг целеого вещества. Пример 13. l,3-Диaцeтoкcи-3эcтpa-i,3,5(lO)- pиeн-17y5 -ол. Раствор из 1 с 1,3-диацетокси-8оСстра-1,3,5(10)-триен-17-она в ЗО мл бсолютного ТГФ при охлаждении льдом пе эемешивают 45 мин с 2 г литийтри-трет-бутоксигидридом алюминия, затем вливают в уксуснокислую ледяную воду с раствором поваренной соли и экстраги руют эфиром. Промывают органическую фазу до нейтральной реакции, cyuiaT и упаривают, Осааок (1г) очищают хроматографией. Получают после кристаллизации из гексана ацетона 38О мг целевого вещества, т. пл. 21О-211°С. Пример 14. 1,3-Диов:си-8сС-эстра-1,3,)триен-1-7-он. Раствор из 3 г 1,3-диацетокси-8ой-эстра-1,3,5(1О)-триен-17-она в 19м метипеяхлорида и 18 мл метанола в атмосфере азота при комнатной темпера туре перемешивают 3 суток, добавляя О,23 мл хлорной кислоты (7О%) и 1 мл метанола. Затем разбавляют уксусным эфиром и промывают насьшхенным раство ром поваренной соли до нейтральной реа ции. После сушки и упаравания получают 2,9 г целевого вещества в виде масла. Пример 15. 1,3-Бис-мезилокси -8 Сб -эстра-1,3,5{10)-триен-17-он. В раствор 1 г 1,3- диги1Я оксв-8 Эб-эстра-1,3,5(10)-трией-17-она в 14 м пиридина при О°С добавляют 1,9 метанхлорсупьфоновой кислоты и перемешиваю 3 суток при О-1О°С. Затем сшюают в подкж:ленную соляной кислотой ледяную воду, шьтруют и осадок растворяю в метиленхлориде. После хроматографии над оквсыо кремввя получают 8ОО мг аеяввого вещества. Пример 16. l,3-Биc-мeзилoкcи8вй -8стра-1,3,5(1О)- риен-17ув -ол. К раствору из 4ОО мг 1,3-бвс-мезв оксда-8 06-эстра-1,3,5 {1О )-триеи-17-она в 10 мл абсолютного ТГФ аобавпвкуг 8ОО мг литийтри-трет-бутоксигиа(Я(да алюминия и перемешивают 6О м ирв О°С. Затем нейтрализуют ледяной уксусной кислотой и экстрагируют уксус ным эфиром. Органическую фйэу 1фомывакгг водой, сушат и упаривают. Получен ньй сьфой продукт (4ОО мг) очишэют при помощи хроматографии. Получают 320 мг целевого вещества. Приме р 17. 1,3-Бис-мезииокси -17/Э -адетокен-8ай-эст| -1,3,5(1О)-триен. В раствор из 2О мг 1,3-б11с-мезилокси-8«з(.-эстра-1,3,3( 1О)-триен-i7ft-ona в 3 мл пиряпнна добавляют 2 мл уксусного ангидрида и выдерживаю 3 суток при комнатной температуре. За тем раствор вливают в ледяную воду, экстрагируют метиленхлоридом, промывакуг водой, сушат и упаривают. Осадок (180 мг) очищают при помощи хроматографии. Получают 150 мл целевого вещества. Пример 18. 1,3-Бис-(п-тозил окси)-8л -эстра-1,3,5(1О)-триен-17-он. В раствор из 1 г 1,3-аиокси-8а:-эстра-1,3,5(10)-трнен-17-она в 14 мл пиридина при О С добавляют. 2,5 г п -тояуолхлорсульфоновой кислоты и перемешивают 3 суток при О-10°С. Затем сливают в подкисленную соляной кислотой ледяную воду, фильтруют и растворяют осадок в метиленхлориде. После хроматографической очистки над силикагелем получают 820 мг целевого вещества. ;П р и м е pl9. 1,3-Бис-(диэт1шам1гаосульфонш1оксй)-8вС-«стра 1,3,5 ( i О )-гриен..17-он. В раствор из 25О мг 1,3-ди6кси-8ой -эстра-1,3,5( 1р)-триен-17-она в 6,5 мл диметилсульфоксида при охлаждении в среде азота добавляют 25О мл едкого натра (50%-ная суспензия в масле) и п емешивают ЗО мин при комнатной температуре. Затем добавляют раствор из 1,05 г диэтиламиносульфонилхлорида в 2 мл диметилсульфокснда и перемешивают 25 ч при комнатной температуре. Смесь сливают в уксуснокислую ледяную воду (с поваренной солью), ортанические вещества экстрагируют ЭФ1ФОМ, экстракт промывают, сушат и упаривают. После хроматографнческой очистки получают 15О мл целевого вещества. Пример 2О. 1,3-Бис-(пипери1игаосупьф жш1Оксв)..дстра-.1,3,5 (1О) -трве1 17-(Ж получают аналогично примеру 6 реакцией 1,3-дигидровсв -8сй -эстра-1,3,5(1О)гриен-17-она с пипериднносульфонилхлоридом. Пример 21. К раствору 9ОО мг 1,3-диокси-8ой -эстра-1,3,5(1О)триен-17-она в 45 мл абсолютного бензола прибавляют 14 мл триэтиламина. Затем при сильном перемешивании прибавляют 5,4 мл изопропилсульфонилхлорида и п емешивают 2 дня при комнатной температуре, выливают на лед и экстрагируют эфиром, экстракт промывают, сушат и упаривают. Сырой продукт очищается путем хроматографии на колонке. Получают 7ОО мг целевого вещества, т, Ш1. 134-136°С (гексан-адетов).
Формула изобретения
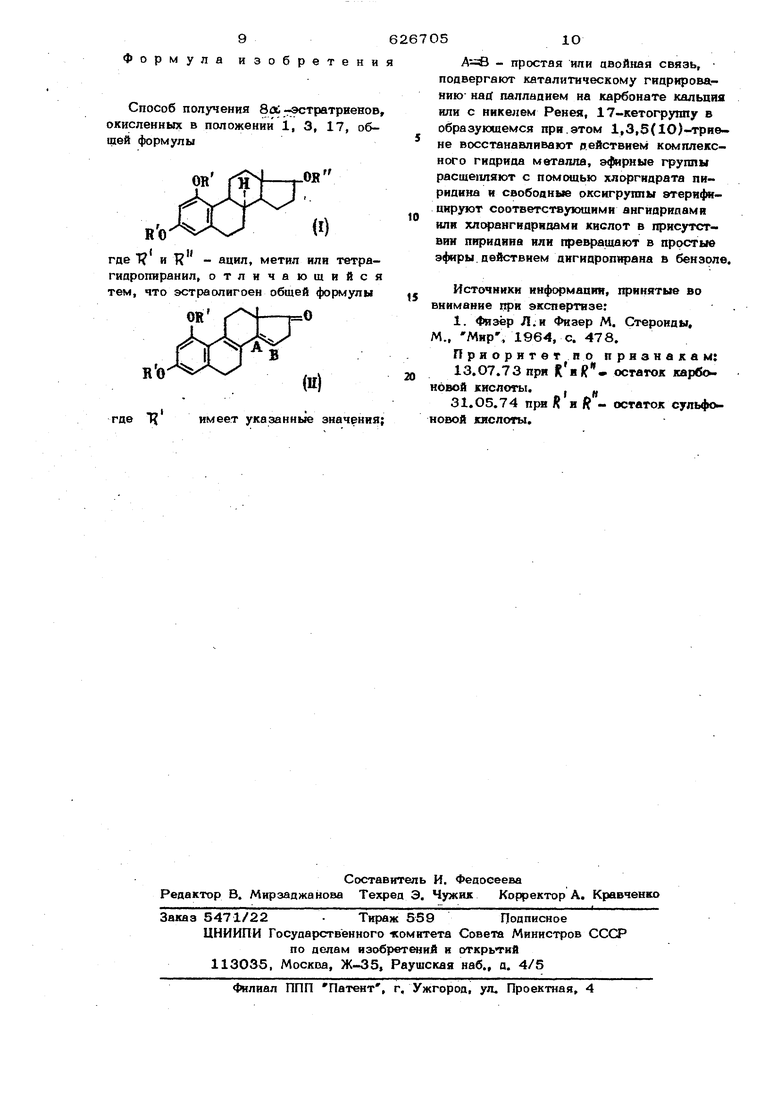
Способ получения 8Л гэстратриенов, окисленных в положении 1, 3, 17, общей формулы
он
где 1 и К - ацил, метил или тетрагидропиранил, отличающийся тем, что эстраолигоен общей формулы
OR
имеет указанные значения;
где
А - простая или авойная связь, подвергают каталитическому гиарированию- Hatf паллапием иа карбонате кальция или с никелем Ренея, 1 Т-кетогруппу в образующемся при.этом 1,3,5(1О)-триене восстанавливают действием комплексного гиарида металла, эфирные группы расщепляют с помощью хлоргндрата пирипина и свобоаные рксигруппы втернфицируют соответствующими ангиарипамя
0 или хлорангидряоами кислот в присутствии пиридина или превращают в прсютые эфиры. действием аигидропирана в бензоле.
Источники информаоия, принятые во
5 внимание при экспертизе;
1. Физёр Л,и Фиаер М. Стероиды, М.. Мир, 1964, с. 478.
Приоритет по признакам:
13.07.73при It н ocrat4 K кврбоновой кислоты..
31.05.74при R я f( - остаток сулы{к новой кислоты.



| название | год | авторы | номер документа |
|---|---|---|---|
| ЭСТРАТРИЕНЫ, СОДЕРЖАЩИЕ МОСТИК | 1990 |
|
RU2087479C1 |
| ТМ. Кл. С 07с 169/08УДК 547.689.6.07(088.8) | 1973 |
|
SU379088A1 |
| Способ получения 7L-oR -эстрадиолов | 1976 |
|
SU677666A1 |
| Способ получения стероидов прегнанового ряда | 1971 |
|
SU448642A3 |
| Способ получения 7-оксиэстрадиолов | 1975 |
|
SU676170A3 |
| СПОСОБ ПОЛУЧЕНИЯ СТЕРОИДНЫХ СОЕДИНЕНИЙ | 1971 |
|
SU293345A1 |
| Способ получения 6,6,9 -трифторпрегнанов | 1971 |
|
SU492079A3 |
| Рацемический 2,17аβ-дисульфамоилокси-3-метокси-D-гомо-8α-эстра-1,3,5(10)-триен в качестве ингибитора пролиферации опухолевых клеток MCF-7 | 2016 |
|
RU2629186C1 |
| Способ получения соединений эстрана | 1971 |
|
SU482041A3 |
| Способ получения производных простагландина | 1978 |
|
SU944502A3 |


Авторы
Даты
1978-09-30—Публикация
1974-07-12—Подача