Изобретение относится к химии фосфорорганических соединений, а именно к новому способу получения S-триалкилсили- ловых и станниловых эфиров 4-метоксифенилдитио- или тритиофосфоновых кислот общей формулы I 4-MeOC6H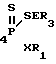 , где R, R1 - низший алкил; E-Si, Sn; X-O, S.
, где R, R1 - низший алкил; E-Si, Sn; X-O, S.
Аналоги соединений I нашли применение в качестве противоклещевых и инсектицидных препаратов, а также могут найти применение в качестве полупродуктов для целенаправленного синтеза аналогов таких инсектицидных препаратов как паратион, тимет, метасистокс, лейбацид и т. п.
S-триалкилсилиловые и станниловые эфиры дитио- и тритиофосфоновых кислот, содержащие у атома фосфора арильные заместители, не описаны. В то же время известен способ получения S-трициклоалкил- станниловых эфиров дитиофосфоновых кислот, содержащих низшие алкильные заместители у атома фосфора, взаимодействием щелочных солей соответствующих О-алкил(алкил)дитиофосфоновых кислот с галогенидами трициклоалкилолова при кипячении в нейтральном растворителе
R-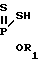 +(R2)3SnX
+(R2)3SnX  R-
R-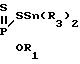 +Mx, где R, R1 - низший алкил; R2 - циклоалкил; X - Cl, B, I; M - Na, K.
+Mx, где R, R1 - низший алкил; R2 - циклоалкил; X - Cl, B, I; M - Na, K.
В химической литературе известны случаи раскрытия дитиадифосфетанового цикла 2,4-бис(фенил- и трет. -бутил)-2,4-дитиок- со-1,3,2 λ5, 4 λ5-дитиадифосфетанов под действием диметиламинотриметилсилана, гексаметилдисилтиана и гексаметилдиолово- сульфида, протекающие с образованием S-триметилсилил-N-диметил(фенил)амидоди- тиофосфоната, бис(триметилсилил)фенилтритиофосфоната и бис(триметилстаннил)трет-бутилтритиофосфоната соответственно
Ph-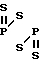 -Ph + Me3SiNMe
-Ph + Me3SiNMe h-
h-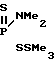
R-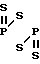 -R +(Me3E)2S
-R +(Me3E)2S R-
R-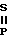 (SEMe3)2 где R = Rh, i-Bu; E = Si, Sn
(SEMe3)2 где R = Rh, i-Bu; E = Si, Sn
Однако, описанные в литературе реакции являются обратимыми. Поэтому продукты реакции не были выделены, так как разлагаются на исходные соединения уже при комнатной температуре.
В то же время реакции дитиадифосфетандисульфидов с алкилтиотриметилсиланами и алкоксидами триалкилолова не описаны в химической и патентной литературе. Целью изобретения является получение производных дитио- и тритиофосфо- новых кислот, содержащих не описанный, анизильный (т. е. пара-метоксифенильный) заместитель. Введение алкокси- и алкилтио-групп к атому фосфора в предложенных продуктах повышает их стабильность; они очищаются перегонками без разложения.
Поставленная цель решена описываемым способом получения S-триалкилсилиловых и станниловых эфиров 4-метоксифе- нилдитио- и тритиофосфоновых кислот, заключающемся в том, что 2,4-бис(4-метоксифенил)-2,4-дитиоксо-1,3,2 λ5, 4 λ5-дити- адифос- фетан подвергают взаимодействию с кремний и оловоорганическими производными, в качестве которых использованы алкилтиотриметилсиланы и алкоксиды триалкилолова, при температуре 15-20оС с последующим выделением целевых продуктов известными приемами.
Реакция протекает по следующей схеме
4-MeOC6H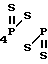 C6H4OMe-4+2R3EXR1_→2
C6H4OMe-4+2R3EXR1_→2 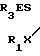 PC6H4OMe-4, где R, R1 - низший алкил; E - Si, Sn; X - O, S.
PC6H4OMe-4, где R, R1 - низший алкил; E - Si, Sn; X - O, S.
Строение полученных соединений подтверждено данными ИК-, ЯМР1Н и 31Р спектроскопии, масс-спектрометрии и элементного анализа.
Целевые продукты в сырых реакционных смесях образуются с выходами 84,5-92,3% . Продукты, очищенные перегонками, выделены с выходами 65,3-89,2% . Изобретение иллюстрируется следующими примерами.
П р и м е р 1. S-н-Пропил-S'-(триметилсилил)-4-метоксифенилтритиофосфонат. (1)
К 24,3 г (163,7 ммол) н-пропилтиотриметилсилана при перемешивании при 20оС добавляют порциями 33,1 г (81,9 ммол) 2,4-бис (4-метоксифенил)-2,4-дитиоксо-1,3,2 λ5, 4 λ5-дитиадифосфетана за 3 ч. Смесь перемешивают 6 ч при 20оС, вакуумируют при 1 и 0,06 мм рт. ст. 2 ч при 40оС. В остатке 49,3 г (86% ) неперегнанного S-н-пропил-S-(триметилсилил)-4-метоксифенилтритиофосфоната (1).
Найдено, % : С 45,01; Н 6,02; Р 8,23; S 26,56; Si 8,43.
C13H23POS3Si.
Вычислено, % : С 44,56; Н 6,64; Р 8,85; S 27,39; Si 7,99.
Из остатка на пленочном испарителе выделяют 37,4 г (65,3% ) S-н-пропил-S'-(триметилсилил)-4-метоксифенилтритиофосфо- ната (1) при температуре термоэлемента 150-160оС (0,05 мм рт. ст. ), d420 1,1347, nD20 1,6058.
Спектр ЯМР 31Р (ЯМР КГУ-4, 10,2 МГц от 85% -ной H3PO4): δp 69 м. д.
Спектр ПМР (Varian Т-60, 60 МГц, CCl4, внутренний стандарт CH2Cl2, δ, м. д. J, Гц): 0,54 (с, 9Н, CH3Si); 1,06 (т, 3Н, CH3CC, 3Jнн7,0); 1,43-1,90 (м, 2Н, С СН2С); 2,67-3,13 (м, 2Н, CH2S); 3,88 (с, 3Н, СН3O); 6,88 (д, д, 2Н, 3-Н2С6Н2, 3Jнн 9,0, 4Jp-н 4,5); 7,95 (д. д, 2Н, 2-Н2С6Н2, 3Jнн 9,0, 3Jpн 15,0). ИК-спектр (UR-20, жидкая пленка, KBr, ν, см-1): 3080 сл, 3010 сл ν (: C - HAr); 2970 ср, 2938 ср, 2915 пл, 2880 2845 сл ν (СН3as; s; CH2as, s) ν/CH3 (Si) s/, 1594 c, 1500 c, 1465 ср ν (C C Ar) , 1260 с δ/CH3(Si)s/, 851 о. с. ш. ρ/CH3(Si)/, 690 о. с ν (P= S), 540 ср, 510 ср ν (S-Si, P-S), ν (PS2s).
C Ar) , 1260 с δ/CH3(Si)s/, 851 о. с. ш. ρ/CH3(Si)/, 690 о. с ν (P= S), 540 ср, 510 ср ν (S-Si, P-S), ν (PS2s).
Найдено, % : С 44,76; Н 6,41; P 8,54; S 26,94; Si 7,69.
С13Н23OPS3Si.
Вычислено, % : С 44,56; H 6,64; P 8,85; S 27,39; Si 7,99.
П р и м е р 2. S-изо-Бутил-S'-(триметилсилил)-4-метоксифенилтритиофосфонат (2).
К 27,5 г (169,6 ммол) изо-бутилтиотриметилсилана при перемешивании при 20оС добавляют порциями 34,3 г (84,9 ммол) 2,4- бис(4-метоксифенил)-2,4-дитиоксо-1, 3, 2λ5, 4 λ5-дитиадифосфетана за 2 ч. Смесь перемешивают 9 ч при 20оС, вакуумируют при 1 и 0,03 мм рт. ст. 3 ч при 40оС. В остатке 52,2 г (84,5% ) неперегнанного S-изо-бутил-S'-(триметилсилил)-4-метоксифенилтритиофо- сфоната (2).
Найдено, % : С 46,80; Н 6,30; Р 8,03; S 26,98; Si 7,01.
С14Н25OPS3Si.
Вычислено, % : С 46,14; H 6,93; P 8,51; S 26,34; Si 7,68.
Из остатка на пленочном испарителе выделяют 46,7 г (75,6% ) S-изобутил-S'-(триметилсилил)-4-метоксифенилтритиофосфо- ната (2) при температуре термоэлемента 175-180оС (0,02 мм рт. ст. ), d420 1,1202, nD201,5979.
Спектр ЯМР 31Р (ЯМР КГУ-4, 10,2 МГц от 85% -ной H3PO4): δp71 м. д.
Спектр ПМР (Varian Т-60, 60 МГц, CCl4, внутренний стандарт CH2Cl2, δ, м. д. , J, Гц): 0,48 (с, 9Н, CH3Si); 1,03 (д, 6Н, СН3СС, 3Jнн 7,0 ); 1,57-2,93 (м, 3Н, CH, СН2); 3,87 (с, 3Н, СН3O); 6,86 (д. д. 2Н, 3-H2C6H2, 3Jнн 9,0 ); 7,96 (д. д. , 2Н, 2-Н2С6Н2, 3Jнн 9,0 3Jрн15,0 ).
ИК-спектр (UR-20, жидкая пленка, KBr, ν, см-1): 3070 сл, 3010 сл ν (: С-HAr), 2965 ср, 2935 пл, 2210 пл, 2840 сл ν (СН3as, s; CH2as, s), ν /CH3(Si)s/, 1595 c, 1500 ср, 1465 ср ν (C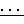 C Ar) , 1387 сл, 1370 сл, δ/(CH3)2Cгемs/, 1260 с /CH3(Si)s/, 851 с, ш, ρ/CH3(Si)/, 690 с. ш. ν (P= S), 540 ср, 510 ср ν (S-Si, P-S), ν(PS2S).
C Ar) , 1387 сл, 1370 сл, δ/(CH3)2Cгемs/, 1260 с /CH3(Si)s/, 851 с, ш, ρ/CH3(Si)/, 690 с. ш. ν (P= S), 540 ср, 510 ср ν (S-Si, P-S), ν(PS2S).
Найдено, % : С 46,32; Н 6,60; P 8,98; S 26,72; Si 7,25.
С14H25OPS3Si.
Вычислено, % : С 46,14; Н 6,93; P 8,51; S 26,34; Si 7,68.
П р и м е р 3. О-Метил-S-(триметилстаннил)-4-метоксифенилдитиофосфонат. (3).
К 9,0 г (46,2 ммол) метокситриметилолова в 30 мл бензола при перемешивании при 15оС добавляют порциями 9,3 г (23,0 ммол) 2,4-бис (4-метоксифенил)-2,4-дитиоксо-1,3,2 λ5, 4 λ5-дитиадифосфетана за 1 ч. Смесь вакуумируют при 1 и 0,03 мм рт. ст. 2 ч при 40оС. В остатке 16,5 г (90,2% ) неперегнанного О-метил-S-(триметилстаннил)-4-метоксифен- илдитиофосфоната (3).
Найдено, % : С 33,60; H 4,51; P 7,51; S 16,53; Sn 30,40.
C11H19O2PS2Sn.
Вычислено, % : С 33,27; Н 4,84; P 7,81; S 16,11; Sn 29,91.
Из остатка на пленочном испарителе выделяют 12,8 г (69,9% ) О-метил-S-(триметилстаннил)-4-метоксифенилдитиофосфо-ната (3) при температуре термоэлемента 160-175оС (0,02 мм рт. ст. ), d420 1,2376, nD201,6178.
Спектр ЯМР 31Р (ЯМР КГУ-4, 10,2 МГц от 85% -ной H3PO4): δp98 м. д.
Спектр ПМР (Varian T-60, 60 МГц, CCl4, внутренний стандарт CH2Cl2, δ, м. д. , J, Гц): 0,67 (с, 9Н, CH3Sn, д, 2J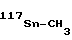 56 ; д,
56 ; д, 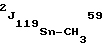 ); 3,77 (д, 3Н, СН3OP, 3Jрн 16,0 ); 3,86 (с, 3Н, СН3OC6H4); 6,92 (д. д. , 2Н, 3-H2C6H2, 3Jнн 9,0 4Jрн4,0 ); 7,92 (д. д, 2Н, 2-Н2С6Н2)
); 3,77 (д, 3Н, СН3OP, 3Jрн 16,0 ); 3,86 (с, 3Н, СН3OC6H4); 6,92 (д. д. , 2Н, 3-H2C6H2, 3Jнн 9,0 4Jрн4,0 ); 7,92 (д. д, 2Н, 2-Н2С6Н2) 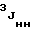 9,0
9,0 ). ИК- спектр (UR-20, жидкая пленка, KBr, ν, см-1): 3070 сл, 3010 сл ν (: C-H Ar); 2950 ср, 2920 сл, 2845 сл ν (СН3as, s; CH2as, s); 1598 ср, 1505 ср, 1470 ср ν (C
). ИК- спектр (UR-20, жидкая пленка, KBr, ν, см-1): 3070 сл, 3010 сл ν (: C-H Ar); 2950 ср, 2920 сл, 2845 сл ν (СН3as, s; CH2as, s); 1598 ср, 1505 ср, 1470 ср ν (C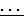 C Ar) ), 1035 о. с. ν/P-O-(C)/, 788 о. с. ρ (Sn-C), 684 ср ν (P= S), 538 c, 514 ср ν (Sn-C, P-S).
C Ar) ), 1035 о. с. ν/P-O-(C)/, 788 о. с. ρ (Sn-C), 684 ср ν (P= S), 538 c, 514 ср ν (Sn-C, P-S).
Найдено, % : С 32,93; Н 5,17; P 8,36; S 15,76; Sn 30,03.
С11Н19O2PS2Sn.
Вычислено, % : С 33,27; Н 4,84; P 7,81; S 16,11; Sn 29,91.
П р и м е р 4. О-Метил-S-(три-н-бутилстаннил)-4-метоксифенилдитиофосфонат. (4).
К 50,5 г (157,3 ммол) метокситри-н-бутилолова при перемешивании при 15оС добавляют порциями 31,8 г (78,7 ммол) 2,4-бис(4-метоксифенил)-2,4-дитиоксо-1,3,2 λ5, 4 λ5-дитиадифосфетана за 1 ч. Смесь вакуумируют при 1 и 0,02 мм рт. ст. 2 ч при 40оС. В остатке 75,1 г (89,5% ) неперегнанного О-метил-S-(три-н-бутилстаннил)-4-метоксифенилдитиофосфоната (4).
Найдено, % : С 46,33; Н 7,53; P 6,34; S 12,40; Sn 23,31; m/z (M+H)+525.
С20H37O2PS2Sn.
Вычислено, % : С 45,89; Н 7,15; P 5,92; S 12,22; Sn 22,70; m/z /М+H/+525.
Из остатка на пленочном испарителе выделяют 62,0 г (73,9% ) О-метил-S-(три-н-бутилстаннил)-4-метоксифенилдитиофос- фоната (4) при температуре термоэлемента 170-180оС (0,02 мм рт. ст. ), d420 1,2297; nD201,5233.
Спектр ЯМР 31Р (ЯМР КГУ-4, 10,2 МГц от 85% -ной H3PO4): δp 100 м. д.
Спектр ПМР (Varian T-60, 60 МГц, CCl4, внутренний стандарт CH2Cl2, δ, м. д. , J, Гц): 0,82-1,67 (м, 27Н, С4Н9Sn); 3,70 (д, 3Н, CH3OP, 3Jрн 15,0
); 3,77 (с, 3Н, СН3OC6H4); 6,85 (д. д. 2Н, 3-Н2С6Н2, 3Jнн 9,0 4Jрн4,0 ); 7,85 (д. д. 2Н, 2-H2C6H2, 3Jнн 9,0 4Jрн15,0 ). ИК-спектр (UR-20, жидкая пленка, KBr, ν, см-1): 3010 сл ν (: C-H Ar), 2960 ср, 2930 ср, 2880 сл, 2860 сл ν (СН3as, s; CH2as, s), 1598 ср, 1500 ср, 1465 ср ν (C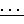 C Ar) , 1035 с ν /PO(C)/, 788 с ρ (Sn-C), 686 ср ν (P= S), 538 ср, 527 ср ν (Sn-C, P-S).
C Ar) , 1035 с ν /PO(C)/, 788 с ρ (Sn-C), 686 ср ν (P= S), 538 ср, 527 ср ν (Sn-C, P-S).
Найдено, % : С 45,44; Н 7,02; Р 5,99; S 11,96; Sn 22,95; m/z /M+H/+ 525.
С20Н37О2PS2Sn.
Вычислено, % : С 45,89; Н 7,15; P 5,92; S 12,22; Sn 22,70; m/z /M+H/+ 525.
П р и м е р 5. О-Этил-S-(три-н-бутилстаннил)-4-метоксифенилдитиофосфонат. (5).
К 17,0 г (50,9 ммол) этокситри-н-бутилолова при перемешивании при 15оС добавляли порциями 10,3 г (25,5 ммол) 2,4-бис(4-ме- токсифенил)-2,4-дитиоксо-1,3,2 λ5, 4 λ5-дитиадифосфетана за 1 ч. Смесь перемешивают 1 ч при 20оС, вакуумируют при 1 и 0,03 мм рт. ст. 2 ч при 40оС. В остатке 25,3 г (92,3% ) О-этил-S-(три-н-бутилстаннил)-4-метокси-фенилдитифосфоната (5).
Найдено, % : С 46,51; Н 7,71; P 5,03; S 12,40; Sn 22,49; m/z /M+H/+538.
C21H39O2PS2Sn.
Вычислено, % : С 46,93; H 7,33; Р 5,77; S 11,91; Sn 22,10; m/z /M+H/+538. Из остатка на пленочном испарителе выделено 22,1 г (80,7% ) О-этил-S-(три-н-бутилстаннил)-4-метоксифенилдитиофосфоната (5) при температуре термоэлемента 170-180оС (0,02 мм рт. ст. ), d420 1,2271, nD201,5608.
Спектр ЯМР 31Р (ЯМР КГУ-4, 10,2 МГц от 85% -ной H3PO4): δp 95 м. д.
Спектр ПМР (Varian T-60, 60 МГц, CCl4, внутренний стандарт CH2Cl2, δ, м. д. , J, Гц): 0,77-1,77 (м, 30Н, CH3 + C4H9Sn); 3,87 (с, 3Н, СН3OC6H4); 4,10 (д. к. , 2Н, CH2OP, 3Jнн 9,0 ); 6,87 (д. д. 2Н, 3-H2C6H2) 3Jнн 9,0 4Jрн4,0 ); 7,90 (д. д, 2Н, 2-H2C6H2), 3Jнн 9,0 4Jрн14,5 ). ИК-спектр (UR-20, жидкая пленка, KBr, ν см-1): 3070 сл (: C-H Ar), 2965 с, 2930 с, 2880 ср, 2860 ср ν (CH3as, s; CH2 as, s), 1598 c, 1505 cр, 1465 ср ν (C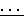 C Ar) , 1035 о. с. ν /PO-(C)/, 950 ср ν (ОС-С), 788 ср ρ (Sn-C), 675 о. с. ν (P= S), 555 ср, 535 с, 520 ср ν (Sn-C; P-S).
C Ar) , 1035 о. с. ν /PO-(C)/, 950 ср ν (ОС-С), 788 ср ρ (Sn-C), 675 о. с. ν (P= S), 555 ср, 535 с, 520 ср ν (Sn-C; P-S).
Найдено, % : С 47,02; Н 7,30; Р 5,65; S 11,68; Sn 21,84; m/z /M+H/+538.
С21Н39O2PS2Sn.
Вычислено, % : С 46,93; Н 7,33; P 5,77; S 11,91; Sn 22,10; m/z /M+H/+538. (56) Патент США N 3992425, кл. C 07 F 7/22, 1976.
Z. "Anorg. Allg. Chem. , 1977. B. 431, 221-226.
Z. "Anorg. Allg. Chem. , 1986. B. 543, N 12, 7-21.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ S-ДИАЛКИЛ, АЛКИЛФЕНИЛ- ИЛИ ДИФЕНИЛАРСИНИСТЫХ ЭФИРОВ 4-МЕТОКСИФЕНИЛДИТИОФОСФОНОВЫХ КИСЛОТ | 1997 |
|
RU2124520C1 |
| Способ получения S-триалкилстанниловых эфиров 0,0-диалкилдитиофосфорных кислот | 1990 |
|
SU1735299A1 |
| Способ получения S-триметилсилиловых эфиров дитио- или тетратиофосфорных кислот | 1990 |
|
SU1735300A1 |
| СПОСОБ ПОЛУЧЕНИЯ ДЛИННОЦЕПНЫХ S-АЛКИЛОВЫХ ЭФИРОВ О, О-ДИАЛКИЛДИТИОФОСФОРНЫХ КИСЛОТ, ОБЛАДАЮЩИХ АНТИКОРРОЗИОННОЙ АКТИВНОСТЬЮ | 2007 |
|
RU2337913C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИЙ ПОЛИЭФИРОВ АРИЛДИТИОФОСФОНОВЫХ КИСЛОТ И ИХ АММОНИЕВЫХ СОЛЕЙ ИЗ ГИПЕРРАЗВЕТВЛЕННЫХ ПОЛИЭФИРПОЛИОЛОВ, КОМПОЗИЦИИ ПОЛИЭФИРОВ АРИЛДИТИОФОСФОНОВЫХ КИСЛОТ И ИХ АММОНИЕВЫЕ СОЛИ, ОБЛАДАЮЩИЕ АНТИКОРРОЗИОННОЙ АКТИВНОСТЬЮ | 2009 |
|
RU2427584C2 |
| СПОСОБ ПОЛУЧЕНИЯ ДИЭТИЛАРСИНИСТЫХ ЭФИРОВ ДИИЗОБУТИЛТЕТРАТИОФОСФОРНОЙ КИСЛОТЫ | 1997 |
|
RU2132333C1 |
| ДЛИННОЦЕПНЫЕ АЛКИЛФОСФОНОВЫЕ КИСЛОТЫ В КАЧЕСТВЕ ИНГИБИТОРА КОРРОЗИИ МЯГКОЙ СТАЛИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2007 |
|
RU2337914C1 |
| Способ получения о,о-диалкил-о-хлорвинил- -арилимидофосфатов | 1970 |
|
SU326864A1 |
| ФОСФОРСЕРООРГАНИЧЕСКИЙ ИНГИБИТОР КОРРОЗИИ СТАЛИ НА ОСНОВЕ АЛЬФА-ОЛЕФИНОВ ПРОМЫШЛЕННОЙ ФРАКЦИИ C, C | 2011 |
|
RU2449056C1 |
| Способ получения диалкиловых эфиров @ -алкил- @ -нитроэтил-N-фенилимидофосфоновых кислот | 1980 |
|
SU928785A1 |
Сущность изобретения: 4-MeOC6H4P(S)(SER3)(XR′) где R′ E - Si, Sn, X = O, S. Реагент 1: 4-MeOC6H4P(S)-S-P(S)(C6H4OMe-4)-S : 2:R3EXR′ где R, R′ E, X как указано выше. Условия реакции: 15 - 20С.
Способ получения S-триалкилсилиловых и станниловых эфиров 4-метоксифенилдитио- или тритиофосфоновых кислот общей формулы
4-MeOC6H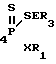
где R3 и R1 - низший алкил;
E - Si, Sn;
X - O, S,
отличающийся тем, что 2,4-бис-(4-метоксифенил)-2,4-дитиоксо- 1, 3, 2 λ5, 4 λ5 -дитиадифосфетан подвергают взаимодействию с алкилтиотриметилсиланами и/или алкоксидами триалкилолова общей формулы
R3EXR1,
где R3, R1, E и X имеют указанные значения,
при 15 - 20oС с выделением целевых продуктов известными приемами.
Авторы
Даты
1994-01-15—Публикация
1991-12-09—Подача