Изобретение относится к области биоорганической химии, а именно к новым соединениям дибромгидрату 6-(D-лейцил- L-пролил-L-аргинил)-аминонафталин-1-пентаметиленсульфамида (I) и его бензилоксикарбонил (Z-производному (II):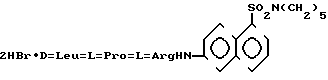 I
I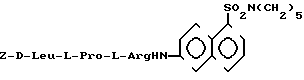 II в качестве субстратов для флуоресцентного определения фермента свертывания крови фактора IXa.
II в качестве субстратов для флуоресцентного определения фермента свертывания крови фактора IXa.
Флуорогенные субстраты для определения фактора IXa, имеющие эффективную детектируемую группу, отсутствуют.
Известны сложные тиоэфиры аминокислот или пептидов, например, тиобензоат Nα-карбобензокси-аргинина или -лизина, которые более часто используются при анализе фактора IXa (McRae et al. Biochemistry 1980, v. 19, Nr. 17, p. 3973). Во время ферментативного гидролиза они превращаются в тиолы, для детекции которых спектрофотометрическим методом используют второй компонент 4,4' -дитиопиридин (1) или 5,5' -дитиобис-(2-нитробензойную кислоту) (Green, G. D. J. et al. Anal. Biochem. 1979, v. 93, Nr. 2, p. 223). Последние соединения дорогие и труднодоступные.
Известные сложные тиоэфиры имеют ряд недостатков. Во-первых, они подвергаются спонтанному гидролизу в буферных растворах. Даже при высоких концентрациях фактора IXa уровень спонтанного гидролиза составляет ≈6% (см. пример 8) от ферментативного разложения субстрата. Это искажает результаты ферментативного гидролиза. Кроме того, использование их в двухкомпонентной системе усложняет определение и делает более дорогим метод анализа.
Целью изобретения является изыскание пептидных субстратов, позволяющих упростить и удешевить методику определения фактора IXа, а также повысить достоверность полученных результатов.
Цель достигается новыми соединениями 6-(D-лейцил-L-пролил-L-аргинил)аминонафталин-1-пентаметиленсульфамидом (I) или его Z-производным (II) в качестве субстратов для прямого определения фактора IXa. При использовании этих соединений отпадает необходимость употребления второго компонента для образования поглощающего соединения (см. пример 7). Резуль- таты анализа делаются более достоверными, так как субстраты I и II являются стабильными в буферных растворах (см. пример 9). Детектируемой группой предложенных субстратов является 6-аминонафталин-1-пентаметиленсульфамид, облада- ющий флуоресцирующими свойствами, что позволяет достоверно фиксировать его концентрацию на спектрофлуориметре "Нitachi MPF-4" до 0,05 мкМ. В случае прототипа Z-Lys-SBzl с использованием 4,4' -дитиопиридина минимальная определяемая концентрация (сmin) составляет 0,5 мкМ, а при использовании 5,5' -дитиобис-(2-нитробензойной кислоты) сmin= 0,74 мкМ. Минимальные концентрации расчитаны по формуле, приведенной в литературе (Булатов М. И. , Калинкин И. П. Практическое руководство по фотоколориметрическим и спектрофотометрическим методам анализа. Л. , Химия, 1976, с. 39):
cmin= 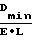 . Принимая l= 1 см и Dmin= 0,01 получаем: для 4,4' -дитиопиридина Е= 19800 М-1см-1 при λ= 324 нм
. Принимая l= 1 см и Dmin= 0,01 получаем: для 4,4' -дитиопиридина Е= 19800 М-1см-1 при λ= 324 нм
cmin=  = 5,05·10-7= 0,5 мкМ, для 5,5' -дитиобис-(2-нитробензойной кислоты)
= 5,05·10-7= 0,5 мкМ, для 5,5' -дитиобис-(2-нитробензойной кислоты)
Е= 13600 М-1см-1 при λ= 412 нм
cmin=  = 7,4·10-7= 0,74 мкМ.
= 7,4·10-7= 0,74 мкМ.
Таким образом, в случае флуорогенного 6-аминонафталин-1-пентаметиленсульфа-мида (в предложенных субстратах) удается достоверно фиксировать концентрации в 10 раз меньше, чем в прототипе, т. е. 0,05 мк вместо (0,5-0,74) мкМ.
Синтез субстратов, их стабильность и гидролиз фактором IХа иллюстрируются примерами.
П р и м е р 1. 6-фталимидонафталин-1-пентаметиленсульфамид.
Растворяют 11 мл (0,11 моль) пиперидина и 14 мл (0,1 моль) триэтиламина в 500 мл ацетона, добавляют в течение 10 мин 37,1 г (0,1 моль) 6-фталимидонафталин-1-сульфонилхлорида и перемешивают при 20оС 4 ч. Ацетон отгоняют, остаток заливают 1 л воды, отсасывают продукт, промывают водой, сушат, перекристаллизовывают из метанола и получают 39,3 г (выход 94% ) продукта с т. пл. 165-169оС.
Найдено, % : С 65,88; Н 4,84; N 6,61; S 7,41
С23Н20N2SO4
Вычислено, % : С 65,7; Н 4,79; N 6,66; S 7,62
П р и м е р 2. 6-Аминонафталин-1-пентаметиленсульфамид.
Заливают 42,0 г (0,1 моль) 6-фталимидонафталин-1-пентаметиленсульфамида 450 мл метанола, прикапывают 5 мл (0,1 моль) гидразингидрата и кипятят 4,5 ч. Метанол отгоняют, остаток экстрагируют 2х200 мл кипящего хлороформа, экстракт упаривают и остаток перекристаллизовывают из метанола. Получают 23,5 г (выход 81% ) продукта с т. пл. 138-143оС. Rf= 0,78 (хлороформ-этилацетат 1: 1). ПМР (ДМСО): 1,30 (СН2), 2,96 (СН2).
Найдено, % : С 62,22; Н 6,37; N 9,52; S 10,21
С15Н18N2SO2
Вычислено, % : С 62,05; Н 6,25; N 9,65; S 11,04
П р и м е р 3. Бромгидрат 6-(Nα-бензилоксикарбонил)-L-аргиниламинонафталин-1-пентаметиленсульфамид.
Растворяют 3,89 г (0,01 моль) бромгидрата Nα-бензилоксикарбонил-L-аргинина и 2,90 г (0,01 моль) 6-аминонафталин-1-пентаметиленсульфамида в 15 мл сухого пиридина, добавляют 30 мл сухого толуола и последний отгоняют. Реакционную смесь охлаждают до -20оС и добавляют раствор 2,22 г (0,11 моль) дициклогексилкарбодиимида (ДЦК) в 6 мл сухого пиридина. Реакционную смесь выдерживают при -20оС в течение 0,5 ч, при 4оС в течение 1 ч и при 20оС в течение 20 ч. Отсасывают выпавшую дициклогексилмочевину, упаривают пиридин и остаток растворяют в 40 мл смеси хлороформ-пропанол (3: 1). Раствор промывают 15 мл воды, 15 мл насыщенного водного NaCl, содержащего 1 мл конц. НСl, 15 м 2% -ного водного аммиака и 15 мл воды, высушивают над безводным Na2SO4. Растворители отгоняют, остаток растирают с эфиром, отсасывают, высушивают и перекристаллизовывают из пропанола. Получают 6,15 г (выход 93% ) продукта с т. пл. 117-123оС, Rf= 0,71 (бутанол-уксусная кислота-вода 4: 1: 2) (БУВ 412), /α/D20-12,8о (с 1; СН3ОН), ПМР (ДМСО): 1,30 (СН2), 2,99 (СН2).
Найдено, % : С 52,65; Н 5,79; N 12,50; S 4,23; Br 11,23
C29Н37N6BrSO5
Вычислено, % : С 52,65; Н 5,64; N 12,70; S 4,85; Br 12,10
П р и м е р 4. Бромгидрат 6-L-аргиниламинонафталин-1-пентаметиленсульфамида.
Растворяют 6,62 г (0,01 моль) бромгидрата 6-(бензилоксикарбонил)-L-аргиниламинонафталин-1-пентаметиленсульфамида в 10 мл 3N HBr в ледяной уксусной кислоте и выдерживают при 20оС в течение 1,5 ч. Реакционную смесь выливают в 100 мл сухого эфира, выпавший осадок отсасывают, промывают эфиром, сушат. Сухой осадок растворяют в 10 мл воды, добавляют 50 мл бутанола и при встряхивании порциями по 15 мл 5% -ный водный NaHCO3 до рН ≈7,5 водного слоя. Органический слой промывают 2х10 мл воды, бутанол упаривают, остаток растирают с эфиром, отсасывают, промывают эфиром, сушат и перекристаллизовывают из метанола. Получают 4,91 г (выход 93% ) продукта с т. пл. 121-130оС, /α/D20-1,2о (с 1; ДМСО), Rf= 0,48 (БУВ 412). ПМР (ДМСО): 1,30 (СН2), 3,00 (СН2).
Найдено, % : С 47,93; Н 6,01; N 15,81; S 5,76; Br 15,44
C21H31N6SBrO3
Вычислено, % : С 47,82; Н 5,92; N 15,93; S 6,08; Br 15,15
П р и м е р 5. 6-(Бензилоксикарбонил-D-лейцил-L-пролил-L-аргинил) аминонафталин-1-пентаметиленсульфамид (II).
Растворяют 0,86 г (2,5 ммоль) Z-D-Leu-L-Pro-OH, 0,35 г (2,5 ммоль) 1-гидроксибензотриазола и 0,51 г (2,5 ммоль) ДЦК в 18 мл охлажденного до -20оС сухого диметилформамида (ДМФА). Реакционную смесь выдерживают при -20оС в течение 0,5 ч, при 4оС 1 ч и заливают охлажденный до 4оС раствор 1,32 г (2,5 ммоль) бромгидрата 6-L-аргиниламинонафталин-1-пентаметиленсу- льфамида в 10 мл ДМФА. Перемешивают при 20оС в течение 20 ч, отсасывают выпавшую дициклогексилмочевину, фильтрат выливают в 125 мл воды, и образовавшуюся суспензию экстрагируют 5х15 мл смеси этилацетат-бутанол (1: 1). Органический слой промывают 3х12 мл 5% -ного водного NaHCO3, 10% -ного водного КНSO4 и воды, растворители упаривают, остаток растирают с эфиром, отсасывают, промывают эфиром, сушат. Получают 1,77 г (выход 92% ) хроматографически чистого целевого продукта с т. пл. 167-172оС, /α/D20-9,9о (с 1; ДМСО), Rf= 0,69 (БУВ 412). ПМР (ДМСО): 1,30 (СН2), 3,00 (СН2), 5,01 (СН2, Z), 7,32 (С6Н5, Z).
П р и м е р 6. Дигидробромид 6-(D-лейцил-L-пролил-L-аргинил)-аминонафталин-1-пентаметиленсульфамида (I).
Растворяют 0,79 г (1 ммоль) соединения II в 5 мл 3N HBr в ледяной уксусной кислоте и выдерживают при 20оС в течение 2 ч. Реакционную смесь выливают в 50 мл сухого эфира, выпавший осадок отсасывают, промывают эфиром, сушат. Получают 0,70 г (выход 85% ) хроматографически чистого целевого продукта с т. пл. 210-222оС, /α/D20-20,9о (с 1; ДМСО), Rf= 0,44 (БУВ 412). ПМР (ДМСО): 1,35 (СН2), 3,05 (СН2).
П р и м е р 7. Гидролиз субстратов I и II фактором IXа.
Приготавливают 1 мкМ раствора 6-аминонафталин-1-пентаметиленсульфамида в 0,1 М трис. -НСl буфера, рН 8,0, 0,1 М NaCl и при 25оС измеряют флуоресценцию λвозб.= 352 нм). В кювету флуориметра помещают 1 мкМ раствора субстрата 1 в 0,1 М трис. НСl буфера. рН 8,0, 0,1 М NaCl, термостатируют при 25оС, добавляют раствор фактора IXа в том же буфере в концентрации 0,1 мкМ и измеряют рост флуоресценции при λ= 470 нλ возб.= 352 нм). Фиксируют время, необходимое для 10% -ного гидролиза, которое равно 21 мин.
Аналогично проводят реакцию соединения II с фактором IXа, фиксируют время 10% -ного гидролиза 24 мин.
П р и м е р 8. Проверка стабильности Z-Lys-SBzl (прототип).
А. Раствор Z-Lys-SBzl, концентрация которого составляет 100 мкМ, в 0,1 М трис. -НСl буфере, рН 8,0, 0,1 М NaСl, помещают в кювету спектрофотометра и термостатируют при 25оС. Добавляют раствор 5,5' -дитиобис-(2-нитробензойной) кислоты (ДТНБ)2 (концентрация в растворе 2 ммоль/л) и измеряют увеличение оптической плотности при λ= 412 нм (D412) в течение времени. Увеличение D412 за 1 ч, составляет 0,156, т. е. ΔD412/1мин = 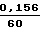 = 0,0026.
= 0,0026.
Б. В такой же раствор, как в опыте А, вместо (ДТНБ)2 добавляют фактор IXа (концентрация в растворе 0,1 мкМ) и аналогично измеряют рост D412. Увеличение D412 за 3,3 мин составляет 0,136, т. е.
ΔD412/1мин =  = 0,0412.
= 0,0412.
Таким образом, спонтанное разложение субстрата Z-Lys-SBzl при 0,1 мкМ фактора IXа составляет: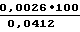 = 6,3% от ферментативного его разложения.
= 6,3% от ферментативного его разложения.
П р и м е р 9. Проверка стабильности соединений I и II.
Приготавливают 1 мкМ и 100 мкМ растворы дибромгидрата 6-(D-лейцил-L-пролил-L-аргинил)-аминонафталин-1-пентаме-тиленсульфамида (I) в 0,1 М трис. -НСl буфере, рН 8,0, 0,1 М NaCl, помещают в термостатированную при 25оС кювету флуориметра и измеряют флуоресценцию при λ= 470 нм λвозб.= 352 нм). Флуоресценция отсутствует. Измерение повторяют в течение 10 ч, через каждые 24 ч в течение 10 дней. Увеличение флуоресценции не замечено.
Аналогично проводят измерение стабильности соединения (II). Флуоресценция также не замечена.
Примеры 7-9 показывают, что предложенные дибромгидрат 6-(D-лейцил-L-пролил-L-аргинил)аминонафталин-1-пентаме- тиленсульфамида или 6-(бензилоксикарбонил-D-лейцил-L-пролил-L-аргинил)амино- нафталин-1-пентаметиленсульфамид являются стабильными в буферных растворах. Время гидролиза фактором IXа равно 21 и 24 мин соответственно. Их детектируемая группа обладает флуоресцирующими свойствами.
Указанные свойства обеспечивают следующие преимущества предложенных соединений по сравнению с прототипом при их использовании в качестве субстратов для определения фактора IXа: упрощение метода анализа фактора IXa за счет исключения необходимости использования дополнительного дорогого второго компонента для детекции; увеличение достоверности результатов анализа; достоверную фиксацию концентрации в 10 раз меньше, чем в прототипе, обусловленную использованием флуоресцентного метода (характеристики прибора).
Изобретение относится к области биоорганической химии, а именно к новым соединениям дибромгидрату 6-(D-лейцил-L-пролил-L-аргинил), аминонафталин-1-пентаметиленсульфамида (1) и его бензилоксикарбонил (Z)-производному (2). Сущность изобретения состоит в том, что новые соединения являются стабильными в буферных растворах. Время гидролиза фактором IXa равно 21 и 24 мин соответственно. Их детектируемая группа обладает флуоресцирующими свойствами. Все указанные свойства обеспечивают преимущество предложенных соединений по сравнению с прототипом при их использовании в качестве субстратов для определения фактора IXa упрощается метод анализа фактора IXa за счет исключения необходимости использования дополнительного дорогого второго компонента для детекции, увеличивается достоверность результатов анализа, а фиксация концентрации в 10 раз меньше, чем в прототипе, обусловленная использованием флуоресцентного метода (характеристика прибора).
Производные 6-/D-лейцил- L-пролил-L-аргинил/ -аминонафталин-1 -пентаметиленсульфамиды общей формулы
RDLeuLProhArgHN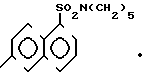

где R = H, X = 2HBr,
R - бензилоксикарбонил, x - отсутствует. в качестве субстратов для флуоресцентного определения фактора IXа.
Авторы
Даты
1994-05-30—Публикация
1991-03-19—Подача