Изобретение относится к новым химическим соединениям, обладающим ценными фармацевтическими свойствами, и касается 5,6-дигидро-2- (замещенный фенил)-1,2,4-триазин- 3,5-[2Н, 4Н] -дионов, обладающих противококсидиальной и коксидиостатической активностью. Известны 2-фенил-асимметричн. триазин-3,5-[2Н, 4Н] -дионы, применяемые для борьбы с коксидиозом (см. патент США 3912723).
Соединения по изобретению обладают более высокой активностью, чем указанные известные соединения. Таким образом, объектом изобретения являются 5,6-дигидро-2- (замещенный фенил)-1,2,4- триазин-3,5-[2H,4H]-дионы общей формулы I
R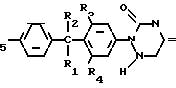 O где R1 - водород, алкил С1-С4;
O где R1 - водород, алкил С1-С4;
R2 - циано-группа или группа СООН;
R3 - галоген или алкил С1-С4;
R4 - галоген или водород;
R5 - галоген или (С1-С4) алкилокси-группа, обладающие противококсидиальной и коксидиостатической активностью.
В приведенных определениях термин "галоген" является родовым термином для фтора, хлора, брома и иода; термин "С1-С4-алкил" включает в себя насыщенные углеводородные радикалы с прямой и разветвленной цепью с количеством атомов углерода 1-4, например метил, этил, 1-метилэтил, 1,1-диметилэтил, пропил, бутил и т.п.
Соединения формулы I могут быть целесообразно получены при помощи реакции восстановления соответствующего 1,2,4-триазин- 3,5-(2Н, 4Н)-диона формулы II
Реакция восстановления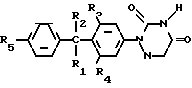 __→
__→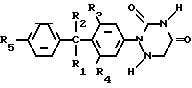
Указанная реакция восстановления может быть целесообразна осуществлена известными методами превращения 1,2,4-триазин-3,5 (2Н,4Н)-диона в 5,6-дигидро-1,2,4-триазин-3,5 (2Н,4Н)-дионовую часть молекулы.
Указанная реакция восстановления может быть, например, осуществлена путем приведения в контакт исходного материала формулы (II) с водородом в присутствии соответствующего катализатора, например, никеля Ренея, платины, палладия, оксида платины (IV) и т.п. Предпочтительно указанную реакцию восстановления осуществляют путем приведения во взаимодействие исходного материала формулы (II) с цинком в уксусной кислоте или хлоридом олова (II) в соляной кислоте, необязательно в присутствии инертного в данной реакции органического растворителя или смеси таких растворителей, например низшего спирта, например, метанола или этанола; углеводорода, например, метилбензола или диметилбензола; кетона, например, 2-пропанона, 1-бутанона; простого эфира, например, тетрагидрофурана, 1,2-диметоксиэтана, 1,4-диоксана; сложного эфира, например, этилацетата; N,N-диметилформамида, N,N-диметилацетамида; пиридина; уксусной кислоты. Для ускорения реакции может быть применена повышенная температура.
Принимая во внимание их исключительно высокую активность в борьбе с коксидиями, соединения по изобретению весьма пригодны для уничтожения или предотвращения роста коксидий у теплокровных животных. Следовательно, соединения формулы I особенно пригодны в качестве противококсидиальных агентов, а также в качестве коксидиостатиков.
Благодаря полезным противококсидиальным и коксидиостатическим свойствам соединения по изобретению могут быть введены в сочетании с любым твердым, полутвердым или жидким разбавителем или носителем, как описано выше. Кроме того, благодаря полезной коксидиостатической активности соединения по изобретению можно смешивать с любым видом корма для теплокровных животных, а также их можно принимать растворенными в питьевой воде.
Примеры, приведенные с целью пояснения изобретения, ни в коей мере не ограничивают его объем.
При отсутствии других указаний все части даны по массе.
А) Получение промежуточных соединений.
П р и м е р 1. К 66 ч. концентрированного раствора серной кислоты добавляют по частям в течение 5 мин 10 ч. 2,6-дихлор- alpha<N> -(4-хлорфенил)-4-(4,5-дигидро-3,5 -диоксо-1,2,4-триазин-2(3Н)- ил)бензолацетонитрила при 60оС. По окончании добавления перемешивание продолжают в течение 1,5 ч при 90оС. После охлаждения реакционную смесь выливают в воду со льдом. Продукт отфильтровывают, промывают водой и обрабатывают малым количеством теплого N,N-диметилформамида до гомогенности. Смесь охлаждают до комнатной температуры, добавляют 48 ч. метанола и кристаллизуют продукт. Его отфильтровывают, промывают метанолом и высушивают в вакууме с получением 9,8 ч (92,2% ) 2,6-дихлор- alpha<N> -(4-хлорфенил)-4-(4,5- дигидро-3,5-диоксо-1,2,4,-триазин- 2(3Н)-ил)бензолацетамида; т.пл. 276,4оС.
П р и м е р 2. Смесь 13,2 ч. 2,6-дихлор- alpha<N> -(4-хлорфенил)-4- (4,5-дигидро-3,5-диоксо-1,2,4- триазин-2(3Н)-ил)бензолацетамида, 648 ч. концентрированной соляной кислоты и 200 ч. уксусной кислоты перемешивают с рефлюксом в течение 224 ч. Полученный продукт отфильтровывают, промывают водой и растворяют в 100 ч. воды. После обработки раствором гидроксида натрия полученный раствор подкисляют концентрированной соляной кислотой. Продукт отфильтровывают и очищают методом колоночной хроматографии на силикагеле с применением в качестве элюента смеси метилбензола, тетрагидрофурана и уксусной кислоты (70:30:1 по объему). Чистые фракции собирают и элюент выпаривают, получают 3,8 ч. (27,8%) 2,6-дихлор- alpha<N> -(4-хлорфенил)-4- (4,5-дигидро-3,5-диоксо- 1,2,4-триазин-2(3Н)-ил) бензолуксусной кислоты; т. пл. 219,5 оС.
П р и м е р 3. а) К перемешиваемой смеси 4 ч. 2,6-дихлор- alpha<N> -(4-хлорфенил)-4-(4,5-дигидро-3,5-диоксо- 1,2,4-триазин-2(3Н)-ил)бензолацетонитрила, 1,4 ч. карбоната калия и 22,5 ч. N,N-диметилформамида добавляют 2,84 ч. иодметана при комнатной температуре. Реакционную смесь перемешивают в течение 1,5 ч. при 40оС. После выпаривания в вакууме остаток растворяют в воде. Выпавший в осадок продукт отфильтровывают и промывают водой. После кристаллизации из ацетонитрила продукт отфильтровывают, промывают 2,2'-оксибиспропаном и высушивают, получают 2,5 ч. (59,2%) 2,6-дихлор- alpha<N> -(4-хлорфенил)-4- (4,5-дигидро-4-метил-3,5- диоксо-1,2,4-триазин- 2(3Н)-ил)бензолацетонитрила; т.пл. 159,7оС.
б) При температуре обратного холодильника перемешивают раствор 20,2 ч. 2,6-дихлор- alpha<N> -(4-хлорфенил)-4- (4,5-дигидро-4-метил-3,5- диоксо-1,2,4-триазин-2(3Н)-ил)- бензолацетонитрила в 250 ч. уксусной кислоты, к нему добавляют порциями 30 ч. цинка в течение 1 ч. По окончании добавления смесь перемешивают 3 ч при температуре обратного холодильника, затем концентрируют до 1/20 объема и концентрат размешивают в воде. Осажденный продукт промывают водой после фильтрования и растворяют в трихлорметане. Остаточную воду удаляют, органический слой высушивают, профильтровывают и выпаривают. Остаток дважды очищают методом колоночной хроматографии на силикагеле с использованием трихлорметана в качестве элюента. Чистые фракции собирают, элюент выпаривают с получением 20,3 ч. (99,8%) 2,6-дихлор- alpha<N> -(4-хлорфенил)-4-(3,4,5,6-тетрагидро- 4-метил-3,5-диоксо-1,2,4- триазин-2(1Н)-ил)бензолуксусной кислоты.
В) Получение целевых соединений
П р и м е р 4. К перемешиваемому раствору 1,5 ч. 2,6-дихлор- alpha<N> -(4-хлорфенил)-4-(4,5-дигидро-3,5- диоксо-1,2,4-триазин-2(3Н)- ил)-бензолуксусной кислоты в 100 ч. уксусной кислоты в условиях кипения с обратным холодильником добавляют 3 ч. цинка. Перемешивание продолжают 30 мин при температуре кипения с обратным холодильником. Соли цинка отфильтровывают и фильтрат упаривают. Остаток промывают водой, после чего твердый продукт отфильтровывают и растворяют в смеси трихлорметана и метанола (90:10 по объему). Раствор осушают, фильтруют и упаривают. Остаток промывают этилацетатом и 2,2'-оксибиспропаном и сушат, получая 0,98 части (67,2%) 2,6-дихлор- alpha<N> -(4-хлорфенил)-4- (3,4,5,6-тетрагидро-3,5-диоксо- 1,2,4-триазин-2(1Н) -ил)бензолуксусной кислоты; т.пл. 194,2оС (соединение I).
П р и м е р 5. К перемешиваемой смеси 1,5 ч. 2-хлор-4-(4,5-дигидро-3,5-диоксо- 1,2,4-триазин-2(3Н)-ил)- alpha<N> -(4-фторфенил)- alpha<N> -метил-бензолацетонитрила и 75 ч уксусной кислоты в условиях кипения с обратным холодильником порциями добавляют 3 ч. цинка на протяжении 30 мин. После завершения добавления перемешивание продолжают 3 ч при кипении с обратным холодильником. Реакционную смесь фильтруют в горячем состоянии и фильтрат концентрируют в вакууме до одной десятой части его объема. К концентрату добавляют воду. Осажденный продукт отфильтровывают и очищают хроматографией в колонке на силикагеле с использованием смеси трихлорметана и метанола (95: 5 по объему) в качестве элюента. Чистые фракции собирают и элюент отгоняют в вакууме. Остаток кристаллизуют из ацетонитрила. Продукт отфильтровывают, промывают 2,2-оксибиспропаном и сушат с получением 0,8 части (53,6% 2-хлор- alpha<N> -(4-фторфенил)-alpha<N> -метил-4-(3,4,5,6-тетрагидро- 3,5-диоксо-1,2,4-триазин-2(1Н)- ил)-бензолацетонитрила; т.пл. 122,5оС (соединение 2).
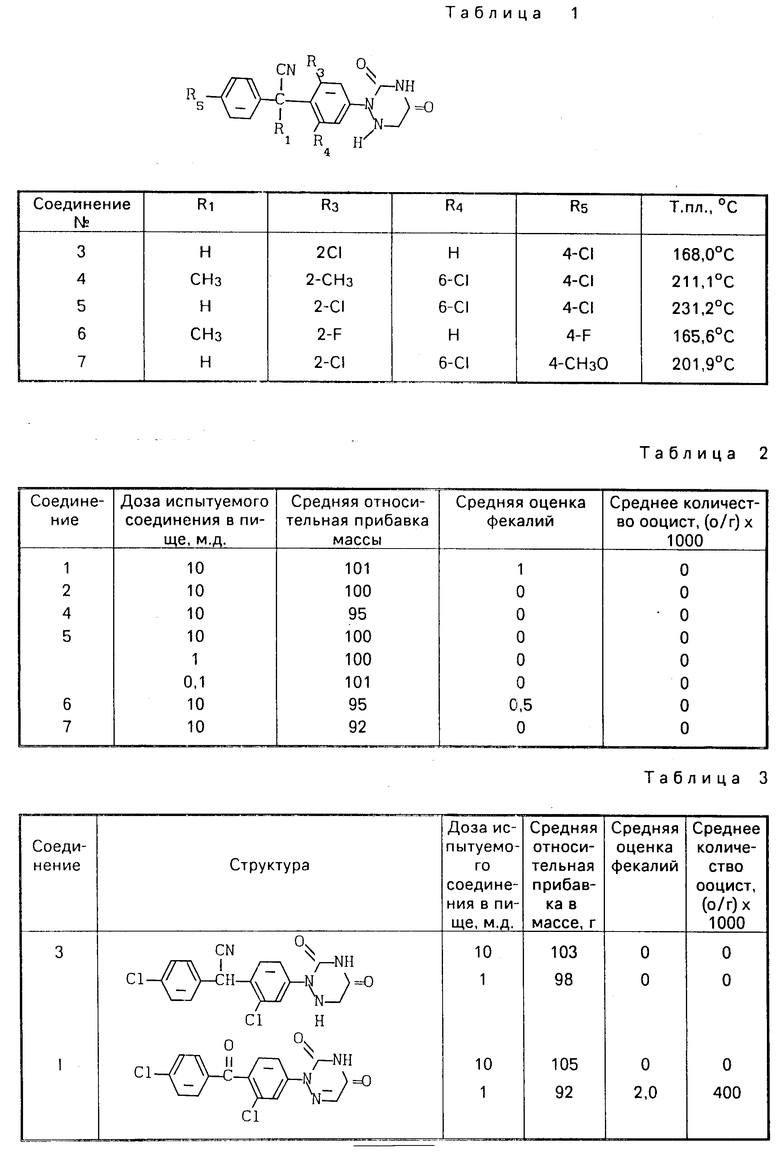
П р и м е р 6. По методикам примеров 4 и 5, используя подходящие исходные материалы, получают следующие соединения, представленные в табл. 1.
С) Фармакологические примеры
Высокую антипротозоальную активность соединений формулы (I) их фармацевтически приемлемых кислотоаддитивных солей, из полученных реакций замещения солей металлов или аминов и их возможных стереохимически изомерных форм доказывают данные, полученные в результате следующих экспериментов. Эти данные приведены только с целью иллюстрации ценных антипротозоальных свойств всех соединений, охватываемых настоящим изобретением, и ни в коей мере не ограничивают настоящее изобретение ни по объему восприимчивых простейших, ни по объему формулы I
П р и м е р 7. Схема испытания антикокцидиальной эффективности в отношении Eimeria tenella.
Цыплята Hisex получали коммерческий основной рацион, не содержащий коксидиостатического агента. 18-Суточные цыплята были разделены на группы по два цыпленка. Вода подавалась автоматически и содержащая лекарственный препарат пища давалась по потребности от дня введения инфекции (день 0) до седьмого (исключительно) дня после введения инфекции. Пища, не содержащая лекарственного препарата, давалась по потребности двум группам, состоящим каждая из 4 птиц, с целью контроля неинфицированных и инфицированных цыплят.
Пища, не содержащая лекарственного препарата, представляет собой коммерческий основной рацион, не содержащий коксидиостатического агента. Пища, содержащая лекарственный препарат, приготовлена из не содержащей лекарственного препарата пищи путем тщательного перемешивания последней с определенным количеством испытуемого соединения.
В день 0 птицы заражены орально 105 спорулированными ооцистами Eimeria tenella. На 5-й день сделана оценка фекалий по следующей шкале:
0 = отсутствие пятен крови
1 = 1-2 пятна крови
2 = 3-5 пятен крови
3 = более 5 пятен крови.
На 7-ой день определяют продуцирование ооцист путем сбора фекалий и подсчета количества ооцист на 1 г фекалий (о/г) и птиц взвешивают.
В табл. 2 в третьем столбце представлено среднее относительное увеличение массы в процентах по сравнению с контрольными неинфицированными цыплятами. В четвертом столбце представлена средняя оценка фекалий, а в пятом - среднее количество ооцист.
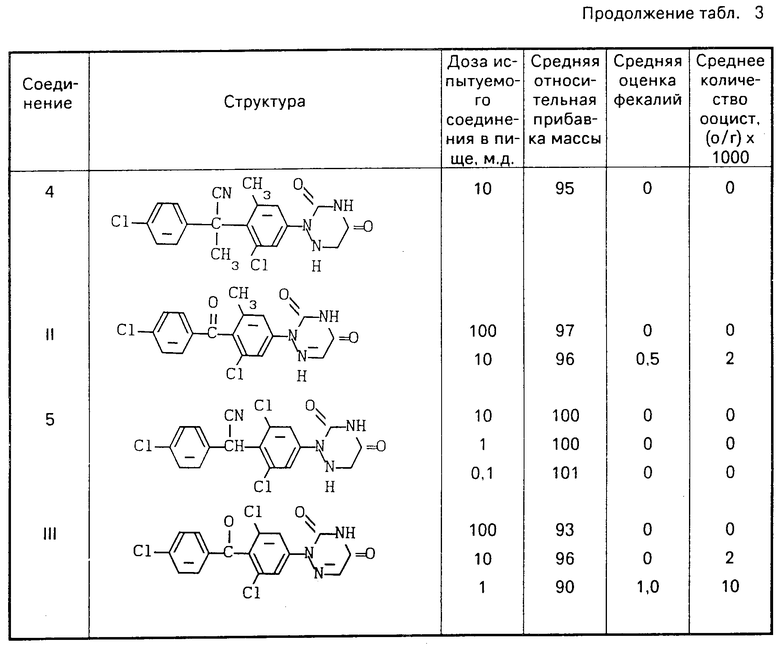
Данные, полученные в тесте на Eimeria tenella, представлены в табл. 3.
Соединения 3, 4, 5 получены согласно изобретению.
Соединения I, II и III являются структурно наиболее близкими соединениями из патента США 3912723.
Использование: в ветеринарии, в частности в качестве веществ, обладающих противококсидальной и коксидиостатической активностью. Сущность изобретения: продукт - 5,6-дигидро-2-(замещенный фенил)-1,2,4-триазин-3,5-[2Н, 4Н] -дион общей ф-лы I 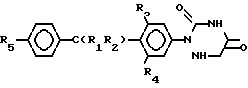 , где R1 - C1-C4 -алкил; R2 - циано или карбоксил; R3 - галоил или C1-C4 -алкил; R4 - водород или галоид, R5 - галоид или C1-C4 -алкоксиггруппа. Реагент 1: соответствующий ненасыщенный 1,2,4-триазин ф-лы 2
, где R1 - C1-C4 -алкил; R2 - циано или карбоксил; R3 - галоил или C1-C4 -алкил; R4 - водород или галоид, R5 - галоид или C1-C4 -алкоксиггруппа. Реагент 1: соответствующий ненасыщенный 1,2,4-триазин ф-лы 2 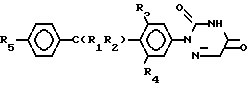 . Реагент 2: водород. Условия реакции: гидрирование ведут в присутствии катализатора гидрирования. 3 табл.
. Реагент 2: водород. Условия реакции: гидрирование ведут в присутствии катализатора гидрирования. 3 табл.
5,6-Дигидро-2-(замещенный фенил)-1,2,4-триазин-3,5-(2Н, 4Н)-дионы общей формулы
где R1 - водород, C1-C4-алкил;
R2 - цианогруппа или группа СООН;
R3 - галоген или C1-C4-алкил;
R4 - галоген или водород;
R5 - галоген или C1-C4-алкилоксигруппа,
обладающие противококсидиальной и коксидиостатической активностью.
| Патент США N 3912723, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Колосниковая решетка с чередующимися неподвижными и движущимися возвратно-поступательно колосниками | 1917 |
|
SU1984A1 |
Авторы
Даты
1994-08-15—Публикация
1987-01-16—Подача