Изобретение относится к новому способу получения 5-гидроксипиразинкарбоновой кислоты и/или ее солей из пиразинкарбоновой кислоты и/или ее солей с использованием микроорганизмов, выращенных с никотиновой кислотой и/или ее солей.
В последующем под никотиновой кислотой, пиразинкарбоновой и 5-гидроксипиразинкарбоновой кислотой следует понимать также их соли, например соли щелочных металлов или соли аммония.
5-Гидроксипиразинкарбоновую кислоту можно применять, например как промежуточный продукт, для получения фармацевтических средств, в частности для получения пиразин-нуклеозидных аналогов с цитостатическим действием (M. Bobek, J. Heterocylic Chem. 1991, 28, с. 1131).
Известно, что 5-гидроксипиразинкарбоновая кислота образуется в процессе обмена веществ у собак и людей из пиразинамида через пиразинкарбоновую кислоту [J. Pharmacol Exp. Ther. 1972, 180(2), 411-434]
5-Ступенчатый химический способ получения 5-гидроксипиразинкарбоновой кислоты из фурфурилглиоксаля был описан, (например в J. Heterocyclic Chem. 19, 1982, с. 402). Способ, однако, имеет существенный недостаток, состоящий в том, что он не может быть применен в крупном промышленном масштабе.
Микробиологический способ получения 5-гидроксипиразинкарбоновой кислоты до сих пор не был известен.
Задача изобретения создание простого, экономичного и экологически чистого способа получения 5-гидроксипиразинкарбоновой кислоты.
Согласно настоящему изобретению в способе получения 5-гидроксипиразинкарбоновой кислоты и/или ее солей осуществляют биотрансформацию пиразинкарбоновой кислоты и/или ее соли в целевой продукт с помощью микроорганизмов, выращенных с использованием никотиновой кислоты и/или ее солей в качестве единственного источника углерода, азота и энергии, причем целевой продукт аккумулируют в реакционной среде.
Предпочтительно проводить биотрансформацию с помощью штамма бактерий Pseudomonas acidovarans DSM 4746, Achromobacter xylosoxydans DSM 2783, Pseudomonas putida NCIB 10521.
Предпочтительно также вести процесс при однократном или постоянном добавлении пиразинкарбоновой кислоты и/или ее соли до достижения концентрации ее в среде не более 20 мас.
Причем целесообразно биотрансформацию проводить в анаэробных условиях при pH 4 10 и температуре 10 60oC.
В принципе для проведения способа могут быть использованы все микроорганизмы, способные разрушать никотиновую кислоту через 6-гидроксиникотиновую кислоту. Эти микроорганизмы могут быть выделены с помощью обычных микробиологических методик, например из очистных установок, с никотиновой кислотой в качестве субстрата. Могут быть использованы семейства типа Pseudomonas, Achromobacter, BBacillus, Azorhizobium, Sarcina и Mycobacterium, уже описанные в Европейской патентной заявке N 152948. Реакцию можно проводить со смесями, а также с чистыми изолятами этих микроорганизмов, в стерильных или нестерильных условиях.
Наиболее предпочтительно использовать следующие виды микроорганизмов:
Pseudomonas acidovorans DSM 4746,
Achromobacter xylosoxydans DSM 2402,
Achromobacter xylosoxydans DSM 2783,
Pseudomonas putida NCIB 10521,
Pseudomonas putida NCIB 8176,
а также их потомство и мутанты. Оптимальным в этом смысле является Pseudomonas acidovorans DSM 4746.
Микроорганизмы Pseudomonas acidovorans DSM 4746 25 июля 1988 г. передали в Германскую коллекцию микроорганизмов и клеточных структур ГМбх.
Микроорганизмы Achromobacter xylosoxydans DSM 2402 и DSM 2783 также хранятся в описанном выше институте и описаны в Европейской патентной заявке EP-A N 152948.
Микроорганизмы вида Pseudomonas putida NCIB 10521 и NCIB 8176 хранятся в Национальной коллекции Института бактерий в Шотландии.
Обычно перед началом собственно реакции проводится выращивание (культивирование) микробов или индукция микроорганизмов в присутствии никотиновой кислоты.
Преимущественно культивирование (выращивание) и индукцию осуществляют в присутствии никотиновой кислоты, которая служит единственным источником углерода, азота и энергии.
Перед подачей субстрата (пиразинкарбоновой кислоты) микроорганизмы либо отделяют с применением обычных способов отделения и ресуспендируют в новую среду, ибо субстрат (пиразинкарбоновую кислоту) добавляют непосредственно к микроорганизмам в первоначальной питательной среде. Для представляемого способа суспензию клеток целесообразно доводить до оптической плотности 650 нм, от 1 до 100, предпочтительно от 10 до 30.
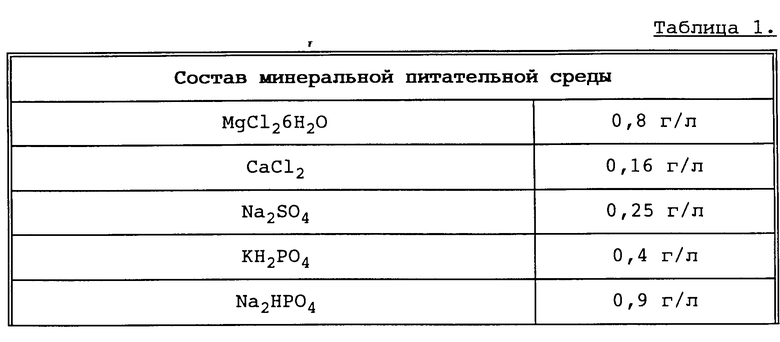
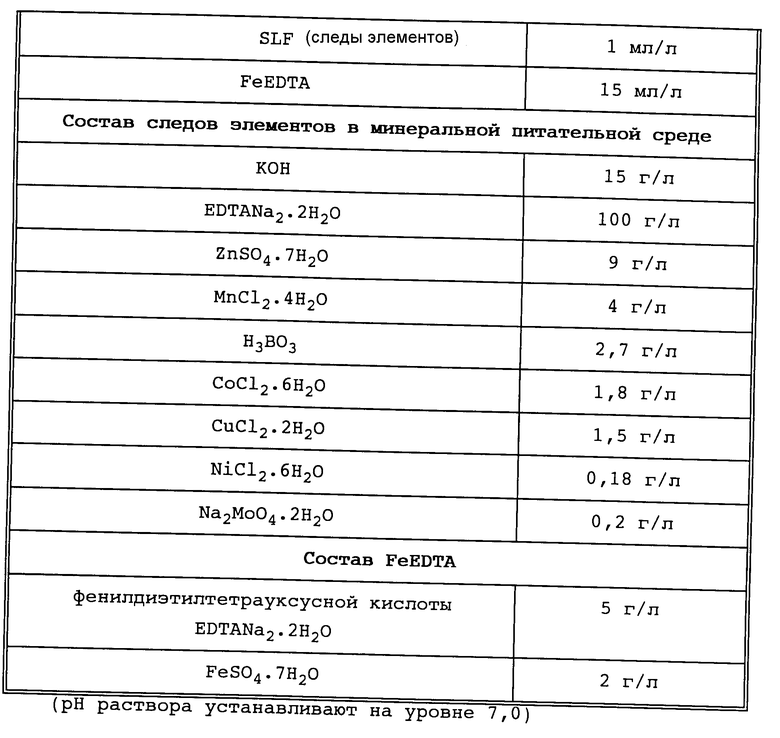
В качестве сред как для культивирования, так и для собственно биотрансформации применяют известные для этих целей среды. Оптимальным можно считать применение сред, состав которых представлен в табл. 1.
Субстрат (пиразинкарбоновую кислоту) можно добавлять однократно или же непрерывным методом.
Наиболее целесообразно добавку субстрата осуществлять таким образом, чтобы концентрация субстрата не превышала 20 мас. предпочтительно 5 мас. Обычно реакция пиразинкарбоновой кислоты и/или ее солей протекает с клетками, находящимися в состоянии покоя.
Реакцию рекомендуется проводить в аэробных условиях при pH от 4 до 10, предпочтительно от 6 до 8.
Температура должна лежать в пределах от 10 до 60oC, предпочтительно от 15 до 45oC.
Обычная продолжительность реакции 4 100 ч, после чего продукт осаждают путем подкисления соответствующим раствором и выделяют с применением обычных методов обработки. В случае натриевой соли 5-гидроксипиразинкарбоновой кислоты продукт осаждают уже в ходе реакции.
Пример 1. Pseudomonas acidovorans DSM 4746 выращивают в минеральной питательной среде (см. табл. 1) при непрерывном добавлении никотината натрия (0,6 г/л/ч) в ферментере при pH 7,0 и температуре от 30oC до оптической плотности при 650 нм порядка 10.
Затем клетки отделяют с помощью центрифуги и суспендируют в 2 л раствора, содержащего 1 моль (146 г) натриевой соли пиразинкарбоновой кислоты с pH 7,0.
Оптическая плотность при 650 нм составляет 20.
По истечение инкубационного периода, 16 ч, в аэробных условиях при pH 7,0 и температуре 30oC с использованием способа УФ-спектроскопи, обнаружить аддукты не удалось. Часть образовавшейся соли 5-гидроксипиразинкарбоновой кислоты выкристаллизовывалась уже при этих условиях. Выпавший в осадок продукт вместе с биомассой отделяют на центрифуге.
Образовавшийся осадок затем ресуспендируют в 500 мл воды и снова отделяют методом центрифугирования.
Затем не содержащий клеток продукт (верхний слой) соединяют и концентрируют в ротационном испарителе до 300 мл и охлаждают до 0oC. Образующиеся кристаллы отфильтровывают, высушивают. В общей сложности можно выделить 0,67 моль (108 г) натриевой соли 5-гидроксипиразинкарбоновой кислоты, что соответствует выходу 67% в перерасчете на использованную натриевую соль пиразинкарбоновой кислоты.
Пример 2. Pseudomonas acidovorans DSM 4746 культивируют в минеральной питательной среде (см. табл. 1) при непрерывном добавлении никотината натрия (0,6 г/л/ч) в ферментере при pH 7,0 и температуре 30oC до оптической плотности при 650 нм порядка 10.
Затем клетки отделяют методом центрифугирования и ресуспендируют в 100 мл раствора, содержащего 0,056 моль (7,9 г) аммониевой соли пиразинкарбоновой кислоты, pH 7,0.
Оптическая плотность при 650 нм составляет тогда 20.
По истечении инкубационного периода, 24 ч, при аэробных условиях, при pH 7,0 и температуре 30oC методом УФ-спектроскопии, аддукта обнаружить не удалось.
Затем не содержащий клеточной структуры верхний слой подкисляют концентрированной серной кислотой до pH 2,0 с целью осаждения 5-гидроксипиразинкарбоновой кислоты. После этого суспензию охлаждают до 4oC и фильтруют.
Остаток от фильтрования дважды промывают 10 мл воды и высушивают.
В общей сложности получают 0,054 моль (7,56 г) 5-гидроксипиразинкарбоновой кислоты, что соответствует выходу 96% на введенную аммониевую соль пиразинкарбоновой кислоты. Содержание 5-гидроксипиразинкарбоновой кислоты составляет более 90% по данным жидкостной хромотографии высокого разрешения (HPLC).
Пример 3. Микроорганизм Bacillus sp. выращивали как описано в работе Ensign Rittenberg (J. Biol. Chem. т.239, N 7, 1964, с. 2285).
Затем клетки отделяют центрифугированием в соответствии с примером 1 и переводят в минеральную питательную среду (см. табл. 1), содержащей 0,65 моль (94,9 г) натриевой соли пиразинкарбоновой кислоты. Биотрансформация происходит при тех же аналогичных условиях, что и в примере 1. В общей сложности может быть выделено 0,34 моль (54,8 г) 5-гидроксипиразинкарбоновой кислоты, что соответствует выходу 52,3%
Примеры 4 и 5. Микроорганизмы Achromobacter xylosoxydans DSM 2783 и Pseudomonas putida NCIB 10521 выращивали так, как описано в Европейской заявке EP-A-152 N 948, и затем проводили биотрансформацию так, как описано в примере 1, (результаты представлены в табл. 2).

Использование: биотехнология. Сущность изобретения: описан микробилогический способ получения 5-гидроксипиразинкарбоновой кислоты и/или ее солей из пиразинкарбоновой кислоты и ее солей в качестве субстрата с помощью микроорганизмов, выращенных с никотиновой кислотой и/или ее солями как единственным источником углерода. Используются бактерии Pseudomonas acidovorans, Achromobacter xylosoxydans. Процесс биотрансформации ведут при pH 4 - 10 и 10 - 60oC. 5 з. п. ф-лы, 2 табл.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Bobek M | |||
| Heterocyclis J | |||
| Chem., 1991, 28, 1131 | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| J | |||
| Pharmacol Exp | |||
| Rer., 1972, 180(2), 411 - 434 | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| J | |||
| Heterocyclis Chem., 19, 1982, 402 | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| EP, заявка, 152948, кл | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| J | |||
| Biol | |||
| Chem., 239, N 7, 1964, 2285. | |||
Авторы
Даты
1997-10-27—Публикация
1992-06-19—Подача