Изобретение относится к биотехнологии и позволяет получать высокоочищенный препарат лимфотоксина.
Лимфотоксин (фактор некроза опухолей β) биологически активный гликопротеин, продуцируемый Т-лимфоцитами в ответ на бактериальную или вирусную инфекцию. Среди большого многообразия биологических свойств этого лимфотоксина наибольшее значение имеет его противоопухолевая, противовирусная и иммуномодулирующая активность. Все это позволяет рассматривать лимфотоксин как перспективный лекарственный препарат для лечения онкологических, вирусных заболеваний и иммунодефицитов различной этиологии. В этой связи важной задачей является разработка способов получения высокоочищенного лимфотоксина, позволяющих получать биологически активный препарат в достаточно больших количествах.
Известны способы получения рекомбинантного лимфотоксина.
Недостатками известных способов получения лимфотоксина из клеток E.coli являются многостадийность процесса очистки, что является нетехнологичным и нередко приводит к снижению выхода и активности целевого продукта. Использование в ряде способов иммобилизованных моноклональных или других специфических антител ограничивает применение очищенного таким способом лимфотоксина в качестве медицинского препарата.
Наиболее близким к предлагаемому решению является способ, описанный в пат. Ер 0230781, 1987.
Недостатком способа, описанного в прототипе, является многоступенчатость процедуры выделения и очистки лимфотоксина из клеток E.coli, что приводит к низкой технологичности и эффективности способа в целом а также снижает выход целевого продукта.
Задачей изобретения является разработка более продуктивного и простого способа получения высокоочищенного и биологически активного рекомбинантного лимфотоксина человека.
Поставленная задача решается путем культивирования штамма-продуцента с последующим выделением и очисткой целевого продукта, причем в качестве продуцента используется штамм E.coli ВКПМ В-5279, который получают непосредственно перед культивированием, культивирование проводят при 30-32оС в течение 20-24 ч в L-бульоне, содержащем 20 мкг/см3 хлорамфеникола, экстракцию лимфотоксина осуществляют путем ультразвуковой дезинтеграции биомассы клеток, очистку проводят с использованием гель-фильтрации на сефадексе G-150 и ионообменной хроматографии на DEAE-TSK 250F-геле и СМ-сефадексе А-25.
Наиболее принципиальные особенности нового способа получения лифотоксина заключаются в следующем:
свежие трансформанты штамма-продуцента получают непосредственно перед культивированием, что значительно повышает выход конечного продукта;
культивирование проводят при пониженной температуре 30-32оС и незначительной аэрации в течение 22-24 ч. В таких условиях основная часть синтезируемого клетками лимфотоксина находится в растворимой форме;
дезинтеграцию биомассы клеток осуществляют с помощью ультразвука без внесения лизоцима или других лизирующих клетки соединений, затрудняющих последующую процедуру очистки;
использование на этапе гель-фильтрации на сефадексе G-150 безсолевого буферного раствора позволяет непосредственно перейти к стадии ионообменной хроматографии, минуя стадии концентрирования и диализа;
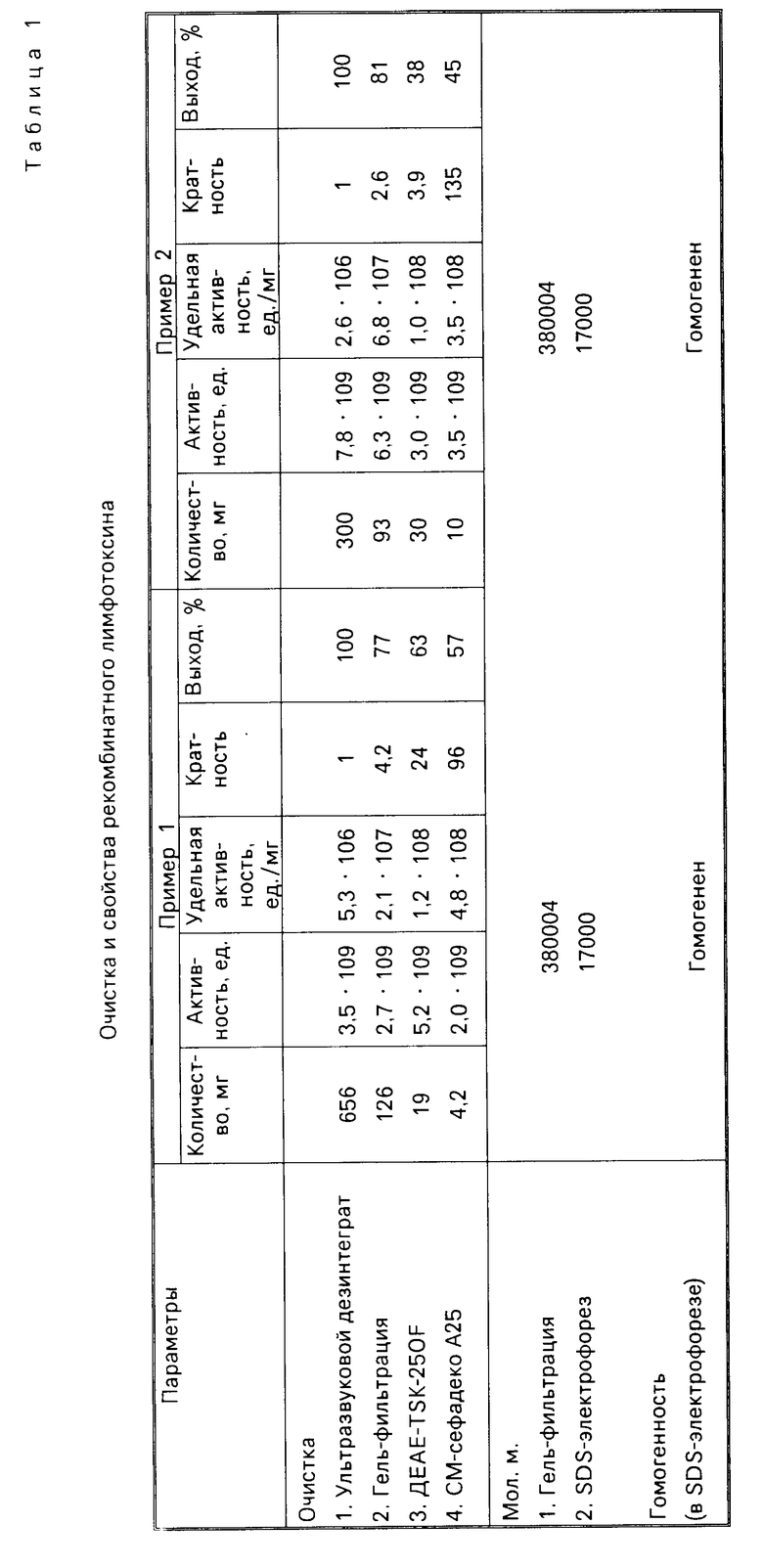
весь процесс очистки включает четыре стадии в отличие от прототипа, где используют шесть этапов очистки;
выход лимфотоксина из 1 г биомассы в 6,5 раз, а удельная активность очищенного новым способом рекомбинантного лимфотоксина приблизительно в 10 раз выше описанных в прототипе.
Предлагаемый способ по сравнению с прототипом является более простым, продуктивным и экономичным.
Способ осуществляется следующим образом.
1. Трансформация.
Получение свежих клеток штамма-продуцента E.coli ВКПМ В-5279 осуществляют традиционным способом.
2. Культивирование.
К 10 см3 L-бульона, содержащего 20 мг/см3 хлорамфеникола, добавляют 1,0 см3 трансформационной смеси и инкубируют при 37оС. Через 12 ч клетки пересевают на 1 ч в 100 см3 свежего L-бульона, а затем весь материал переносят в сосуд с 4000 см3 L-бульона с хлорамфениколом и инкубируют 20-24 ч при 30-32оС и умеренной аэрации.
3. Выделение лимфотоксина из клеток.
Выросшие клетки собирают центрифугированием. Осадок ресуспендируют в 0,01 М трис-НС буфере (рН 8,0), содержащем 0,1 М NaCl, из расчета 20,0 г клеток на 100 см3 буфера. Клетки разрушают на холоду путем десятикратной ультразвуковой обработки суспензии в течение 30 с с интервалом 60 с. Полученный дезинтеграт осветляют центрифугированием при 20000 об/мин в течение 30 мин и надосадок, содержащий растворимый лимфотоксин, используют для дальнейшей очистки.
4. Хроматография на сефадексе G-150.
Экстракт клеток, содержащий лимфотоксин, наносят на колонку с сефадексом G-150, уравновешенную 0,01 М трис-HCl буфером (рН 8,0). Элюирование проводят со скоростью 20 см3/ч тем же буфером. Фракции, содержащие лимфотоксин, объединяют и используют для дальнейшей очистки.
5. Хроматография на DEAE-TSK геле.
Препарат лимфотоксина, полученный на предыдущей стадии, наносят на колонку с DEAE-TSK-250F, уравновешенную 0,01 М трис-HCl буфером (рН 8,0), со скоростью 20 см3/ч. Колонку промывают тем же буфером. Элюирование проводят линейным градиентом концентрации хлористого натрия со скоростью 10 см3/ч. Фракции, содержащие лимфотоксин, объединяют и диализуют против 0,01 М Na-ацетатного буфера (рН 6,0).
6. Хроматография на СМ-сефадексе.
Препарат лимфотоксина после диализа наносят на колонку с СМ-сефадексом А-25, уравновешенную 0,01 М Na-ацетатным буфером (рН 6,0) со скоростью 20 см3/ч. Элюирование осуществляют линейным градиентом концентрации хлористого натрия со скоростью 10 см3/ч. Фракции, содержащие лимфотоксин, объединяют, диализуют против 0,01М Na-ацетатного буфера (рН 6,0) и хранят замороженным при температуре минус 70оС.
П р и м е р 1. Трансформацию клеток E.coli с получением штамма-продуцента осуществляли традиционным способом. К 10 см3L-бульона, содержащего 20 мг/см3 хлорамфеникола, добавляли 1,0 см3трансформационной смеси и инкубировали при 37оС и 100 об/мин. Через 12 ч клетки пересевали на 1 ч в 100 см3 свежего L-бульона, а затем весь материал переносили в сосуд с 4000 см3 L-бульона, содержащего 20 мг/см3хлорамфеникола, и инкубировали 20 ч при 30-32оС и умеренной аэрации. Выросшие клетки собирали центрифугированием. Осадок в количестве 20 г ресуспендировали в 100 см3 0,01 М трис-HCl буфере (рН 8,0), содержащем 0,1М NaCl. Клетки разрушали на холоду путем десятикратной ультразвуковой обработки суспензии в течение 30 с с интервалом 60 с. Дезинтеграт осветляли центрифугированием при 20000 об/мин в течение 30 с и 35,0 см3надосадка, содержащего лимфотоксин, наносили на колонку с сефадексом G-150, уравновешенную 0,01 М трис-HCl буфером (рН 8,0). Элюирование проводили со скоростью 20 см3/ч тем же буфером. Фракции в количестве 90 см3, содержащие лимфотоксин, наносили на колонку с DEAE-TSK-250F, уравновешенную 0,01 М трис-HCl буфером (рН 8,0), со скоростью 20 см3/ч. Элюирование проводили градиентом концентрации хлористого натрия (0-1 М) со скоростью 10 см3/ч. Фракции, содержащие лимфотоксин, объединили, диализовали против 0,01 М Na-ацетатного буфера (рН 6,0) в течение 18 ч.
44 см3 отдиализованного лимфотоксина наносили на колонку с СМ-сефадексом А-25, уравновешенную 0,01 М Na-ацетатным буфером (рН 6,0) со скоростью 20 см3/ч, промывали тем же буфером, элюирование осуществляли линейным градиентом концентрации хлористого натрия (0-1 М) со скоростью 10 см3/ч. Собранную активную фракцию составляющую 67 см3, диализуют против 0,01 М Na-ацетатного буфера (рН 6,0) и хранят при температуре минус 70оС.
П р и м е р 2. Культивирование штамма, выделение и очистку лимфотоксина проводили аналогично примеру 1, за исключением того, что культивирование проводили при 30оС в течение 24 ч.
В результате осуществления способа согласно примерам 1 и 2 получают электрофоретически гомогенные препараты рекомбинантного лимфотоксина. Оценку биологической активности полученных препаратов проводят в традиционном тесте цитотоксичности на клетках мышиных фибробластов линии L-929 в присутствии актиномицина D и выражают в единицах активности на 1 мг белка. За одну единицу активности принимают такое количество белка, которое вызывает лизис 50% клеток L-929. Данные по выделению двух препаратов лимфотоксина и их характеристики представлены в табл. 1.
Полная аминокислотная последовательность лимфотоксина следующая:
M tLeuAlaHisSerThrLeuLysProA
tLeuAlaHisSerThrLeuLysProA AlaHisLeuIleGlyAspProSerLysG
AlaHisLeuIleGlyAspProSerLysG AsnSer
AsnSer
LeuLeuTrpArgAlaAsnThrA ArgAlaPheLeuGlnAspGlyPheSerL
ArgAlaPheLeuGlnAspGlyPheSerL SerAsnAsnSer
SerAsnAsnSer
LeuLeuValProThrS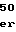 GlyIleTyrPheValTyrSerGlnV
GlyIleTyrPheValTyrSerGlnV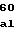 ValPheSerGlyLysAlaTyr
ValPheSerGlyLysAlaTyr
SerProLysA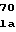 ThrSerSerProLeuTyrLeuAlaHisG
ThrSerSerProLeuTyrLeuAlaHisG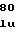 ValGlnLeuPheSerSerGlnTyr
ValGlnLeuPheSerSerGlnTyr
ProP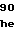 HisValProLeuLeuSerSerGlnLys
HisValProLeuLeuSerSerGlnLys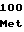 ValTyrProGlyLeuGlnGluProTrp
ValTyrProGlyLeuGlnGluProTrp
HisSerMetTyrHisGlyAlaAlaPhe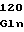 LeuThrGlnGlyAspGlnLeuSerThr
LeuThrGlnGlyAspGlnLeuSerThr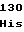 ThrAsp
ThrAsp
GlyIleProHisLeuValLeu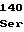 ProSerThrValPhePheGly
ProSerThrValPhePheGly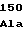 PheAlaLeu
PheAlaLeu
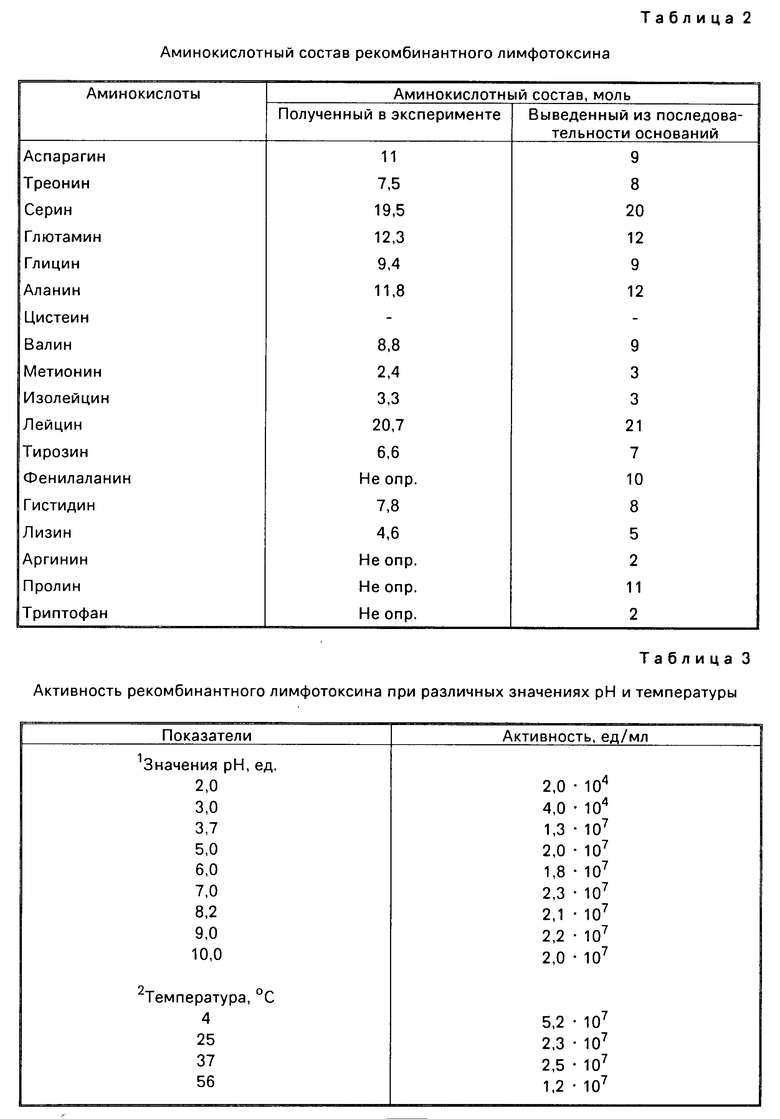
Соответствие аминокислотного состава ожидаемому подтверждают аминокислотным анализом выделенного рекомбинантного лимфотоксина. Результаты определения аминокислотного состава лимфотоксина после гидролиза 6н. HCl при 110оС в течение 24 ч представлены в табл. 2. Рекомбинантный лимфотоксин, как и природный, характеризуется высокой стабильностью в широком диапазоне рН и температуры. Данные по влиянию указанных параметров на биологическую активность рекомбинантного лимфотоксина представлены в табл. 3.
Специфическая кроличья антисыворотка к лимфотоксину нейтрализует биологическую активность рекомбинантного лимфотоксина при инкубации в течение 1 ч при температуре 37оС (табл. 4).
Рекомбинантный лимфотоксин проявляет противоопухолевую и противовирусную активность. В качестве модели для проверки противоопухолевого действия рекомбинантного лимфотоксина использована перевиваемая опухоль мышей С 57 В 1/6 МХ 11 (индуцированная метилхолантреном).
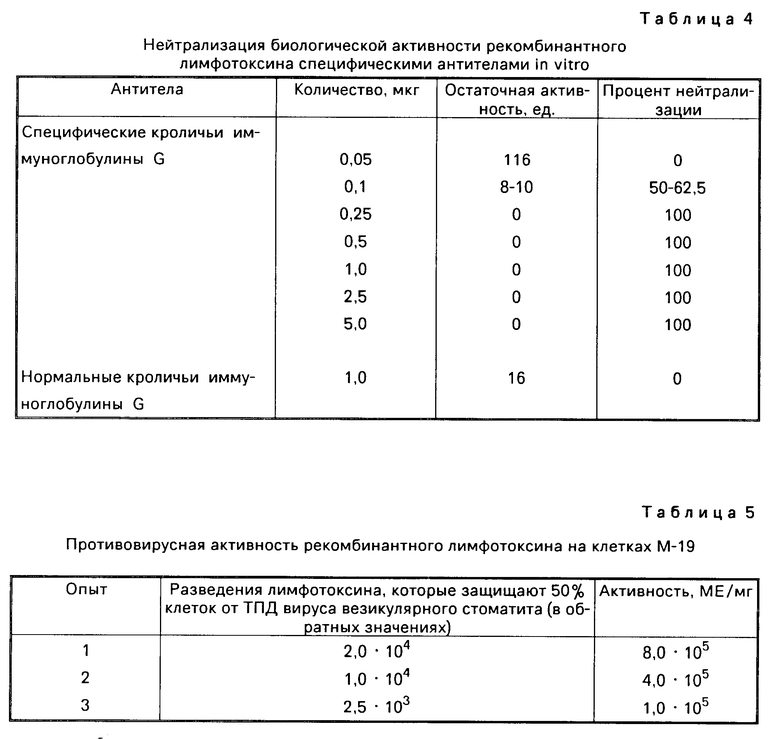
На чертеже представлена динамика изменения веса опухолевой ткани после пятикратного ежедневного введения рекомбинантного лимфотоксина.
Кривая А контроль, кривая Б лимфотоксин (1000 ед/мышь).
Проверка противовирусной активности рекомбинантного лимфотоксина проведена с использованием стандартной методики на клетках эмбриональных фибробластов человека М-19 и вируса везикулярного стоматита штамма Индиана. Активность выражают в международных единицах на 1 мг белка. В качестве контроля используют стандартный препарат гамма-интерферона. Результаты представлены в табл. 5.
Таким образом, предлагаемое изобретение позволяет более простым и экономичным способом получать рекомбинантный продукт, который по физико-химическим и основным биологическим свойствам соответствует лимфотоксину человека, с более высокой удельной активностью и конечным выходом.
Использование: биотехнология, медицина. Сущность изобретения: полученный непосредственно перед использованием штамм-продуцент лимфотоксина человека E.coli ВКПМ-5279 культивируют при температуре 30 32°С в течение 20 24 ч в L-бульоне, содержащем 20 мкг/см3 хлорамфеникола, клетки разрушают ультразвуком, отделяют клеточный остаток, а очистку рекомбинантного лимфотоксина из надосадочной жидкости проводят путем гель-фильтрации на сефадексе G-150 и ионообменной хроматографии на DEAE TSK 250 F-геле и CM-сефадексе а-25. 1 ил. 5 табл.
СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ЛИМФОТОКСИНА ЧЕЛОВЕКА, включающий культивирование штамма-продуцента, полученного путем трансформации Escherichia coli рекомбинантной плазмидой, содержащей последовательность природного гена лимфотоксина человека, разрушение клеток методом ультразвуковой обработки, отделение клеточного остатка и хроматографическую очистку целевого продукта, отличающийся тем, что в качестве штамма-продуцента используют штамм E. coli ВКПМ-5279, который получают непосредственно перед культивированием, культивирование осуществляют при 30-32oС в течение 20-24 ч в Z-бульоне, содержащем 20 мкг/см3 хлорамфеникола, а очистку проводят с использованием гель-фильтрации на сефадексе G 150 и ионообменной хроматографии на ЕАЕ-ТSК 250 F-геле и СМ-сефадексе А-25.
| Европейский патент N 0230781 кл | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
Авторы
Даты
1995-07-20—Публикация
1992-07-29—Подача