Изобретение относится к области иммунологии и может быть использовано для экспрессной индикации бактериальных средств при возникновении очага бактериального заражения.
Известен способ постановки реакции пассивной гемагглютинации при индикации бактериальных средств, который включает титрование исследуемого материала в разводящей жидкости, внесение эритроцитарных диагностикумов и наблюдение за формированием эритроцитами диагностикумов на днищах емкостей типичной картины окончания реакции (Инструкция по применению серологических методов диагностики при эпизоотологическом обследовании природных очагов чумы. Саратов, 1974 г. с. 38-39).
Недостатком этого способа является длительность реакции (2-4 ч), что не позволяет его использование для экспрессной индикации.
Кроме того, эритроцитарные диагностикумы обладают недостаточностью при длительном хранении, собственной антигенностью, нестандартностью физико-химических свойств, что снижает точность индикации бактериальных средств.
В последнее время в стране и за рубежом активно применяют полимерные микрочастицы с заданными физико-химическими свойствами, на основе которых получают диагностические препараты.
Например, испытания лиофилизированного полимерного иммуноглобулинового диагностикума при обнаружении и идентификации возбудителя туляремии и объемных реакциях агломерации (РАС) по типу реакции непрямой гемагглютинации (РНГА) показали соответствующие медикобиологическим требованиям результаты по активности, специфичности и чувствительности препарата.
Реакция демонстративна, стабильна, легко учитывается за счет яркой окраски препарата (современные аспекты природной очаговости, эпидемиологии и профилактики особо опасных инфекционных болезней. Тезисы докладов научной конференции, Омск, октябрь, 1993 г. Ставрополь, 1993 г. с.214-215).
Однако учет результатов реакции осуществляется через 1,5-2,0 ч, что не обеспечивает экспрессность метода.
Наиболее близким по технической сущности к заявляемому изобретению является выбранный в качестве прототипа способ диагностики возбудителя чумы по обнаружению капсульного антигена в реакции агглютинации латексного антительного диагностикума (Рудник М.П. Груднева Л.Г. Экспресс-диагностика возбудителя сумы с использованием реакции агглютинации латекса. Проблемы природно-очаговых и зоонозных инфекций в Сибири и на Дальнем Востоке. Тезисы докладов к региональной научно-практической конференции 16-17 сентября 1993 г. Чита, 1993 г. с.134-135).
Этот способ включает постановку двух отдельных серологических реакций, проводимых объемным и капельным методами и осуществляется следующим образом.
Серодиагностику капсульного антигена проводили путем постановки реакции агглютинации латекса по типу РНГА объемным методом в лунках планшета для иммунологических реакций с микробными взвесями возбудителя чумы или с раствором антигена, с использованием диагностикума чумного иммуноглобулинового полиакролеинового. Учет результатов реакции проводили через 1,5-2,0 ч по формированию типичной картины скончания реакции ("зонтики", "пуговки").
Экспресс-диагностику проводили путем постановки реакции агглютинации капельным методом на стекле, осуществляя учет результатов реакции через 4-15 мин по видимым хорошо сформированным агглютинатам с полным просветлением жидкости.
У прототипа и заявляемого способа имеются следующие сходные существенные признаки.
Проведение реакции агглютинации внесением иммуноглобулинового полиакролеинового диагностикума с последующим учетом результатов реакции.
Недостатком прототипа является неудовлетворительная точность экспресс-диагностики. Учет результатов реакции, выполняемый капельным методом на стекле, возможен в течение 4-15 мин с момента ее постановки, поскольку через 30 мин появляются спонтанные агглютинаты с отрицательных контролях. Кроме того, постановка серологической реакции капельным методом сопряжена с необходимостью отдельного проведения раститровки исследуемого материала, с возможностью растекания капель на поверхности стекла и смешиванию с соседними, что приводит к нестандартным условиям образования и учета комплексов.
Учет более точных результатов объемной реакции непрямой суспензионной агглютинации РНСА возможен через 304,0 ч, что не обеспечивает экспрессность способа.
Целью изобретения является обеспечение экспрессной индикации бактериальных средств с требуемой точностью результатов реакции за счет ускорения процесса формирования типичной картины окончания реакции.
Поставленная цель достигается тем, что реакция агглютинации смеси исследуемого материала и иммуноглобулинового полиакролеинового диагностикума проводится в электролите, который используется и в качестве разводящей жидкости, под воздействием электрического поля при напряженности 1000-1200 В/м и плотности тока 0,2-0,4 а/мм2 в течение 2-5 мин, при этом смесь исследуемого материала и диагностикума помещается в микрокамеру, изолированную от электролита токопроводящим материалом и расположенную изолирующими проводниками перпендикулярно направленности электрического поля, учет результатов реакции осуществляется визуально под микроскопом.
При оптимально подобранных значениях напряженности электрического поля и плотности тока происходит нарастание значений поверхностных зарядов, за счет электродвижущих сил диагностикуму и бактериальному антигену, находящимся в электролите, сообщаются кинетические свойства, что и приводит к ускорению и усилению взаимодействия последних. Сокращение сроков индикации антигенов происходит за счет ускоренного формирования видоспецифических комплексов иммуноглобулиновых полиакролеиновых диагностикумов с антигенами в электрическом поле. Оптимальные значения режимов реакции смеси исследуемого материала и диагностикума в электролите под воздействием электрического поля установлены по зависимости скорости формирования типичной картины агглютинации в объеме опытной микрокамеры от напряженности электрического поля в В/м (кривая 1) и плотности тока в А/мм2 (кривая 2), представленным на фиг,1, где по оси ординат представлена значения напряженности электрического поля и плотности тока, по оси абцисс время агглютинации в мин. Точки пересечения кривых 1 и 2 и их протяженность в рамках интервалов времени (2-5 мин), достаточных для осуществления экспрессной индикации, очерчивают геометрическую фигуру (заштрихованный сегмент) определенной площади, включающий совокупность оптимальных параметров напряженности поля (1000-1200 В/м) и плотности тока (0,2-0,4 А/мм2). Крайняя правая тоска пересечения кривых 1 и 2 ограничивает максимальные параметры напряженности и плотности тока, превышение которых ведет к разрешению агглютинирующих комплексов.
Возможность осуществления способа с использованием полной совокупности заявляемых признаков подтверждается примерами конкретного выполнения.
Пример 1. Исследуемый материал смыв с поверхности (дальнейшем смыв) заразили клетками чумного вакцинного штамма Y.pestis EV в концентрации 0,2•107 мк/мл и обеззаразили формалином. Смыв с поверхности в объеме 0,4 мл вносили в начальную лунку полистироловой пластины, содержащей 0,4 мл разводящей жидкости, в качестве которой использовали электролит - трис-ацетатный буферный раствор pH 8,0 (в дальнейшем электролит), и титровали в шести лунках с удалением 0,4 мл из последней. В одну контрольную лунку вносили только 0,4 мл электролита. В лунки с раститрованным смывом и в контрольную вносили по 0,05 мл 0,15% взвеси чумного полиакролеинового иммуноглобулинового диагностикума (в дальнейшем диагностикума), который путем легких сотрясений равномерно суспендировали в жидкости. Диагностикум предварительно разводили электролитом. Стеклянные капиллярные трубки длиной 10-15 мм поочередно заполняли содержимым каждой лунки и укладывали на горизонтальной столик электрофоретической камеры с ориентацией торцевых отверстий микрокамер, т.е. капилляров, в направлении к электродам. Торцевые отверстия капилляров закрывали 1,0% раствором агарозы в электролите при температуре 47oC. Горизонтальную электрофоретическую камеру заполняли электролитом, устанавливали на предметный столик микроскопа, находили в поле зрения исследуемых объектов (капилляров) частицы диагностикума под малым увеличением. При этом электролит покрывал капилляры слоем толщиной около 1 мм. Напряженность между электродами устанавливали 1000 В/м, плотность тока 0,2 А/мм2. Учет реакции проводили через 5 мин под микроскопом. При этом в поле зрения каждого из шести капилляров, заполнявшихся реакционной известью, отмечали образование агломератов по 20-25 частиц диагностикума в виде "хлопьев" с просветлением фона. В капиллярах, заполненных содержимым из лунок с концентрацией бактерий 62 и 31 тыс. мк/мл отмечали отдельные зоны с четко выраженным образованием агломератов. Дальнейшее увеличение времени наблюдения до 30 мин не сопровождалось изменениями в картине распределения частиц диагностикума. В капилляре заполнением из контрольной лунки отметили равномерное распределение частиц диагностикума в течение всего времени наблюдения.
Достоверность учета положительных результатов РНСА в электрическом поле в капиллярах под микроскопом проверяли путем проведения контрольного исследования аналогичного вышеизложенному с единственным отличием в том, что материал смыв с поверхности, приготовленный при тех же условиях, не заражали клетками чумного вакцинного штамма Y.pestis EV. При этом в течение 30 мин наблюдения в капиллярах, в том числе и в контрольном, не было обнаружено образования агломератов из частиц диагностикума.
Для контроля предлагаемого способа индикации бактериальных антигенов, с указанием выше параметрами электрического поля: напряженности 1000 В/м и плотности тока 0,2 А/мм2, смыв, зараженный клетками Y.pestis EV в концентрации 0,2•107 мг/мл, предварительно обеззараживали формалином и исследовали с помощью реакции суспензионной агломерации (РНСА). Смыв с поверхности в объеме 0,4 мл вносили в начальную лунку полистироловой пластины, содержащую 0,4 мл рабочего раствора белкового стабилизатора - разводящей жидкости (в дальнейшем разводящей жидкости) и титровали в 6 лунках с удалением 0,4 мл из последней. В одну контрольную лунку вносили только 0,4 мл разводящей жидкости. В лунки с раститрованным смывом и в контрольную лунку вносим по 0,05 мл 0,15% взвеси чумного полиакролеинового иммуноглобулинового диагностикума, который путем легких сотрясений пластины равномерно суспендировали в жидкости, после чего пластину оставляли на горизонтальной поверхности. Через 3-5 ч производили учет результатов реакции. В первых трех лунках отмечали образование феноменов "зонтиков", что свидетельствовало о наличии Y.pestis EV в концентрации 250 тыс. мк/мл в третьей лунке с оценкой интенсивности реакции (++++). В последующих трех лунках и в контрольной лунке отмечали образование феноменов "пуговок" с четкими краями, что свидетельствовало об отрицательном результате с оценкой (+).
Выводы: данный пример демонстрирует сокращение сроков учета РНСА в электрическом поле в капиллярах под микроскопом до 5 мин при напряженности 1000 в/м и плотности тока 0,2 А/мм2 с одновременным повышением чувствительности до 31 тыс. мк/мл. При проведении аналогичного исследования смыва, не зараженного клетками Y.pestis EV, получены отрицательные результаты. В РНСА, поставленной по обычной методике, результаты получены через 4 ч и чувствительность составила 250 тыс. мк/мл.
Пример 2. Выполнение данного примера не отличалось от вышеописанного примера 1, за исключением увеличения прикладываемых параметров электрического поля: напряженности 1100 В/см, плотности тока 0,3 А/мм2, что позволило получить новые результаты.
Выводы: данный пример демонстрирует сокращение сроков учета РНСА в электрическом поле в капиллярах под микроскопом до 3,5 мин при напряженности 1100 В/м и плотности тока 0,3 А/мм2 с одновременным повышением чувствительности до 31 тыс. мк/мл. При проведении аналогичного исследования смыва, не зараженного клетками Y.pestis EV, получены отрицательные результаты. В РНСА, поставленной по обычной методике, результаты получены через 3,5 ч и чувствительность составила 250 тыс. мк/мл.
Пример 3. Выполнение данного примера не отличается от вышеописанного примера 1, за исключением увеличения прикладываемых параметров электрического поля: напряженности составила 1200 В/см и плотность тока 0,4 А/мм2, что позволило получить новые результаты.
Выводы: данный пример демонстрирует сокращение сроков учета РНСА в электрическом поле в капиллярах под микроскопом до 2 мин при напряженности 1200 В/м и плотности тока 0,4 А/мм2 с одновременным повышением чувствительности до 31 тыс. мк/мл. При проведении аналогичного исследования смыва, не зараженного клетками Y.pestis EV, получены отрицательные результаты.
В РНСА, поставленной по обычной методике, результаты получены через 4 ч и чувствительность составила 250 тыс. мк/мл.
Выполнение примеров, отличающихся от вышеописанных тем, что в одном случае напряженность составила 900 В/м, плотность тока 0,1 А/мм2, а в другом, напряженность 1300 В/м, плотность тока 0,5 А/мм2, соответственно привело к увеличению сроков образования агломератов более 5 мин или же к разрушению типичной картины агломерации частиц диагностикума в течение 1 мин.
Таким образом, предлагаемый в качестве изобретения способ индикации бактериальных антигенов реально осуществим, полученные с его помощью результаты полностью коррелируют с таковыми, полученными с использованием обычных методов, однако отличаются скоростью получения результатов 2-5 мин и повышением чувствительности, что обеспечивает возможность организации экспрессной индикации бактериальных средств при возникновении очагов бактериального заражения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИНДИКАЦИИ БАКТЕРИАЛЬНЫХ АНТИГЕНОВ | 1994 |
|
RU2102761C1 |
| СПОСОБ ИНДИКАЦИИ БАКТЕРИАЛЬНЫХ АНТИГЕНОВ | 1995 |
|
RU2101356C1 |
| СПОСОБ ИНДИКАЦИИ БАКТЕРИАЛЬНЫХ АНТИГЕНОВ | 1997 |
|
RU2133958C1 |
| СПОСОБ ИНДИКАЦИИ БАКТЕРИАЛЬНЫХ АНТИГЕНОВ | 1991 |
|
RU2035187C1 |
| СПОСОБ ПОСТАНОВКИ РЕАКЦИИ ЛАТЕКСНОЙ АГГЛЮТИНАЦИИ | 2001 |
|
RU2198407C2 |
| СПОСОБ СЕРОДИАГНОСТИКИ КАПСУЛЬНОГО АНТИГЕНА ЧУМНОГО МИКРОБА | 1994 |
|
RU2092852C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИАГНОСТИКУМА СУСПЕНЗИОННОГО ЧУМНОГО АНТИГЕННОГО НА ОСНОВЕ ФРАКЦИИ I | 2001 |
|
RU2199750C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЛАТЕКСНОГО ДИАГНОСТИКУМА | 1991 |
|
RU2012888C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АФФИННОСТИ АНТИТЕЛ С ПОМОЩЬЮ СЕРОЛОГИЧЕСКИХ РЕАКЦИЙ | 1996 |
|
RU2126155C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЗАРАЖЕННОСТИ ПРОДОВОЛЬСТВИЯ ПАТОГЕННЫМИ БИОЛОГИЧЕСКИМИ АГЕНТАМИ В УСЛОВИЯХ ЧРЕЗВЫЧАЙНЫХ СИТУАЦИЙ | 2006 |
|
RU2350656C2 |
Использование: иммунология, экспрессная индикация бактериальных средств в чрезвычайных ситуациях. Сущность изобретения: реакцию агглютинации смеси исследуемого материала и иммуноглобулинового полиакролеинового диагностикума проводят в электролите, используемом и в качестве разводящей жидкости под воздействием электрического поля при напряженности 1000-1200 В/см и плотности тока 0,2-0,4 А/мм2 в течение 2-5 мин. Для этого смесь исследуемого материала и диагностикума помещают в микрокамеру, изолированную от электролита токопроводящим материалом и расположенную изолирующими проводниками перпендикулярно направленности электрического поля. Учет результатов ведут под микроскопом. 1 ил.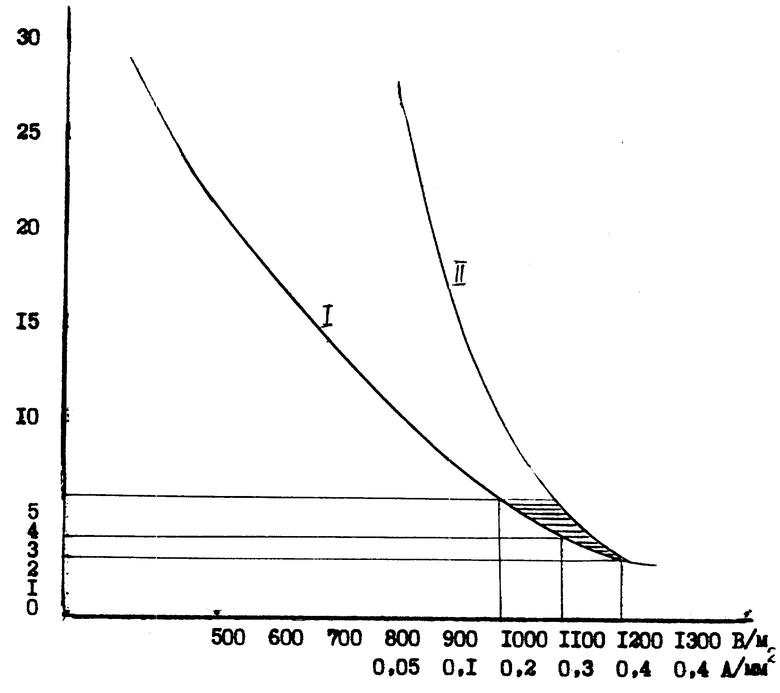
Способ индикации бактериальных антигенов в реакции агглютинации, включающий смешивание исследуемого материала и иммуноглобулинового полиакролеинового диагностикума в разводящей жидкости и визуальный учет результатов реакции, отличающийся тем, что реакцию проводят в электролите, используемом в качестве разводящей жидкости, под воздействием электрического поля при напряженности 1000 1200 В/м и плотности тока 0,2 0,4 А/мм2 в течение 2 5 мин, при этом смесь исследуемого материала и диагностикума помещают в микрокамеру, изолированную от электролита токопроводящим материалом и расположенную изолирующими проводниками перпендикулярно направленности электрического поля, а учет результатов ведут под микроскопом.
| Рудник М.П., Груднева Л.Г | |||
| Экспресс-диагностика возбудителя чумы с использованием реакции агглютинации латекса | |||
| Проблемы природно-очаговых и зоонозных инфекций в Сибири и на Дальнем Востоке | |||
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
| Способ изготовления фанеры-переклейки | 1921 |
|
SU1993A1 |
| Халат для профессиональных целей | 1918 |
|
SU134A1 |
Авторы
Даты
1998-01-20—Публикация
1995-02-20—Подача