Изобретение относится к микробиологии и может быть использовано в лабораторной диагностике особо опасных инфекций.
В настоящее время реакция латексной агглютинации (РЛА) находит широкое применение в экспрессной диагностике инфекционных заболеваний.
Преимущества РЛА перед реакцией пассивной гемагглютинации (РПГА) обоснованы в сравнительных исследованиях этих методов с использованием вакцинного штамма чумного микроба EV ВНИИЭГ и набора гетерогенных штаммов. В качестве антительного диагностикума использовали полиакролеиновые латексные частицы диаметром 1,2-1,8 мкм, сенсибилизированные иммуноглобулиновой фракцией G, выделенной из кроличьей гипериммунной чумной сыворотки.
Постановка РЛА осуществлялась в полистироловых микропланшетах, образование агглютинатов происходило в фосфатно-буферном растворе (ФБР) рН 7,2 [Рудник М.П., Гриднева Л.Г. Экспресс-диагностика возбудителя чумы с использованием реакции агглютинации латекса // Проблемы природно-очаговых и зоонозных инфекций в Сибири и на Дальнем Востоке: Тез. докл. региональной науч. -практ. конф. (16-17 сент. 1993 г.) - Чита, 1993. - С.134-135].
Однако, если при использовании очищенных антигенов уже через 1,5-2,0 ч четко просматривалось наличие в исследуемом и отсутствие в гетерогенных штаммах агглютинатов, то при исследовании объектов внешней среды на наличие антигена зачастую наблюдалась неспецифическая агглютинация.
Наиболее близким к заявленному является способ постановки РЛА при исследовании проб полевого материала [Пат. РФ 2012888, C 01 N 33/531, оп. 15.05.94. БИ 9].
Способ осуществляется последовательным внесением в полистироловые микропланшеты разводящей жидкости, исследуемого материала, антительного латексного диагностикума и формированием агглютината.
В качестве разводящей жидкости использовали 0,15 М раствор хлорида натрия в фосфатно-солевом буфере рН 7,2. В качестве исследуемого материала - образцы полевого материала, подозреваемого на зараженность возбудителями бактериальных особо опасных инфекций. Применяли полигрупповые диагностикумы на основе полиакролеиновых частиц, сенсибилизированных иммуноглобулинами полигрупповой сыворотки.
Недостатками прототипа является то, что при исследовании материала из объектов внешней среды на наличие антигена содержащиеся в нем посторонние агенты могут вызвать частичное повреждение поверхностной структуры диагностикумов. Чаще всего это обуславливает потерю инертности микросфер диагностикума, которые начинают отталкиваться друг от друга, образуя ложноположительные "зонтики". Частичная неспецифическая агглютинация латекса имеет место при постановке РЛА с отдельными сериями диагностикумов, что выражается в нечетком формировании "пуговок" и "колечек" в контролях.
Техническим результатом заявляемого способа является расширение диапазона объектов исследования в РЛА при высокой чувствительности и демонстративности результатов реакций, а также повышение демонстративности реакции с отдельными сериями диагностикумов.
Указанный технический результат достигается тем, что способ постановки РЛА включает последовательное введение в полистироловые микропланшеты разводящей жидкости, в качестве которой используют раствор белкового стабилизатора (БС) в разведении 1:50-1:100 на фосфатно-солевом буфере (ФСБ) рН 7,0-7,4 с добавлением неионного детергента твин-80 в разведении 1:50000-1: 100000, исследуемого материала, антительного полиакролеинового диагностикума и формирование агглютината. При этом в качестве белкового стабилизатора используют водную эмульсию белка куриного яйца.
По отношению к прототипу заявляемый способ имеет следующие отличительные признаки.
Использование в качестве разводящей жидкости ФСБ рН 7,0-7,4 обеспечивает оптимальные условия для связывания антигена с антителами, фиксированными на латексных микрочастицах.
Добавление к разводящей жидкости белкового стабилизатора снижает неспецифическую активность реакции агглютинации, обеспечивая иммунологическую инертность диагностикума.
Введение в разводящую жидкость неионного детергента твин-80 способствует образованию стабильной гетерогенной коллоидной системы.
Совокупность отличительных признаков обеспечивает прохождение РЛА только за счет специфического связывания антигена и антител при расширении диапазона исследуемых объектов и повышении демонстративности результатов реакции.
Возможность практического использования заявляемого способа иллюстрируется примерами его конкретного выполнения.
Пример 1. В круглодонные лунки микропланшеты для иммунологических реакций раскапывают по 50 мкл 0,05 М ФСБ рН 7,0-7,4. В первую лунку вносят 50 мкл суспензии внутренних органов загнившего трупа животного, павшего от чумы, и титруют с шагом 1:2. Затем во все лунки добавляют по 25 мкл 0,1-0,2% суспензии диагностикума полиакролеинового чумного иммуноглобулинового. Параллельно ставят реакцию торможения латексной агглютинации (РТЛА) с чумной агглютинирующей сывороткой. В РЛА наблюдается формирование зонтиков в 10 лунках, а в РТЛА - в 9 лунках. Это вызывает сомнение в наличии чумного антигена в исследуемой пробе.
Пример 2. РЛА и РТЛА ставят аналогично примеру 1, но в разводящую жидкость дополнительно добавляют белковый стабилизатор в разведении 1:100 и твин-80 в концентрации 1:80000. БС готовят следующим образом: к 25 мл белка куриного яйца добавляют 75 мл дистиллированной воды и 1,25 г натрия углекислого кислого, перемешивают в течение 10-15 мин на магнитной мешалке. Затем прогревают при температуре 56oС 40-60 мин, фильтруют через 8 слоев марли и лиофилизируют.
В РЛА наблюдается формирование зонтиков в 10 лунках, а в РТЛА - в 6 лунках при четких контролях. Система реакций указывает на наличие в исследуемой пробе чумного антигена (Ф I).
Пример 3. В круглодонные полистироловые микропланшеты для иммунологических реакций вносят по 50 мкл 0,05 М ФСБ рН 7,0-7,4. В первую лунку вносят взвеси клеток чумного микроба, выращенные при 37oС. Во все лунки добавляют по 25 мкл 0,1-0,2% суспензии диагностикума чумного иммуноглобулинового. При концентрации 3,12•105-1,56•105 м.кл./мл формируются "зонтики", занимающие не менее 2/3 дна лунок. Контроли с некоторыми сериями диагностикума (2 из 7) нечеткие, так как отдельные латексные микрочастицы спонтанно отталкиваются друг от друга и не оседают на дно лунок.
Пример 4. РЛА ставят, как в примере 2. При концентрации взвесей микробных клеток 3,12•105-1,56•105 м.кл./мл формируются "зонтики", занимающие не менее 2/3 дна лунок. Контроли с аналогичными сериями, как в примере 3, четкие. Демонстративность реакции улучшена.
Демонстративность реакции латексной агглютинации схематически представлена на фиг.1 и фиг.2.
Степень агглютинации обозначается: (++++) - хорошо выраженный агглютинат, покрывает все дно лунки тонким равномерным слоем в виде "зонтика"; (+++) - агглютинат несколько меньшего диаметра, чем при (++++); (++) - агглютинат в два раза меньше диаметра лунки; (+) - частицы латекса оседают в самом центре лунки и вокруг имеются отдельные зерна агглютининов; (-) - латексные микросферы оседают в самом центре лунки в виде "пуговки" или маленького колечка с ровно очерченными краями. Положительной считается реакция со степенью агглютинации (+++) - (++++).
По горизонтали обозначены лунок с материалом, раститрованным с шагом 1:2 (лунки 12 - контрольная) - по вертикали - лунок с различными вариантами разводящей жидкости.
Варианты разводящей жидкости:
А, В - ФСБ рН 7,0-7,4;
С, D - ФСБ рН 7,0-7,4 + твин-80 в разведении 1:80000;
Е, F - ФСБ рН 7,0-7,4 + БС в разведении 1:100;
G, H - ФСБ рН 7,0-7,4 + БС в разведении 1:100 + твин-80 в разведении 1: 80000.
На фиг.1 представлены результаты учета РЛА через 2 ч в двух повторностях опыта. При использовании в качестве разводящей жидкости ФСБ рН 7,0-7,4 формирование агглютинатов, оцениваемых в (+++), наблюдается в 9-ых лунках при отсутствии четких контролей (+, ++). Добавление к разводящей жидкости твин-80 в разведении 1:80000 приводит к аналогичному результату. Внесение в разводящую жидкость БС в разведении 1:100 позволяет несколько улучшить демонстративность РЛА. При этом в 8-ых лунках образовались "зонтики", оцениваемые в (+++, ++++) при удовлетворительных контролях (-, +). Применение сочетания твин-80 в разведении 1:80000 с БС в разведении 1:100 значительно повышает демонстративность реакции. Отмечается четкая картина агглютинации в 7-ых лунках (++++) при отличных контролях (-).
На фиг. 2 отображены результаты учета РЛА через 18-22 ч. Положительные результаты наблюдались в 8-ых лунках при применении всех вышеуказанных вариантов разводящей жидкости. Однако использование ФСБ и ФСБ с твин-80 давало менее четкие "зонтики" (+++, ++++) при удовлетворительных контролях (-, +). БС и БС в сочетании с твин-80 позволяли дать абсолютно четкую картину агглютинации после полного прохождения реакции (опыт - (++++), контроль - (-)).
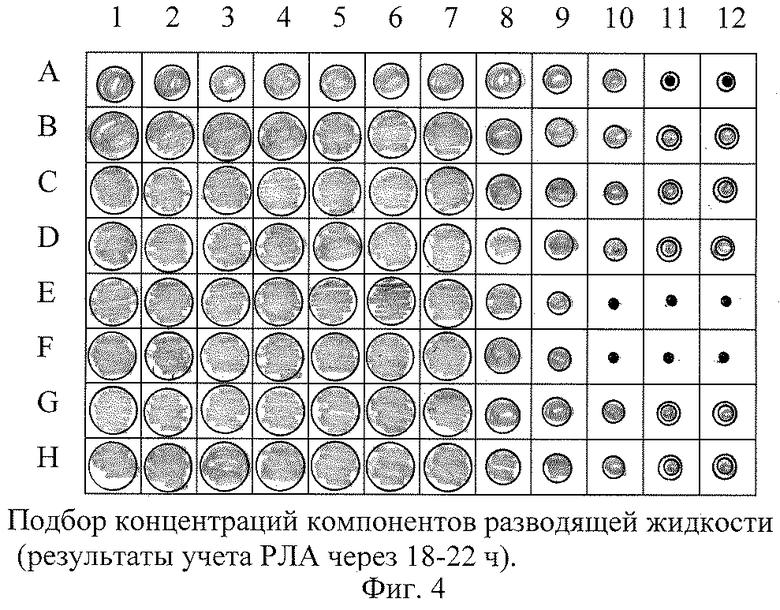
Как показали экспериментальные исследования, схематические представленные на фиг.3 и фиг.4, заявленные пределы значений концентраций белкового стабилизатора и твина-80 являются оптимальными.
По горизонтали обозначены лунок с материалом, раститрованным с шагом 1:2 (лунки 12 - контрольная) - по вертикали - лунок с различными вариантами разводящей жидкости.
Варианты разводящей жидкости:
А - твин-80 в разведении 1:20000;
В - твин-80 в разведении 1:40000;
С - твин-80 в разведении 1:80000;
D - твин-80 в разведении 1:160000;
Е - БС в разведении 1:25;
F - БС в разведении 1:50;
G - БС в разведении 1:100;
Н - БС в разведении 1:200.
Использование заявляемого способа позволит значительно расширить возможности применения РЛА как экспресс-метода в полевых условиях и при чрезвычайных ситуациях.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИНДИКАЦИИ БАКТЕРИАЛЬНЫХ АНТИГЕНОВ | 1995 |
|
RU2102762C1 |
| СПОСОБ СЕРОДИАГНОСТИКИ КАПСУЛЬНОГО АНТИГЕНА ЧУМНОГО МИКРОБА | 1994 |
|
RU2092852C1 |
| СПОСОБ ИНДИКАЦИИ БАКТЕРИАЛЬНЫХ АНТИГЕНОВ | 1994 |
|
RU2102761C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИАГНОСТИКУМА СУСПЕНЗИОННОГО ЧУМНОГО АНТИГЕННОГО НА ОСНОВЕ ФРАКЦИИ I | 2001 |
|
RU2199750C2 |
| СПОСОБ ИНДИКАЦИИ БАКТЕРИАЛЬНЫХ АНТИГЕНОВ | 1997 |
|
RU2133958C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЛАТЕКСНОГО ДИАГНОСТИКУМА | 1991 |
|
RU2012888C1 |
| СПОСОБ ИНДИКАЦИИ БАКТЕРИАЛЬНЫХ АНТИГЕНОВ | 1995 |
|
RU2101356C1 |
| СПОСОБ ПОЛУЧЕНИЯ МАГНОИММУНОСОРБЕНТА ДЛЯ ОБНАРУЖЕНИЯ БАКТЕРИАЛЬНЫХ АНТИГЕНОВ | 2003 |
|
RU2246968C2 |
| КОМПОЗИТНЫЙ ЧУМНОЙ АНТИГЕННЫЙ F1-ДИАГНОСТИКУМ ДЛЯ ИНДИКАЦИИ СПЕЦИФИЧЕСКИХ АНТИТЕЛ | 2015 |
|
RU2582941C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЛАТЕКСНЫХ АНТИГЕННЫХ ДИАГНОСТИКУМОВ ДЛЯ ВЫЯВЛЕНИЯ АНТИТЕЛ ПРОТИВ ВОЗБУДИТЕЛЕЙ БРУЦЕЛЛЕЗА, ТУЛЯРЕМИИ | 2021 |
|
RU2777803C1 |


Изобретение относится к микробиологии и может быть использовано в лабораторной диагностике особо опасных инфекций. Способ включает последовательное введение в полистироловые планшеты разводящей жидкости, неионного детергента твин-80, белкового стабилизатора, исследуемого материала, антительного полиакролеинового диагностикума и формирование агглютината. В качестве белкового стабилизатора используют водную эмульсию белка куриного яйца. Предложенный способ более чувствителен и более демонстративен. 1 з.п. ф-лы, 4 ил.
| СПОСОБ ПОЛУЧЕНИЯ ЛАТЕКСНОГО ДИАГНОСТИКУМА | 1991 |
|
RU2012888C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТРЕПОНЕМНОГО АНТИГЕННОГО ДИАГНОСТИКУМА | 1997 |
|
RU2139539C1 |
| СПОСОБ ЭКСПРЕСС-ДИАГНОСТИКИ ТУБЕРКУЛЕЗА НА ОСНОВЕ РЕАКЦИИ ЛАТЕКС-АГГЛЮТИНАЦИИ | 1998 |
|
RU2130615C1 |
| СПОСОБ ИММУНОЛОГИЧЕСКОЙ ЭКСПРЕСС-ДИАГНОСТИКИ ТОКСИЧЕСКИХ ФОРМ ДИФТЕРИЙНОЙ ИНФЕКЦИИ | 1994 |
|
RU2113172C1 |
Авторы
Даты
2003-02-10—Публикация
2001-02-20—Подача