Изобретение относится к новым N-замещенным [2R, 3R (2'R, 3'R), 6R, 7S, 8S, 9R, 10R]-3-(2',3'-дигидроксипент-2'-ил)-7-[(2,6-дидеокси-3-C-метил-3-O- α -L-рибо-гексапиранозил)-окси] -9-[(3,4,6-тридеокси-3-амино-B-D-ксило-гексапиранозил)-окси] -2,6,8,10,12-пентаметил-4,13-диоксабицикло [8,2,1] -тридец-12-ен-5-он-соединениям с мотилинагонистическими свойствами, к их солям-продуктам кислотного присоединения, а также к фармацевтическим средствам, содержащим указанные соединения и способы, а также промежуточным продуктам для их получения. Соединения согласно изобретению являются суженными в кольце N-дезметил-N-изопропил-производными эритромицина A.
Как известно, антибиотик эритроцитомин A наряду с антибиотической активностью отличается нежелательным побочным действием, связанным с деятельностью желудочно-кишечного тракта, а именно ярко выраженным увеличением контракционной активности в области желудка и кишечника, сопровождающейся спазмами и иногда резкими болями в желудке и кишечнике, тошнотой, рвотой и поносом.
Было предпринято множество попыток преобразовать эритромицин A таким образом, чтобы получить производные, в которых антибиотическая активность практически более не проявлялась, но сохранялся мотилитет желудочно-кишечного тракта. Из Европейской патентной заявки N 0349100 известны фармацевтические средства, содержащие в качестве активного вещества гастропрокинетического характера суженный в кольце эритромицин A-производный или его четвертичные соли, способные усиливать по холинергическому механизму мотилитет желудка.
Поэтому в основу изобретения была положена задача разработать новые суженные в кольце производные эритромицина A, не обладающие антибиотической активностью, но обладающие способностью оказывать благоприятное влияние на мотилитет желудочно-кишечного тракта.
Было установлено, что новые суженные в кольце N-дезметил-N-изопропил-производные эритромицина A обладают селективными мотилинагонистическими свойствами, стимулируя мотилитет желудочно-кишечного тракта благоприятным образом и обнаруживая в то же время действие, способное усиливать тонус нижнего сфинктера пищевода. На основе такого профиля активности вещества согласно изобретению могут быть использованы для лечения повреждений мотилитета в желудочно-кишечном тракте, обнаруживая при этом хорошую совместимость.
Изобретение относится к новым [2R, 3R(2'R, 3'R) 6R, 7S, 8S, 9R, 10R]-3-(2', 3'-дигидроксипент-2'-ил)-2,6,8,10,12-пентаметил-4,13- диоксабицикло[8,2,1]-тридец-12-ен-5-он-производным с общей формулой ,
,
где
R1 -метил или водород, а также к их стабильным и физиологически совместимым солям, продуктам присоединения кислот.
Наиболее удачным в этом смысле можно считать, в частности, соединение формулы I, где R1-метил.
Соединения формулы 1 могут быть получены известным способом тем, что в [2R, 3R(2'R, 3'R)6R, 7S, 8S, 9R, 10R]-3-(2',3'-дигидроксипент-2'-ил)-2,6,8,10,12-пентаметил-4,13- диоксабицикло[8,2,1] -тридец-12-ен-5-он-производные - соединения общей формулы ,
,
где
R1 имеет указанное выше значение, вводят радикал изопропила или по желанию в полученное соединение с формулой I, где R1 - водород, вводят метил-радикал R1, или в полученное соединение формулы I, где R1 означает метил, отщепляют метиловый радикал R1 и по желанию свободные соединения формулы I переносят в их стабильные соли-продукты кислотного присоединения или, наоборот, переводят соли продуктов присоединения кислоты в свободные соединения формулы I.
Для введения изопропилового радикала соединения формулы II можно аклилировать известным образом. Предпочтительно проводить алкилирование как восстановительное алкилирование путем взаимодействия соединений формулы II с ацетатом при восстановительных условиях. Например, соединения с формулой II могут взаимодействовать с ацетатом в присутствии восстановителя типа комплексного боргидридного соединения, такого как цианоборгидрит натрия, триацетоксиборгидрад натрия или боргидрит натрия. По желанию можно производить алкилирование, в частности, такого соединения с формулой II, где R1 - метил, также путем взаимодействия с изопропилгалогенидом, в частности изопропилйодидом, изопропилсульфатом или эфиром изопропилсульфокислоты. Алкилирование целесообразно проводить в инертном органическом растворителе. Для восстановительного алкилирования, например, в качестве растворителя можно использовать избыток ацетона. В качестве растворителя могут быть использованы также циклические эфиры, такие как тетрагидрофуран или диоксан, ароматические углеводороды, например толуол или низшие спирты. Алкилирование можно проводить в интервале температур от комнатной до температуры кипения растворителя. При алкилировании с применением изопропилпроизводного, например изопропилгалогенида, такого как изопропилйодид, целесообразно проводить работу в присутствии основания, например карбоната щелочного металла или третичного органического амина.
Полученное соединение с формулой I, где R1 означает водород, можно по желанию в последующем алкилировать по известному методу в соответствующее N-метил-соединение. Алкилирование можно проводить известным образом путем взаимодействия с метиленгалогенидом или как восстановительное алкилирование путем взаимодействия с формальдегидом при восстановительных условиях или можно, например, проводить в условиях, аналогичных проведению алкилирования соединений формулы II.
Из соединений с формулой I, где R1 означает метил, можно по желанию отщепить метиловый радикал R1. Деметилирование можно проводить известным способом путем обработки соединения галогеном, в частности йодом или бромом, в инертном растворителе в присутствии подходящего основания. В качестве оснований могут быть использованы, например, гидроокиси и соли щелочных металлов слабых органических кислот. Деметилирование проводят предпочтительно в слабо щелочной области преимущественно при pH 9 во избежание побочных реакций гидролиза.
Соединения с формулой I можно выделять, используя известные способы, и очищать. Соли присоединенных кислот можно преобразовывать обычным образом в свободные основания с последующим их превращением по желанию известным образом в фармакологически совместимые соли присоединения кислот. Для устранения побочных реакций гидролиза целесообразно для образования солей использовать только эквивалентные количества кислот.
В качестве фармакологически приемлемых солей-продуктов присоединения кислоты соединений с формулой I могут быть использованы, например, их соли с неорганическими кислотами, например угольной, галоидводородными кислотами, в частности хлористоводородной кислотой, или с органическими кислотами, например низшими алифатическими моно- или дикарбоновыми кислотами, такими как малеиновая, фумаровая, молочная, винная или уксусная кислоты.
Исходные соединения формулы II еще недостаточно хорошо описаны в литературе. В соответствии с изобретением соединения формулы II представляют собой весьма ценные промежуточные продукты для получения фармакологически активных соединений, например соединений формулы I.
Соединения с формулой II могут быть получены исходя из эритромицина A с формулой ,
,
при использовании известных методов. Так, например, эритромицин A по известному методу, в частности по методу, описанному в патентной заявке Германии N 2154032, подвергается однократному или двукратному деметилированию путем взаимодействия с галогеном, предпочтительно с йодом, в инертном растворителе в присутствии подходящего основания. В качестве оснований могут применяться, например, гидроокиси щелочных металлов, карбонаты и соли щелочных металлов слабых карбоновых кислот, такие как, например, ацетаты и пропионаты щелочных металлов. Предпочтительно вводить от 1 до 5 эквивалентов галогена в перерасчете на количество подлежащего деметилированию соединений эритромицина. Количество оснований предпочтительно выбирать таким образом, чтобы гарантировать поддержание pH на уровне 5 - 9, чтобы устранить возможность побочных реакций гидролиза или алкоголиза. В качестве растворителей подходят метанол, циклические эфиры, такие как диоксан или тетрагидрофуран, диметилформамид или смеси указанных растворителей с водой. Деметилирование целесообразно проводить при температурах от комнатной до 50oC. Реакция требует облучения светом, например светом с длиной волны свыше 290 нм от ртутной лампы с пониженным давлением, снабженной фильтром из кварцевого или огнеупорного стекла (например, марки "пирекс"). Реакция протекает с получением монодеметилированного или дидеметилированного продукта в зависимости главным образом от количества используемого галогена. При применении одного эквивалента галогена получают предпочтительно монодеметилированный продукт. По желанию для получения дидеметилированного продукта можно исходить из монодеметилированного продукта.
Моно- и дидеметилированный эритромицин A можно также, используя известную методику, путем обработки кислотой в щадящих условиях преобразовывать в соответствующие моно- или дидеметилированные 8, 9-ангидроэритромицин-A-6,9-гемикетали с общей формулой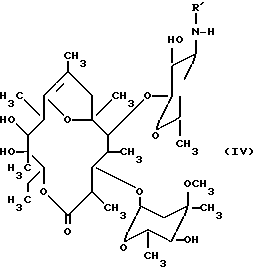 ,
,
где
R1 - водород или метил. Образование гемикеталя можно осуществлять, например, путем обработки ледяной уксусной или разбавленной минеральной кислотой при температурах от комнатной до 50oC.
В соединениях формулы IV известным образом можно проводить внутримолекулярную транслактонизацию по сужению 14-членного лактонового кольца в молекуле эритромицина, преобразуя его в 12-членное лактоновое кольцо с получением соответствующих соединений формулы II. Для этой цели соединения формулы IV необходимо нагреть по известной методике в низшем спирте в присутствии основания, например, при температурах от 40 до 70oC, предпочтительно до температуры кипения реакционной смеси. В качестве оснований могут быть использованы, в частности, карбонаты щелочных металлов, а также органические основания, такие как третичные амины, в частности низшие алкиламины. При таком сужении кольца конфигурация центров хиральности центров не изменяется.
Новые соединения с формулой I и их физиологически совместимые соли присоединения кислот обладают интересными фармакологическими свойствами, в частности способностью воздействовать на мотилин желудочно-кишечного тракта, стимулируя его деятельность. Антибиотическое действие в них отсутствует, однако они обладают высоким селективным средством к рецепторам мотилина, в то время как в эффективных дозах, обладающих агонистическим в отношении мотилина действием, они практически не проявляют релевантного сродства с другими рецепторами желудочно-кишечного тракта, такими как, например, адреналин, ацетилхолин, гистамин, допамин или серотонин.
Чтобы обеспечить регулярное переваривание принимаемой пищи, в здоровом состоянии совместно действуют автономная нервная система и гормоны желудочно-кишечного тракта, которые обеспечивают упорядоченную деятельность по сокращению желудочно-кишечного тракта не только в случае приема пищи, но и как говорится "на пустой желудок". Мотилин представляет собой известный пептидный гормон желудочно-кишечного тракта, стимулирующий его деятельность и координирующий состояние во всей желудочно-кишечной деятельности натощак, а также при приеме пищи.
Соединения формулы I проявляют физиологическую активность, аналогичную действию мотилина, действуя в качестве агонистов для рецепторов мотилина. Так, соединения формулы I проявляют ярко выраженное стимулирующее действие желудочно-кишечной области и нижнего сфинктера пищевода. В частности, они способствуют быстрому опорожнению желудка, повышая на длительное время спокойный тонус сфинктера. Ввиду своей мотилиноподобной активности эти вещества могут быть использованы для лечения болезненных состояний, связанных с нарушениями функции мотилина в желудочно-кишечном тракте и/или обратного выброса пищевой кашицы из желудка в пищевод. Так, соединения формулы I, например, показаны при парезе желудка различнейших происхождений, нарушениях функции опорожнения желудка и гастроэзофогальном рефлюксе, дисперсии, аномалиях мотилитета толстой кишки (усиленной перистальтике толстого кишечника, сокращению УПК), а также постоперативных нарушениях мотилитета, например, кишечной непроходимости (илеусе).
Соединения формулы I, обладающие желудочно-кишечной активностью, можно испытывать в стандартных фармакологических опытах in vivo и in vitro.
Определение связывающей способности исследуемых веществ на рецепторах мотилина.
Сродство соединений формулы I с рецепторами мотилина измеряли in ritro на фракции тканевого гомогената антрума (пещеры сосцевидного отростка) кролика. Целью исследования было определение степени вытеснения мотилина, меченного радиоактивным йодом, из мотилин-рецепторной связи испытываемым веществом.
Изучение рецепторных связей проводили по одной из модификаций метода Бормана и сотр. (Regulatory Peptides, 15 (1986), 143-153). Для получения 125йод-маркированного мотилина проводилось йодирование мотилина по известному методу, например по аналогии с методом Блоома и сотр. (Scand. T. Gastroenterol, 11 (1976)47-52), с применением ферментативного способа при использовании лактопероксидазы.
Для выделения применяемой при испытании фракции гомогена из ткани антрума кролика слизистую оболочку выделенной части антрума размельчали и гомогенезировали в 10-кратном объеме холодного гомогенизирующего буферного раствора (50 ммолей трис-HCl-буфер, 250 ммолей сукрозы, 25 ммолей KCl, 10 ммолей Mg2Cl2, pH 7,4) при добавлении ингибиторов (1 ммоль йодацетамида, 1 мкмоль пепстатина, 0,1 г/л бактразина) при использовании гомогенизатора в течение 15 с (1500 об/мин). Затем гомогенизат центрифугировали в течение 15 мин в количестве 1000 г, полученный остаток четырежды промывали раствором буферного гомогенизированного раствора, после чего повторно суспендировали в 0,9%-ном растворе хлорида натрия (в объеме, соответствующем 5-кратному весовому количеству антрума). Полученную таким образом фракцию ткани, получившую название "мембрана заготовки", использовали для испытаний.
Для опыта 200 мкл мембранной фракции (0,5 - 1 мг протеина) в 400 мкл буферного раствора A (50 ммолей трис-HCl-буфера, 1,5% BSA, 10 ммолей MgCl2, pH 8) разбавляли 100 мкл йодированного мотилина в буферном растворе Б (10 ммолей трис-HCl-буфер, 1% BSA, pH 8) (конечная концентрация 50 pM) и инкубировали в течение 60 мин при 30oC. Реакцию останавливали при добавлении 3,2 мл холодного буферного раствора Б, после чего производили отделение связанного мотилина от несвязанного, используя для этого метод центрифугирования (1000 г, 15 мин). Остаток, образующийся после центрифугирования в виде шелухи, промывали буферным раствором Б, после чего производили подсчет в гамма-счетчике. Исследование степени вытеснения проводилось при добавлении все возрастающих количеств исследуемого вещества в инкубационную среду. В качестве растворов исследуемых веществ использовали водные растворы, полученные при подходящем разбавлении 60•100-4 молярных водных штаммовых растворов. Трудно растворимые в воде исследуемые вещества предварительно растворялись в 60%-ном этаноле, и эти растворы разбавлялись таким количеством воды, чтобы концентрация этанола в испытуемом веществе (растворе) не превышала 1,6 об.%. Исходя из данных, полученных при измерении, определяли ту концентрацию соответствующего исследуемого вещества как IC50, которая вызывала 50%-ное торможение специфической связи йодированной связи в рецепторах мотилина. Из этого рассчитывали соответствующее pIC50 -значение. По указанному методу определяли величину pIC50 для вещества примера 1, составляющую 8,32.
Определение влияния вещества на скорость опорожнения желудка при опытах in vivo.
Скорость опорожнения желудка определяли на собаках породы "гончая", которым перед опытом проводили операцию по наложению фистулы и имплантации дуоденального канала. Через 15 мин после дуоденального введения исследуемого вещества голодным взрослым собакам вводили через фистулу 285 г полужесткой калорийной пищи. Содержимое опорожняющегося желудка отбирали с интервалом в 15 мин через доуденальный канал. Из выделенных количеств содержимого желудка рассчитывали тот отрезок времени, в течение которого происходило 50%-ное опорожнение желудка. Этот временный отрезок и рассматривался как мера опорожнения желудка.
На данной тестовой модели соединение примера 1 обнаруживало ярко выраженное стимулирующее действие на скорость опорожнения желудка при доза 0,46 мкммоль/кг. Время, необходимое для 50%-ного опорожнения желудка, составило в контрольной группе животных 46 мин, в то время как в группе, которой вводилось исследуемое вещество, оно снижалось до 27 мин.
Определение влияния веществ на тонус покоя сфинктера в опытах in vivo.
Определение проводилось на тренированных взрослых собаках породы "гончая" натощак, которым до начала проведения опыта вводилась фистула и вставлялся доуденальный канал. Давление на нижнем конце сфинктера измерялось с помощью перфундированной системы катетеров с боковым отверстием, которая соединялась с приемником давления и самописцем. Катетер через фистулу эзофагуса вводился в желудок, а затем медленно вручную выводился из него (манометрия протока). При прохождении части катетера с боковым отверстием через зону повышенного давления на нижнем конце сфинктера регистрировался пик. По этому пику определялось давление в миллиметрах ртутного столба.
Таким образом, сначала в качестве контрольного значения определялось основное (базальное) давление сфинктера пищевода. Затем исследуемое вещество вводилось внутрь двенадцатиперстной кишки и через 15 мин проводились измерения давления на нижнем сфинктере пищевода. Интервалы между измерениями составили 2 мин, продолжительность измерений составила 46 мин. Рассчитывалось повышение давления после введения исследуемого вещества в сравнении с установленным вначале базальным давлением.
В этом опыте базальный тонус сфинктера пищевода при дозе 0,251 мкммоль на кг вещества из примера 1 более чем удваивался. Этот эффект сохранялся в течение всего хода испытаний, т.е. 45 мин.
Вследствие своей активности в желудочно-кишечном тракте соединения с формулой I используются в гастроэнтерологии в качестве лекарств для крупных млекопитающих, в частности для человека, для профилактики и лечения нарушения функции мотилина в желудочно-кишечной деятельности.
Принимаемые дозы должны назначаться строго индивидуально и могут варьироваться с учетом состояния больного или формы применения лекарства. Например, парэнтерально вводимые препараты могут содержать меньше активного вещества, чем оральные. В основном, однако, для лечения крупных млекопитающих, в частности человека, используются лекарственные формы с содержанием активного вещества от 5 до 200 мг на разовую дозу.
Соединения формулы I, используемые в качестве лекарственных средства, принимаются вместе с обычными вспомогательными фармацевтическими веществами в галенических формах, таких как таблетки, капсулы, свечи или растворы. Эти галенические составы могут быть получены по известным методикам с применением обычных твердых носителей, таких как молочный сахар, крахмал, тальк, или жидких разбавителей, например воды, жирных масел или жидких парафинов, или же с применением обычных фармацевтических вспомогательных средств, таких как таблетообразующие средства, стимуляторы растворения, или консервирующих средств.
Приведенные ниже примеры призваны более подробно иллюстрировать предмет изобретения, однако перечнем примеров сущность представляемого изобретения не ограничивается.
Пример 1. [2R, 3R(2'R, 3'R), 6R, 7S, 8S, 9S, 10R]-3-(2',3'-дигидроксипент-2'-ил)-7-[(2,6-дидеокси-3-C-метил-3-O-метил- α -L-рибо-гекспиранозил)-окси] -9-[(3,4,6-тридеокси-3-(N-метил-N- изопропиламино)-B-D-ксилогексопиразонил)-окси] -2,6,8,10,12-пентаметил- 4,13-диоксабицикло[8,2,1]-тридец-12-ен-5-он (соединение с формулой I, где R1 - метил).
А. Получение N-дезметилэритромицина A.
20 г эритромицина A (27, 2 ммоля) и 11,2 г (136,2 ммоля) ацетата натрия растворяли в 200 мл смеси из метанола и воды (852). Раствор нагревали до 47oC, после чего добавляли 6,9 г (136,2 ммоля) йода. Путем добавления разбавленного раствора (водного) гидроокиси натрия поддерживали pH на уровне 8 - 9. Через 3 ч реакционную смесь с целью дальнейшей обработки сливали в смесь из 1 л воды и 20 мл раствора гидроокиси аммония. Проводили экстрагирование реакционной смеси, используя этиловый эфир уксусной кислоты, а органический экстракт промывали водой, содержащей гидроокись аммония, и концентрировали. Оставшийся после удаления растворителя сырой продукт перекристаллизовывали из смеси ацетона с раствором гидроокиси аммония, взятых в соотношении 50:3. Точка плавления 143 - 148oC.
Б. Получение N-дез-метил-8,9-ангидроэритромицин-A-6,9-гемикеталя (соединения с формулой IV, R1-метил).
21 г полученного в соответствии с п.А продукта растворяли в 110 мл ледяной уксусной кислоты и полученный раствор перемешивали в течение 1 ч при комнатной температуре. Затем реакционную смесь с целью обработки при ледяном охлаждении добавляли по каплям в 400 мл концентрированного раствора гидроокиси аммония. Реакционную смесь экстрагировали этиловым эфиром уксусной кислоты, органический экстракт промывали водой и растворитель отгоняли. Образующийся в качестве остатка сырой продукт перекристаллизовывали сначала из эфира, а затем из метанола. Получали 14 г чистого продукта с т. пл. 145oC.
В. Получение [2R,3R(2'R,3'R),6R,7S,8S,9R,10R]-3-(2',3'-дигидроксипент- 2'-ил)-7-[(2,6-дидеокси-3-C-метил-3-O-метил- α -L-рибо-гекспиранозил)-окси] 9-[(3,4,6-тридеокси-3-метиламино-B-D-ксило- гексапиранозил)-окси] -2,6,8,10,12-пентаметил-4,13-диоксабицикло-[8,2,1] - тридец-12-ен-5-она (соединение формулы II, где R1-метил).
9,4 г (13,4 ммоля) продукта, полученного по п. Б, кипятили с 1,9 г (13,4 ммоля) карбоната калия в метаноле в течение 2,5 ч до флегмы. С целью обработки реакционную смесь сгущали, разбавляли водой и экстрагировали этиловым эфиром уксусной кислоты. Оставшийся после отгонки растворителя сырой продукт перекристаллизировали из изопропанола. Получали 7,1 г чистого продукта с т. пл. 199 - 200oC и оптическим вращением (α)
Г. Получение указанного в заголовке соединения.
2 г (2,8 ммолей) продукта, полученного в соответствии с п. В, растворяли в метаноле и путем добавления разбавленного раствора соляной кислоты устанавливали pH на уровне 4. К раствору добавляли 2 г молекулярного сита (алюминийсиликат кальция, диаметр пор  ), избыток ацетона и 0,4 г (6,4 ммоля) натрийцианборгидрида. Реакционную смесь перемешивали в течение 12 ч. С целью обработки молекулярное сито отфильтровывали, фильтрат сгущали, разбавляли водой и экстрагировали этиловым эфиром уксусной кислоты. Образующийся после сгущения экстракта этилового эфира уксусной кислоты в качестве остатка сырой продукт очищали методом хроматографии на колонке через кизельгель (элюент - этиловый эфир уксусной кислоты: метанол 95:5). Получали 1,4 г указанного в заголовке соединения с точкой плавления 130 -134oC с оптическим вращением (α)
), избыток ацетона и 0,4 г (6,4 ммоля) натрийцианборгидрида. Реакционную смесь перемешивали в течение 12 ч. С целью обработки молекулярное сито отфильтровывали, фильтрат сгущали, разбавляли водой и экстрагировали этиловым эфиром уксусной кислоты. Образующийся после сгущения экстракта этилового эфира уксусной кислоты в качестве остатка сырой продукт очищали методом хроматографии на колонке через кизельгель (элюент - этиловый эфир уксусной кислоты: метанол 95:5). Получали 1,4 г указанного в заголовке соединения с точкой плавления 130 -134oC с оптическим вращением (α)
Пример 2. [2R, 3R(2'R, 3'R), 6R,7S,8S,9R,10R]-3-(2',3'-дигидроксипент- 2'-ил)-7-[(2,6-дидеокси-3-C-метил-3-O-метил- α -L-рибо-гекспиранозил)-окси] -9-[(3,4,6-тридеокси-3-(N-метил-N- изопропиламино)-B-D-ксило-гексопиразонил)-окси] -2,6,8,10,12-пентаметил- 4,13-диоксабицикло[8,2,1]-тридец-12-ен-5-он (соединение с формулой I, R1-метил).
А. Получение N-дезметилэритромицина A.
5 г эритромицина A и 4,7 г ацетата натрия (•3H2O) растворяли в 200 мл смеси, состоящей из метанола и воды 8 : 2. К раствору добавляли 1,75 г йода, после чего реакционную смесь при комнатной температуре в течение 20 мин облучали кварцевой лампой. Затем половину растворителя выпаривали, а оставшуюся реакционную смесь сливали в смесь из 140 мл воды и 10 мл аммиака. Реакционную смесь трижды экстрагировали, используя каждый раз 20 мл метил-1-бутилового эфира. Эфирный экстракт отделяли и эфир частично выпаривали. Затем происходила кристаллизация реакционного продукта, который в дальнейшем перекристаллизовали из ацетона. Получали 2 г N-дезметилэритромицина A.
Б. Для получения N-дезметил-8,9-ангидроэритроцитин-A-6,9-гемикеталя (соединение с формулой IV, R1-метил) 2 г полученного в соответствии с п. А продукта обрабатывали по методике, приведенной в примере 1 Б. Получали 2,3 г гемикеталя в качестве аморфного продукта.
В. Для получения [2R,3R(2'R,3'R),6R,7S,8S,9R,10R]-3-(2',3'-дигидроксипент-2'-ил)-7-[(2,6- дидеокси-3-C-метил-3-O-метил- α -L-рибо-гекспиранозил)-окси]-9-[(3,4,6- тридеокси-3-метиламино-B-D-ксило-гексопиранозил)-окси] -2,6,8,10,12-пента- метил-4,13-диоксабицикло[8,2,1] -тридец-12-ен-5-она(соединение с формулой II, где R1-метил) 2,3 г полученного выше продукта обрабатывали в соответствии с методикой примера 1 В. Полученный сырой продукт перекристаллизовывали из этилацетата. Получали 1,3 г чистого продукта с т.пл. 199 - 202oC.
Г. 1,3 г полученного выше продукта загружали в смесь из 26 мл ацетона и 0,1 мл уксусной кислоты. К реакционной смеси порциями добавляли 0,6 г натрийтриацетоксиборгидрида в атмосфере азота и перемешивали реакционную смесь в течение 4 ч при комнатной температуре. Затем две трети растворителя выпаривали, а остаток разбавляли 40 мл этилацетата. При энергичном перемешивании добавляли 65 мл насыщенного раствора кислого карбоната натрия. От образующегося прозрачного раствора отделяли органическую фазу, а водную фазу еще раз промывали 20 мл этилацетата. Соединенные органические фазы промывали 13 мл воды и просушивали над сульфатом натрия. Растворитель выпаривали, остаток растворяли в 20 мл толуола, после чего последний тоже выпаривали. Полученный сырой продукт очищали путем фильтрации через колонку с окисью алюминия (25 г Al2O3, стадия активности II/III) при использовании этилацетата в качестве элюента. Затем добавляли н-гексан до помутнения смеси. Кристаллизацию продукта производили на холоде. Образовавшиеся кристаллы отфильтровывали при пониженном давлении и промывали н-гексаном. Получали 0,8 г указанного в заголовке соединения с т.пл. 128 - 135oC.
Д. Для преобразования в ацетат 1 г (1,3 ммоля) указанного в заголовке соединения растворяли в метаноле, а раствор разбавляли 0,08 мл (1,3 ммоля) уксусной кислоты. Затем растворитель отгоняли при пониженном давлении, а образующийся ацетат указанного в заголовке соединения высушивали. Т. пл. ацетата 145 - 150oC, оптическое вращение (α)
Пример 3. Получали таблетки следующего состава в расчете на 1 таблетку:
[2R, 3R(2'R, 3'R), 6R, 7S,8S,9R,10R]-3-(2',3'-дигидрооксипент-2'-ил)-7-[(2,6-дидеокси-3-C-метил-3-O-метил- α -L-рибо-гекспиранозил)-окси] -9-[(3,4,6- тридеокси-3-(N-метил-N-изопропиламино)-B-D-ксило-гексопиранозил)-окси] - 2,6,8,10,12-пентаметил-4,13-диоксабицикло[8,2,1] -тридец-12-ен-5-он (соединение с формулой I, где R1-метил) - 20 мг
Маисовый крахмал - 135 мг
Молочный сахар - 60 мг
Желатин (в виде 10%-ного раствора) - 6 мг
Активное вещество, маисовый крахмал и молочный сахар загущивали в 10%-ном растворе желатина. Образующуюся пасту размельчали, распределяли на листах и высушивали при 45C. Просушенный гранулят пропускали через дробилку и смешивали в миксере со следующими вспомогательными веществами, мг:
Тальк - 5
Стеарат магния - 5
Маисовый крахмал - 9,
после чего выдавливали через пресс таблетки по 240 мг.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ 10,13,15-ТРИОКСАТРИЦИКЛО (9.2.1.1.)-ПЕНТАДЕКАНОНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И СОДЕРЖАЩИЕ ЭТИ СОЕДИНЕНИЯ ЛЕКАРСТВЕННЫЕ СРЕДСТВА | 1997 |
|
RU2181727C2 |
| ПРОИЗВОДНЫЕ 11-АЦЕТИЛ-12,13-ДИОКСАБИЦИКЛО [8.2.1] ТРИДЕЦЕНОНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И СОДЕРЖАЩИЕ ЭТИ СОЕДИНЕНИЯ ЛЕКАРСТВЕННЫЕ СРЕДСТВА | 1999 |
|
RU2218346C2 |
| ЛЕКАРСТВЕННЫЕ СРЕДСТВА, СОДЕРЖАЩИЕ ПРОИЗВОДНЫЕ ИМИДАЗОЛ-1-ИЛА | 1993 |
|
RU2125877C1 |
| С-21 МОДИФИЦИРОВАННЫЕ ЭПОТИЛОНЫ | 2000 |
|
RU2253652C2 |
| НОВЫЕ НУКЛЕОЗИДЫ, ИМЕЮЩИЕ БИЦИКЛИЧЕСКУЮ САХАРНУЮ ГРУППИРОВКУ, И СОДЕРЖАЩИЕ ИХ ОЛИГОНУКЛЕОТИДЫ | 1999 |
|
RU2211223C2 |
| КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ЭПОТИЛОН, И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2005 |
|
RU2416407C2 |
| ПРОИЗВОДНЫЕ БЕНЗАЗЕПИН-, БЕНЗОКСАЗЕПИН- ИЛИ БЕНЗОТИАЗЕПИН-N-УКСУСНОЙ КИСЛОТЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ЛЕКАРСТВЕННОЕ СРЕДСТВО, ИХ СОДЕРЖАЩЕЕ | 1996 |
|
RU2159768C2 |
| РЕГУЛЯТОРЫ-ПРОИЗВОДНЫЕ СТЕРОИДОВ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2797408C2 |
| ПРОИЗВОДНЫЕ ДИАЗАБИЦИКЛИЧЕСКИХ АЛКАНОВ С NK-АНТАГОНИСТИЧЕСКОЙ АКТИВНОСТЬЮ | 2003 |
|
RU2310656C2 |
| ЦИТОСКЕЛЕТОАКТИВНЫЕ СОЕДИНЕНИЯ, КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ | 2006 |
|
RU2407745C2 |
Использование: в качестве агентов, обладающих способностью оказывать благоприятное воздействие на мотилитет желудочно-кишечного тракта. Сущность: продукт - [2R, 3R (2'R, 3'R), 6R, 7S, 8S, 9R, 10R] - 3(2', 3'-дигидрокси-пент 2'-ил)-2,6,8,10,12-пентаметил-4,13-диоксабицикло [8,2,1] -тридец-12-ен-5-он-производные формулы I, приведенной в формуле изобретения:
где R' - метил или водород, или их стабильные и физиологически совместные соли присоединения кислоты. I получают введением в [2R, 3R(2'R, 3'R), 6R, 7S, 8S, 9R, 10R]-3(2', 3'-дигидроксипент-2' - ил)-2, 6, 8, 10, 12-пентаметил-4,13-диоксабицикло [8, 2, 1]-тридец-12-ен изопропилового радикала с последующим переводом I в соль или превращением соли I в свободное соединение I. 3 с. и 1 з. п.ф-лы.

где R1 - метил или водород, или их стабильные и физиологически совместимые соли присоединения кислоты.
где R1 - метил или водород, или их стабильные и физиологически приемлемые соли присоединения кислот, отличающийся тем, что в производные [2R, 3R (2'R, 3'R), 6R, 7S, 8S, 9R, 10R]-3-(2', 3'- дигидроксипент-2-ил)-2,6,8,10,12-пентаметил-4,13-диаоксабицикло [8,2,1]-тридец-12-ен-5-она общей формулы
где R' имеет указанное выше значение, вводят остаток изопропила, при желании свободные соединения формулы I переводят в их стабильные соли присоединения кислот или соли присоединения кислот переводят в свободные соединения формулы I.
| EP, 0349100, C 07 H 17/08, 1990 | |||
| J | |||
| of Org | |||
| Устройство для устранения мешающего действия зажигательной электрической системы двигателей внутреннего сгорания на радиоприем | 1922 |
|
SU52A1 |
Авторы
Даты
1998-03-20—Публикация
1992-12-30—Подача