Данное изобретение относится к новым индан и инден производным, фармацевтическим композициям, содержащим эти соединения, и их использованию в качестве эндотелиновых рецепторных антагонистов.
Эндотелин (ET) является чрезвычайно высокоактивным сосудосуживающим пептидом синтезируемым и выделенным васкулярным эндотелием. Эндотелин существует в виде трех изоформ, ET-I, ET-2 и ET-3. Было найдено, что из них только ET-1 и ET-3 экспрессируются в системах млекопитающих. /Если указано особо, "эндотелин" будет означать любой или все изомеры (изоформы) эндотелина/. Эндотелин оказывает глубокое воздействие на сердечно-сосудистую систему, и в частности, на коронарное, почечное и мозговое кровообращение. Повышенное или ненормальное выделение эндотелина связано с сокращением гладких мышц, которые вовлекаются в патогенез сердечно-сосудистой, церебрально-сосудистой, респираторной и почечной патафизиологии. Сообщалось о существовании повышенных уровней эндотелина в плазме у пациента со значительной артериальной гипертензией, острым инфарктом миокарда субарахноидальным кровообращением, атеросклерозом, и пациентов с уремией, подвергающихся диализу.
In vivo, эндотелин оказывает явно выраженное воздействие на кровяное давление и минутный сердечный выброс. Внутривенозная инъекция ударной дозы ET (от 0,1 до 3,0 нмоль/кг) вызывает у крыс временную, связанную с дозой депрессорную реакцию (отклик) (спустя от 0,5 до 2 мин) с последующим устойчивым, зависящим от дозы повышением артериального кровяного давления, которое может оставаться увеличенным в течение 2-3 ч после введения дозы. У крыс дозы свыше 3 нмоль/кг часто вызывает летательный исход.
Эндотелин по-видимому оказывает предпочтительное воздействие на почечное сосудистое ложе. Он вызывает заметное продолжительное снижение почечного кровотока, сопровождаемое существенным снижением в GFR, объема мочи, выделения натрия и калия с мочой. Эндотелин вызывает длительный антинатриуретический эффект, несмотря на значительное увеличение атриального натриуретического пептида. Эндотелин также стимулирует renin активность (плазмы). Эти результаты наводят на мысль, что ET вовлекается в регулирование почечной функции и вызовет в целом ряде почечных расстройств, включающих острую почечную недостаточность, циклоспориновую нефротоксичность и хроническую почечную недостаточность.
Исследования показали, что in vivo, церебральная сосудистая сеть является высокочувствительной как к сосудорасширяющему, так и сосудосуживающему воздействию эндотелина. Поэтому ET может быть важным медиатором церебрально-сосудистого спазма частого и часто смертельного последствия субарахноидального кровотечения.
ET также проявляет непосредственное воздействие на центральную нервную систему, такое как тяжелое апноэ и ишемические паталогии, которые наводят на мысль, что ET может принимать участие в развитии церебральных инфарктов и гибели нейронов.
ET может быть также вовлеченным в ишемию миокарда (Nichols et al. Br. J. Pharm. 99: 597-601, 1989, and Clozel, Circ. Res., 65: 1193-1200, 1989), спазмы коронарных сосудов (Fukuda et al., Eur. J. Pharm. 165: 301-304, 1989 and Liischer, Circ., 83:701, 1991) при сердечной недостаточности, пролиферацию васкулярных клеток гладкой мышцы, (Jakagi, Biochem. & Biophys. Res. Commun. , 168: 537-543, 1990, Bobek et al., Am. J. Physiol. 258:408-C 415, 1990) и атеросклерозы (Nakaki et al., Biochem. & Biophys. Res. Commun. 158: 880-881, 1989, and Lerman et al., New Eng. J. of Med. 325: 997-1001, 1991). Было показано существование повышенных уровней эндотелина после коронарной пластической операции с использованием надувного баллона (Kadel et al., No 2491, Circ. 82:627, 1990).
Кроме того, было найдено, что эндотелин является сильнодействующим констриктором выделенной у млекопитающих ткани дыхательных путей, включающей человеческие бронхи. (Ushida et al., Eur. J. of Pharm. 154: 227-228 1988, La Gente, Clin. Exp. Allergy, 20: 343-348, 1990; and Springall et al., Lancet, 337: 697-701, 1991).
Эндотелин связан с возникновением кровоизлияний и некротических нарушений слизистой оболочки желудка (Whittle et al., Br. J. Pharm. 95: 1011-1013, 1988); симптома Raynand'a, Cinniniello et al., Lancet 337: 114-115, 1991); мигрени (Edmeads, Headache, Feb. 1991 p. 127); сепсиса (Weitzberg et al., Circ. Shock. 33: 222-227, 1991; Pittet et al., Ann. Surg. 213: 262-264, 1991, циклоспорин-индуцируемой почечной недостаточности или гипертензии (Eur. J. Pharmacol., 180: 191-192, 1990, Kidney Int., 37: 1487-1491, 1990) и эндотоксинового бактериально-токсического шока и других вызываемых эндотоксином заболеваний (Biochem., Biophys. Res. Commun. 161: 1220-1227, 1989, Acta Phisiol Scand. 137: 317-318, 1989), J.Clin. Invest., 83, 1989, 1762-1767.
Таким образом, эндотелиновые рецепторные антагонисты будут представлять уникальный метод для фармакотерапии гипертензии, почечной недостаточности, заболеваний сосудов головного мозга, ишемии миокарда, ангины, сердечной недостаточности, астмы, атеросклероза, симптома Raynand'a, язв, сепсиса, мигрени, глаукомы, эндотоксинового шока, вызываемого эндотоксином множественного органического нарушения или распространенной внутрисосудистой коагуляции, циклоспорин-индуцируемой почечной недостаточности и в качестве вспомогательного средства при пластической операции на сосудах и предотвращения рестеноза.
Данное изобретение включает индан- и инденпроизводные, представленные формулой (I), и фармацевтические композиции, содержащие эти соединения, и их использование в качестве эндотелин рецепторных антагонистов, которые являются полезными в лечении разнообразных сердечно-сосудистых и почечных заболеваний, включающих, но не ограничивающих ими, следующие: гипертензия, острая и хроническая почечная недостаточность, циклоспорин-индуцируемая нефротоксичность, внезапный приступ, цереброваскулярный вазоспазм, ишемия миокарда, ангина, сердечная недостаточность и атеросклероз.
Кроме того, изобретение представляет способ подавления эндотелиновых рецепторов у животных, включая людей, который включает введение нуждающемуся в этом животному эффективного количества соединений формулы (I).
Соединения данного изобретения представлены структурной формулой (I)
где R1 является -X(CH2)nAr или -X(CH2)n R8 или (c)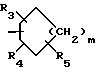
R2 является водородом, Ar или (c);
R1 - -X(CH2)nR8;
R2 - -X(CH2)nR8 или -XR9Y;
R3 и R5 независимо водород, R11, OH, C1-8-алкокси, S(O)qR11; N(R6)2, Br, F, I, Cl, CF3, NHCOR6, -R11CO2R7, -XR9-4 или -X(CH2)nR8, где метиленовые группы -X(CH2)nR8 могут быть незамещенными или замещенными одной или более -(CH2)nAr-группами;
R4 - водород, R11, OH, C1-5-алкокси, S(O)qR11 N(R6)2, -X(R11), Br, F, I, Cl или NHCOR6, где C1-C5-алкокси может быть незамещенной или замещенной с помощью OH, метокси или галогена;
R6 независимо - водород или C1-4-алкил;
R7 независимо - водород, C1-C6-алкил или (CH2)nAr;
R8 - водород, R11CO2R7, PO3H2, P(O)(OH)R7, CN, -C(O)N(R6)2, тетразол или OR6;
R9 - C1-C10-алкил, C2-C10-алкенил или фенил, все они могут быть незамещенными или замещенными одним или более OH N(R6)2, COOH, галогеном или XC1-5-алкилом:
R10 представляет R3 или R4;
R11 - C1-C8-алкил, C2-C8-алкенил, C2-C8-алкинил, все они могут быть незамещенными или замещенными одним или более OH, CH2OH, N(R6)2 или галогеном;
X (CH2)n, O, NR6 или S(O)q;
Y - CH3 или X(CH2)nAr;
Ar является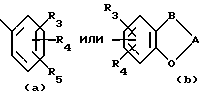
нафтил, индонил, пиридил, тиенил, оксазолидинил, оксазолил, тиазолил, изотиазолил, пиразолил, триазолил, тетразолил, имидазолил, имидазолидинил, тиазолидинил, изоксазолил, оксадиазолил, тиадиазолил, морфолинил, пиперидинил, пиперазинил, пирролил или пиримидил; все они могут быть незамещенными или замещенными одной или более R3- или R4-группами;
A является C = O или [C(R6)2]m;
B является -CH2- или -O-;
Z1 и Z2 независимо - водород, C1-C8-алкил, C2-8-алкенил, C2-8-алкинил, OH, C1-8-алкокси, S(O)q, C1-8-алкил, N(R6)2, Br, F, I, Cl, NHCOR6, -X(CH2)nR8, фенил, бензил или C3-6-циклоалкил, где C1-8-алкил, C2-8-алкенил, или C2-8-алкинил могут быть независимо замещенными COOH, OH, CO(CH2)nCH3, CO(CH2)nCH2N(R6)2 или галогеном, или Z1 и Z2 вместе могут быть -O-A-O- на прилегающих углеродных атомах;
Z3 является Z1 или XR9Y;
q = 0, 1 или 2;
n = 0 - 6, целое число;
m = 1, 2 или 3;
пунктирная линия обозначает необязательное наличие двойной связи,
или фармацевтически приемлемая их соль, при условии, что R2 не является водородом, когда X - S(O)q; когда необязательная двойная связь присутствует, есть только один R10 и отсутствует R1; соединение формулы I не является (1RS)-1,3-дифенилиден-2-карбоновая кислота; (цис,цис)-(1RS,3SR)- 1,3-дифенилиндан-2-карбоновая кислота; (1RS)-3-[3-метил-1-фенил- (1H)-инд-2-ен-1-]ил пропионовая кислота; или (1RS)-2[1,3-дифенил-(1H)- инд-2-ен-2-ил]этановая кислота. В изобретение также включаются фармацевтические приемлемые комплексы солей.
Все алкил, алкенил, алкинил и алкокси группы могут быть прямолинейными или разветвленными. Термин "галоген" используется для образования обозначения иодо, фторо, хлоро или бромо. Алкильные группы могут быть замещенными одним или более галогенами до полного галогенирования.
Соединения данного изобретения могут содержать один или более асимметричных атомов углерода и могут существовать в рацемической или оптической активной форме. Все эти соединения и диастереоизомеры рассматриваются как входящие в рамки объема данного изобретения и приложенных пунктов.
Предпочтительными являются такие соединения, в которых R1 является : X(CH2)nAr, (Ar представляет (a) или (b)), дигидробензофуранил, бензодиоксанил, циклогексил, C1-4-алкил, R2 представляет (a), (b) C1-4-алкил, индонил или водород; R3 и R5 представляют независимо водород, OH, C1-5 алкокси, галоген, -OC1-4-алкил фенил, R11CO2R7, C1-4-алкил, N(R6)2, NH(CO)CH3, -X(CH2)n R8, -XR9 пиридил, фенил или S(O)pC1-5-алкил; R4 представляет водород, OH, C1-5-алкокси, галоген, C1-4-алкил, N(R6)2, H(CO)CH3 или S(O)pC1-5-алкил; Z1, Z2, и Z3 независимо представляют XR9Y, бензил, водород, OH, C1-5-алкокси, -N(R)6)2, S(O)qC1-8-алкил, NHCOR6, X(CH2)nR8 или галоген, или Z1 и Z2 вместе могут быть -O-A-O на прилегающих углеродных атомах; R1 и R2 независимо представляют водород, CO2H или тетразол, Ar представляет (a), (b), фенил, или пиридил; X представляет (CH2)n или кислород.
Более предпочтительными являются соединения, в которых R3 представляет водород или -X(CH2)nR8, R11CO2R7; R4 и R5 независимо представляют водород, OH, C1-5-алкокси, SC1-5-алкил, F, Br, C1-3-алкил или NH2; Z1 и Z3 представляют водород и Z2 представляет водород, OH, C1-5 алкокси, галоген, X(CH2)nR8, NH2, бензил, NH(CO)CH3, или Z1 и Z2 вместе могут быть O-A-O.
Самыми предпочтительными являются соединения, в которых R1 представляет (b) и R2 представляет (a) или (b); A является CH2, B является -O-; отсутствует необязательная двойная связь; R1 и R2 находятся в транс по отношению к R1; Z2 представляет OH, C1-5-алкокси, -OCH2CHCH2 или водород, Z1 представляет водород; X(CH2)qCOOH или CH=CHCO2H, R4 представляет водород, замещенный фенил, или C1-2-алкокси и R5, R10 и R2 - водород.
Особенно предпочтительными являются следующие соединения:
(1RS), 2SR, 3SR)-1-(4-метоксифенил)-3-(3,4- метилендиоксифенил)индан-2-карбоновая кислота;
(1RS, 2RS, 3SR)-5-гидрокси-3-(4-метоксифенил)-1- (3,4-метилендиоксифенил)индан-2-карбоновая кислота;
(1RS, 2RS, 3SR)-5-метокси-3-(4-метоксифенил)-1-(3,4 -метилендиоксифенил)индан-2-карбоновая кислота;
(1RS, 2SR, 3SR)-1,3-бис(3,4-метилендиоксифенил)-5-5- гидроксииндан-2-карбоновая кислота;
(1RS, 2SR,3RS)-3-(2-карбоксиметокси-4-метоксифенил)-1- (3,4-метилендиоксифенил)-5-(проп-1-илокси)-индан-2-карбоновая кислота
(1RS, 2SR, 3SR)-3-(2-карбоксиметокси-4-метоксифенил)-1- (2-метокси-4,5-метилендиоксифенил)-5-(проп-1-илокси)-индан-2-карбоновая кислота;
(1RS, 2SR, 3RS)-3-2-(1-карбоксиэт-2-илокси)-4-метоксифенил-1- (3,4-метилендиоксифенил)-5-(проп-1-илокси)-индан-2-карбоновая кислота, соль бис-дициклогексиламина;
(1RS, 2SR, 3SR)-3-[2-[(E)-2-карбоксиэтен-1-ил-4-метоксифенил] -1-(3,4-метилендиоксифенил)-5-(проп-1-илокси)индан-2-карбоновая кислота;
(1RS, 2SR, 3SR)-3-[2-(2-карбоксиэт-1-ил)-4-метоксифенил] -1- (3,4-метилендиоксифенил)-5-(проп-1-илокси)-индан-2 карбоновая кислота;
(1RS,2SR,3RS)-3-[2-(3-карбоксифенил)-4-метоксифенил]-1- (3,4-метилендиоксифенил)-5-(проп-1-илокси)индан-2-карбоновая кислота;
Данное изобретение дает соединения формулы (I), приведенные выше
которые могут быть приготовлены по способу, включающему
(a) воздействие соединения формулы (2)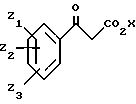
где X является C1-5-алкилом с замещенным бензальдегидом или альдегидом формулы (3)
D - CHO
где D является Ar или (c), как определено в формуле I, в подходящем растворителе, таком как бензол, с катализатором, таким как пиперидин ацетат, при нагревании до кипения с обратным холодильником с целью получения соединения формулы (4)
Циклизация соединения (4) в присутствии подходящей кислоты Льюиса, такой как тетрахлорид титана или хлорид алюминия, или иначе, когда Z1 является 3-OR (мета) (где R является C1-5 алкилом, или бензилом), трифторуксусной кислоты, дает инданон формулы (5)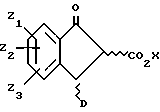
Дегидрирование с 2,3-дихлор-5,6-дициано-1,4-бензохиноном в соответствующем растворителе или иначе бромирование с пиридин гидробромид пербромидом в дихлорметане с последующей обработкой 1,5-диазабицикло(4.3.0)-нон-5-еном дает инденоны формулы (6)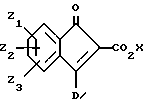
(b) или же иначе, соединение формулы 6, где Z1, Z2 и Z3 являются водородом и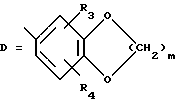
может быть приготовлено обработкой 2 бромобензойной кислоты двумя эквивалентами н-бутиллития в растворителе, таком как тетрагидрофуран, в атмосфере аргона при -78oC с последующим добавлением хлорангидрида кислоты формулы (7)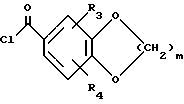
что дает соединение формулы (8)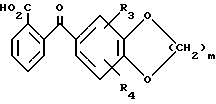
Обработка соединений типа (8) тионил хлоридом при нагревании до кипения с обратным холодильником дает хлорангидрид кислоты, который может быть выделен путем концентрации при пониженном давлении. Этот хлорангидрид кислоты может быть затем обработан диэтил магний малонатом в растворителе, таком как диэтиловый эфир, для получения соединения формулы (9)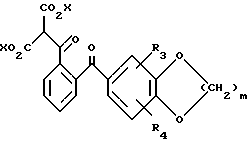
Реакция соединения типа (9) при нагревании до кипения с обратным холодильником с 5% водным карбонатом натрия дает соединения формулы (10)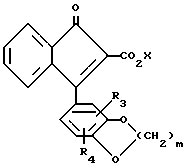
c) Обработка инденона формулы (11)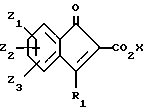
где Z1, Z2, Z3 и R1 такие, как определено для формулы I, или группа, преобразуемая в них магнийорганическим соединением формулы (12)
R2(CH2)nMgBr,
в котором R2 такой, как определено для формулы I, или группа, преобразуемая в него, в подходящем растворителе при 0oC:
дает соединения формулы (13)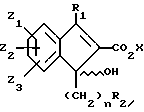
Омыление соединений формулы (13) использованием гидроокиси натрия в водном метаноле с последующим восстановлением с триэтилсиланом и бор трифторид эфератом в подходящем растворителе, таком как дихлорметан, при 0oC приводит к рацемическим соединениям формулы (14)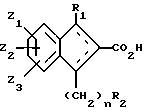
Коньюгированное присоединение нуклеофилов к эфиру, полученному из формулы (14), с последующим омылением приводит к соединениям формулы (I), имеющим R10, отличный от водорода. Повторное восстановление двойной связи в эфире, полученном из таких кислот с последующим коньюгированным присоединением, других нуклеофильных частиц и последующее омыление дает соединения формулы (I), в которых один из R10 заместителей не является водородом.
Восстановление соединений формулы (13) триэтилсиланом и бор трифторид эфератом в подходящем растворителе, таком как дихлорметан, при 0oC с последующим гидрированием газообразным водородом под давлением приблизительно 60 psi (4.22 кг/см2) в присутствии подходящего катализатора, такого как 10% палладий на активированном угле, дает соединения формулы (15)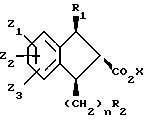
Алкилирование или ацилирование эфирного энолята, производного от формулы (15), дает соединения, в которых P1 и P2 являются такими, как определено для формулы (I).
Иначе, гидрирование соединений формулы (13) газообразным водородом под давлением приблизительно 60 psi в присутствии подходящего катализатора, такого как 10% палладий на активированном угле, в подходящем растворителе, таком как этил ацетат или метанол, содержащем 1-5% уксусной кислоты, дает соединения формулы (15). Обработка этих соединений основанием, таким как гидроокись натрия в подходящем растворителе, таком как водный этанол дает рацемические соединения формулы (16)
где Z1, Z2 и Z3 являются водородом;
R1 = R2;
n = 0.
Обработка соединений формулы (13) триэтилсиланом и бор трифторид эфератом в подходящем растворителе, таком как дихлорметан, при 0oC с последующим взаимодействием с самарий II иодидом в подходящем растворителе, таком как тетрагидрофуран, и затем омылением дает соединения формулы (17)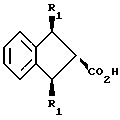
С соответствующими корректировками и защитой любых химических функциональных групп синтезы оставшихся соединений формулы (I) выполняются по методикам, аналогичным приведенным выше, и методикам, описанным в Экспериментальном разделе.
С целью использования соединения формулы (I) или его фармацевтически приемлемой соли для лечения людей и других млекопитающих оно обычно составляется в соответствии со стандартной фармацевтической практикой в виде фармацевтической композиции.
Для лечения указанных заболеваний соединения формулы (I) и их фармацевтически приемлемые соли могут назначаться стандартным способом, например орально, парентерально, подъязычно, через кожу, ректально, посредством ингаляции или транбуккальным методом.
Соединения формулы (I) и их фармацевтически приемлемые соли, которые активны, когда вводятся орально, могут быть составлены в виде сиропов, таблеток, капсул и лепешек. Технология приготовления лекарственного средства в виде сиропа обычно должна включать суспензию или раствор соединения или его соли в жидком носителе, например этаноле, арахисовом масле, оливковом масле, глицерине или воде с ароматическими добавками и красителями. Когда композиция составлена в форме таблеток, могут быть использованы любые фармацевтические носители, обычно применяемые в технологии приготовления твердых лекарственных препаратов. Примеры таких носителей включают стеарат магния, terra alba, тальк, желатину, агар, пектин, смолу акации, стеариновую кислоту, крахмал, лактозу, сахарозу. Когда композиция используется в форме капсул, подходящими являются любые общепринятые включения в капсулу, например использование вышеупомянутых носителей в твердой желатиновой оболочке капсулы. Когда композиция составляется в форме капсулы с мягкой желатиновой оболочкой, могут рассматриваться любые фармацевтические носители, обычно используемые для приготовления дисперсий или суспензий, например водные камеди, целлюлозы, силикаты или масла, и заключаются в мягкую желатиновую оболочку капсулы.
Типичные парентеральные композиции состоят из раствора или суспензии соединения или соли в стерильном водном или безводном носителе, необязательно содержащем парентерально приемлемое масло, например полиэтиленгликоль, поливинилпирролидон, лецитин, арахисовое масло или кунжутное масло.
Типичные композиции для ингаляции изготавливаются в форме раствора, суспензии или эмульсии, которые могут вводиться как сухой порошок или в форме аэрозоля, использующего общепринятые пропелленты, такие как дихлордифторметан или трихлортрифторметан.
Типичный состав суппозитория включает соединение формулы (I) или его фармацевтически приемлемую соль, которые активны при введении таким путем, со связывающим и/или смазывающим агентом, например полимерными гликолями, желатиной, маслом какао или другим растительным воском или жирами или их синтетическими аналогами.
Типичные трансдермальные составы включают обычные водные или безводные наполнители, например пасту, мазь, лосьон или крем, или применяются в форме медицинского пластыря, бляшки или пленки.
Предпочтительно композиции изготавливаются в унифицированной дозировочной форме, например таблетки, капсулы или измеренной аэрозольной дозе, так что пациент может применять их в разовой дозе.
Каждая дозированная единица для орального введения содержит соответственно от 0,1 до 500,0 мг/кг, и предпочтительно от 1 до 100 мг/кг, и каждая дозированная единица для парентерального введения содержит соответственно от 0,1 до 100,0 мг, соединения формулы (I) или его фармацевтически приемлемой соли, рассчитанной на свободную кислоту. Каждая дозированная единица введения через нос содержит соответственно 1 - 400 мг, предпочтительно от 10 до 200 мг на индивида. Составы локального применения содержат соответственно от 0,01 до 1,0% соединения формулы (I).
Суточная дозировка, требующаяся для орального введения, составляет соответственно приблизительно от 0,01 до 40,0 мг/кг, соединения формулы (I) или его фармацевтически приемлемой соли в расчете на свободную кислоту. Суточная дозировка, требуемая для парентерального введения, составляет соответственно приблизительно от 0.001 до 40,0 мг/кг соединения формулы (I) или его фармацевтически приемлемой соли в расчете на свободную кислоту.
Суточная дозировка, требуемая для введения через нос или для ротовой ингаляции, составляет соответственно приблизительно от 10 до 500 мг/индивид. Активный ингредиент может вводиться от 1 до 6 раз в день, что достаточно для проявления желаемой активности.
При введении соединений данного изобретения в соответствии с данным изобретением исключаются нежелательные токсикологические эффекты.
Биологическая активность соединений формулы (I) демонстрируется следующими испытаниями.
1. Тест связывания
А) Приготовление мембран.
Крысиный мозжечок или кортикальный слой почек быстро извлекали и немедленно замораживали в жидком азоте или использовали свежими. Ткани, 1 - 2 г для мозжечка или 3 - 5 г для кортикального слоя почек, гомогенизировали в 15 мл буфера, содержащего 20 мМ трис HCl и 5 мМ ЭДТА, pH 7,5 при 4oC, используя механический гомогенизатор. Гомогенаты отфильтровывали через марлю и центрифугировали при 20000 g (об/мин) 10 мин при 4oC. Супернатант удалили и центрифугировали при 40000 g 30 мин при 4oC. Полученный в результате осадок ресуспендировали в небольшом объеме буфера, содержащего 50 мМ Трис, 10 мМ Mg Cl2, pH 7,5; разделили на аликвоты в маленьких сосудах и заморозили в жидком азоте. Препарат мембран разбавили так, чтобы на каждую пробирку количество белка в анализе связывания составило 1 и 5 мг для мозжечка и кортикального слоя почек.
Свежевыделенные мезентериальная артерия и коллатеральное сосудистое ложе крысы промыли ледяным физиологическим раствором и удалили лимфатические узлы вдоль главного сосуда. Затем ткань гомогенизировали, используя политрон в буфере, содержащем 20 мМ Трис и 5 мМ ЭДТА, pH 7,5 при 4oC в 15 мл объеме для ≈ 6 gm мезентериального ложа артерии. Гомогенат пропустили через марлю и центрифугировали при 2000 g 10 мин при 4oC. Супернатант удалили и центрифугировали при 40000 g 30 мин при 4oC. Полученный осадок ресуспендировали как объяснено выше для мозжечка и кортикального слоя почек. В экспериментах по связыванию использовали приблизительно 10 мг мембранного белка для каждой пробирки.
В) Протокол 125I ET - I связывания.
Связывание 125I ET - I с мембранами крысиного мозжечка (2 - 5 мг белка/пробирку) или кортикального слоя почки (3 - 8 мг белка на пробирку) измерили после 60 минут инкубации при 30oC в буфере 50 мМ Трис HCl, 10 мМ MgCl2, 0.05% (BSA) бычьего сывороточного альбумина, pH 7.5 в общем объеме 100 мл. Мембранный белок добавляли в пробирки, содержащие или буфер, или указанные концентрации соединений. [125I] ET-I (2200 Ci/ммоль) разбавили в том же буфере, содержащем бычий сывороточный альбумин (БСА) так, чтобы получить конечную концентрацию 0,2 - 0,5 нМ ET-I. Общее и неспецифическое связывание измеряли в отсутствии и в присутствии 100 нМ немеченого ET-I. После инкубации реакции гасили 3 мл охлажденного буфера, содержащего 50 мМ Трис и 10 мМ Mg Cl2, pH 7,5. Связанную с мембранами радиоактивность отделили от свободного лиганда фильтрацией через фильтровальную бумагу Whatman GF/C и промыванием фильтров 5 раз по 3 мл охлажденного буфера, используя устройство для сбора клеток Brandel'a. Фильтры просчитаны в гамма счетчике с эффективностью 75%. IC50'S для соединений данного изобретения находится в пределах от 0,1 нм до 50,0 мкм.
11. Активность гладкой мускулатуры сосудов in vitro
Аорту крысы очистили от соединительной ткани и прилипшего жира и разрезали на кольцевые сегменты приблизительно от 3 до 4 мм длиной. Сосудистые кольца суспендировали в камерах для инкубации органов (10 мл), содержащих бикарбонатный раствор Кребса следующего состава, ммоль: NaCl-112,0; RCl-4,7; KH2PO4-1,2; MgSO4-1,2; CaCl2-2,5; N2HCO3-25,0 и декстроза-11,0. Инкубационные растворы поддерживали при 37oC и непрерывно аэрировали смесью 95% O2 и 5% CO2. Остаточное напряжение аорты поддерживали при 1 г и дали уравновеситься в течение 2 ч, в течение которых инкубационных раствор заменяли каждые 15 - 20 мин. Изометрические напряжения записывали на динографах Beckman'a R-611 с преобразователем силы Grass'a FTO3. Кумулятивные кривые концентрация-ответ на ET-I или других стимуляторов сокращения построили методом постепенного пошагового прибавления стимулятора. Концентрации ET-I увеличивали только после того, как предыдущая концентрация давала в ответ устойчивое сокращение. На каждом кусочке ткани получали только одну кривую концентрация-ответ на ET-I. Антагонисты рецепторов ET добавлялись к парным образцам ткани за 30 мин до начала определения концентрационных кривых ответа на стимуляторы сокращения.
Индуцируемые ET-I сокращения сосудов выражают как процент ответа на 60 мМ KCl для каждой индивидуальной ткани, который определяют в начале каждого эксперимента. Данные выражают как среднее ± стандартная ошибка среднего (S. E.M.). Конденсаты диссоциации (Kb) конкурентных антагонистов определили стандартным методом Arunlakshana u Schild'a. Действующий диапазон для соединений данного изобретения находится в пределах от 0,1 нМ до 50,0 мкм.
Следующие примеры являются иллюстративными и не ограничивают соединения данного изобретения.
Пример 1.
(1RS,2RS,3SR)-1-(4-Метоксифенил)-3-фенилиндан-2-карбоновая кислота.
а) Этил(1RS)[1-Гидрокси-1-(4-метоксифенил)]-3-фенилиден-2- карбоксилат.
К сухой магниевой стружке (0.88 г, 36 ммоль) в атмосфере аргона добавили порциями раствор п-броманизола (4.5 мл, 36 ммоль) в 5% ТГФ/Et2O (37 мл). Полученный раствор п-метоксифенил магний бромида добавили к раствору этил 1-оксо-3-фенил-инден-2-карбоксилата (5.0 г, 18 ммоль) в Et2O (300 мл) в атмосфере аргона при 0oC. Полученной смеси дали нагреться до комнатной температуры и перемешивали 10 мин. Смесь распределялась между 3М HCl (100 мл) EtOAc (200 мл). Органический экстракт последовательно промыли водой, водным NaHCO3, H2O и насыщенным водным NaCl и высушили (Na2SO4). Растворитель удалили при пониженном давлении для получения желтого масла, которое обработали Et2O/гексан. Образовавшийся твердый продукт собрали путем фильтрации (3.47 г). Фильтрат сконцентрировали при пониженном давлении и очистили мгновенной хроматографией. Материал, который был изолирован, обработали Et2O/гексан, и образовавшийся дополнительный твердый продукт (1.76 г, 75% общего выхода) собрали путем фильтрации с целью получения названного в заглавии соединения.
в) этил (RS)-1-(4-Метоксифенил)-3-фенилинден-2-карбоксилат.
К раствору этил (1RS) [1-гидрокси-1-(4-метоксифенил)]-3- фенилинден-2 карбоксилата (4,65 г, 12,0 ммоля) в CH2Cl2 (40 мл) при 0oC в атмосфере аргона добавили триэтилсилан (2.34 мл, 14.6 ммоль), и впоследствии - бор трифторид эферат (8.8 мл, 71 ммоль). Реакционной смеси дали нагреться до комнатной температуры и перемешивали 10 мин, медленно добавив за это время 3М HCl (50 мл). Смесь экстрагировали EtOAc (150 мл). Органический экстракт последовательно промыли водой, водным N2HCO3, H2O и насыщенным водным NaCl и высушили. Растворитель удалили при пониженном давлении и остаток очистили мгновенной хроматографией на силикагеле, элюируя 10% EtOAc/гексан для получения названного в заглавии соединения (4.2 г, 95%) в виде смеси Δ 1 и Δ 2 изомеров двойной связи.
с) Этил (1RS,2SR,3SR)-1-(4-Метоксифенил)-3-фенилиндан-2- карбоксилат.
К раствору этил (RS)-1-(4-метоксифенил)-3-фенилинден-2- карбоксилата (5.75 г, 15 ммоль) в EtOAc (150 мл) добавили 5% палладий на активированном углероде (600 мг). Полученную суспензию перемешивали в атмосфере H2 1 день, затем профильтровывали через слой Целита. Фильтрат сконцентрировали при пониженном давлении, что дало названное в заглавии соединение, которое использовали без дополнительной очистки.
d) (1RS,2RS,3-SR)-1-(4-Метоксифенил)-3-фенилиндан-2- карбоновая кислота.
К раствору этил (1RS, 2SR, 2SR)-1-(4-метоксифенил)-3-фенилиндан -2-карбоксилата, (5,5 г, 14.8 ммоля) в EtOH (70 мл) добавили 5H NaOH (9 мл, 45 ммоль). Полученную смесь перемешивали в атмосфере аргона 1 день, добавили за это время H2O (70 мл). Смесь сконцентрировали при пониженном давлении. Водный остаток экстрагировали Et2O и Et2O - экстракты отбросили. Водную фазу подкислили 6М HCl и экстрагировали несколько раз EtOAc. Объединенные EtOAc экстракты промыли последовательно водой и насыщенным водным NaCl и высушили. Растворитель удалили при пониженном давлении для получения маслянистого остатка, кристаллизовавшегося при стоянии. Твердый продукт перекристаллизовывался из EtOAc/гексан, получив названное в заглавии соединение (4.25 г, 83%); Т.пл. 164 - 166oC.
Здесь и далее:
в спектре ПМР 1H-ЯМР m - мультиплет, d - дуплет, s - синглет, t - триплет, dd - двойной дуплет, br - уширенный, apparent - кажущийся, sextet - секстет, dt - двойной триплет,
В данных элемент. анализа: Calc. - рассчитано, Found - найдено
В данных масс-спекрометрия: (exact mass) - точная масса
1H NMP (CDCl3): δ 7.35 - 7.18 (m, 9H); 6,92 - 6.88 (m, 4H), 4,68 (d, 1H, J = 10 HZ); 4,64 (d, 1H, J = 10 HZ); 3.81 (S, 3H); 3.34 (t, 1H, J = 10 HZ).
M: 345 [(M + H)+].
Anal. CaIc. C23H20O3: C, 80.21; H, 5.85.
C, 80,21; H 6,03.
Пример 2. (транс, транс)-1,3, -ди(4-Метоксифенил)-индан-2- карбоновая кислота.
a) Этил-2-Бензоил-3-(4-гидроксифенил)пропеонат.
К раствору 4-гидроксибензальдегида (31,7 г, 0.26 ммоль) и этил бензоилацетата (45.5 мл, 0.26 ммоль) в EtOH (45 мл) в атмосфере аргона добавили пиперидин (2.6 мл, 0.026 ммоль) и уксусную кислоту (3 капли). После перемешивания в течение ночи при комнатной температуре, полученную твердую смесь обрабатывали горячим EtOH (700 мл) и затем дали охладиться. Образовавшиеся кристаллы собрали фильтрацией, получив названное в заглавии соединение (61.0 г, 79%).
b) Этил (2RS,3SR)-3-(4-Гидроксифенил)-1-оксоиндан-2- карбоксилат.
К смеси этил 2-бензоил-3-(4-гидроксифенил)пропеоната (0.50 г, 1.7 ммоль) в CH2Cl2 (15 мл) при 0oC в атмосфере аргона добавили титан тетрахлорид (0,93 мл, 8.3 ммоль). Полученной смеси дали перемешаться в течение ночи при комнатной температуре. Реакцию медленно прекратили добавлением 3М охлажденной HCl, затем реакционную смесь распределили между EtOAc (50 мл) и 3М HCl. Водную фазу экстрагировали EtOAc, и объединенные органические экстракты промыли последовательно H2O и насыщенным водным NaCl и высушили (Na2SO4). Растворитель удалили при пониженном давлении, и твердый остаток перекристаллизовали из EtOAc/гексан для получения названного в заглавии соединения (410 мг, 82%).
c) Этил (2RS, 3SR)-3-(4-Бутилдиметилсилоксифенил)-1-оксоиндан -2-карбоксилат.
К раствору этил (2RS,3SR)-3-(4-гидроксифенил)-1-оксоиндан-2- карбоксилата (3.0 г, 10.2 ммоль) в ДМФ (10 мл) в атмосфере аргона добавили имидазол (1.72 г, 25.3 ммоль) и т-бутилдиметилхлоро-силан (1.82 г, 12.1 ммоль). Полученной смеси дали перемешиваться 3 дня при комнатной температуре, затем вылили в разбавленную водную HCl и экстрагировали EtOAc (2х). Объединенные органические экстракты промыли последовательно H2O, водным NaHCO3, H2O и насыщенным водным NaCl и высушили. Растворитель удалили при пониженном давлении для получения названного в заглавии соединения (5,40 г), которое использовали без дальнейшей очистки.
d) Этил 3-(4-т-бутилдиметилсилоксифенил)-1-оксоинден-2 -карбоксилат.
К раствору этил (2RS,3SR)-3-(4-т-бутилдиметилсилоксифенил)-1- оксоиндан-2-карбоксилата (130 мг, 0.32 ммоль) в CH2Cl2 (3 мл) в атмосфере аргона добавили 2,3-дихлоро-5,6-дициано-1,4- бензохинон (80 мг, 0,35 ммоля). Полученную смесь перемешивали 2,5 часа. Добавили водный NaHSO3 и EtOAc, и смесь перемешивали 5 мин. Водную фазу отделили и экстрагировали EtOAc, и объединенные органические экстракты промыли последовательно водным NaHCO3, H2O и насыщенным водным NaCl и высушили. Растворитель удалили при пониженном давлении и остаток очистили мгновенной хроматографией на силикагеле с целью получения названного в заглавии соединения (110 мг, 85%).
e) Этил (1RS)-3-(4-т-бутилдиметилсилоксифенил)-1-гидрокси-1- (4-метоксифенил)инден-2-карбоксилат.
К сухой магниевой стружке (119 мг, 4.9 ммоль) в атмосфере аргона порциями добавляли раствор п-бромоанизола (0,61 мл, 4.9 ммоль) в 9:1 Et2O/ТГФ (10 мл). Полученный раствор п-метоксифенил магний бромида добавили к раствору этил 3-(4-т-бутилдиметилсилоксифенил)-1-оксоинден-2-карбоксилата (1.00 г, 2.5 ммоль) в Et2O (60 мл) в атмосфере аргона при 0oC. Полученной смеси дали нагреться до комнатной температуры и перемешали в течение 5 мин. Смесь распределили между 3М HCl и EtOAc. Органический экстракт промыли последовательно H2O, водным NaHCO3, H2O и насыщенным водным NaCl и высушили. Растворитель удалили при пониженном давлении с целью получения указанного в заглавии соединения (1.47 г), которое использовали без дальнейшей очистки.
f) Этил (RS)-1-(4-т-бутилдиметилсилоксифенил)-3- (4-метоксифенил)инден-2-карбоксилат.
К раствору этил (1RS)-3-(4-т-бутилдиметилсилоксифенил)-1-гидрокси -1-(4-метоксифенил)инден-2-карбоксилата (2,5 ммоль, приготовленного выше) в CH2Cl2 (10 мл) при 0oC в атмосфере аргона добавили триэтилсилан (0.48 мл, 3.0 ммоль), и впоследствии бор трифторид эферат (1.8 мл, 14.6 ммоль). Реакционной смеси дали нагреваться до комнатной температуры и перемешивали 10 мин, добавляя медленно за это время 3М HCl. Смесь экстрагировали EtOAc. Органический экстракт промыли последовательно H2O, водным NaHCO3, H2O и насыщенным водным NaCl и высушили. Растворитель удалили при пониженном давлении и остаток очистили мгновенной хроматографией на силикагеле, элюируя 15% Et2O/гексан с целью получения названного в заглавии соединения в виде смеси Δ 1 и Δ 2 изомеров двойной связи (820 мг, 67% для двух ступеней).
g) Этил (1RS, 2SR,3SR)-1-(4-т-бутилдиметилсилоксифенил)-3- (4-метоксифенил)индан-2-карбоксилат.
К раствору этил (RS)-3-(4-т-бутилдиметилсилоксифенил)-1- (4-метоксифенил)инден-2-карбоксилата (смесь Δ 1 и Δ 2 изомеров двойной связи) (750 мл, 1,5 ммоля) в EtOH (25 мл) добавили 5% палладий на активированном углероде (70 мг). Полученную суспензию перемешивали в атмосфере H2 18 часов, затем профильтровывали через слой Целита. Фильтрат сконцентрировали при пониженном давлении с целью получения названного в заглавии соединения (730 мг, 97%), которое использовали без дополнительной очистки.
h) Этил (1RS,2RS,3SR)-1-(4-гидроксифенил)-3-(4-метоксифенил) индан-2-карбоксилат.
К раствору этил (2RS,2SR,3SR)-1-(4-бутилдиметилсилоксифенил) -3-(4-метоксифенил)индан-2-карбоксилата (723 мг, 1,4 ммоль) в EtOH (20 мл) добавили 1М NaOH (1.6 мл, 1.6 ммоля), и полученную смесь перемешивали при комнатной температуре 30 мин. Смесь распределили между 3М HCl и EtOAc. Водную фазу экстрагировали EtOAc и объединенные органические экстракты промывали последовательно H2O и насыщенным водным NaCl и высушили. Растворитель удалили при пониженном давлении с целью получения названного в заглавии соединения (554 мг, 100%).
i) Этил (цис,цис)-1,3-ди(4-метоксифенил)индан-2-карбоксилат.
К раствору этил (1RS, 2RS, 3SR)-1-(4-гидроксифенил)-3-(4- метоксифенил)индан-2-карбоксилата (270 мг, 0,7 ммоль) в ацетонитриле (5 мл) при 0oC добавили 1.8-диазабицикло (5.4.0)-ундек-7-ена (0,25 мл, 1,7 ммоль), и впоследствии метил иодид (0.5 мл, 8.0 ммоль). Полученной смеси дали нагреться до комнатной температуры и перемешивали всю ночь. Смесь распределили между EtOAc и разбавленной водной HCl. Органический экстракт промыли насыщенным водным NaCl и высушили. Растворитель удалили при пониженном давлении, и остаток очистили мгновенно хроматографией для получения названного в заглавии соединения (40 мг, 32% относительно выделенного исходного материала).
j) (транс,транс)-1,3-Ди(4-метоксифенил)инден-2-карбоновая кислота.
К раствору этил (цис,цис)-1,3-ди(4-метоксифенил)-индан-2- карбоксилата (35 мг, 0,09 ммоль) в EtOH (3 мл) добавили 1М NaOH (0,25 мл, 0,25 ммоль), и полученной смеси дали перемешиваться при комнатной температуре всю ночь. Тонкослойный хроматографический анализ на это время показал, что реакция завершилась, после чего добавили 5М BaOH (0,15 мл, 0,75 ммоль), и смесь оставили стоять 5 дней при 0oC. Добавили воду и смесь сконцентрировали при пониженном давлении. Водный остаток экстрагировали Et2O (2x) и отбросили эфирные экстракты. Водную фазу подкислили 6М HCl и экстрагировали несколько раз EtOAc. Объединенные EtOAc экстракты промыли последовательно H2O и насыщенным водным NaCl, высушили. Растворитель удалили при пониженном давлении, получив маслянистый остаток, который кристаллизовался при стоянии. Твердый продукт перекристаллизовали из EtOAc/гексан для получения названного в заглавии соединения (19 мг, 59%); т.пл. 192 - 193oC.
1H-ПМР (ацетон - d6): δ 7.25 (dd, 4H, J = 6.6 HZ, 2.1 HZ); 7.21 - 7.18 (m, 2H), 6.92 (dd, 4H, J = 6.6 HZ, 2.1 HZ); 6.86 - 6.83 (m, 2H); 4.59 (d, 2H, J = 10 HZ); 3.79 (S, 6H); 3.26 (t, 1H, J = 10 HZ). MS : 392 [(M + NH4)+] .
Anal. CaIc. C24H22O4: C, 76.99; H, 5.92.
C, 76.74; H 6.15.
Пример 3. (1RS, 2SR, 3SR)-1-(4-Метоксифенил)-3- (3,4-метилендиоксифенил)индан-2-карбоновая кислота.
a) 2-(3,4-Метилендиоксибензоил)бензойная кислота.
К раствору 2-бромбензойной кислоты (12 г, 0.06 моля) в ТГФ (200 мл) при -100oC в атмосфере аргона добавили по каплям н-бутиллитий (50 мл 2.5 М раствора в гексане, 0.125 моля), поддерживая температуру ниже -90oC. По завершении добавления полученный раствор перемешивали 1 ч при -100oC, медленно добавив за это время раствор хлорангидрида пиперониловой кислоты (11 г, 0,06 ммоль) в ТГФ (50 мл), поддерживая температуру ниже -90oC. Полученной смеси дали нагреться до -80oC и перемешивали 1 час, затем дали медленно нагреться до комнатной температуры и оставили стоять на 48 ч. Реакционную смесь сконцентрировали при пониженном давлении, и остаток распределили между Et2O и 1 M HCl. Органическую фазу экстрагировали 10% водным NaOH. NaOH - экстракт подкислили концентрированной HCl, и объединенный водный продукт экстрагировали Et2O. Et2O - экстракт высушили (MgSO4) и сконцентрировали при пониженном давлении. Остаток очистили мгновенной хроматографией на силикагеле, элюируя с градиентом растворителя 10 - 30% EtOAc (0,1% HOAc) гексан для получения названного в заглавии соединения в виде не совсем белого твердого продукта (4,5 г, 28%).
b) Диэтил 2-[2-(3,4-метилендиоксибензоил)бензоилмалонат.
Раствор 2-(3,4-метилендиоксибензоил)бензойной кислоты (4,0 г, 14,8 ммоль) в тионил хлориде (30 мл) нагревали до кипения с обратным холодильником в течение 2 ч, затем дали охладиться и сконцентрировали при пониженном давлении. Остаток растворили в Et2O (50 мл) и к этому раствору добавили раствор диэтил магний малоната, приготовленный по методике Walker and Hauser, JACS, 68, 1386 (1946), использованием (0.8 г, 33.3 ммоль) и диэтил малоната (4.9 г, 30.6 ммоль) в Et2O. Полученную смесь нагревали до кипения с обратным холодильником 1 ч, затем дали охладиться и вылили в охлажденную льдом водную H2SO4 (100 мл). Водную фазу экстрагировали Et2O, и объединенный органический продукт промыли насыщенным водным NaCl и высушили. Растворитель удалили при пониженном давлении с целью получения названного в заглавии соединения в виде органического масла, которое использовали без дальнейшей очистки.
c) Этил 3-(3,4-Метилендиоксифенил)-1-оксоинден-2-карбоксилат.
Раствор, содержащий диэтил 2-[2-(3,4-метилендиоксибензоил) бензоилмалонат (неочищенное вещество, приготовленное выше) в 5% водном Na2CO3 (100 мл) нагревали до кипения с обратным холодильником 10 мин. Реакционной смеси дали затем охладиться и водную часть удалили декантацией. Остаток поместили в H2O (50 мл) и смесь нагрели до кипения, охладили и сконцентрировали при пониженном давлении. Остаток перекристаллизовали из гексана для получения названного в заглавии соединения в виде желтого твердого продукта (5.0 г, 100% для двух стадий).
d) Этил (1RS, )-1-гидрокси-1-(4-метоксифенил)-3-(3,4- метилендиоксифенил)инден-2-карбоксилат.
Раствор 4-броманизола (0.89 г, 5.0 ммоль) в 9:1 Et2O /ТГФ (10 мл) добавили к магниевой стружке (0.105 г, 5,0 ммоль), и полученной смеси дали перемешаться 30 мин. Полученный 4-метоксифенил магний бромид добавили по каплям к раствору этил 3-(3,4-метилендиоксифенил)-1-оксоинден-2-карбоксилата (0.77 г, 2.4 ммоль) в 10:1 Et2O/ТГФ (55 мл) при 0oC. Полученную смесь перемешивали при 0oC 1 ч и затем распределили между EtOAc и 1М HCl. Водную фазу экстрагировали EtOAc, и объединенные органические экстракты промыли последовательно 5% водным NaHCO3 и насыщенным водным NaCl и высушили (MgSO4). Растворитель удалили при пониженном давлении, и остаток очистили мгновенной хроматографией на силикагеле, элюируя 10% EtOAc/гексан для получения названного в заглавии соединения в виде желтого стеклообразного твердого продукта (0.80 г, 80%).
e) Этил (RS)-1-(4-метоксифенил)-3-(3,4-метилендиоксифенил) инден-2-карбоксилат.
К раствору этил (1RS)-1-(4-метоксифенил)-3-(3,4-метилендиоксифенил) -инден-2-карбоксилата (0.80 г, 1.9 ммоль) в CH2Cl2 (10 мл) при 0oC в атмосфере аргона добавили триэтилсилан (0.28 г, 2.4 ммоля) и впоследствии бор трифторид эферат (1 мл, 8.1 ммоля). Полученный раствор перемешивали при 0oC 10 мин, и затем распределили между EtOAc и 3М HCl. Органический экстракт промыли насыщенным водным NaCl и высушили (MgSO4). Растворитель удалили при пониженном давлении и остаток профильтровали через слой силикагеля, элюируя CH2Cl2. Названное в заглавии соединение (см. Δ 1 и Δ 2 изомеров двойной связи) получили в виде стеклообразного, желтого твердого вещества (0,72 г, 94%).
f) Этил (1RS, 2RS, 3SR)-1-(4-метоксифенил)-3-(3,4- метилендиоксифенил)инден-2-карбоксилат.
К раствору этил (RS)-1-(4-метоксифенил)-3-(3,4-метилендиоксифенил)- инден-2-карбоксилата (0.72 г, 1.7 ммоль) в EtOH (30 мл) добавили 10% палладий на активированном углероде (1 г). Полученную суспензию перемешивали в атмосфере H2 56 ч и отфильтровывали. Фильтрат сконцентрировали при пониженном давлении для получения названного в заглавии соединения в виде желтого твердого вещества (0.70 г, 95%), которое использовали без дальнейшей очистки.
g) (1RS, 2SR, 3SR)-1-(4-Метоксифенил-3-(3,4-метилендиоксифенил) индан-2 карбоновая кислота.
К раствору этил (1RS,2RS,3SR)-1-(4-метоксифенил)-3- (3,4-метилендиоксифенил)индан-2 карбоксилата (0.10 г, 0.2 ммоль) в EtOH (5 мл) добавили раствор гидроокиси натрия (0.10 г, 2.5 ммоля) в H2O (2 мл) Полученную смесь перемешивали при комнатной температуре в течение ночи. Смесь подкислили и образовавшийся твердый продукт собрали фильтрацией и высушили при пониженном давлении для получения названного в заглавии соединения в виде рыжевато-коричневого твердого вещества (0.04 г, 86%).
1H NMP (CDCl3): δ 7.25 (m, 5H); 6,90 (m, 4H); 6,77 (d 2H, J = 7 HZ); 5,95 (m, 2H); 4,61 (d, 2H, J = 10 HZ); 3,81 (S, 3H); 3,25 (t, 2H, J = 10 H). MS: 387 [(M - H+].
Anal. CaIc. C24H20O5 • 1/8 H2O : C, 73.79; H, 5.22.
C, 76.73; H 5.21.
Пример 4. (1RS, 2SR, 3SR)-1-(4-фторофенил)-3-(3,4- метилендиоксифенил)индан-2-карбоновая кислота.
a) Этил (1RS)-1-(4-фторофенил)-1-гидрокси-3-(3,4- метилендиоксифенил)инден-2-карбоксилат.
К раствору этил 3-(3,4-метилендиоксифенил)-1-оксоинден-2- карбоксилата (100 мг, 0,31 ммоль) в ТГФ (5 мл) в атмосфере аргона при 0oC добавили раствор свежеприготовленного 4-фторофенил магний бромида (0,62 ммоль). После перемешивания в течение 45 мин смесь распределили между 3М HCl и EtOAc. Органический экстракт последовательно промыли H2O, 5% водным NaHCO3 и насыщенным водным NaCl. Растворитель удалили при пониженном давлении и остаток очистили мгновенной хроматографией, элюируя 15% EtOAc /гексан с целью получения названого в заглавии соединения (45 мг, 35%).
b) Этил (RS)-1-(4-фторофенил)-3-(3,4-метилендиоксифенил) инден-2-карбоксилат
К раствору этил (1RS)-1-(4-фторфенил)-1-гидрокси-3-(3,4- метилендиоксифенил)инден-2-карбоксилата (45 мг, 0,11 ммоль) в CH2Cl2 (3 мл) при 0oC добавили триэтилсилан (38 мкл, 0.24 ммоль), и впоследствии бор трифторид эферат (121 мкл, 0.98 ммоля). Реакционной смеси дали нагреться до комнатной температуры и перемешивали 15 мин, медленно добавляя за это время 3М HCl. Смесь экстрагировали EtOAc. Органический экстракт промыли последовательно H2O, 5% водным NaHCO3 и насыщенным водным NaCl. Растворитель удалили при пониженном давлении для получения названного в заглавии соединения (40 мг, 90%) в виде смеси Δ 1 и Δ 2 изомеров двойной связи.
c) Этил (1RS, 2RS, 3SR)-1-(4-фторофенил)-3-(3,4- метилендиоксифенил)индан-2-карбоксилат.
К раствору этил (RS)-1-(4-фторофенил)-3-(3,4- метилендиоксифенил)инден-2-карбоксилата (40 мг, 0.10 ммолей) в EtOH (3 мл) добавили 10% палладий на активированном углероде (45 мг). Полученную суспензию перемешивали в атмосфере H2 в течение ночи, затем профильтровали через слой Целита. Фильтрат сконцентрировали при пониженном давлении с целью получения названного в заглавии соединения (40 мг, 100%), которое использовали без дальнейшей очистки.
d) (1RS, 2SR,3SR)-1-(4-фторофенил)-3-(3,4- метилендиоксифенил)индан-2-карбоновая кислота.
К раствору этил (1RS,2RS,3SR)-1-(4-фторофенил)-3-(3,4- метилендиоксифенил)индан-2-карбоксилата (60 мг 0.15 ммоль) в EtOH (0,5 мл) добавили 6М KOH (0.14 мл, 0.84 ммоль). Полученной смеси дали перемешиваться при комнатной температуре в течение ночи, затем сконцентрировали при пониженном давлении. Остаток распределили между H2O и Et2O. Водную фазу подкислили 3М HCl и экстрагировали несколько раз EtOAc. Объединенные EtOAc экстракты промыли последовательно H2O и насыщенным водным NaCl и высушили (MgSO4). Растворитель удалили при пониженном давлении с целью получения масла, которое кристаллизовали из EtOAc /гексан. Названное в заглавии соединение получили в виде почти белого кристаллического твердого вещества (22 мг, 39%); т.пл. 146 - 149oC.
1H-NMP (CDCl3): δ 7.23 (m, 4H); 6,96 (m, 1H); 6.90 (m, 1H), 6,79 (S, 2H); 6.75 (S, 1H); 5.96 (m, 2H); 4.62 (apparent br t 2H, J = 10 HZ); 3.25 (t, 1H, J = 10 HZ).
MS m/e (rel. int): 753 [(2M + I)+, 3].
Anal. CaIcd. C23H17FO4: C, 73.40; H, 4.55.
Found: C, 73.19, H, 4.45.
Пример 5. (1RS, 2SR, 3SR)-1-(3-Метоксифенил)-3-(3,4- метилендиоксифенил)индан-2-карбоновая кислота.
a) Этил (1RS)-1-гидрокси-1-(3-метоксифенил)-3-(3,4- метилендиоксифенил)инден-2-карбоксилат.
К раствору этил 3-(3,4-метилендиоксифенил)-1-оксоинден-2- карбоксилата (100 мг, 0,31 ммоль) в ТГФ (2 мл) в атмосфере аргона при 0oC добавили раствор свежеприготовленного 3-метоксифенил магний бромида (0,31 ммоль). После перемешивания в течение 15 мин дополнительно добавили 3-метоксифенил магний бромид (0.06 ммоль). Перемешивание продолжали 45 мин к этому времени анализ тонкослойной хроматографией показал, что реакция завершена. Дополнительно добавили 3-метоксифенил магний бромид (0.12 ммоль). После перемешивания в течение еще 2 ч смесь распределили между 3М HCl и EtOAc. Органический экстракт последовательно промыли H2O, 5% водным NaHCO3, H2O и насыщенным водным NaCl. Растворитель удалили при пониженном давлении и остаток очистили мгновенной хроматографией, элюируя 15% EtOAc /гексан с целью получения названного в заглавии соединения (150 мг, 100%).
b) Этил (1RS)-1-(3-метоксифенил)-3-(3,4- метилендиоксифенил)инден-2-карбоксилат.
К раствору этил (1RS)-1-гидрокси-1-(3-метоксифенил)-3-(3,4- метилендиоксифенил)-инден-2-карбоксилата (150 мг, 0.35 ммоля) в CH2Cl2 добавили триэтилсилан (67 мкл, 0.42 ммоль) и впоследствии бор трифторид эферат (213 мкл, 1.73 ммоль). Реакционной смеси дали перемешиваться в течение 30 мин, медленно добавив за это время 5% водную HCl. Смесь экстрагировали EtOAc. Органический экстракт промыли последовательно H2O, 5% водным NaHCO3, H2O и насыщенным водным NaCl и высушили (MgSO4). Растворитель удалили в вакууме и остаток очистили мгновенной хроматографией, элюируя 10% EtOAc /гексан с целью получения названного в заглавии соединения (45 мг, 31%) в виде смеси Δ 1 и Δ 2 изомеров двойной связи.
c) Этил (1RS, 2RS, 3RS)-1-(3-метоксифенил)-3-(3,4- метилендиоксифенил)индан-2-карбоксилат.
К раствору этил (RS)-1-(3-метоксифенил)-3-(3,4- метилендиоксифенил)инден-2-карбоксилата (45 мг, 0.11 ммоль) в EtOH (3 мл) добавили 10% палладий на активированном углероде (45 мг). Полученную суспензию встряхивали на гидрогенизаторе Парра при 50 psi (10.546 кг/см2) H2 в течение ночи, затем профильтровывали через слой Целита. Фильтрат концентрировали при пониженном давлении с целью получения названного в заглавии соединения (43 мг, 94%), которое использовали без дальнейшей очистки.
d) (1RS, 2SR,3SR)-1-(3-Метоксифенил)-3-(3,4- метилендиоксифенил)индан-2-карбоновая кислота.
К раствору этил (1RS,2RS,3SR)-1-(3-метоксифенил)-3-(3,4- метилендиоксифенил)индан-2-карбоксилата (43 мг, 0.10 ммоля) в EtOH (1 мл) добавили 6М KOH (0.10 мл, 0.60 ммоль). Полученной смеси дали перемешиваться при комнатной температуре в течение ночи, затем распределили между H2O и Et2O. Водную фазу подкислили 3М HCl и экстрагировали несколько раз EtOAc. Объединенные EtOAc экстракты промыли последовательно H2O и насыщенным водным NaCl и высушили (MgSO4). Растворитель удалили при пониженном давлении для получения масла, которое кристаллизовали из Et2O /гексан. Названное соединение получено в виде твердого продукта с т.пл. 131 - 133oC.
1H NMR (CDCl3: δ 7.21 (m, 3H); 6,97 - 6.73 (m, 8H); 5.95 (m, 2H); 4,61 (apparent br t 2H, J = 9 HZ); 3.67 (S, 3H); 3.30 (t, 1H, J = 9 HZ).
MS m/e (rel. int.): 777 [(2M + 1)+, 65].
Anal. Calcd. C24H20O5: C, 74.21; H, 5.19.
Found : C, 74.74; H, 5.47.
Пример 6. (1RS,3SR)-1,3-Ди-(3,4-метилендиоксифенил)- индан-2-карбоновая кислота.
a) Этил (1RS)-1-ди-(3,4-метилендиоксифенил)-1-гидроксиинден-2- карбоксилат.
К сухой магниевой стружке (0.25 г, 10 ммоль) в атмосфере аргона добавили 4-бромо-1,2-метилендиоксибензола (2.1, 10 ммоля) в 1:10 ТГФ / Et2O (22 мл). Полученному раствору дали перемешиваться при комнатной температуре в течение 2 ч. За это время дополнительно добавили ТГФ (4 мл). Полученный 3,4-метилендиоксифенилмагний бромид добавили к раствору этил 3-(3,4-метилендиоксифенил)-1-оксоинден-2- карбоксилата (0.50 г, 2 ммоля) в 1:4 ТГФ/Et2O (25 мл) в атмосфере аргона при 0oC. Полученную смесь перемешивали при 0oC 15 мин, за это время добавили 1М HCl (50 мл). Фазы разделили и водную фазу экстрагировали Et2O. Объединенные органические экстракты промыли насыщенным водным NaCl и высушивали (MgSO4). Растворитель удалили при пониженном давлении и остаток очистили мгновенной хроматографией, элюируя 10% EtOAc / гексан с целью получения названного в заглавии соединения в виде желтого твердого продукта (0,29 г, 42%).
b) Этил (RS)-1-1,3-ди-(3,4-метилендиоксифенил)инден-2- карбоксилат.
К раствору этил (1RS)-1,3-ди-(3,4-метиленлиоксифенил)-1- гидроксиинден-2-карбоксилата (0,29 г, 0,65 ммоль) в CH2Cl2 (3 мл) при 0oC в атмосфере аргона добавили триэтилсилан (91 мг, 0,78 ммоль), и впоследствии бор трифторид эферат (0.3 мл, 2.4 ммоль). Реакционную смесь перемешивали 10 мин, за это время добавили охлажденную льдом 1М HCl, и смесь экстрагировали EtOAc. Органический экстракт промыли насыщенным водным NaCl и высушили (MgSO4). Растворитель удалили при пониженном давлении, осадок поместили на небольшой слой силикагеля, элюируя CH2Cl2 для получения названного в заглавии соединения (257 мг, 92%).
c) Этил (1RS,3RS)-1,3-ди-(3,4-метилендиоксифенилиндан-2- карбоксилат.
Этил (RS)-1,3-ди-(3,4-метилендиоксифенил)инден-2-карбоксилат (163 мг, 0.38 ммоль) поместили в MeOH (0.05 мл), и к этой смеси добавили SmI2 (10 мл 0.1М раствора в ТГФ, 1.0 ммоль). Полученную смесь перемешивали в атмосфере аргона в течение ночи, к этому времени анализ тонкослойной хроматографией показал, что реакция завершилась. Добавили дополнительное количество SmI2 (5 мл 0.1 M раствора в ТГФ, 0.5 ммоль), и перемешивание продолжали в течение 2 ч. Реакционную смесь распределили между Et2O и 5% водным Na2S2O3. Органический экстракт промыли насыщенным водным NaCl и высушили (MgSO4). Растворитель удалили при пониженном давлении и остаток очистили мгновенной хроматографией, элюируя 10% EtOAc /гексан с целью получения названного в заглавии соединения в виде бесцветного, стеклообразного твердого вещества (120 мг, 75%).
d) (1RS,3RS)-1,3-ди-(3,4-Метилендиоксифенил)индан-2-карбоновая кислота.
К раствору этил (1RS,3RS)-1,3-ди-(3,4-метилендиоксифенил)индан- 2-карбоксилата (75 мг, 0.17 ммоль) в EtOH (20 мл) добавили NaOH (0.10 г, 2.5 ммоль). Полученной смеси дали перемешиваться при комнатной температуре 3 дня, к этому времени тонкослойная хроматография показала, что реакция завершилась. Смесь нагревали затем до кипения с обратным холодильником в течение 36 ч, дали охладиться и сконцентрировали при пониженном давлении. К остатку добавили концентрированной HCl, и образовавшийся твердый продукт собрали фильтрацией и высушили. Твердый продукт растерли в порошок с кипящим гексаном с целью получения названного в заглавии соединения в виде белого твердого вещества (50 мг, 73%); т.пл. 182 - 185oC.
1HNMP (CDCl3), δ 7.25 (m, 2H); 7.15 (m, 1H); 7.00 (m, 1H); 6.76 (S, 2H); 6,68 (m, 2H); 6.50 (dd, 1H, J = 8,1 HZ); 6.40 (d, 1H, J = 2 HZ); 5.94 (S, 2H); 5.90 (d, 1H, J = 1 HZ); 5.87 (d, 1H, J = 1HZ); 4.84 (d, 1H, J = 10 HZ); 4.78 (d, 1H, J = 10 HZ); 3.63 (dd, 1H, J = 10 HZ, 9 HZ).
MS: 402 (M)+
Anal : CaIcd. C24H18O6 • 1/5 H2O: C, 71.00; H, 4.52.
Found : C, 71.13; H, 4.46.
Пример 7. (транс,транс)-1,3-ди-(3,4-Метилендиоксифенил)индан- 2-карбоновая кислота.
a) Этил (цис,цис)-1,3-ди-(3,4-метилендиоксифенил)-индан-2- карбоксилат.
К раствору этил (RS)-1,3-ди-(3,4-метилендиоксифенил)инден -2-карбоксилата (93 мг, 0.22 ммоль) в EtOH (2 мл) добавили 10% палладий на активированном углероде (0,10 г). Полученную суспензию встряхивали на гидрогенизаторе Парра при 55 psi (10.898 кг/см2) в атмосфере H2 в течение 2 дней, затем профильтровали через слой целита. Фильтрат сконцентрировали при пониженном давлении с целью получения названного соединения (45 мг, 48%) в виде стеклообразного, желтого твердого вещества, которое использовали без дальнейшей очистки.
b) (транс,транс)-1,3-ди-(3,4-Метилендиоксифенил)-индан-2- карбоновая кислота.
К раствору этил (цис,цис)-1,3-ди-(3,4-метилендиоксифенил)индан -2-карбоксилата (45 мг, 0.1 ммоль) в 2:1 EtOH) H2O (15 мл) добавили гидроокись натрия (50 мг, 1.2 ммоль). Полученному раствору дали перемешиваться при комнатной температуре в течение ночи, затем сконцентрировали при пониженном давлении. Остаток обработали концентрированной HCl, и полученный твердый продукт собрали фильтрацией и высушили. Твердый продукт перекристаллизовали из Et2O / гексан с целью получения названного в заглавии соединения в виде твердого вещества светло-рыжевато-коричневого цвета (12 мг, 30%); т.пл. 188 - 191oC.
Пример 8. (1RS, 2RS, 3SR)-1-(3,4-Метилендиоксифенил)-3- фенилиндан-2-карбоновая кислота.
a) Этил (1RS)-1-гидрокси-1-(3,4-метилендиоксифенил)-3- фенилинден-2-карбоксилат.
К раствору этил 1-оксо-3-фенилинден-2-карбоксилата (1.0 г, 3.6 ммоль) в ТГФ (35 мл) в атмосфере аргона при 0oC добавили к раствору свежеприготовленный 3,4-метилендиоксифенил магний бромид (5.4 ммоль). После перемешивания в течение 30 мин смесь распределили между 3М HCl и EtOAc. Органический экстракт промыли последовательно H2O, 5% водным насыщенным водным NaCl и высушили (MgSO4). Растворитель удалили при пониженном давлении, и остаток очистили мгновенной хроматографией, элюируя 10% EtOAc/гексан с целью получения названного в заглавии соединения (1,03 г, 72%).
b) Этил (RS)-1-(3,4-метилендиоксифенил)-3-фенил-инден-2- карбоксилат.
К раствору этил (1RS)-1-гидрокси-1-(3,4-метилендиоксифенил)-3- фенилинден-2-карбоксилата (1,03 г, 2,58 ммоля) в CH2Cl1 (40 мл) добавили триэтилсилан (0,49 мл, 3,07 ммоль) и впоследствии бор трифторид эферат (1,55 мл, 12,6 ммоль). Реакционной смеси дали перемешаться в течение 15 мин, за это время медленно добавили 3М HCl. Смесь экстрагировали EtOAc. Органический экстракт промыли последовательно H2O, 5% водным NaHCO3 и насыщенным водным NaCl. Растворитель удалили при пониженном давлении для получения названного в заглавии соединения (1,00 г, 100%) в виде смеси Δ 1 и Δ 2 изомеров двойной связи.
c) Этил (1RS,2SR,3SR)-1-(3,4-метилендиоксифенил)-3-фенилиндан- 2-карбоксилат.
К раствору этил (RS)-1-(3,4-метилендиоксифенил)-3-фенилинден-2- карбоксилат (1.00 г, 2.60 ммоль) в (25 мл) добавили 10% палладия на активированном углероде (30 мг). Полученную суспензию перемешивали в атмосфере H2 в течение ночи. Когда анализ тонкослойной хроматографией показал, что реакция закончилась, добавили дополнительно 10% палладия на активированном углероде (30 мг), и смесь встряхивали на гидрогенизаторе Парра при 30 psi (2.109 кг/см2) H2 в течение 2 дней. К этому времени анализ тонкослойной хроматографией снова показал, что реакция завершена. Реакционную смесь профильтровали через слой Целита и добавили 10% палладий на активированном углероде (250 мг). Реакционную смесь встряхивали на гидрогенизаторе Парра при 60 psi (4.218 кг/см2) H2 в течение ночи. Фильтрация и повтор последних условий гидрирования привели к полному расходованию исходного материала. Реакционную смесь профильтровали через слой Целита, и фильтрат сконцентрировали при пониженном давлении с целью получения названного в заглавии соединения (650 мг, 65%, которое использовали без дальнейшей очистки.
d) (1RS, 2RS,3SR)-1-(3,4-Метилендиоксифенил)-3-фенилиндан-2- карбоновая кислота.
К раствору этил (1RS, 2SR,3SR)-1-(3,4-метилендиоксифенил)-3- фенилиндан-2-карбоксилата (650 мг, 1.68 ммоль) в EtOH, содержащему несколько капель ТГФ, добавили 6М KOH (1.68 мл, 10.1 ммоль). Полученной смеси дали перемешиваться при комнатной температуре в течение ночи, затем сконцентрировали при пониженном давлении. Остаток распределили между H2O и Et2O. Водную фазу подкислили 3М HCl и экстрагировали несколько раз EtOAc. Объединенные EtOAc экстракты промыли последовательно H2O и насыщенным водным NaCl и высушили (MgSO4). Растворитель удалили при пониженном давлении с целью получения масла, которое кристаллизовалось из EtOAc/гексан. Названное соединение получено в виде твердого вещества (305 мг, 51%); т.пл. 186 - 187oC.
Anal. CaIcd. C23H18O4: C, 77.08; H, 5.06.
Found : C, 76.60; H, 5.08.
Пример 9. (1RS, 2SR, 3SR)-1-(4-Метоксифенил)-3-(3,4- метилендиоксифенил)-2-(тетразол-5-ил)-индан.
a) (1RS, 2SR,3SR)-1-(4-Метоксифенил)-3-(3,4- метилендиоксифенил)индан-2-карбоксамид.
Смесь (1RS, 2SR, 3SR)-1-(4-метоксифенил)-3-(3,4- метилендиоксифенил)индан-2-карбоновой кислоты (250 мг, 0,64 ммоля) в SOCl2 (2,5 мл) дали перемешиваться в течение ночи в атмосфере аргона. Реакционную смесь сконцентрировали при пониженном давлении, и остаток растворили в бензоле (5 мл). К полученной смеси добавили в атмосфере аргона концентрированный NH4OH (5 мл). Образовавшийся твердый продукт собрали фильтрацией, промыли H2O и высушили при пониженном давлении с целью получения названного в заглавии соединения (185 мг, 75%).
b) (1RS, 2SR,3SR)-1-(4-Метоксифенил)-3-(3,4- метилендиоксифенил)индан-2-карбонитрил.
К охлажденному льдом ДМФ (1 мл) в атмосфере аргона добавили оксалил хлорид (68 мкл, 0,78 ммоль). После перемешивали в течение 5 мин при 0oC, добавили раствор (1RS,2SR,3SR)-1-(4-метоксифенил)- 3-(3,4-метилендиоксифенил)индан-2-карбоксамида карбоксамида (150 мг, 0.39 ммоль) в ДМФ (2 мл), и дополнительно продолжали перемешивание 10 мин при 0oC. Реакционную смесь распределили между EtOAC и 3М HCl. Водную фазу экстрагировали EtOAc, и объединенные органические экстракты промыли последовательно H2O, водным NaHCO3, H2O и насыщенным водным NaCl и высушили. Растворитель удалили при пониженном давлении с целью получения названного в заглавии соединения в виде белого твердого вещества (135 мг, 94%), которое использовали без дальнейшей очистки.
c) (1RS, 2SR, 3SR)-1-(4-Метоксифенил)-3-(3,4-метилендиоксифенил) -2-(тетразол-5-ил)индан.
К ТГФ (2,5 мл) при -78oC в атмосфере аргона добавили алюминий хлорид (90 мг, 0,67 ммоль). После медленного нагревания до комнатной температуры добавили азид натрия (130 мл, 2,2 ммоля), и полученную смесь нагревали при 70oC в течение 5 мин, затем охладили до комнатной температуры. К реакционной смеси добавили раствор (1RS,2SR,3SR)-1-(4-метоксифенил)-3-(3,4-метилендиоксифенил) -индан-2-карбонитрила (125 мг, 0.34 ммоль) в ТГФ (2,5 мл). После нагревания при 70oC в течение ночи анализ реакционной смеси тонкослойной хроматографией показал присутствие исходного материала, поэтому было приготовлено дополнительное количество AI(N3)3 как описано выше (1,34 ммоль) в ТГФ. К этой смеси добавили реакционную смесь и нагревали при 70oC, продолжали дополнительно 5 ч. Смесь распределили между EtOAc и 3М HCl. Водную фазу экстрагировали EtOAc, и объединенные органические экстракты промыли последовательно H2O и насыщенным водным NaCl и высушили. Растворитель удалили при пониженном давлении, и остаток кристаллизовали из EtOAc/гексан с целью получения названного в заглавии соединения (78 мг, 56%). Часть этого продукта была в дальнейшем очищена методом MPL C (многократной препаративной тонкослойной хроматографией) (Lichroprep RP-18, MeOH/H2O = 60/40) и затем перекристаллизацией; т.пл. 155 - 157oC (EtOAc /гексан).
1H NMR (CDCl3): δ 7.28 - 7.15 (m, 4H); 7.03 - 6.95 (m, 2H); 6.87 - 6.84 (m, 2H); 6.74 (S, 3H); 5.94 (d, 1H, J = 1.2 HZ); 5.92 (d, 1H, J = 1.2 HZ); 4.79 (d, 1H, J = 11.6 HZ); 4.73 (d, 1H, J = 11.6 HZ); 3.79 (S, 3H); 3.65 (t, 1H, J = 11.6 HZ). MS (m/e) : 413.2 [(M + H)+].
Пример 10. (1RS, 2SR, 3RS)-1-(2-Метоксифенил)-3-(3,4- метилендиоксифенил)индан-2-карбоновая кислота.
a) Этил (1RS)-1-гидрокси-1-(2-метоксифенил)-3-(3,4- метилендиоксифенил)инден-2-карбоксилат.
К сухой магниевой стружке (81 мг, 3.4 ммоль) в атмосфере аргона добавили раствор 2-броманизола (0.64 г, 3.4 ммоль) в 5:1 ТГФ/Et2O (3 мл). Часть образовавшегося раствора 2-метоксифенил магний бромида (0.45 мл, 0.51 ммоля) добавили по каплям к раствору этил 3-(3.4-метилендиоксифенил)-1-оксоинден-2-карбоксилата (100 мг, 0.34 ммоль) в ТГФ (6 мл) в атмосфере аргона при 0oC. После перемешивания в течение 15 мин смесь распределили между 3М HCl и EtOAc. Органический экстракт промыли последовательно H2O, 5% водным NaHCO3, H2O и насыщенным водным NaCl. Растворитель удалили при пониженном давлении и остаток очистили мгновенной хроматографией, элюируя 15% EtOAc/гексан с целью получения названного в заглавии соединения (100 мг, 68%).
b) Этил (RS)-1-(2-метоксифенил)-3-(3,4-метилендиоксифенил) инден-2-карбоксилат.
К раствору этил (1RS)-1-гидрокси-1-(2-метоксифенил)-3-(3,4- метилендиоксифенил)инден-2-карбоксилата (100 мг, 0.23 ммоль) в CH2Cl2 (5 мл) добавили триэтилсилан (32 мг, 0.28 ммоль), и впоследствии бор трифторид эферат (0.13 мл, 1.05 ммоль). Реакционной смеси дали нагреться до комнатной температуры и перемешивали 10 мин, за это время медленно добавили 3М HCl. Смесь экстрагировали EtOAc. Органический экстракт промыли последовательно H2O, 5% водным NaHCO3, H2O и насыщенным водным NaCl и высушили (MgSO4. Растворитель удалили при пониженном давлении для получения названного в заглавии соединения (91 мг, 96%) в виде смеси Δ 1 и Δ 2 изомеров двойной связи.
c) Этил (1RS, 2RS, 3RS)-1-(2-метоксифенил)-3-(3,4- метилендиоксифенил)индан-2-карбоксилат.
К раствору этил (RS)-1-(2-метоксифенил)-3-(3,4- метилендиоксифенил)инден-2-карбоксилата (90 мг, 0.22 ммоль) в EtOH (10 мл) добавили 10% палладий на активированном углероде (90 мг). Полученную суспензию встряхивали на гидрогенизаторе Парра при 60 psi H2 в течение ночи, затем профильтровали через слой Целита. Фильтрат сконцентрировали при пониженном давлении с целью получения названного в заглавии соединения (90 мг, 100%), которое использовали без дальнейшей очистки.
d) (1RS, 2SR,3RS)-1-(2-Метоксифенил)-3-(3,4- метилендиоксифенил)индан-2-карбоновая кислота.
К раствору этил (1RS,2RS,3RS)-1-(2-метоксифенил)-3- (3,4-метилендиоксифенил)индан-2-карбоксилат (90 мг, 0.22 ммоль) в EtOH (2 мл), содержащему несколько капель ТГФ, добавили 6М KOH (0.22 мл, 1,32 ммоль). Полученной смеси дали перемешиваться при комнатной температуре в течение ночи, затем сконцентрировали при пониженном давлении. Остаток распределили между H2O и Et2O. Водную фазу подкислили 3М HCl и экстрагировали EtOAc. EtOAc экстракт промыли последовательно H2O и насыщенным водным NaCl и высушили (MgSO4). Растворитель удалили при пониженном давлении с целью получения названного в заглавии соединения (40 мг, 49%).
1H NMP (CDCl3): δ 7.37 - 6.73 (m, 11H); 5.93 (m, 2H); 5.03 (d, 1H, J=10 HZ); 4.67 (d, 1H, J=10 HZ); 3.70 (S, 3H); 3.38 (t, 1H, J=10 HZ).
Пример 11. (1RS, 2SR, 3SR)-5-Гидрокси-3-(4-метоксифенил)-1-(3,4- метилендиоксифенил) индан-2-карбоновая кислота, натриевая соль
a) 3-Бензилоксиацетофенон.
К смеси гидрида натрия (4.5 г, 80% дисперсии в минеральном масле, 0.15 моль), который был освобожден от минерального масла промывкой, в ДМФ (25 мл) добавили по каплям при охлаждении раствор 3-гидроксиацетофенона (20.5 г, 0.15 моль) в ДМФ (25 мл). После завершения добавления смеси дали перемешиваться при комнатной температуре 15 мин, за это время добавили бензил бромид (25,6 г, 0.15 моль). Полученной смеси дали перемешиваться при комнатной температуре в течение ночи, затем распределили между EtOAc и 3М HCl. Водную фазу экстрагировали EtOAc, и объединенные органические экстракты промывали последовательно 1М NaOH, H2O и насыщенным водным NaCl и высушили. Растворитель удалили при пониженном давлении с целью получения названного в заглавии соединения (33 г, 97%), которое использовали без дальнейшей очистки.
b) Метил 2-(3-бензилокси)бензоилацетат.
К смеси гидрида натрия (28.3 г 80% дисперсии в минеральном масле, 0.94 моль), который был освобожден от минерального масла промывкой, в диметил карбонате (100 мл) в атмосфере аргона добавили за 30 мин раствор 3-бензилоксиацетофенона (92,3 г, 0.41 моль) в диметил карбонате (150 мл). По завершении добавления смесь нагревали до кипения с обратным холодильником в течение 30 мин, затем охладили в ледяной бане и остановили реакцию медленным добавлением 3М HCl, и водную фазу экстрагировали EtOAc. Объединенные органические экстракты промыли последовательно H2O, водным NaHCO3, H2O и насыщенным водным NaCl и высушили. Растворитель удалили при пониженном давлении с целью получения названного в заглавии соединения (112,5 г, 97%)
c) Метил 2-(3-бензилоксибензоил)-3- (3,4-метилендиоксифенил)пропеонат.
Смесь, содержащую метил 2-(3-бензилокси)бензоилацетат (75.0 г, 0.26 моль) пиперонал (43.6 г, 0.29 моль), уксусную кислоту (3.6 мл) и пиперидин (1.2 мл) в бензоле (70 мл) нагревали до кипения с обратным холодильником с азеотропным удалением воды. После нагревания до кипения с обратным холодильником в течение 4 ч реакционную смесь сконцентрировали при пониженном давлении, и остаток кристаллизовали из EtOH с целью получения названного в заглавии соединения (93.5 г, 85%); т.пл. 116 - 118oC.
d) Метил (1RS, 2SR)-5-бензилокси-1-(3,4-метилендиоксифенил)- 3-оксаиндан-2-карбоксилат.
К трифторуксусной кислоте (150 мл) при 0oC в атмосфере аргона добавили метил 2-(3-бензилоксибензоил)-3-(3,4- метилендиоксифенил)пропеноат (80.0 г, 0.19 моль). Смеси дали нагреваться до комнатной температуры и перемешивали 30 мин, при этом смесь сконцентрировали при пониженном давлении. Остаток растворили в EtOAc и промыли последовательно NaHCO3, H2O и насыщенным водным NaCl и высушили. Растворитель удалили при пониженном давлении, и маслянистый остаток кристаллизовали из EtOAc/гексан с целью получения названного в заглавии соединения (51.3 г, 64%); т. пл. 148 - 150oC.
e) Метил 5-бензилокси-1-(3,4-метилендиоксифенил)-3-оксоинден-2- карбоксилат.
К раствору метил 5-бензилокси-1-(3,4-метилендиоксифенил)-3- оксоиндан-2-карбоксилата (27.3 г, 65.6 ммоль) в бензоле (90 мл), охлажденному в бане лед-вода, добавили 2,3-дихлоро 5,6-дициано-1,4-бензохинон (15,4 г, 67.8 ммоль). Полученную смесь перемешивали при 0oC 1 ч, дали нагреться до комнатной температуры за 1.5 ч, и в заключении нагрели до 40oC за 1 час. Образовавшийся твердый продукт удалили фильтрацией и промыли бензолом. Объединенный фильтрат и промывные воды вылили в EtOAc (200 мл) и промыли последовательно водным Na2CO3 (3x), H2O (3x), 3M HCl, H2O (3x) и насыщенным водным NaCl и высушили. Растворитель удалили при пониженном давлении, и остаток кристаллизовали из EtOAc /гексан с целью получения названного в заглавии соединения (16.4 г, 60%) в виде красного кристаллического твердого соединения; т. пл. 140 - 141oC.
f) Метил (3RS)-5-бензилокси-3-гидрокси-3-(4-метоксифенил)-1- (3,4-метилендиоксифенил)инден-2-карбоксилат.
К сухим магниевым стружкам (0.96 г, 40 ммоль) в атмосфере аргона добавили раствор 4-бромоанизола (7.48 г, 40 ммоль) в 9:1 Et2O /ТГФ (50 мл). Полученный раствор 4-метоксифенил магний бромида добавили порциями к раствору метил 5-бензилокси-1-(3,4- метилендиоксифенил)-3-оксоинден-2-карбоксилата (8,29 г, 20 ммоль) в ТГФ (250 мл) в атмосфере аргона. По завершении добавления, смесь резко охладили добавлением 3М охлажденной HCl и экстрагировали EtOAc. Органический экстракт промыли последовательно H2O, водным NaHCO3, H2O и насыщенным водным NaCl. Растворитель удалили при пониженном давлении с целью получения названного в заглавии соединения (11.58 г, 100%), которое использовали без дальнейшей очистки.
g) Метил (RS)-5-бензилокси-3-(4-метоксифенил)-1-(3,4- метилендиоксифенил)инден-2-карбоксилат.
К раствору метил (3RS)-5-бензилокси-3-гидрокси-3- (4-метоксифенил)-1-(3,4-метилендиоксифенил)инден-2-карбоксилата (сырой продукт, приготовленный выше) в CH2Cl2 (75 мл) в атмосфере аргона, при 0oC добавили триэтилсилан (3,9 мл, 23,6 ммоль) и впоследствии бор трифторид эферат (14.7 мл, 120 ммоль). Реакционную смесь перемешивали 10 мин при 0oC при этом смесь распределили между 3М HCl и EtOAc. Органический экстракт промыли последовательно H2O, водным NaHCO3, H2O и насыщенным водным NaCl и высушили. Растворитель удалили при пониженном давлении, и остаток очистили мгновенной хроматографией, элюируя с градиентом растворителя 25 - 45% Et2O /гексан. Названное в заглавии соединение (8,41 г, 83% для двух стадий) выделили в виде смеси Δ 1 и Δ 2 изомеров двойной связи.
h) Метил (1RS,2RS,3SR)-5-гидрокси-3-(4-метоксифенил)-1-(3,4- метилендиоксифенил)индан-2-карбоксилат.
К дегазированному раствору метил (RS)-5-бензилокси-3- (4-метоксифенил)-2-(3,4-метилендиоксифенил)инден-2-карбоксилата (6,60 г, 13,0 ммоль) EtOAc (25 мл) и EtOH (175 мл) добавили 5% палладий на активированном углероде (0,6 г). Полученную суспензию встряхивали на гидрогенизаторе Парра при 60 psi H2 в течение 20 ч. к этому времени ЯМР анализ реакционной смеси показал, что реакция завершилась. Катализатор удалили фильтрацией через слой Целита, и добавили свежий 5% палладий на активированном углероде (0,6 г). Смесь встряхивали на гидролизаторе Парра при 60 psi H2 дополнительно 48 ч. Катализатор удалили фильтрацией через слой Целита и фильтрат сконцентрировали при пониженном давлении. Остаток кристаллизовали из EtOAc /гексан с целью названного в заглавии соединения (4.83 г, 89%); т. пл. 187 - 188oC.
i) (1RS, 2SR, 3SR)-5-Гидрокси-3-(4-метоксифенил)-1-(3,4- метилендиоксифенил)индан-2-карбоновая кислота натриевая соль.
К раствору метил (1RS,2RS,3SR)-5-гидрокси-3-(4-метоксифенил) -1-(3,4-метилендиоксифенил)индан-2-карбоксилата (150 мг, 0,36 ммоль) в EtOH (4 мл) добавили 10% NaOH (4 мл), и полученной смеси дали перемешиваться в атмосфере аргона в течение ночи. Добавили воду (5 мл), и смесь сконцентрировали при пониженном давлении. Концентрат экстрагировали Et2O, и водную фазу подкислили и экстрагировали EtOAc. EtOAc экстракт промыли последовательно H2O и насыщенным водным NaCl и высушили. Растворитель удалили при пониженном давлении. Приготовили натриевую соль, и порцию ее (100 мг) очистили обращенно-фазовой хроматографией с целью получения названного в заглавии соединения (73 мг, 48%). Растирание этого продукта с EtOAc дало белый кристаллический твердый продукт; т. пл. 198oC (разл.).
1H NMR (MeOH-d4): δ/ 7.20 (dd, 2H, J=6.8 HZ, 2.0 HZ); 6.85 (dd, 2H, J= 6.8 HZ, 2.0 HZ); 6.80 - 6.64 (m, 5H); 6.25 (S, 1H); 5.88 - 5.87 (m, 2H); 4.47 (d, 1H, J=10 HZ); 4.43 (d, 1H, J=10 HZ); 3.76 (S, 3H); 3.03 (t, 1H, J= 10 HZ). MS (m/e) : 427 [(M+H}+].
Пример 12. (1RS,2SR,3RS)-3-(2-Карбоксиметокси-4-метоксифенил) -1-(3,4-метилендиоксифенил)-5-(проп-1-илокси)-индан-2-карбоновая кислота.
a) 3-(Проп-1-илокси)ацетофенон.
К суспензии NaH (13.84 г, 0.58 моль) в сухом ДМФ (50 мл) при 0oC C, добавили раствор 3-гидроксиацетофенона (50 г, 0,37 моль). После перемешивания в течение 30 мин добавили 1-иодопропан (70 мл, 0.72 моль) и смесь перемешивали в течение ночи при комнатной температуре. Смесь разбавили сухим ДМФ (50 мл) и далее добавили (2.77 г, 0.12 моль) и впоследствии 1-иодопропан (23 мл, 0.24 моль). Через 1 ч TCX показала, что реакция закончена и продукт осторожно погасили 6М HCl и экстрагировали EtOAc. EtOAc экстракт промыли последовательно: H2O, 10% водным NaOH и затем раствором соли. После высушивания (MgSO4) фильтрация и упаривание дали названное в заглавии соединения (65 г, 98%) в виде желтого масла, которое использовали без дальнейшей очистки.
b) Метил 3-(проп-1-илокси)бензоилацетат.
К суспензии NaH (12 г, 0.5 моль) в сухом диметил карбонате (50 мл) добавили медленно раствор 3-(проп-1-илокси) ацетофенона (65 г, 0,37 моль) в сухом диметил карбонате (100 мл). Во время добавления экзотермичность реакции привела к нагреванию до температуры кипения. После добавления смесь перемешали механически в течение ночи и затем осторожно погасили 3М HCl и экстрагировали EtOAc. EtOAc экстракт промыли последовательно: H2O, 5% водным NaHCO3, H2O и раствором соли. После промывания (MgSO4) фильтрация и упаривание дали желтое масло (82 г, количественный), которое использовали без дальнейшей очистки.
c) Метил-(1RS, 2SR)-1-(3,4-Метилендиоксифенил)-5- (проп-1-илокси)-3-оксо-индан-2-карбоксилат.
К раствору метил-3-(проп-1-илокси)бензоилацетата (10 г, 4.2 ммоль) в бензоле (50 мл) добавили 3,4-метилен диоксибензальдегид (6.36 г, 4.2 ммоль) и впоследствии пиперидин (0.42 мл, 0.42 ммоль) и ледяную уксусную кислоту (прибл. 8 капель). Смесь нагревали до кипения с обратным холодильником в течение 2 ч и летучие продукты удалили при пониженном давлении, получив метил (Z)-3-(3,4- метилендиоксифенил)-2-3-(проп-1-илокси)-бензоил пропеонат в виде желтого масла. Этот остаток растворили в трифторуксусной кислоте (50 мл) и смесь перемешивали при комнатной температуре 20 мин. Трифторуксусную кислоту удалили при пониженном давлении для получения названного в заглавии соединения в виде темного маслянистого остатка (16 г), который использовали в следующей стадии без очистки.
1H NMR (CDCl3) δ inter alia 7.85 (1H, S); 7.56 - 7.30 (3H, m); 7.08 - 7.15 (1H, m); 6.95 (1H, dd, J=8, 2 HZ); 6.78.
d) Метил-3-(3,4-метилендиоксифенил)-6-(проп-1-илокси)-1-оксо- инден-2-карбоксилат.
Метил (1RS, 2SR)-1-(3,4-метилендиоксифенил)-5-(проп-1-илокси)-3- оксо-индан-2-карбоксилат (16 г, сырой продукт из предыдущего эксперимента) растворили в диоксане (150 мл) и добавили DDQ 22 г, 0,097 моль). Смесь нагревали до кипения с обратным холодильником в течение 2 ч, затем охладили, отфильтровали и растворитель удалили при пониженном давлении. Продукт очистили мгновенной колоночной хроматографией на силикагеле (элюент: EtOAc/гексан, 20:80) для получения названного в заглавии соединения в виде оранжевого твердого вещества (5.2 г, 31% за две стадии); т. пл. 125 - 126oC.
e) Метил-(1RS)-1-(2-бензилокси-4-метоксифенил)-1-гидрокси-3-(3,4- метилендиоксифенил)-6-(проп-1-илокси)инден-2-карбоксилат.
К сухим магниевым стружкам (0.15 г, 6.25 мг, атомов) в атмосфере аргона добавили порциями раствор 2-бензилокси-4-метоксибромбензола (приготовление смотри ниже) (1.80 г, 6.15 ммоль) в 5% ТГФ/диэтиловый эфир (7 мл). Полученный 2-бензилокси-4-метоксифенил магний бромид добавили в раствору метил-3-(3,4-метилендиоксифенил)-6-(проп-1- илокси)-1-оксо-инден-2-карбоксилата (1.5 г, 4.1 ммоль) в Et2O (65 мл) в атмосфере аргона при 0oC. Полученному раствору дали нагреться до комнатной температуры и перемешивали 10 мин. Смесь распределили между 3М HCl (30 мл) и EtOAc (75 мл). Органический экстракт промыли последовательно H2O, водным NaHCO3, H2O и насыщенным водным NaCl и высушили (Na2SO4). Растворитель удалили при пониженном давлении, остаток очистили мгновенной хроматографией на силикагеле (элюент: EtOAc/гексан, 30:70) с целью получения названного в заглавии соединения в виде бледно-желтого масла (1.4 г, 59%).
f) Метил-(RS)-3-(2-бензилокси-4-метоксифенил)-1-(3,4- метилендиоксифенил)-5-(проп-1-илокси)инден-2-карбоксилат.
К раствору (1.35 г, 2.33 ммоль) в CH2Cl2 (20 мл) при 0oC в атмосфере аргона добавили триэтилсилан (0.47 мл, 2.94 ммоль), и впоследствии бор трифторид эферат (1.4 мл, 11.4 ммоль). Полученный раствор перемешивали при 0oC 10 мин затем распределили между 1М HCl и органический экстракт промыли последовательно H2O, 5% водным NaHCO3, H2O и раствором соли. После высушивания (Na2SO4) растворитель удалили при пониженном давлении, и продукт очистили колоночной хроматографией на силикагеле (элюент: EtOAc/гексан, 25:75). Названное в заглавии соединение (в виде отдельного неопределенного изомера двойной связи) получено в виде желтого масла (0.65 г, 50%).
g) Метил-(1RS,2RS,3RS)-3-(2-гидрокси-4-метоксифенил)-1- (3,4-метилендиоксифенил)-5-(проп-1-илокси)индан-2-карбоксилат.
Метил-(RS)-3-(2-бензилокси-4-метоксифенил)-1-(3,4- метокси-фенил)-1-(3,4-метилендиоксифенил)-5-(проп-1-илокси)- инден-2-карбоксилат (0.64 г, 1.13 ммоль) растворили в небольшом объеме EtOAc и добавили EtOH (25 мл) и впоследствии 10% палладий на активированном углероде (0.2 г). Полученный раствор перемешивали в атмосфере водорода 10 дней и профильтровали. Фильтрат сконцентрировали при пониженном давлении и продукт очистили колоночной хроматографией на силикагеле (элюент: EtOAc/гексан, 30:70) для получения названного в заглавии соединения в виде бесцветного твердого продукта (0.21 г, 39%); т. пл. 155 - 156oC.
h) Метил-(1RS, 2RS, 3RS)-3-(2-карбоэтоксиметокси-4-метоксифенил) -1-(3,4-метилендиоксифенил)-5-(проп-1-илокси)индан-2-карбоксилат.
Раствор метил-(1RS, 2RS, 3RS)-3-(2-гидрокси-4-метоксифенил) -1-(3,4-метилендиоксифенил)-5-(проп-1-илокси)-индан-2-карбоксилата (0.05 г, 0.11 ммоль) в сухом ДМФ (1 мл) добавили к NaH (4 мг, 0.17 ммоль) в небольшом объеме сухого ДМФ. Смесь перемешивали при комнатной температуре 10 мин и добавили этил бромацетат (0.016 мл, 0.14 ммоль). Через 20 мин реакция была остановлена смешением продуктов с 3М охлажденной HCl и смесь экстрагировали EtOAc, EtOAc экстракт промыли водой и затем раствором соли, высушили (MgSO4), профильтровали и упарили. Продукт очистки колоночной хроматографией на силикагеле (элюент: EtOAc/гексан, 30:70) для получения названного в заглавии соединения в виде бледно-желтого масла (0,05 г. 85%).
i) (1RS, 2SR,3RS)-3-(2-Карбоксиметокси-4-метоксифенил)-1-(3,4- метилендиоксифенил)-5-(проп-1-илокси)индан-2-карбоновая кислота.
К раствору метил-(1RS, 2RS, 3RS)-3-(2-карбоэтоксиметокси-4- метоксифенил)-1-(3,4-метилендиоксифенил)-5-(проп-1-илокси)индан-2- карбоксилата (0.05 г, 0.089 ммоль) в EtOH (1 мл) (необходимо нагревание) добавили 6М NaOH (0.089 мл, 0,53 ммоль). После перемешивания в течение ночи продукт распределили между EtOAc и 3М HCl. Органический экстракт промыли H2O и затем раствором соли, высушили (MgSO4), профильтровали и упарили для получения бесцветного масла. Продукт кристаллизовали из Et2O/гексан для получения названного в заглавии соединения в виде не совсем белого твердого вещества (0.03 г, 65%); т. пл. 195 - 198oC.
1H NMR [(CD3)2CO] δ 7.17 (1H, d, J=9.1 HZ); 6.8 - 6.71 (5H, m); 6.55 - 6.47 (3H, m); 5.94 (2H, S); 4.97 (1H, br, d); 4.73 (1H, d, J=16.5 HZ); 4.63 (1H, d, J=16.5 HZ) 4.52 (1H, d, J=7 HZ); 3.80 - 3.76 (2H, m); 3.76 (3H, S); 3,48 - 3.35 (1H, br, m); 1.65 (2H, sextet = 7.4 HZ); 0.92 (3H, t, J=7.4 HZ). MS: 538 [(M+NH4)+].
Anal. CaIc. C29H28O9: C, 66.92; H, 5.42.
C, 67.37; H, 5.32.
Пример 12a.
Приготовление 2-бензилокси-1-бромо-4-метоксибензола.
a) 1-Бромо-2-гидрокси-4-метоксибензол.
3-Бромо-2-гидрокси-6-метоксибензойная кислота.
[J. de Paulis et al., J. Med. Chem. (1985), 28, 1263-1269] (5 г, 0.02 моль) нагревали в хинолине (200 мл) при 160oC в течение 1 ч. При охлаждении продукт распределили между Et2O и 3M HCl. Органический экстракт промыли водой и раствором соли и высушили (MgSO4), профильтровали и упарили для получения названного в заглавии соединения в виде светло-коричневого масла (4 г, 97%). Этот продукт использовали без дальнейшей очистки.
1H NMR (CDCl3) δ 7.32 (1H, d, J=9 HZ); 6.60 (1H, d, = 1.5 HZ); 6.43 (1H, dd, J=9.1 5HZ).
b) 2-Бензилокси-1-бромо-4-метоксибензол.
К суспензии NaH (1,01 г, 0,042 моль) в сухом ДМФ (мл) при 0oC добавили раствор 1-бромо-2-гидрокси-4-метоксибензола (7 г, 0.035 моль). После перемешивания при комнатной температуре в течение 30 мин раствор охладили до 0oC и добавили бензил бромид (6.24 мл, 0.052 ммоль). Смесь нагрели до комнатной температуры за 20 мин и затем осторожно остановили реакцию добавления 3М охлажденной HCl и экстрагировали EtOAc. EtOAc экстракт промыли последовательно H2O, 5% водным NaHCO3, H2O и окончательно раствором соли. После высушивания (MgSO4) фильтрация и упаривание дали темно окрашенное масло. Продукт очистили мгновенной колончатой хроматографией (элюент: EtOAc/гексан, 20:80) для получения названного в заглавии соединения в виде бесцветного масла (7.5 г, 73%).
1H NMR (CDCl3) δ 7.50 - 7.25 (6H, m); 6.51 (1H, d, J=1.5 HZ); 6,39 (1H, d, J=9HZ); 5.09 (2H, S); 3.72 (3H, S).
Пример 13. (1RS,2SR,3RS)-3-[2-(3-Гидроксипроп-1-илокси)-4- метоксифенил] -1-(3,4-метилендиоксифенил)-5-(проп-1-илокси)-индан-2- карбоновая кислота, соль дициклогексиламина.
Метил (1RS, 2RS,3RS)-3-(2-гидрокси-4-метоксифенил)-1- (3,4-метилендиоксифенил)-5-(проп-1-илокси)-индан-2-карбоксилат (0.14 г, 0.29 ммоль) в сухом ДМФ (1 мл) добавили к NaH (9 мг, 0.38 ммоль) в небольшом объеме сухого ДМФ. Смесь перемешивали при температуре окружающей среды в течение 20 мин, затем добавили 3-бромопропан-1-ол (37 мкл, 0.41 ммоль). После перемешивания в течение 1 ч продукт распределили между 3М водной HCl и этил ацетатом. Органический слой промыли водой и затем раствором соли, затем высушили (MgSO4 безводн. ), профильтровали и упарили для получения масла. Продукт очистили колоночной хроматографией для получения метил (1RS,2SR,3RS)-3-[2-(3-гидроксипроп-1-илокси)-4-метоксифенил-1- (3,4-метилендиоксифенил]-5-(проп-1-илокси)индан-2-карбоксилата (0.1 г, 65%) (ПМР показал, что произошла некоторая эпимеризация при C-2). Этот продукт использовали без дальнейшей очистки. Метил (1RS, 2SR, 3RS)-3-[2-(3-гидроксипроп-1-илокси) -4-метоксифенил] -1-(3,4-метилендиоксифенил)-5-(проп-1-илокси)-индан- 2-карбоксилат (0.04 г, 0.075 ммоль) растворили в метаноле (2 мл) и добавили водную гидроокись калия (2М, 0.22 мл, 0.44 ммоль). Смесь перемешивали при нагревании до температуры кипения с обратным холодильников в течение ночи, затем охладили, разбавили водой, подкислили 3М водной соляной кислоты и экстрагировали этилацетатом. Органический экстракт промыли водой и раствором соли, высушили (MgSO4 безводный), профильтровали и упарили для получения масла. Продукт очистили хроматографией на силикагеле (элюент: этил ацетат/гексан/ 3% уксусная кислота) для получения 12 мг свободной кислоты, которую превратили в ее соль с дициклогексиламином. т. пл. 110 - 112oC.
Пример 14. (1RS,2SR,3RS)-3-[2-(1-Карбоксиэт-2-илокси)-4- метоксифенил] -1-(3,4-метилендиоксифенил)-5-(проп-1-илокси)- индан-2-карбоновая кислота, соль бис-дициклогексиламина.
(1RS, 2SR, 3RS)-3-2-(3-Гидроксипроп-1-илокси)-4-метоксифенил-1- (3,4-метилендиоксифенил)-5-(проп-1-илокси)индан-2-карбоновую кислоту (0.07 г, 0.13 ммоль) растворили в сухом дихлорметане (0.5 мл) и добавили периодинан Dess-Martin'a (0.07 г, 0.17 ммоль) в сухом дихлорметане (1 мл). Через 2 ч продукт распределили между диэтиловым эфиром и насыщенным водным раствором карбоната натрия, содержащим тиосульфат натрия. Эфирный экстракт промыли водой, затем раствором соли, высушили (MgSO4 безводным), профильтровали и упарили для получения масла, которое использовали без очистки. Сырой продукт растворили в т-бутаноле (5 мл) и к этому раствору добавили раствор хлорида натрия (18 мг, 0.2 ммоль) и сульфаминовой кислоты (21 мг, 0.22 ммоль) в воде (1.5 мл). После перемешивания в течение 1 ч при температуре окружающей среды продукт экстрагировали этил ацетатом. Органический слой промыли водой, затем раствором соли и затем высушили (MgSO4 безводн.), профильтровали и упарили до получения масла. Продукт очистки колоночной хроматографией на силикагеле (элюент: этил ацетат/гексан/ 3% уксусная кислота) для получения 12 мг свободной кислоты, которую превратили в ее соль бисдициклогексиламина. Т. пл. 160 - 162oC.
MS (exach mass) M+ : 534.1879 (freedi-acid) (Δ = +1.1 mDA for C30H30O9)
По приведенным выше методикам получены следующие соединения по примерам 15 - 29.
Пример 15. (1RS)-1-(4-Метоксифенил)-3-фенилинден-2-карбоновая кислота. Т. пл. 191 - 193oC.
m.p. 191 - 193oC
Anal. C23H18O3; C, 80.68; H, 5.30
C, 80,54; H, 5.33
Пример 16. (транс,транс)-1,3-Дифенилиндан-2-карбоновая кислота. Т. пл. 164 - 165oC.
m.p. 164 - 165oC
MS (m/e) : 332 [(M + NH4)+].
Пример 17. (1RS,2RS,3SR)-1-(4-Гидроксифенил)-3-фенилиндан-2- карбоновая кислота.
MS (m/e) : 331 [(M + H)+].
Пример 18. (1RS,2RS,3SR)-1-(4-Карбоксифенил)-3-фенилиндан-2- карбоновая кислота.
MS (m/e) : 359 [(M + H)+].
Пример 19. (1RS,2RS,3SR)-1-(3-Метоксифенил)-3-фенилиндан-2- карбоновая кислота.
MS (m/e) : 362 [(M + NH4)+].
Пример 20. (1RS, 2RS, 3SR)-1-(4-Этилфенил)-3-фенилиндан-2- карбоновая кислота.
Т. пл. 163 - 164oC.
MS (m/e) : 360 [(M + NH4)+]
Anal. CaIcd. C24H22O2: C, 84.18; H 6,48.
Found C, 84.24; H, 6.73.
Пример 21. (1RS,3RS)-1,3-Дифенилиндан-2-карбоновая кислота.
Т. пл. 210 - 211oC.
Пример 22. (1RS, 2RS, 3SR)-1-(4-Бут-4-илоксифенил)-3-(4- метоксифенил)индан-2-карбоновая кислота
1H NMR (CDCl3): δ 7.26 - 7.17 (m, 6H); 6.93 - 6.87 (m, 6H); 4.62 (d, 2H, J= 10.1 HZ); 3.96 (t, 2H, J=6.5 HZ); 3.81 (S, 3H); 3.29 (t, 1H, J=10.1 HZ); 1.80 - 1.73 (m, 2H); 1.54 - 1.45 (m, 2H); 0.98 (t, 3H, J=7.3 H).
Пример 23. (1RS,2RS,3SR)-1-(4-Ацетамидофенил)-3-(4-метоксифенил) -индан-2-карбоновая кислота.
Т. пл. 231 - 232oC.
MS (m/e) rel.int) : 803 [(2M + I)+, 100].
Anal. Calcd. C25H23NO4, 1/2 H2O: C, 73.12; H, 5.85; N, 3.41. Found: C, 72.92; H, 5.61; N, 3.24.
Пример 24. (1RS,2RS,3SR)-1-(4-Аминофенил)-3-(4-метоксифенил)- индан-2-карбоновая кислота, соль дициклогексиламина
Т. пл. 187 - 190oC.
MS (m/e, rel. int): 1076.2 [(2M + I)+, 25].
Пример 25. (1RS, 2SR,3SR)-1-(4-Гидроксифенил)-3-(3,4- метилендиоксифенил)индан-2-карбоновая кислота.
Т. пл. 94 - 96oC.
MS (m/e): 392.4 [(M + NH4)+].
Пример 26. (1RS, 2RS,3SR)-1-(3,4-Диметоксифенил)-3-(4- метоксифенил)-индан-2-карбоновая кислота.
Т. пл. 126 - 128oC.
MS (m/e, rel.int): 807 [(2M + I)+, 35]; 403 [(M - H)-, 100].
Anal. CaIcd. C25H24O5: C, 74.24; H, 5.98. Found: C, 74.10; H, 5.99
Пример 27. (1RS, 2RS,3SR)-1-(3,4-Метилендиоксифенил)-3-(4- метилтиофенил)индан-2-карбоновая кислота
MS (exact mass): (M.)+ = 404.1074 ( Δ = + 0.8 mDA for C24H20O4S).
Пример 28. (1RS,2RS,3SR)-5-Метокси-3-(4-метоксифенил)-1- (3,4-метилендиоксифенил)индан-2-карбоновая кислота.
Т. пл. 129 - 131oC.
MS (m/e): 441.2 [(M + Na)+].
Пример 29. (1RS, 2SR,3SR)-1,3-Бис)3,4-метилендиоксифенил)-5- гидроксииндан-2-карбоновая кислота.
MS (m/e): 436.2 [(M + NH4)+].
Пример 30. (1RS, 2SR,3SR)-3-(2-Карбоксиметокси-4-метоксифенил) -1-(2-метокси-4,5-метилендиоксифенил)-5-(проп-1-илокси)-индан-2- карбоновая кислота.
Метил (1RS,2RS,3SR)-5-гидрокси-3-(2-метоксиметокси-4- метоксифенил)-1-(2-метокси-4,5-метилендиоксифенил)-индан-2- карбоновую кислоту приготовили с 23% общим выходом из метил 2-(3-бензилокси)бензоилацетата согласно методике примера 11. 5-Гидроксил составляющую превратили в пропилат согласно методике, приведенной в примере 12, и этот сырой материал обработали согласно методике примера 70 для удаления метоксиметил группы с 55% выходом. Названное в заглавии соединение затем согласно методике, приведенной в примере 12, с 42% выходом. Т. пл. 188 - 190oC.
Anal. CaIcd C30H30O10: C, 65.45; H, 5.49.
Found: C, 65.38; H, 5.49.
Пример 31. (1RS,2SR,3RS)-3-(2-Метоксиметокси)-4-метоксифенил) -1-(3,4-метилендиоксифенил)-5-(проп-1-илокси)индан-2-карбоновая кислота.
Т. пл. 161 - 163oC.
Пример 32. (1RS, 2SR, 3RS)-3-(2-Гидрокси-4-метоксифенил)-1- (3,4-метилендиоксифенил)-5-(проп-1-илокси)индан-2-карбоновая кислота.
(exact mass) M+: 462.1678 (Δ = 0.4 mDA C27H26O7).
Пример 33. (1RS,2SR,3SR)-3-(2-Карбоксиметокси-4-метоксифенил) -1-[(2-проп-1-илокси)-4,5-метилендиоксифенил] -5-(проп-1-илокси) индан-2-карбоновая кислота.
Anal. CaIc. C32H34O10•0,5 H2O: C, 65.41; H, 6.00.
Found : C, 65.27; H, 5.99
m.p. 196 - 197oC.
Пример 34. (1RS,2SR,3RS)-1-(2-Карбоксиметокси-4,5- метилендиоксифенил) -3-(4-метоксифенил)-5-(проп-1-илокси)индан-2-карбоновая кислота.
MS (DCl NH3) m/e : 538.2 (M + NH3)+, 520.2 (M+H)+ (exact mass) M+: 520.1733 (Δ = 0.0 mDA for C29H28O9)
Пример 35. (1RS, 2SR, 3RS)-1-(3,4-Метилендиоксифенил)-3-[(2- проп-1-илокси)фенил]-5-(проп-1-илокси)индан-2-карбоновая кислота
Т. пл. 179 - 180oC.
MS (DCl CH4) m/e : 503.2 (M + C2H5)+, 474.1 (M + H)+ (exact mass) M+ : 474.2034 (Δ = +0.8 mDA for C29H30O6).
Пример 36. (1RS, 2SR,3SR)-3-(2-Гидроксифенил)-1-(3,4- метилендиоксифенил)-5-(проп-1-илокси)индан-2-карбоновая кислота.
Т. пл. 97 - 98oC.
MS (exact mass) M+ : 432.1568 (Δ = +0.5 mDA for C26H24O6)
Пример 37. (1RS,2SR,3RS)-3-(2-Карбоксиметоксифенил)-1-(3,4- метилендиоксифенил)-5-(проп-1-илокси)индан-2-карбоновая кислота
Т. пл. 169 - 170oC.
Anal. CaIc. C28H26O8 • 0,25 H2O: C, 67.94; H, 5.40.
Found : C, 67.75; H, 5.37.
Пример 38. (1RS,2SR,3RS)-3-(2-Бензилокси-4-метоксифенил)-1- (3,4-метилендиоксифенил)-5-(проп-1-илокси)-индан-2-карбоновая кислота.
MS (exact mass) M+ : 552.2149 (Δ = -0.1 mDA for C34H32O7)
Пример 39. (1RS, 2SR, 3RS)-3-[2-(2-Гидроксиэт-1-илокси)-4- метоксифенил)-1-(3,4-метилендиоксифенил)-5-(проп-1-илокси)индан -2-карбоновая кислота, соль дициклогексиламина
Т. пл. 182 - 184oC.
Anal. CaIc. C41H53NO8: C, 71.59; H, 7.77; N, 2.04 Found : C, 71.67; H, 7.66; N, 2.42
Пример 40. (1RS, 2SR,3RS)-3-(2-Этокси-4-метоксифенил)-1-(3,4- метилендиоксифенил)-5-(проп-1-илокси)индан-2-карбоновая кислота.
Anal. CaIc. C29H30O7: C, 71.01; H, 6,16;
Found : C, 70.71; H, 6.01
Пример 41. (1RS,2SR,3RS)-3-[4-Метокси-2-(проп-1-илокси)-1-1- (3,4-метилендиоксифенил)-5-(проп-1-илокси)индан-2-карбоновая кислота.
Anal. CaIc. C30H32O7: C, 71.41; H, 6.39;
Found: C, 71.43; H, 6.31.
Пример 42. (1RS,2SR,3RS)-3-[4-Метокси-2-проп-2-илокси)фенил] -1-(3,4-Метилендиоксифенил)-5-(проп-1-илокси)индан-2-карбоновая кислота.
Т. пл. 75 - 79oC.
Пример 43. (1RS,2SR,3RS)-3-[4-Метокси-2-(-2-метилпроп-1-илокси) -фенил] -1-(3,4-метилендиоксифенил)-5-(проп-1-илокси)индан-2- карбоновая кислота. Т. пл. 85 - 89oC.
Пример 44. (1RS,2SR,3RS)-3-[4-Метокси-2-(3-метилбут-1-илокси) -фенил]-1-(3,4-метилендиоксифенил)-5-(проп-1-илокси)-индан-2- карбоновая кислота, соль дициклогексиламина.
Т. пл. 150 - 155oC.
Пример 45. (1RS,2SR,3RS)-3-[4-Метокси-2-(3-пиридилметокси)- фенил]-1-(3,4-метилендиоксифенил)-5-(проп-1-илокси)-индан-2- карбоновая кислота.
Anal. CaIc. C33H31NO7 • 0,5 H2O: C, 71.02; H, 5.78; N, 2.51; Found : C, 71.02; H, 5.53; H, 2.30.
Пример 46. (1RS,2SR,3RS)-3-[4-Метокси-2-(4-пиридилметокси)- фенил]-1-(3,4-метилендиоксифенил)-5-(проп-1-илокси)-индан-2 карбоновая кислота.
Anal. CaIc. C33H31NO7• 0.5 H2O: C, 71.02; H, 5.78; N, 2.51; Found: C, 70.89; H, 5.59; H, 2.37.
Пример 47. (1RS,2SR,3RS)-3-[4-Метокси-2-(2-пиридилметокси)- фенил]-1-(3,4-метилендиоксифенил)-5-(проп-1-илокси)-индан-2- карбоновая кислота
Т. пл. 153 - 155oC.
Пример 48. (1RS,2SR,3RS)-3-[2-(Гепт-1-илокси)-4-метоксифенил] -1-(3,4-метилендиоксифенил)-5-(проп-1-илокси)индан-2-карбоновая кислота
Т. пл. 70 - 73oC.
Пример 49. (1RS,2SR,3RS)-3-[4-Метокси-2-(5-тетразолилметокси)- фенил]-1-(3,4-метилендиоксифенил)-5-(проп-1-илокси)-индан-2- карбоновая кислота.
Т. пл. 102 - 105oC.
Пример 50. (1RS,2SR,3RS)-3-(2-Цианометокси-4-метоксифенил)-1- (3,4-метилендиоксифенил)-5-(проп-1-илокси)индан-2-карбоновая кислота.
Т. пл. 199 - 201oC.
Пример 51. (1RS,2SR,3RS)-3-(2-Карбоксамидометоксид-4- метоксифенил)-1-(3,4-метилендиоксифенил)-5-(проп-1-илокси)индан- 2-карбоновая кислота.
Anal. CaIc. C29H29NO8 • O,5 C4H8O: C, 67.02; H, 5.99; N, 2.52; Found : C, 67.76; H, 5.96; H, 2.56.
Пример 52. (1RS, 2SR, 3RS)-5-Ацетамидо-1,3- бис(3,4-метилендиоксифенил)индан-2-карбоновая кислота.
MS m/e 460 [(M+H}+].
Пример 53. (1RS, 2SR,3SR)-5-Амино-1,3-бис(3,4- метилендиоксифенил)-индан-2-карбоксилат, соль дициклогексиламина.
MS m/e: 418 [(M+H)+].
Пример 54. (1RS, 2SR, 3SR)-3-[2-(3-Карбоксифенил)- 4-метоксифенил]-1-(3,4-метилендиоксифенил)-5-(проп-1-илокси)индан- 2-карбоновая кислота.
a) Этил 3-[три-1-ил/станнил]бензоат
Этил 3-бромобензоат (2.0 г, 8.7 ммоль), гексабутилдистаннан (5.51 мл, 10.9 ммоль), тетракис(трифенилфосфин)палладий (0) (0.08 г, 0.07 ммоль) и ацетат палладия (II) (0.19 г, 0.85 ммоль) смешали в сухом толуоле (25 мл) и нагревали до кипения с обратным холодильником в течение 72 ч в атмосфере аргона. Растворитель удалили при пониженном давлении и остаток очистили колоночной хроматографией на силикагеле (элюент:гексан). Названное в заглавии соединение получили в виде бесцветного масла (1.1 г, 30%).
b) Метил (1RS,2SR,3RS)-3-[2-(3-карбометоксифенил)-4- метоксифенил]-1-(3,4-метилендиоксифенил)-5-(проп-1-илокси)индан-2- карбоксилат.
Метил (1RS, 2SR, 3RS)-3-(4-метокси-2-трифторометансульфонилоксифенил)- 1-(3,4-метилендиоксифенил)-5-(проп-1-илокси)индан-2-карбоксилат (0.118 г, 0.19 ммоль), литий хлорид (0.058 г, 1.37 ммоль), тетракис(трифенилфосфин)-палладий (0) (0.018 г, 0.016 ммоль) и этил 3-три(бутил-1-ил)станнил бензоат (0.253 г, 0.58 ммоль) смешали в сухом диметилформамиде (5 мл) и нагревали до кипения с обратным холодильником в течение 24 ч. Продукт профильтровали через целит и целит промыли этил ацетатом. Объединенный фильтрат упаривали при пониженном давлении и методом TCX было показано, сто он представляет смесь двух компонентов. Очистка колоночной хроматографией на силикагеле дала менее полярную фракцию: метил (1RS,2SR,3SR)-3-[2-(бут-1-ил)-4- метоксифенил)-1-(3,4-метилендиоксифенил) -5-(проп-1-илокси)индан-2-карбоксилат (0.038 г), который был получен в виде бесцветного масла. Названное в заглавии соединение представляло более полярный компонент (0.08 г), который все еще оставался загрязненным остатками олова (ПМР) и был использован без дальнейшей очистки.
c) (2RS, 2SR, 3RS)-3-[2-Карбоксифенил)-4-метоксифенил]-1- (3,4-метилендиоксифенил)-5-(проп-1-илокси)-индан-2-карбоновая кислота.
Метил (1RS, 2SR, 3RS)-3-[2-(3-карбометоксифенил)-4-метоксифенил] -1-(3,4-метилендиоксифенил)-5-(проп-1-илокси)индан-2-карбоксилат (0,08 г, сырой) растворили в пропан-2-оле (1 мл) и добавили водную гидроокись натрия (1М, 1 мл, 1 ммоль). Смесь нагревали до кипения с обратным холодильником 12 часов, затем охладили, разбавили водой, подкислили 3М-водной соляной кислотой и экстрагировали этил ацетатом (3х). Объединенный органический экстракт очистили колоночной хроматографией на силикагеле (элюент: 30% EtOAc/гексан/ 5% AcOH) для получения названного в заглавии соединения в виде бесцветного твердого вещества (20 мг).
Т. пл. 257 - 268oC.
Пример 55. (1RS,2SR,3SR)-3-[2-(Бут-1-ил)-4-метоксифенил)-1- (3,4-метилендиоксифенил)-5-(проп-1-илокси)индан-2-карбоновая кислота, соль дициклогексиламина.
Метил (1RS, 2SR,3SR)-3-[2-(бут-1-ил)-4-метоксифенил)-1-(3,4- метилендиоксифенил)-5-(проп-1-илокси)индан-2-карбоксилат (0.038 г, 0.074 ммоль) растворили в пропан-2-ола (1 мл) и добавили водную гидроокись натрия, (1М, 0.75 мл, 0.75 ммоль). Смесь нагревали до кипения с обратным холодильником 12 ч и затем охладили, разбавили водой, подкислили 3М-водной соляной кислотой и экстрагировали этил ацетатом (3х). Объединенный органический экстракт очистили колоночной хроматографией на силикагеле (элюент: 30% EtOAc/гексан, затем 30% EtOAc гексан/ 5% AcOH). Превращение продукта в его соль с дициклогексиламином дало названное соединение.
Т. пл. 179 - 182oC.
Anal. CaIc. C41H53NO8: C, 71.59; H, 7.77; N, 2.04.
Found: C, 71.67; H, 7.66; N, 2.42.
Пример 56. (1RS,2SR,3SR)-3-(4-Метокси-2-фенилфенил)-1-(3,4- метилендиоксифенил)-5-(проп-1-илокси)индан-2-карбоновая кислота.
a) Метил (1RS,2RS,3SR)-3-(4-метокси-2-фенилфенил)-1-(3,4- метилендиоксифенил)-5-(проп-1-илокси)индан-2-карбоксиат.
К суспензии безводного LiCl (46 мг, 1.1 ммоль) и тетракис(трифенилфосфин)палладия (0) (24 мг, 0.02 ммоль) в сухом диоксане (3 мл) добавили раствор метил (1RS,2RS,3RS)-3-(4-Метокси- 2-трифторометансульфонилоксифенил)-1-(3,4-метилендиоксифенил)-5- (проп-1-илокси)индан-2-карбоксилата (95 мг, 0.16 ммоль) и три(бут-1-ил)станнилбензола (319 мг, 0.87 ммоль) в диоксане (1 мл). Смесь нагревали до кипения с обратным холодильником в атмосфере аргона 17 ч, охладили до комнатной температуры, разбавили этил ацетатом (5 мл) и полученный раствор промыли последовательно раствором соли и водой. Органический слой высушили (MgSO4 безводный), профильтровали через небольшую колонку из силикагеля и сконцентрировали при пониженном давлении для получения масла. Продукт очистили мгновенной колоночной хроматографией (силикагель, градиентное элюирование из гексана 10% этил ацетат/гексан) с целью получения названного соединения в виде белого твердого вещества (92 мг, 86%).
b) (1RS, 2SR, 3SR)-3-(4-Метокси-2-фенилфенил)-1-(3-4- метилендиоксифенил)-5-(проп-1-илокси)индан-2-карбоновая кислота.
К раствору метил (1RS,2RS,3SR)-3-(4-метокси-2-фенилфенил)-1- (3,4-метилендиоксифенил)-5-(проп-1-илокси)индан-2-карбоксилата (80 мг, 0.12 ммоль) в диоксане (2 мл) добавили 1М водного NaOH (0.3 мл, 0.3 ммоль). Полученную смесь нагревали до кипения с обратным холодильником в течение 48 час. Затем сконцентрировали при пониженном давлении. Остаток распределили между разбавленной водной HCl и этил ацетатом. Этил ацетатный экстракт промыли водой и высушили (MgSO4 безводный). Растворитель удалили при пониженном давлении и остаток очистили мгновенной колоночной хроматографией (силикагель, 20% этил ацетат/гексан, содержащий 5% уксусную кислоту) с целью получения названного в заглавии соединения (36 мг, 46%).
Т. пл. 199 - 200oC.
1H NMR (CDCl3) δ 7.18-7.09 (m, 6H); 6.85 (dd, 1H, J=8.6, 2.1 HZ); 6.71-6.65 (m, 6H); 6.36 (bs, 1H); 5.85 (S, 2H); 4.59 (d, 1H, J=10.2 HZ); 4.31 (d, 1H, J=10.2 HZ); 3.75 (t, 2H, J=7.3 HZ); 3.73 (S, 3H); 3.14 (dd, 1H, J=10.2, 10.2 HZ); 1.68 (sextet, 2H, J=7.3 HZ); 0.93 (t, 3H, J=7.3 HZ).
MS m/e : 540 (M+NH4)+.
Anal. CaIc. C33H30O6 • 3/4 H2O: C, 73.93; H, 5.90. Found: C, 74.12; H, 5.80.
Пример 57. (1RS,2SR,3SR)-3-[2-[(E)-2-Карбоксиэтен-1-ил]-4- метоксифенил] -1-(3,4-метилендиоксифенил)-5-(проп-1-илокси)индан-2- карбоновая кислота.
a) Метил (1RS,2SR,3SR)-3-[2-[(E)-2-карбометокси-этен-1-ил]-4- метоксифенил]-1-(3,4-метилендиоксифенил)-5-(проп-1-илокси)индан-2- карбоксилат.
1,3-бис(Дифенилфосфино)пропан (0.066 ммоль), трис(дибензилиденацетон)дипалладий (0) (24 мг, 0.026 ммоль) и бис(трифенилфосфин)палладий (II) хлорид (18 мг, 0.026 ммоль), растворили в 4: 1 смеси триэтиламин/ацетонитрил (5 мл) в атмосфере аргона. Через 10 мин при комнатной температуре раствор метил (1RS,2SR,3RS)-3-(4-метокси-2-трифторометиленсульфонилоксифенил)-1- (3,4 метилендиоксифенил)-5-(проп-1-илокси)индан-2-карбоксилата (160 мг, 0.26 ммоль) и метил акрилат (679 мг, 7.89 ммоль) добавили в упомянутой выше смеси растворителей (3 мл). Реакционную смесь нагревали до кипения с обратным холодильником в атмосфере аргона в течение 20 ч, охладили до комнатной температуры и небольшую аликвотную пробу анализировали методом ПМР, который показал, что реакция не происходит. Затем добавили ацетат палладия (II) (6 мг, 0.025 ммоль) и метил ацетат (679 мг, 7.89 ммоль) в сухом ДМФ (5 мл). Реакционную смесь нагревали до кипения с обратным холодильником в течение ночи. По охлаждении раствор профильтровали через колонку с силикагелем и сконцентрировали до получения масла. Сырой продукт очистили мгновенной колоночной хроматографией (силикагель, градиентное элюирование : от 10 до 20% этил ацетат/гексан) с целью получения названного в заглавии соединения в виде рыжевато-коричневого твердого вещества (87 мг, 62%).
1H NMR (CDCl3): δ 8.17 (d, 1H, J=15.7 HZ); 7.44 (d, 1H, J=8.7 HZ); 7.11-7.07 (m, 2H); 6.90-6.70 (m, 6H); 6.42 (d, 1H, J=15.7 HZ); 5.94 (bs, 2H); 5.04 (d, 1H, J=7.5 HZ); 4.75 (d, 1H, J=7.6 HZ); 3.89 (t, 2H, J=6.7 HZ); 3.85 (S, 3H); 3.85 (dd, 1H, J=7.5, 7.4 HZ); 3.83 (S, 3H); 2.96 (S, 3H); 1.79 (sextet, 2H, J=6.7 HZ); 1.03 (t, 3H, J=6.7 HZ).
b) (1RS, 2SR, 3SR)-3-[2-(E)-2-Карбоксиэтен-1-ил] -4-метоксифенил] -1-(3,4-метилендиоксифенил)-5-(проп-1-илокси)индан-2-карбоновая кислота.
К раствору метил (1RS,2SR,3SR)-3-[2-[(E)-2-карбокметоксиэтен-1- ил]-4-метоксифенил]-1-(3,4-метилендиоксифенил)-5-(проп-1-илокси)индан -2-карбоксилата (80 мг, 0.15 ммоль) в диоксане (2 мл) добавили 1H NaOH (0.5 мл, 0.5 ммоль). Полученную смесь нагревали до кипения с обратным холодильником в течение 3 ч, затем охладили и сконцентрировали при пониженном давлении. Остаток распределили между разбавленным водным HCl и этил ацетатом. Этил ацетатный экстракт промыли водой и высушили (MgSO4 безводный). Растворитель удалили при пониженном давлении и названное в заглавии соединение получили в виде белого твердого вещества (73 мг, 96%).
1H NMR (CDCl3): δ 8.32 (d, 1H, J=15.6 HZ); 7.24-6.55 (m, 9H); 6.29 (d, 1H J= 15.6 HZ); 5,94 (bs, 2H); 5.18 (d, 1H, J=9.9 HZ); 4.69 (d, 1H, J=9.9 HZ); 3.85 (S, 3H); 3.84 (t, 2H, J=6.9 HZ); 2.94 (dd, 1H, J=9.9, 9.9 HZ); 1.79 (sextet, 2H, J=6.9 HZ); 1.00 (t, 3H, J=6.9 HZ).
MS m/e : 517 [(M+H)+].
Abal. CaIc. C30H28O8: C, 69.76; H, 5.46.
Found : C, 69.73; H, 5.26.
Пример 58. (1RS,2SR,3SR)-3-[2-(2-Карбоксиэт-1-ил)-4- метоксифенил]-1-(3,4-метилендиоксифенил)-5-(проп-1-илокси)-индан-2- карбоновая кислота
К раствору (1RS,2SR,3SR)-3-[2-[(E)-2-карбоксиэтен-1-ил]- 4-метоксифенил] -1-(3,4-метилендиоксифенил)-5-(проп-1-илокси)индан-2- карбоновой кислоты (43 мг, 0,08 ммоль) в этаноле (40 мг) добавили 10% палладий на активированном углероде (40 мг). Полученную суспензию перемешивали в течение ночи на атмосфере аргона, затем профильтровали через слой целита. Фильтрат сконцентрировали при пониженном давлении с целью получения названного в заглавии соединения (35 мг, 82%) в виде белого твердого вещества.
1H NMR (CDCl3): δ 6.99 (d, 1H, J=8.6 HZ); 6.78-6.66 (m, 7H); 6.23 (bs, 1H); 5.88-5.87 (m, 2H); 4.88 (d, 1H, J=9.7 HZ); 4.54 (d, 1H, J=9.7 HZ); 3.72 (S, 3H); 3.70 (t, 2H, J=7 HZ); 2.98-2.90 (m, 1H); 2.68-2.51 (m, 2H); 1.65 (sextet, 2H, J=7.0 HZ); 0.89 (t, 3H, J=7.0 HZ).
MS (exact mass) M+: 518.1930 (Δ = +1.1 mDA for C27H26O7)
По методикам, приведенным выше в примерах 54 - 58, были получены следующие соединения.
Пример 59. (1RS, 2SR, 3RS)-3-(2-Карбоксиметилтио-4-метоксифенил) -1-(3,4-метилендиоксифенил)-5-(проп-1-илокси)индан-2-карбоновая кислота.
Т. пл. 242 - 246oC (разл.)
Пример 60. (1RS, 2SR, 3SR)-3-[4-Метокси-2-(проп-2-ен-1-ил)фенил] -1-(3,4-метилендиоксифенил)-5-(проп-1-илокси)индан-2-карбоновая кислота.
Т. пл. 126 - 127oC.
(exact mass) M+: 486.2021 (Δ = +2,1 mDA for C30H30O6)
Пример 61. (1RS, 2SR,3SR)-3-[4-Метокси-2-(проп-1-ил)фенил]-1- (3,4-метилендиоксифенил)-5-(проп-1-илокси)индан-2-карбоновая кислота.
Т. пл. 155 - 156oC.
Anal. CaIc. C30H32O6: C, 73.75; H, 6.60
Found : C, 73.45; H, 6.43
Пример 62. (1RS,2SR,3RS)-3-[2-Карбокси-A-метоксифенил]-1-(3,4- метилендиоксифенил)-5-(проп-1-илокси)индан-2-карбоновая кислота.
Anal. CaIc. C28H26O8: C, 68.56; H, 5.34.
Found : C, 68.61; H, 5.58.
Пример 63. (1RS, 2SR, 3SR)-3-[2-(2-Гидроксиэтил)-4-метоксифенил] -1-(3,4-метилендиоксифенил)-5-(проп-1-илокси)индан-2-карбоновая кислота.
(exact mass) M+: 490.1994 ( Δ = +0.3 mDA for C29H30O7).
Пример 64. (1RS,2SR,3SR)-3-(2-Карбоксиметил-4-метоксифенил)-1- (3,4-метилендиоксифенил)-5-(проп-1-илокси)индан-2-карбоновая кислота.
(exact mass) M+: 504.1788 ( Δ = -0.4 mDA for C29H28O8).
Пример 65. (1RS,2SR,3SR)-3-[2-(3-Гидроксипроп-1-ил)-4- метоксифенил]-1-(3,4-метилендиоксифенил)-5-(проп-1-илокси)-индан-2- карбоновая кислота
MS (exact mass) M+: 504.2143 ( Δ = +0.5 mDA C30H32O7).
Пример 66. (1RS,2SR,3SR)-5-(4-Карбоксифенил)-1,3-бис(3,4- метилендиоксифенил)-1-индан-2-карбоновая кислота.
Т. пл. 230 - 231oC.
Пример 67. (1RS,2SR,3SR)-5-(4-Бензилоксифенил)-1,3-бис(3,4- метилендиоксифенил)индан-2-карбоновая кислота
Т. пл. 105 - 106oC.
Пример 68. (1RS,2SR,3SR)-5-([4-Гидроксифенил)-1,3-бис(3,4- метилендиоксифенил)индан-2-карбоновая кислота
MS m/e: 512 [(M+NH4)+].
Пример 69. (транс,транс-1,3,5-трис(3,4-Метилендиоксифенил)- индан-2-карбоновая кислота.
Anal. CaIc. C31H22O8 • 5/8 H2O: C, 69.76; H, 4.39.
Found : C, 69,81, H, 4,46.
Пример 70. (1RS,3RS)-3-(2-Гидрокси-4-метоксифенил)-1-(3,4- метилендиоксифенил)-5-(проп-1-илокси)индан.
a) (1RS,3RS)-3-[(2-Метоксиметокси)-4-метоксифенил)]-1-(3,4- метилендиоксифенил)-5-(проп-1-илокси)индан.
Раствор (1RS, 2SR, 3RS)-3-2-(метоксиметокси)-4-метоксифенил-1- (3,4-метилендиоксифенил)-5-(проп-1-илокси)индан-2-карбоновой кислоты (0.2 г, 0.39 ммоль) в дихлорметане (4 мл) и пиридин (28 мкл, 1.6 ммоль) охладили до 0oC в атмосфере аргона. К раствору добавили тионил хлорид (60 мкл, 0.8 ммоль). Смеси дали нагреться до температуры окружающей среды за 20 мин, летучие продукты удалили при пониженном давлении. Остаток повторно растворили в толуоле и упарили при пониженном давлении (дважды). Остаток растворили в дихлорметане (4 мл) и добавили триэтиламин (250 мкл). К этому раствору при комнатной температуре в атмосфере аргона добавили 2-меркаптопиридиноксид (120 мг, 0.8 ммоль), растворенный в дихлорметане (1 мл). После перемешивания в течение 20 мин при комнатной температуре добавили т-бутилтионил (450 мкл, 4 ммоль) и смесь облучали 20 мин (150 ватт точечный источник света). Летучие продукты удалили при пониженном давлении и продукт распределили между этил ацетатом и 3-M-водной HCl. Органический экстракт промыли водой, нас. водн. раствором NaHCO3 и окончательно раствором соли. После высушивания (MgSO4 безводный) продукт отфильтровали и упарили. Очистка колоночной хроматографией дала названное в заглавии соединение (0.075 г, 41%).
1H NMR (CDCl3): δ 7.13 (d, 1H, J=8.5 HZ); 6.83 (d, 1H, J=8.3 HZ); 6,79-6,69 (m, 5H); 6.54 (dd, 1H, J=8.5, 2.5 HZ); 6,51 (br S, 1H); 5,92 (br, S, 2H) 5.18 (d, 1H, J=6.7 HZ); 5.15 (d, 1H, J=6.7 HZ); 4.66 (dd, J=10.5, 7.6 HZ, 1H, J= 6.7 HZ); 4.22 (dd, 1H, J=10.5, 7.4 HZ); 3.81 (m, 2H); 3.80 (S, 3H); 3,43 (S, 3H); 2.90-2.83 (m, 1H); 2.06-1.98 (m, 1H); 1.73 (sextet, 1H, J=7.1 HZ); 0.92 (t, 3H, J=7.1 HZ).
b) (1RS, 3RS)-3-(2-Гидрокси-4-метоксифенил)-1-(3,4- метиленоксифенил)-5-(проп-1-илокси)индан.
К раствору (1RS,3RS)-3-(2-метоксиметокси)-4-метоксифенил)-1- (3,4-метилендиоксифенил)-5-(проп-1-илокси)индан (0.075 г, 0.16 ммоль) в метаноле (5 мл) добавили 4 - 5 капель 6М HCl и смесь нагревали до кипения с обратным холодильником в течение 1,5 ч в атмосфере аргона. Растворитель удалили при пониженном давлении и продукт распределили между EtOAc и водой. Органический экстракт промыли водой, затем насыщенным водным раствором NaHCO3 и окончательно раствором соли. После высушивания (MgSO4 безводным) фильтрация и упаривание дали названное в заглавии соединение (0,064 г, 94%).
1H NMR (CDCl3): δ 7.11 (d, 1H, J=8.4 HZ); 6.87 (d, 1H, J=7.8 HZ); 6.77-6.74 (4H, m); 6.61 (br S, 1H); 6.50 (dd, 1H, J=8.4, 2.5 HZ), 6.42 (d, 1H, J=2.5 HZ); 5.94 (d, 1H, J=1.2 HZ); 5.93 (d, 1H, J=1.2 HZ); 4.74 (S, 1H), 4.43 (dd, 1H, J=10.4, 7.6 HZ), 4.20 (dd, 1H, J=10.7, 7.3 HZ), 3.82 (t, 2H, J= 6.7 HZ), 3.79 (S, 3H), 2.89-2.82 (m, 1H), 2.15-2.08 (m, 1H), 1.77-1.71 (sextet, 2H, J=7.2 HZ), 0.99 (t, 3H, J=2.5 HZ).
MS (exact mass) M+ Found : 418.1782 ( Δ ≠ -0.2 mDA for C26H26O5).
Пример 71. (1RS, 2RS)-3-(2-Карбоксиметокси-4-метоксифенил)-1- (3,4-метилендиоксифенил)-5-(проп-1-илокси)индан.
К суспензии гидрида натрия (5 мг, 0.21 ммоль) в диметилформамиде (0,5 мл) добавили (1RS, 3RS)-3-(2-гидрокси-4-метоксифенил)-1-(3,4- метилендиоксифенил)-5-(проп-1-илокси)индан (0,058 г, 0,14 ммоль) при температуре ледяной бани в атмосфере аргона. После перемешивания в течение 15 мин добавили этил бромацетат (50 мкл, 0,2 ммоль) и раствор перемешивали в течение 1 ч при комнатной температуре. Продукт распределили между этил ацетатом и 3М водн. HCl. Органический экстракт промыли водой, раствором насыщенного водного NaHCО3 и окончательно раствором соли. После высушивания (MgSO4, безводный) фильтрация и упаривание с последующей хроматографией дали (1RS,3RS)-3-(2-карбоэтоксиметокси-4-метоксифенил)-1-(3,4- метилендиоксифенил)-5-(проп-1-илокси)индан (0,041 г). Продукт растворили в горячем этаноле (10 мл) и добавили 1 M водный NaOH. Смесь нагревали до кипения с обратным холодильником в течение 1 ч, затем охладили, подкислили 6М водной HCl и экстрагировали этил ацетатом. После упаривания остаток кристаллизовали из этил ацетат/гексан для получения названного в заглавии соединения (0,035 г, 93%).
Т. пл. 177 - 178oC.
1H NMR (CDCl3): δ 7.18 (d, 1H, J=8.5 HZ), 6.87 (d, 1H, J=8.4 HZ), 6.88-6.71 (4H, m), 6.56 (dd, 1H, J=8.4, 2.3 HZ), 6.53 (br.S, 1H), 6.41 (d, 1H, J= 2,3 HZ), 5,91 (br, S, 2H), 4.68-4.60 (m, 3H), 4.61 (dd, 1H, J=10.7, 7.2 HZ), 3.83-3.80 (m, 2H), 3.81 (S, 3H), 2.86 (dt, 1H, J=12.4, 7.2 HZ), 2.10-1.98 (m, 1H), 1.73 (sextet, 2H, J=7.2 HZ), 0.98 (t, 3H, J=7.4 HZ). MS (exact mass) M+ = 476.1829 ( Δ = +0,6 mDA for C28H28O7).
Примеры 72 - 84. По приведенным выше методикам следующие соединения.
(1RS, 2SR, 3SR)-1-(4-Метоксифенил)-3-(3,4,5- триметоксифенил)индан-2-карбоновая кислота;
(1RS, 2SR,3SR)-1-(4-Этоксифенил)-3-(3,4-метилендиоксифенил)индан- 2-карбоновая кислота;
(1RS,2SR,3SR)-5-Карбокси-1,3-бис(3,4-метилендиоксифенил)индан- 2-карбоновая кислота;
(1RS, 2SR, 3SR)-3-(4-Метоксифенил)-1-(3,4-метилендиоксифенил) -5-(проп-2-анилокси)индан-2-карбоновая кислота;
(1RS, 2SR, 3RS)-3-(2,4-Диметоксифенил)-5-гидрокси-1-(3,4- метилендиоксифенил)и-индан-2-карбоновая кислота;
(1RS,2SR,3SR)-3-5-(2,3-Дигидро)-бензфуранил-5-гидрокси-1- (3,4-метилендиоксифенил)-индан-2-карбоновая кислота;
(1RS, 2SR,3RS)-5-Гидрокси-3-(3,4-метилендиоксифенил)-1- (2,4,6-триметоксифенил)индан-2-карбоновая кислота;
(1RS,2SR,3SR)-1-5-(2,3-Дигидробензфуранил-1-(4-метоксифенил) индан-2-карбоновая кислота;
(1RS, 2SR, 3RS)-1-3,4-(1,2-Этилендиокси)фенил-3-(4-метоксифенил) индан-2-карбоновая кислота;
(1RS, 2SR, 3SR)-5-Гидрокси-3-(3,4-метилендиоксифенил)-1-(4- метоксифенил)индан-2-карбоновая кислота;
(1RS,2SR,3RS)-5-Гидрокси-3-(4-метоксифенил)-1-(2-метокси- 4,5-метилендиоксифенил)индан-2-карбоновая кислота;
(1RS, 2SR, 3SR)-1-(3,4-метилендиоксифенил)-3-(4-метоксифенил) -5-(проп-1-илокси)индан-2-карбоновая кислота;
(1RS, 2SR, 3RS)-5-Метокси-3-(4-метоксифенил)-1-(2-метокси-4,5- метилендиоксифенил)индан-2-карбоновая кислота.
Пример 85. Составы для фармацевтического использования, включающие соединения данного изобретения, могут быть приготовлены в разнообразных формах и с многочисленными наполнителями. Примеры таких составов приведены ниже.
Составы для ингаляции.
Соединение формулы I (от 1 до 100 мг) распыляется из отмеряющего дозу ингалятора для отпуска желаемого количества лекарства на применение.
Таблетки/Ингредиенты - На таблетку
1. Активный ингредиент (соед. форм. I) - 40
2. Кукурузный крахмал - 20
3. Альгиновая кислота - 20
4. Альгинат натрия - 20
5. Mg-стеарат - 1.3 - 2.3
Способ приготовления таблеток.
Стадия 1: Смешивают ингредиенты N 1 - 4 в подходящем миксере/смесителе.
Стадия 2: К смеси из стадии I добавляют достаточное количество воды порциями с тщательным перемешиванием после каждого добавления. Такие добавления воды и перемешивание продолжают до тех пор, пока концентрация массы позволит превратить ее во влажные гранулы.
Стадия 3: Важную массу превращают в гранулы, пропуская ее через вибрационный гранулятор, используя фильтр M 8 меш. (2.38 мм).
Стадия 4: Влажные гранулы затем высушивают в сушильном шкафу при 140oC (60oC) досуха.
Стадия 5: В сухие гранулы вводят смазывающий ингредиент N 5.
Стадия 6: Смазанные гранулы прессуют на соответствующем прессе для таблеток.
Парентеральный состав.
Фармацевтическую композицию для парентерального применения приготавливают растворением соответствующего количества соединения формулы 1 в полиэтилен гликоле при нагревании. Этот раствор разбавляют затем водой для инъекций Ph Eur. (до 100 мл). Раствор затем стерилизуют фильтрацией через 0.22 мкм мембранный фильтр и запаивают в стерильные емкости.
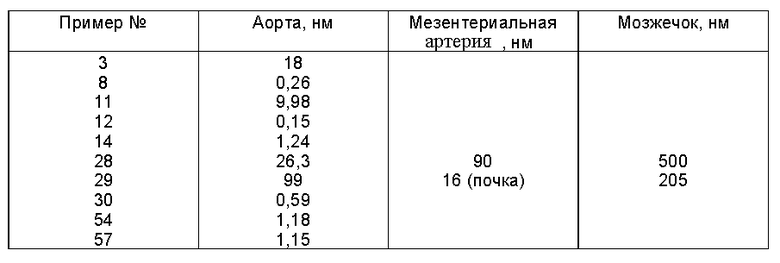
Описаны новый индан и инден производные, которые являются эндотелиновыми рецепторными антагонистами формулы (I)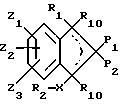
R1=-X(CH2 n Ar или -X(CH2)n CO2H (тетразол);
R2 - Ar;
P1 и P2-X(CH2 n CO2H или -X(CH2 n тетразол;
Z1, Z2, Z3 -H, OH, CH1-8-алкокси, N(R6)2, NHCOR6, фенил, бензил;
R6 - H или низший алкил.
Описан способ их получения взаимодействием соответствующих сложного эфира и магнийорганического соединения, а также описаны фармкомпозиция и способ подавления эндотелиновых рецепторов. 4 с. и 6 з.п. ф-лы, 1 табл.
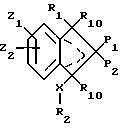
где R1 является - X(CH2)nAr или -X(CH2)nR8;
R2 - Ar;
P1 является - X(CH2)nR8;
P2 является - X(CH2)nR8;
R3 и R5 независимо - водород, R11, OH, C1-8-алкокси, S(O)R11, - XR9 - Y, или -X(CH2)nR8, где метиленовые группы -X(CH2)nR8 могут быть незамещенными или замещенными одной или более -(CH2)nAr-группами;
R4 - водород;
R11 - OH или C1-5-алкокси, который может быть незамещен или замещен метоксигруппой;
R6 - водород или C1 - C4-алкил;
R7 - водород, C1 - C6-алкил и (CH2)nAr;
R8 представляет CO2H или тетразол, R11 или R7;
R9 - моно- или дивалентный C2 - C10-алкенил или фенил, каждый из которых может быть незамещен или замещен одним или более OH или COOH;
R10 представляет R3 или R4;
R11 - моно- или дивалентный C2 - C8-алкенил или C2 - C8-алкинил, которые могут быть незамещенными или замещенными одним или более OH, либо R11 - COOH;
X - (CH2)n или S(O)q;
Y - CH3 или CH2X(CH2)nAr;
Ar представляет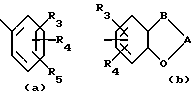
пиридил, тетразолил, которые могут быть незамещены или замещены одной или более R3- или R4-группами;
A - [C(R6)Z]m;
B - -CH2- или -O-;
Z1 и Z2 независимо - водород, OH, C1-8-алкокси, N(R6)Z, NHCOR6, фенил, бензил или C2 - C8-алкинил, которые могут быть независимо замещены COOH или OH, либо Z1 и Z2 вместе могут быть -O-A-O на смежных углеродных атомах;
q = 0 или 1;
n = 0;
m = 1, 2 или 3;
пунктирная линия обозначает необязательное наличие двойной связи,
или их фармацевтически приемлемая соль,
при условии, что а) R2 не является водородом, когда X - S(O)q; б) когда необязательная двойная связь присутствует, есть только один R10 и отсутствует P1; с) соединение формулы I не является (1RS) 1,3-дифенилинден-2-карбоновой кислотой, (цис, цис)-(1RS, 3SR)-1,3-дифенил-индан-2-карбоновой кислотой; (1RS)-3[3-метил-1-фенил-1 (H)-инд-2-ен-1-ил]пропионовой кислотой; (1RS)-2-[1,3-дифенил-(1H)-инд-2-ен-2-ил] этановой кислотой; 1,3-дифенил-1-этоксиинден-2-карбоновой кислотой; 1,2,3-трифенилинденом, 1,3-дифенилинденом; 1-(2,3-диметил-2-бутен-1-ил)-1,3-дифенилинденом; 1,3-дифенил-метилинденом; 1,3-дифенил-2-метилинданом; 1,3-дифенилинданом; 5,6-диметокси-1,3-дифенилинденом; 1,3-бис(4,5-диметокси-2-гидроксифенил)-5,6-диметоксиинданом; 1,3-бис(3,4-диметоксифенил)-5,6-диметоксиинданом; 1,3-дифенил-2-метоксиинденом; 1,3-дифенил-2-этоксиинденом; 5-фтор-2-метил-инден-3-уксусной кислотой.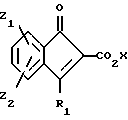
где Z1 Z2 и R1 - такие, как в п.1, или группа, превращаемая в них;
X - алкил,
с магнийорганическим соединением формулы (III)
R2 - (CH2)n - MgBr,
где R2 такой, как в п.1, или группа, превращаемая в него,
в подходящем растворителе с получением соединения формулы (IV)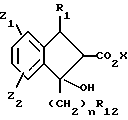
которое восстанавливают и после этого при желании или необходимости подвергают конверсии R1, R2, Z1, Z2 с целью получения соединения формулы (I).
| US 3737455 П, 1977 | |||
| ШТАНГОВЫЙ ТРАНСПОРТЕР | 0 |
|
SU206241A1 |
| Способ получения производных бензодиоксола | 1973 |
|
SU507232A3 |
| US 4981950 A, 1991 | |||
| Способ лечения гипертонической болезни | 1985 |
|
SU1421347A1 |
| SU 228623, 1968 | |||
| J.Clin | |||
| Jnvest | |||
| Пуговица | 0 |
|
SU83A1 |
Авторы
Даты
1999-02-10—Публикация
1992-10-29—Подача