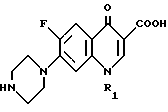
Настоящее изобретение относится к области органической химии и касается способа получения биологически активного соединения 1-замещенной-6-фтор-4-оксо-7-(1-пиперазинил)-1,4-дигидрохинолин-3- карбоновой кислоты общей формулы II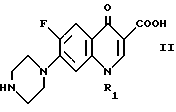
в которой R1 представляет собой низший алкил, низший циклоалкил, нового промежуточного продукта 1-замещенного-6-фтор-4-оксо-7-(4-замещенного-1-пиперазинил)- 1,4-дигидрохинолин-3-карбоксилат-бор-диацетата общей формулы I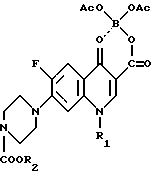
в которой R1 представляет собой низший алкил, низший циклоалкил, а R2 представляет собой низший алкил, а также способ получения этого соединения.
Соединения формулы II применяют в медицине для лечения различного рода воспалительных заболеваний. Спектр их активности очень широк, поскольку они обладают активностью как против грамположительных, так и грамотрицательных бактерий.
Синтез соединений общей формулы II описан в целом ряде патентных публикаций, например замещение хлора в 7-положении 1-замещенной-6-фтор-7-галоген-4-оксо-1,4-дигидрохинолин-3- карбоновой кислоты на пиперазин описано в патентах Японии 66686/1979 и 33453/1980, а патентах Германии 2840910 и 3308909, а реакция гидролиза алкилового эфира в 3-положении 1-алкил-6-фтор-7-(1-пиперазинил)-4-оксо-1,4-дигидрохинолин-3- карбоновой кислоты описана в патенте Бельгии 890223.
Однако характерной особенностью всех этих способов является то, что реакция замещения успешно протекает только при температурах выше 100oC, которые обуславливают большую процентную долю конкурирующей реакции в 6-положении.
В ES 9001782 описано нуклеофильное замещение в хелатах бора, алюминия и кремния, при котором продукт замещения не выделяют, а непосредственно проводят его гидролиз с образованием биологически активного соединения. В патенте Венгрии 1505/87 также описано нуклеофильное замещение атома галогена в 7-положении хелатного комплекса бора, которое имеет место при температурах выше 100oC. В этом случае полученный продукт замещения также не выделяют, осуществляя гидролиз непосредственно после синтеза.
Задачей изобретения является разработка нового способа получения биологически активной 1-замещенной-6-фтор-4-оксо-7-(1-пиперазинил)- 1,4-дигидрохинолин-3- карбоновой кислоты, позволяющего сократить выход побочного продукта, а также создание нового промежуточного продукта - 1-замещенной-6-фтор-4-оксо-7-(4-замещенной-1-пиперазинил)- 1,4-дигидрохинолин-3-карбоксилатбор-диацетата и способа его получения. Поставленная задача достигается данным способом, заключающимся в том, что соединение общей формулы I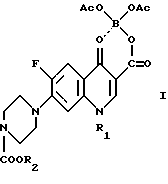
в которой R1 имеет указанное выше значение, а R2 представляет собой низший алкил, подвергают щелочному гидролизу и при необходимости полученное соединение формулы I превращают в фармацевтически приемлемую соль - продукт присоединения кислоты, например гидрохлорид или лактат и их гидраты.
Щелочной гидролиз проводят в водной или водно-спиртовой среде, например, с раствором гидроокиси щелочного металла, таким как 10% NaOH, при температуре от 50oC до температуры флегмы, предпочтительно при температуре флегмы реакционной смеси.
После нейтрализации кислотой, предпочтительно уксусной кислотой, получают продукт, содержащий (без дополнительной очистки) менее 0,5% примесей.
Поставленная задача достигается также новым промежуточным продуктом, а именно 1-замещенный-6-фтор-4-оксо-7-(4-замещенный -1- пиперазинил)- 1,4-дигидро-хинолин-3-карбоксилат-бор-диацетатом общей формулы I, используемым в качестве исходного продукта в указанном выше способе получения биологически активного соединения общей формулы II, и который получают путем проведения нуклеофильного замещения атома галогена в 7 положении в 1-замещенной-6-фтор-4-оксо-7-галоген -4-оксо-1,4-дигидрохинолин-3- карбоксилат-бор-диацетате общей формулы III при использовании 1-замещенного пиперазина общей формулы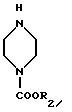
в которой R2 имеет указанное выше значение.
Реакцию проводят в органическом растворителе, например пиридине, диметилсульфоксиде, диметилформамиде, 1-метил-2-пирролидоне, предпочтительно в 1-метил-2-пирролидоне при температурах от 0 до 45oC, предпочтительно при 25 - 30oC. В указанном диапазоне температур реакция завершается в течение 10 - 15 часов (при применении 1-метил-2-пирролидона в качестве растворителя), без образования побочных продуктов, причем гидролиза соли бора при этом не происходит. При реакционных температурах свыше 40oC отмечается разложение соли бора, которое очень быстро прогрессирует при повышении температуры. Образующаяся в результате этого разложения 3-карбоновая кислота значительно менее реакционноспособна, так как нуклеофильное замещение происходит при температурах свыше 100oC.
Выделять полученное соединение формулы I очень несложно, так как при осаждении спиртом получают практически чистое соединение, не требующее дополнительной очистки.
Соединение общей формулы I используют в качестве исходного материала для получения соединения общей формулы II в выделенном виде или in situ.
Все реакционные компоненты либо находятся в продаже, либо получены описанным выше способом.
Оба соответствующих изобретению способа иллюстрируются следующей реакционной схемой, в которой X, R1 и R2 имеют указанное выше значение.
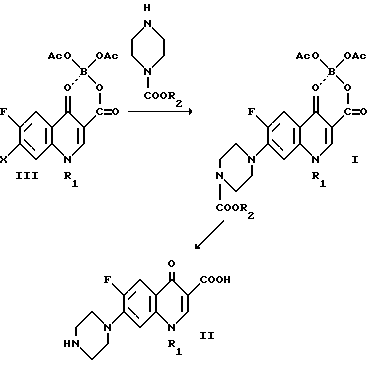
Более подробно изобретение иллюстрируется следующими примерами, однако их описанием объем изобретения не ограничивается.
Пример 1. 1-циклопропил-6-фтор-4-оксо-7-(4-карбоэтокси-1- пиперазинил)-1,4-дигидрохинолин-3-карбоксилат-бор-диацетат.
1-циклопропил-6-фтор-4-оксо-7-хлор-1,4-дигидрохинолин-3- карбоксилат-бор-диацетат (10 г, 0,0244 молей) и 1-карбоэтоксипиперазин (15,44 г, 0,0977 молей) суспендируют в 1-метил-2-пирролидоне (40 мл) и перемешивают при температуре 30oC в течение 12 часов. После завершения реакционного процесса в реакционную смесь добавляют абсолютный этанол (60 мл) и продолжают перемешивание при комнатной температуре 2 часа. Полученный осадок обрабатывают на вакуум-фильтре, промывают этанолом и сушат в вакууме при 80oC. Фильтрат охлаждают до 0 - 5oC, полученный осадок фильтруют под небольшим раздражением, суспендируют в смесь 1-метил-2-пирролидон/этанол (2:1) и вымачивают в течение 2 часов, после чего обрабатывают на вакуум-фильтре и сушат. Полученные продукты соединяют. Таким образом получают хроматографически чистый 1-циклопропил-6-фтор-4-оксо-7-(4-карбоэтокси-1-пиперазинил)-1,4- дигидрохинолин-3-карбоксилат-бор-диацетат (10,75 г, 83%) с т.пл. 235-240oC.
Данные спектроскопического анализа:
1H-ЯМР-спектр (CF3COOH, TMS), снятый с использованием 300 мгерц-прибора:
δ CH2(циклопропил) = 1,29(м, J=8 герц, 2H), δ CH3 = 1,30(T, J=8 герц, 3H), δ CH2(циклопропил) = 1,52(м, J=8 герц, 2H), δ CH3 = 2,03 (с, 6H), δ CH2(пиперазинил) = 3,42 (м, 4H), δ CH2(пиперазинил) = 3,74 (м, 4H), δ CH(циклопропил) = 3,73(м, J = 8 герц, 1H), δ OCH2 = 4,2 (q, J = 8 герц 2H), δ H8 = 7,48 частей на миллион (д, J = 8 герц, 1H), δ H5 = 8,08 (д, J = 14,3 герц, 1H), δ H2 = 9,0 частей на миллион (с, 1H).
ИК-спектр:
1700, 1630, 1480, 1370, 1275, 1240, 1060, 960 см-1.
Пример 2. 1-этил-6-фтор-4-оксо-7-(4-карбоэтокси-1- пиперазинил)-1,4-дигидрохинолин-3-карбоксилат-бор-диацетат.
1-этил-6-фтор-4-оксо- 7-хлор-1,4-дигидрохинолин-3-карбоксилат-бор-диацетат (2,37 г, 0,006 молей) и 1-карбоэтоксипиперазин (3,78 г, 0,024 моля) суспендируют в 1-метил-2-пирролидоне (9,5 мл) и перемешивают при 30oC в течение 9 часов. После завершения реакционного процесса к реакционной смеси добавляют абсолютный этанол (19 мл) и продолжают перемешивать при комнатной температуре в течение 2 часов. Полученный продукт обрабатывают на вакуум-фильтре, промывают этанолом и сушат в вакууме при 80oC. Таким образом получают 1-этил-6-фтор-4-оксо- 7-(4-карбоэтокси-1-пиперазинил)-1,4-дигидрохинолин-3-карбоксилат- бор-диацетат (2,7 г, 87%) с т.пл. 235-238oC.
Данные спектроскопического анализа:
1H-ЯМР-спектр (CF3COOH, TMC), снятый при использовании 60 мгерц-прибора:
δ CH3 = 1,53(т, J=7 герц, 3H), δ CH3 = 1,97(т, J=7 герц, 3H), δ CH3 = 2,4(с, 6H), δ CH2(пиперазинил) = 4,0 (м, 8H), δ NCH2 = 4,53 (кв, J=7 герц, 2H), δ OCH2 = 5,03 (кв, J=7 герц, 2H), δ H8 = 7,7 (д, J = 6 герц, 1H), δ H5 = 8,4 (д, J = 12 герц, 1H), δ H2 = 9,6 частей на миллион (с, 1H).
19F-ЯМР-спектр (CF3COOH, CFCl3), снятый при использовании 60 мгерц-прибора:
δ F = -114,0 частей на миллион (дд, J = 12 герц, 6 герц).
Данные ИК-спектра:
1777, 1635, 1490, 1375, 1285, 1240, 1060, 970 см-1.
Пример 3. 1-циклопропил-6-фтор-4-оксо-7-(1-пиперазинил)-1,4- дигидрохинолин-3-карбоновая кислота.
1-циклопропил-6-фтор-4-оксо-7-(4-карбоэтокси-1-пиперазинил) -1,4-дигидрохинолин-3-карбоксилат-бор-диацетат (10 г, 0,0188 молей) суспендируют в 10% KOH (187 мл) и кипятят с обратным холодильником в течение 1,5 часов. Затем реакционную смесь охлаждают до комнатной температуры с помощью уксусной кислоты, устанавливают pH на уровне 7,2-7,4. Реакционную смесь перемешивают еще в течение 30 минут, осадок обрабатывают на вакуум-фильтре, промывают этанолом и сушат. Получают 1-циклопропил-6-фтор-4-оксо- 7-(1-пиперазинил)-1,4- дигидрохинолин-3-карбоновую кислоту (5,95 г, 96%) с т.пл. 258-263oC.
Пример 4. Гидрохлоридмоногидрат 1-циклопропил-6-фтор-4-оксо- 7-(1-пиперазинил)-1,4-дигидрохинолин-3-карбоновой кислоты.
1-циклопропил-6-фтор-4-оксо-7-(4-карбоэтокси-1-пиперазинил)- 1,4-дигидрохинолин-3-карбоксилат-бор-диацетат (3 г, 0,0056 молей) суспендируют в 10% KOH (56 мл) и кипятят с обратным холодильником в течение 1,5 часов. После окончания реакционного процесса добавляют концентрированную HCl (8 мл) и нагревают при температуре 80oC в течение 30 минут. После этого реакционную смесь охлаждают до комнатной температуры, добавляют этанол (14 мл), продолжают перемешивание еще в течение 30 минут. Образующийся осадок обрабатывают с помощью вакуумного фильтра, промывают водой и сушат до постоянного веса. Получают 1-циклопропил-6-фтор-4-оксо- 7-(1-пиперазинил)-1,4- дигидрохинолин-3-карбоновокислый гидрохлорид-моногидрат (1,98 г, 92%) с т.пл. 282-288oC.
Пример 5. 1-этил-6-фтор-4-оксо- 7-(1-пиперазинил)-1,4- дигидрохинолин-3-карбоновая кислота.
1-этил-6-фтор-4-оксо-7-(4-карбоэтокси-1-пиперазинил)- 1,4-дигидрохинолин-3-карбоксилат-бор-диацетат (1,04 г, 0,002 молей) суспендируют в 10% KOH (16 мл) и этаноле (12 мл), после чего смесь кипятят с обратным холодильником в течение 11 часов. Затем смесь окончания реакционного процесса добавляют концентрированную HCl (8 мл) и нагревают при температуре 80oC в течение 30 минут. После этого реакционную смесь охлаждают до комнатной температуры, добавляют этанол (14 мл), продолжают перемешивание еще в течение 30 минут. Образующийся осадок обрабатывают с помощью вакуумного фильтра, промывают водой и сушат до постоянного веса. Получают 1-циклопропил-6-фтор-4-оксо- 7-(1-пиперазинил)-1,4- дигидрохинолин-3-карбоновокислый гидрохлорид-моногидрат (1,98 г, 92%) с т.пл. 282-288oC.
Пример 5. 1-этил-6-фтор-4-оксо-7-(1-пиперазинил)- 1,4-дигидрохинолин-3-карбоновая кислота.
1-этил-6-фтор-4-оксо-7-(4-карбоэтокси-1-пиперазинил)- 1,4-дигидрохинолин-3-карбоксилат-бор-диацетат (1,04 г, 0,002 молей) суспендируют в 10% KOH (16 мл) и этаноле (12 мл), после чего смесь кипятят с обратным холодильником в течение 11 часов. Затем смесь охлаждают до 15oC, с помощью 15% HCl поддерживают pH на уровне 7,2-7,4 и продолжают перемешивать при этой температуре еще в течение 30 минут. Полученный осадок помещают на вакуумный фильтр, промывают водой и сушат до постоянного веса в вакуумной сушилке при температуре 100oC. Получают 1-этил-6-фтор-4-оксо- 7-(1-пиперазинил)-1,4- дигидрохинолин-3-карбоновую кислоту (0,6 г, 93%) с т.пл. 218-221oC.
Способ получения 1-замещенный-6-фтор-4-оксо-7-(1-пиперазинил)-1,4-дигидрохинолин-3-карбоновой кислоты общей формулы II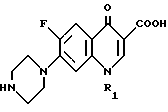
в которой R1 представляет собой низший алкил низший циклоалкил, по которому 1-замещенный-6-фтор-4-оксо-7-(4-замещенный-1-пиперазинил)-1,4-дигидрохинолин-3-карбоксилат-бор-диацетат общей формулы I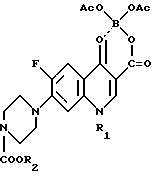
в которой R2 представляет собой низший алкил подвергают щелочному гидролизу. Соединение формулы I используют в медицине для лечения различного рода воспалительных явлений. Соединение формулы I представляет собой принципиально новое соединение. Его получают путем нуклеофильного замещения атома галогена в 7-наложении в соединении формулы III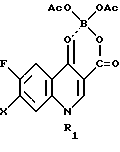
при использовании 1-замещенного пиперазина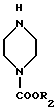 3 с. и 4 з.п. ф-лы.
3 с. и 4 з.п. ф-лы.
в которой R1 представляет собой низший алкил, низший циклоалкил или ее фармацевтически приемлемой соли - продукта присоединения кислоты, например, гидрохлорида или лактата или их гидратов, отличающийся тем, что соединение общей формулы I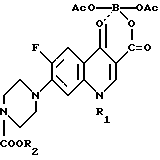
в которой R1 имеет указанные выше значения, а R2 представляет собой низший алкил, подвергают щелочному гидролизу, и при необходимости, полученное соединение общей формулы II превращают в фармацевтически приемлемую соль - продукт присоединения кислоты, например, гидрохлорид или лактат и их гидраты.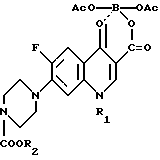
в которой R1 представляет собой низший алкил, низший циклоалкил и R2 представляет собой низший алкил.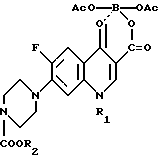
в которой R1 представляет собой низший алкил, низший циклоалкил и R2 представляет собой низший алкил, отличающийся тем, что в 1-замещенном-6-фтор-7-галоген-4-оксо-1,4-дигидро-хинолин-3-карбоксилат-бор-диацетате общей формулы III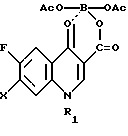
в которой X представляет собой F или Cl, а R1 имеет указанное выше значение, нуклеофильное замещение атома галогена в 7-положении проводят при использовании 1-замещенного пиперазина формулы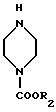
в которой R2 имеет указанные выше значения.
| Заряд для боеприпасов | 2024 |
|
RU2840910C1 |
| 0 |
|
SU330899A1 | |
| RU 2002744 C1, 15.11.93 | |||
| Способ получения производных хинолинкарбоновой кислоты или их гидратов | 1981 |
|
SU1015827A3 |
| Способ получения хинолинкарбоновых кислот или их фармацевтически приемлемых солей | 1988 |
|
SU1701110A3 |
Авторы
Даты
1999-03-10—Публикация
1993-12-10—Подача