Данное изобретение относится к области медицины, а именно к диагностике вирусной инфекции, вызываемой вирусом эпидемического паротита. Предлагаемый метод используется как еще один способ выявления показателя инфекционного состояния путем обнаружения антигена в слюне у детей, больных эпидемическим паротитом.
Основным способом диагностики паротитно-вирусной инфекции является обнаружение антител в крови больных различными формами данного заболевания и установление сероконверсии антител в ходе эпидемического процесса. Обнаружение антител проводится в различных вирусологических реакциях, таких как РСК, РТГА, реакция нейтрализации в культуре ткани (Леннет Э., Шмидт Н. Лабораторная диагностика вирусных и риккетсионных заболеваний, М., 1977, с. 374 - 378). Однако эта диагностика не является экспрессной и подтверждение может быть получено только после выздоровления больного.
Другим методом диагностики паротитной инфекции является выделение вируса из материалов от больных: слюне, моче, молоке, спинно-мозговой жидкости (Mumps. , "Brit. Med. J", 1977, 6075, p. 1489 - 1490, Feldman H. Mumps. "Viral. Infect. Hum. Epid. " New-York - London, 1976, p. 317 - 336). Для выделения используются куриные эмбрионы и различные первичные перевиваемые тканевые культуры. Данные методы достаточно точны, исследователь сразу получает вирусный штамм. Однако время выделения и типирования вируса достаточно длительно (1 - 2 недели) и диагносцировать инфекцию непосредственно в первые дни заболевания не представляется возможным.
Наиболее близким к данному способу является способ выделения вируса на культурах почечных клеток хомяка (Takimoto S., Monteiro de Massas M. et al., Utilizacao da cultura de celulas de rim de hamster para o isolamento do virus da caxumba (parotidite epidemica), "Rev. Inst. A. Lutz", 1983, 43, N 1 - 2, p. 81 - 84). В этой культуре было проведено выделение вируса паротита от больных различными формами паротитной инфекции с достаточно высоким процентом выделения.
В то же время недостатком этого способа является длительный этап выделения вируса паротита (более недели), необходимость специальных методов типирования выделенного вируса (специфическими иммунными сыворотками или по реакции гемадсорбции).
В предлагаемом авторами способе выявления вируса паротита в биологических жидкостях организма осуществляется без выделения вируса, а при помощи выявления его или антигенов вируса паротита в серологической иммуноферментной реакции. Способ основан на принципе, что антиген данного вируса, присутствующий в слюне, может быть связан со специфическими антителами, которые добавляются к слюне in vitro. Добавленный к образованному иммунному комплексу экзогенный комплемент сорбируется на нем, а степень этой сорбции выявляется по ферментной реакции.
Сущность этой реакции заключается в том, что при наличии антигена в обследуемой слюне количественное выявление остатка комплемента после его сорбции проводится по определению уровня оксидазных ферментов, вышедших из лизируемых эритроцитов. Последний происходит после добавления к иммунному комплексу с комплементом гемолитической системы, состоящей из взвеси бараньих эритроцитов и антибараньей гемолитической сыворотки. Вышедшие из лизируемых эритроцитов ферменты оксидазной группы (каталаза, пероксидаза) определяются с помощью перекисного метода. Расщепление этими ферментами перекиси водорода тестируется количественно по изменению цветности вводимого в реакцию ортофенилендиамина спектрофотометрически на иммуноферментном анализаторе при длине волны 495 нм.
Чувствительность метода позволяет обнаруживать антиген в слюне больных различными формами паротитно-вирусной инфекции даже в случае отсутствия его выделения в чувствительных тканевых культурах. Специфичность способа основана на связи выявляемого антигена со специфическими антипаротитными антителами.
Метод осуществляется следующим образом.
Предварительно слюна больного с паротитно-вирусной инфекцией замораживается в низкотемпературной камере при -20 градусах и выдерживается при этой температуре в течение 3 часов. Далее после размораживания слюна центрифугируется при 3000 об/мин в течение 20 мин.
Полученный надосадок разводится 1 : 5, и в равных объемах соединяется с сывороткой реконвалесцента данной инфекции с титром противопаротитных антител в пределах 1 : 640 - 1 : 1280 (по реакции торможения гемагглютинации). Сыворотка предварительно разводится соответственно титру 1 : 20 - 1 : 40.
Далее к этой реакционной смеси - слюна + сыворотка реконвалесцента добавляются раститрованные заранее две гемолитических дозы комплемента в таком же объеме.
Контролями к основному способу служили: слюна + мединал-вироналовый буфер + комплемент; мединал-вироналовый буфер + антипаротитная сыворотка + комплемент; мединал-вироналовый буфер + комплемент; мединал-вироналовый буфер.
Все составляющие контрольных рядов вносились в соответствующих объемах.
Полученные опытная и контрольная смеси выдерживаются в термостате при 37 градусах в течение 1 часа. После этого контакта добавляется гемолитическая система, состоящая из 0.6% взвеси эритроцитов барана, приготовленной в растворе гемолитической сыворотки, разведенной 1 : 100. Гемолитическая смесь вносится в двойном объеме по отношению к исходному объему слюны. Далее соответствующие смеси выдерживались при комнатной температуре до появления начальных признаков гемолиза в контрольных рядах, особенно в первом контроле, где слюна соединялась с комплементом без антипаротитной сыворотки.
После появления гемолиза контрольные и опытные смеси центрифугировали при 1500 об/мин 2 - 3 мин, надосадок переносится в планшеты в объеме 50 мкл. Далее в лунки планшет добавляли приготовленный ex tempore раствор 3% перекиси водорода в 0.2% растворе ортофенилендиамина (50 мкл на лунку). Через 20 - 30 мин реакцию останавливали 1N H2SO4.
Количественную величину оксидазных ферментов, выделенных из лизированных эритроцитов определяли по величине цветности, измеренную спектрофотометрически на планшетном иммуноферментном анализаторе любой формы при длине волны 492 нм с фоном 600 нм.
Количественное содержание антигена в пробах слюны выражали в относительных единицах (OE) от 0.0 до 1.0. Расчет единиц осуществляли по формуле: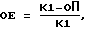
где K1 - показатели контроля - слюна + мединал-вироналовый буфер + комплемент + гемолитическая система;
ОП - опытная проба.
Пример 1
Больной Запольский Андрей 12 лет поступил в клинику НИИДИ 3.06.96 с диагнозом "Эпидемический паротит. Серозный менингит?". В клинике диагноз серозного менингита подтвержден. При серологическом обследовании уровень антител к паротитному антигену 4.06.96 в РТГА - 1 : 20. Одновременно слюна обследована на наличие антигенов вируса паротита заявляемым способом.
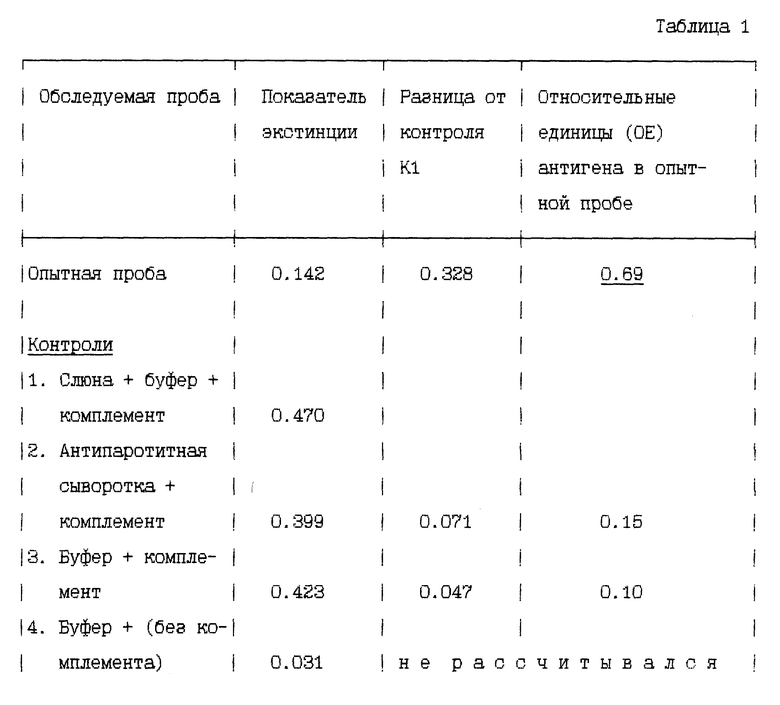
Результаты обследования (см. табл. 1)
Преимуществами данного метода являются следующее:
- в отличие от прототипа заявляемый способ позволяет определять антиген в слюне экспрессно в течение 4 - 5 часов от поступления материала в лабораторию;
- при быстроте постановки реакции способ позволяет иметь количественный результат, что позволяет сравнивать интенсивность выделения вируса у больных эпидемическим паротитом и коррегировать эпидемические мероприятия в инфекционных заведениях;
- по сравнению с прототипом аппаратный учет результатов гарантирует точность получаемых данных;
- исключение этапа использования тканевых культур облегчает и упрощает постановку заявляемого способа, что экономит как материальные затраты (стоимость тканевых культур и сред для их выращивания), так и время, затрачиваемое специалистами на проведение анализов;
- возможность диагностики паротитной инфекции заявляемым способом без определения у больных антител по результатам сероконверсии, то есть без взятия крови из вены, а использование только слюны, обеспечивает безболезненность и безопасность взятия материала.
При обследовании отличительных признаков заявляемого способа необходимо выделить следующие моменты. Трехчасовое замораживание слюны позволяет предупредить неспецифическое взаимодействие ряда высокомолекулярных ингибиторов и ферментов с вносимыми в реакцию агентами. При отсутствии этого этапа заявляемого способа резко снижаются показатели контролей 2 и 3 и при этом за счет неспецифически увеличивается показатель OE в этих контролях (Табл. 1). Образовавшиеся после замораживания конгломераты удаляем центрифугированием. Для дополнительного исключения неспецифических реакций в иммуно-ферментном тесте надосадок слюны затем разводится 1 : 5. Более высокие разведения нецелесообразны, так как при незначительном содержании антигенов в более высоких разведениях выявить невозможно.
Для образования иммунного комплекса в заявляемом способе лучше использовать сыворотку реконвалесцентов, так как при естественном образовании антител в организме больного сорбция комплемента в дальнейшем с такой сывороткой проходит более интенсивно, видимо из-за присутствия в такой сыворотке антител класса Ig M, которые лучше сорбируют комплемент. Высокий титр антител в используемой сыворотке необходим не только для того, чтобы в разведении ее 1 : 20 - 1 : 40 их было достаточно для образования прочного иммунного комплекса, но и для того, чтобы отстроиться от возможного присутствия антител к другим возбудителям.
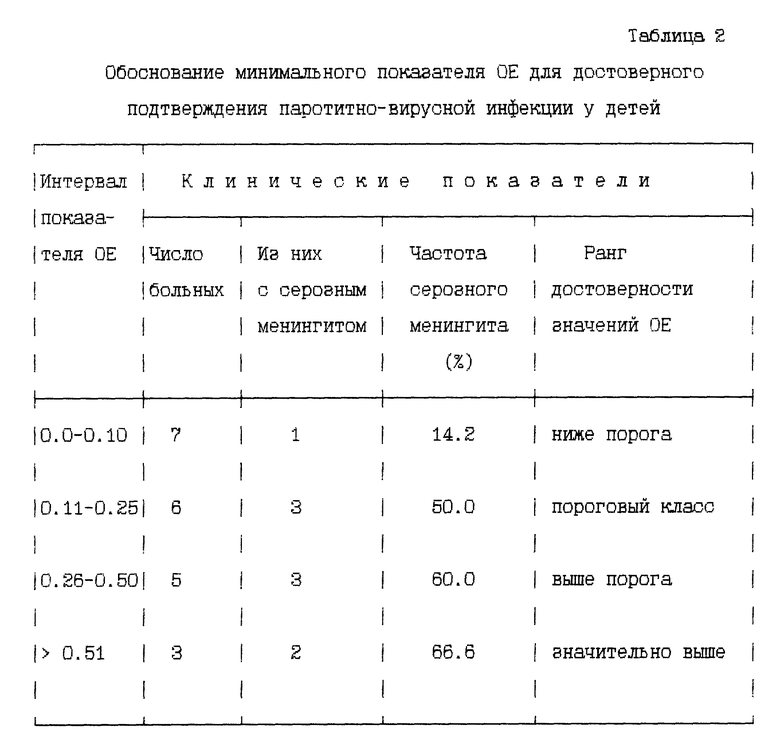
При разработке заявляемого способа нами был обоснован минимальный показатель OE для достоверного подтверждения паротитно-вирусной инфекции.
С этой целью в группе детей (21 человек) с различными показателями OE было проведено ранжирование по четырем классам уровней OE (Табл. 2). В каждом классе была прослежена частота основного осложнения паротитно-вирусной инфекции - серозного менингита. Установлено, что в классе 0.0 - 0.10 число детей с менингитом было минимальным. За пороговый класс взяты больные, у которых серозный менингит развивался в половине случаев. В соответствии с этим среднее значение OE в этом классе (0.11 + 0.25) : 2 = 0.18 нами принято за достоверный показатель наличия антигена в слюне больных (см. табл. 2)
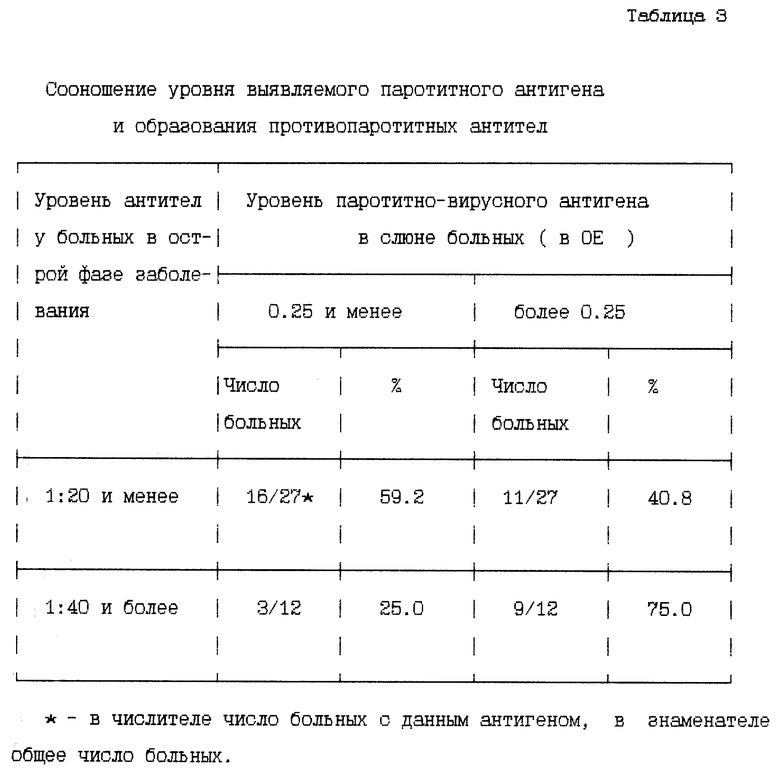
Дополнительным доказательством истинности заявляемого способа явилось подтверждение соотношения между уровнем выявляемого антигена в слюне и уровня антител в крови больного. Теоретически при большем уровне антигена в слюне организм должен вырабатывать большие концентрации антител. Дети были разбиты на две группы с уровнем порогового показателя антигена и ниже (< 0.25) и выше порогового уровня. (см. табл. 3)
Из табл. 3 видно, что большая выработка антител в начале заболевания обнаруживалась у больных с паротитно-вирусной инфекцией, у которых в слюне тестировались большие величины паротитно-вирусного антигена. Это явилось достаточно репрезентативным доказательством истинности предлагаемого нами метода.
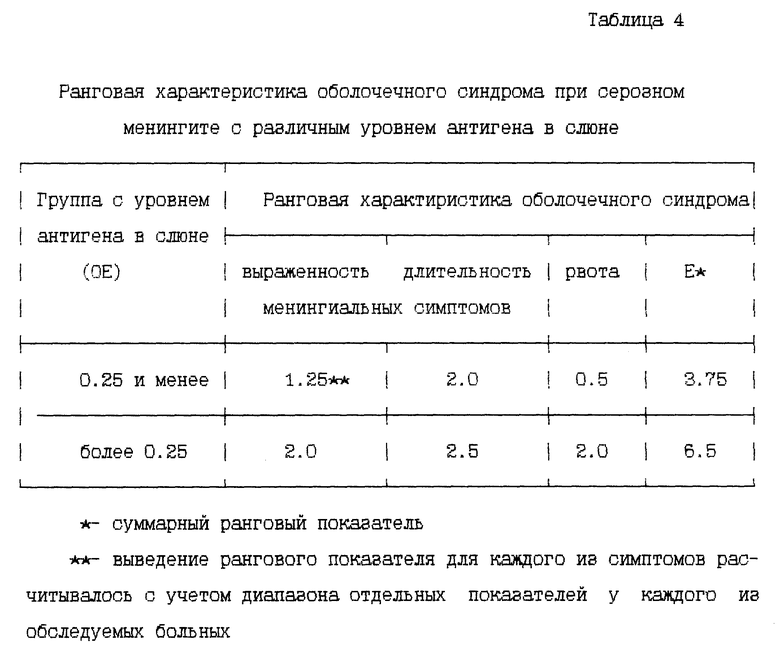
При детальном сопоставлении указанных двух групп больных с минимальным (0.25 и менее OE) и достаточным (более 0.25 OE) содержанием паротитно-вирусного антигена и клинической картины серозного менингита обнаружено наличие параллелизма между концентрацией антигена в слюне и выраженностью общемозговой симптоматики (табл. 4). Так при большем антигене в слюне достоверно чаще отмечались повторные многократные рвоты, более длительными и выраженными были менингиальные симптомы.
Данное изобретение относится к области медицины, а именно к диагностике вирусной инфекции, вызванной вирусом эпидемического паротита. Способ заключается в том, что антиген выявляют в жидкостном иммуноферментном тесте после 3-часового замораживания слюны больных при температуре -20o, последующим центрифугированием, затем надосадок разводят 1:5 и соединяют в равных объемах с сывороткой реконвалесцента, содержащей антипаротитно-вирусные антитела с титром 1:640-1:1280, и двумя дозами комплемента и наличие антигена определяют спектрофотометрически. Способ позволяет обнаружить антиген в слюне больных различными формами паротитно-вирусной инфекции даже в случае отсутствия его выделения в чувствительных тканевых культурах, обладает высокой чувствительностью. 4 табл.
Способ диагностики паротитно-вирусной инфекции путем выявления антигена в слюне больных эпидемическим паротитом, отличающийся тем, что антиген выявляют в жидкостном иммуноферментном тесте после 3-часового замораживания слюны больных при температуре -20o, последующего центрифугирования, затем надосадок разводят 1 : 5 и соединяют в равных объемах с сывороткой реконвалесцента, содержащей антипаротитно-вирусные антитела с титром 1 : 640 - 1 : 1280, и двумя дозами комплемента и наличие антигена определяют спектрофотометрически.
| Способ иммунодиагностики инфекций | 1983 |
|
SU1492280A1 |
| Takimoto S., Monteiro de Massas et al | |||
| Rev | |||
| Inst | |||
| A | |||
| Zutz | |||
| Гребенчатая передача | 1916 |
|
SU1983A1 |
| Справочник по микробиологическим и вирусологическим методам исследования | |||
| /Под ред | |||
| М.О | |||
| Биргера | |||
| - М.: Медицина, 1967, с.372 - 374. | |||
Авторы
Даты
1999-03-20—Публикация
1996-07-10—Подача