Изобретние относится к неописанным ранее солям 1,3-диметил-4,8-диалкокси-6-R-пирроло-(тиено-)[c]тропилия общей формулы (I)
где Z = S, N-H, N-R, где R=(C1-C10)алкил, бензил, фенил, незамещенный или замещенный (C1-C10)алкилом, (C1-C10)алкокси, карбоэтокси-группой или атомом галогена;
R1 = атом водорода, стирил, фенил, незамещенный или замещенный моно- или дигидрокси, моно- или ди(C1-C10)алкокси, метилендиокси, ди(C1-C6)алкиламино-группой;
R2=(C1-C10)алкил;
X = ClO4, HSO4, Br;
и способу их получения.
Соединения I являются потенциально биологически активными соединениями, и могут быть использованы как синтоны для производства различных известных и новых соединений пирроло(тиено-)[c]тропилиевого и азаазуленового ряда, также потенциально обладающих ценными физиологическими и физико-химическими свойствами.
Большинство известных тропон(олон)овых систем, пирролотропон(олон)овых систем и тиенотропон(олон)овых систем проявляют различные виды физиологической активности (Lopez de Lerma J., Garcia-Blanco S. // Tetrahedron Lett. 1980. P. 1273-1275), обладают противовоспалительной (Muth C.W., Streiniger D. O., Papanstrassion Z.B. // J. Am. Chem. Soc. 1955. Vol. 77. P. 3393), концеростатической (Pfan A.S., Plattner P.A. // Helv. Chim. Acta. 1940. Vol. 23. P. 768) и бактериостатической активностью (Anderson A.G., Tazyma I.I. // J. Am. Chem. Soc. 1953. Vol. 75, P. 4479), входят в состав природных соединений, проявляющих биологически активные свойства (Marshall J.A., Conrow R. E. // J. Am. Chem. Soc. 1980. Vol. 102. P. 4274-4277), объектами для специальных физико-химических исследований (Олехнович Л.П., Курбатов С.В., Тихонова М.Е., Волошин Н.А., Сухоленко Е.В., Рыскина Т.А., Жданов Ю.А., Минкин В. И. // ЖОрХ. 1990. Т. 26. Вып. 9. С. 1829-1838), специфичными лигандами в металлоорганической химии переходных металлов, синтезе п-комплексов переходных металлов, получении селективных катализаторов - комплексных соединений фуротропонов с переходными металлами (т.н. металлокомплексный катализ) (El Borai M. , Guillard R., Fournari P., Dussausoy U., Protas J. // Bull. Soc. Chim. Fr. 1977. P. 75) для гидрирования, изомеризации, полимеризации, карбонелирования олефинов и ацетиленов, окисления олефинов, алкилароматических углеводородов и др.
Близкими по структуре для 1,3-диметил-4,8-диалкокси-6-R-пирроло-(тиено-)[c]тропилия (I) являются производные 2-тиониазуленов (VI) (Ельцов А. В. , Гинесина А.А. // ЖОрХ. 1967. Т. III. Вып. 1. С. 191-197) и производные 2-азониазуленов (VII, VIII) (Vorkapic-Furac J., Suprina M. // Heterocycles. 1989. V. 29. P. 1005-1009).

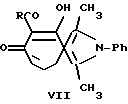

Однако данные соединения, являющиеся представителями пирроло-(тиено-)[c] тропоновых(олоновых) систем не могут быть использованы, из-за отсутствия реакционноспособных лабильных алкоксигрупп в качестве простых, удобных и доступных синтонов для одностадийных либо однореакторных синтезов различных потенциально биологически активных соединений ряда пирроло(тиено-)[c]тропилия.
Способ получения 2-тиониазуленов (тиенотропонов) (VI) заключается во взаимодействии в инертной атмосфере диальдегидов (X), свежеприготовленных из 2,5-диметил-3,4-ди(хлорметил)тиофена (IX), с кетонами (XI) в присутствии этилата натрия.
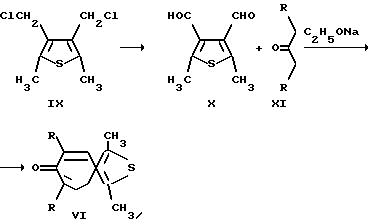
VI a: R=H; b: R=Alk.
Способ получения 2-азониазуленов (VII, VIII) заключается во взаимодействии свежеполученного N-фенил-2,5-диметилпирроло-3,4-диальдегида (XIII), образуется при длительном нагревании N-фенил-2,5-диметилпиррола (XII) (100oC, 12-15 часов) с диметилформамидом в присутствии POCl3, с дикетонами (XI) в этаноле в присутствии смеси пиперидина и уксусной кислоты в инертной атмосфере (аргон) (для получения соединений (VII), либо в хлороформе в присутствии смеси пиридина и пиперидина (для получения соединений (VIII).

VII, VIII: R = Me, п-анизил; Py = пиридин; Pi = пиперидин.
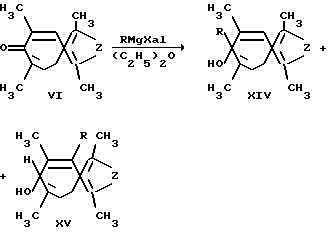
Однако данные способы также не позволяют получать соединения общей формулы (I). Кроме того, известно, что пирроло-(тиено-)[c]тропоны-6 (VI, Z = N, S)) вступают в некоторые реакции с нуклеофильными реагентами (Ельцов А.В. , Гинесина А. А. // ЖОрХ. 1967. Вып. 3. С. 191), но при этом в большинстве случаев реакция проходит неоднозначно, и образуется, как правило с низким выходом несколько изомерных (XII, XIII) продуктов (Гинесина А.А., Ельцов А. В. // ЖОрх. 1968. Т. IV. Вып. 6. с. 1096-1104; Hori M., Kataoka T., Shimizu H. , Yoshimura S. // Yakugaku Zasshi. 1974. 94. P. 1429-1438. [CA 82, 170549 (1975)] ), что ограничивает препаративность этого метода в синтезе производных 2-тиони(азони)-азуленов (XIV-XV), и сферу применения этих соединений в качестве синтонов для дальнейших синтезов различных производных данных гетероазуленов.
Наиболее близкими по структуре являются перхлораты пирроло-(тиено-)[c] тропилия (Z: a. N-Ph; b. S) общей формулы (XVI), (Ельцов А.В., Кивокурцева Л.Н., Гинесина А.А. // ЖОрХ. 1968. Т. IV. Вып. 5. с. 907-914).
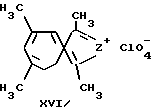
Способ получения соединений (XVI) заключается в восстановлении алюмогидридом лития 1,3,5,7-тетраметилпирроло-(тиено-)[c] трополонов-6 (VI, Z = N-Ph; S) с образованием карбинолов (XII), и обработке эфирных растворов (XII) хлорной кислотой с образованием с выходом 30-45% соединений (XVI).

Недостатком данного способа получения солей пирроло-(тиено-)[c]тропилия (XVI) является малый выход соединений общей формулы (XVI) (30-35%), многостадийность процесса, а именно необходимость предварительного получения пирроло-(тиено-)[c] тропонов-6 (VI, Z = N-Ph; S), что само по себе многостадийно, и сопряжено с уже описанными выше трудностями. Кроме этого, соли 1,3,5,7-тетраметилпирроло-(тиено-)[c]тропилия (XVI) являются, по сравнению с солями 1,3-диметил-4,8-диалкокси-6-R- пирроло-(тиено-)[c]тропилия (I), мало активными соединениями, из-за отсутствия реакционноспособных лабильных алкоксигрупп и не могут быть использованы как синтоны в синтезе различных производных пирроло-(тиено-)[c] тропилия, что значительно снижает практическую значимость этих соединений.
Техническим результатом изобретения являются новые соединения ряда пирроло-(тиено-)[c] тропилия - а именно соли 1,3-диметил-4,8-диалкокси-6-R-пирроло-(тиено-)[c] тропилия (I), являющиеся потенциально биологически активными соединениями, синтонами для производства различных производных ряда пирроло-(тиено-)[c] тропилия, потенциально обладающих ценными физиологическими и физико-химическими свойствами, а также способ их получения.
Технический результат достигается соединениями общей формулы (I) и способом их получения.
Способ получения соединений общей формулы (I) заключается в том, что: а) для получения соединений (I), где Z = S, 3,4-диацетилгександион-2,5 (II) нагревают с сероводородом в уксусной кислоте, и образующийся 2,5-диметил-3,4-диацетилтиофены (IV, Z = S) вводят во взаимодействие с триалкилортоформиатами и неорганической кислотой (для получения соединений I, где R1 = H), или ароматическими альдегидами (V) в присутствии хлорной кислоты с последующей обработкой триалкилортоформиатом (для получения соединений I, где R1 = стирил, фенил, незамещенный или содержащий заместители, принимающие вышеприведенные значения); или: б) для получения соединений (I), где Z = N-H, 3,4-диацетилгександион-2,5 (II) сплавляют с ацетатом аммония, и образующийся 2,5-диметил-3,4-диацетилпирролы (IV, Z = N-R) однореакторно, или с промежуточным выделением из реакционной массы вводят во взаимодействие с триалкилортоформиатами и неорганической кислотой (для получения соединений I, где R1 = H), или ароматическими альдегидами (V) в присутствии хлорной кислоты с последующей обработкой триалкилортоформиатом (для получения соединений I, где R1 = стирил, фенил, незамещенный или содержащий заместители, принимающие вышеприведенные значения; или: в) для получения соединений (I), где Z = N-R, 3,4-диацетилгександион-2,5 (II) сплавляют с алкиламинами или ариламинами, или их уксуснокислыми солями, и образующийся 2,5-диметил-3,4-диацетилпирролы (IV, Z = N-R) однореакторно, или с промежуточным выделением из реакционной массы вводят во взаимодействие с триалкилортоформиатами и неорганической кислотой (для получения соединений I, где R1 = H), или ароматическими альдегидами (V) в присутствии хлорной кислоты с последующей обработкой триалкилортоформиатом (для получения соединений I, где R1 = стирил, фенил, незамещенный или содержащий заместители, принимающие вышеприведенные значения).
Формирование соединений общей формулы (I, R1 = H) включает протонирование промежуточных 2,5-диметил-3,4-диацетилпирролов(тиофенов) и дальнейшую внутримолекулярную циклоконденсацию с триалкилортоформиатом и алкилирование диалкоксикарбокатионом, образующимся из триалкилортоформиата в кислой среде до конечных 1,3-диметил-4,8-диалкокси-6-H-пирроло(тиено-)[c]тропилиев общей формулы (I).
Формирование соединений общей формулы (I, R1 = стирил, фенил незамещенный или содержащий заместители, принимающие вышеприведенные значения), также включает в себя стадию образования протонированной формы 2,5-диметил-3,4-диацетилпиррола (тиофена) (П1), который, конденсируясь с альдегидами (V), образует сопряженную кислоту халкона (П2), и за счет внутримолекулярного присоединения по Михаэлю образует протонированную форму пирролоциклогептандиона (П3). Последний дегидрируется диалкоксикарбокатионом, и этерифицируется в тропилиевой части системы (Дорофеенко Г.Н., Ткаченко В.В. // ЖОрХ. 1972. Т. 8. Вып. 10. С. 2188-2191) до конечных солей 1,3-диметил-4,8-диалкокси-6-R-пирроло-(тиено-)[c]тропилия общей формулы (I).

Соединения общей формулы (I), а также способ их получения обладают изобретательским уровнем, так как являются производными нового ряда соединений: солей пирроло-(тиено-)[c]тропилия, обладают потенциально биологически активными свойствами и являются синтонами для получения производных пирроло-(тиено-)[c] тропона и пирроло-(тиено-)[c]трополона, в ряду которых известны биологически активные соединения, при этом возможность их получения является неочевидной.
Ранее не была изучена реакция 1,3-диметил-3,4-диацетилпиррола или тиофена и алифатических или ароматических альдегидов (III) в присутствии смеси хлорной кислоты и уксусной кислоты с последующей обработкой триэтилортоформиатом.
Известно, что в зависимости от условий проведения реакции и применяемых реагентов 3,4-диацетилгександион-2,5 (II) образует либо тетраацетилэтилен (XVII), либо 3,4-диацетил-2,5-диметилфуран (XVIII), либо 3,4-диацетил-2-бром(хлор)метил-5-метилфуран (XIX) (Adembri G., De Sio F., Nesi R., Scotton M. // J. Chem. Soc. (C). 1970. 1536-1540).

Реагенты - A: EtOTl; I2; B: H+; C: N-хлор-(X = Cl) или N-бром-(X = Br) сукцинимид.
Совместное поведение 3,4-диацетилгександиона-2,5 (II) и альдегидов (V) в кислых средах или реакция 1,3-диметил-3,4-диацетилпиррола или тиофена и алифатических или ароматических альдегидов (V) в присутствии смеси хлорной кислоты и уксусной кислоты с последующей обработкой триэтилортоформиатом неизвестна.
Также известно, что при действии на 3,4-диацетилгександион-2,5 (II) гидразингидрата, в зависимости от соотношения реагентов образуются либо 5,7-дигидро-1,4,5,7-тетраметилфуро[3,4-d] пиридазин (XX), либо пирролопиридазин (XXI), либо 1,4,5,8-тетраметилпиридазино [4,5-d] пиридазин (XXII) (Adembri G. , De Sio F., Nesi R., Scotton M. // J. Chem. Soc. (C). 1970. 1536-1540).

Формирование 1,3-диметил-3,4-диацетилпиррола или тропилиевого цикла либо гетероазуленовой системы в данных условиях также невозможно.
Ранее описано формирование тропилиевого цикла при действии на 3,4-диацетилгександиона-2,5 или 3,4-диацетилфуран смеси триалкилортоформиата и хлорной кислоты для получения тропилиевого цикла, незамещенного в положении-6, либо смеси алифатического или ароматического альдегида, триалкилортоформиата и хлорной кислоты для получения тропилиевого цикла, замещенного в положении-6 на алифатическую или ароматическую группу. При этом установлено, что в реакцию вступают арилальдегиды только с заместителями, повышающими основность карбонильной группы (OR или N(CH3)2 в положениях 4- или 3- и 4-аральдегида) (Олехнович Е. П. , Борошко С.Л., Бородкин Г.С., Коробка И.В., Минкин В.И., Олехнович Л.П. // ЖОрХ. 1996. Т. 31. Вып. 6. С. 891-896).

Подобная конденсация 1,3-диметил-3,4-диацетилпиррола или тиофена и алифатических или ароматических альдегидов в присутствии смеси хлорной кислоты и уксусной кислоты с последующей обработкой триэтилортоформиатом ранее неизвестна.
Таким образом ранее неизвестна и неизучена реакция 3,4-диацетилгександиона-2,5 с сероводородом (III, Z = S) в уксусной кислоте или его сплавления с аммиаком, алкиламинами, ариламинами (III, Z = N-R) или их уксуснокислыми солями, приводящая к 2,5-диметил-3,4-диацетилпирролы(тиофены) (IV), которые однореакторно, или с промежуточным выделением из реакционной массы вводят во взаимодействие с ортоформиатами или ароматическими альдегидами (V) в присутствии смеси хлорной кислоты и уксусной кислоты с последующей обработкой триалкилортоформиатом, приводящая к новым, неописанным ранее солям 1,3-диметил-4,8-диалкокси-6-R-пирроло-(тиено-)[c]тропилия общей формулы (I).
Ниже приведены примеры получения соединений (I) двумя методами: однореакторно, без выделения 1-R-2,5-диметил-3,4-диацетилпирролов (V) (примеры I-III), и двустадийно, с промежуточным выделением соединений IV (пример IV).
Спектры ИК образцов полученных соединений регистрировались на спектрометре Specord IR-71 в вазелиновом масле. Спектры ПМР записаны на спектрометре Varian VXR-300 (300 МГц) в дейтерированных растворителях. Элементный анализ осуществлен в лаборатории микроанализа НИИФОХ РГУ. Экспериментально полученные данные о соединениях (I): их константы (R-R2, Z), выходы, температуры плавления, элементный анализ и спектральные характеристики приведены в табл. 1 и 2.
Пример I. Получение 1,3-диметил-2-фенил-4,8-диметоксипирроло[c]тропилия перхлората (Iа)
Смесь 1,98 г (0,01 моль) 3,4-диацетилгексан-2,5-диона (II) и 0,93 г (0,01 моль) анилина нагревают при 170-180oC до прекращения выделения воды. Плав охлаждают, прибавляют 20 мл триметилортоформиата и 1 мл 70%-ной хлорной кислоты. Раствор кипятят в течение 25-30 мин с отгонкой легкокипящих фракций, охлаждают, разбавляют равным объемом эфира, выделившиеся светло-коричневые кристаллы отфильтровывают. Перекристаллизовывают из нитрометана. Данные о элементном анализе, спектроскопии ИК и ПМР приведены в табл. 1 и 2.
Пример II. Получение 1,3-диметил-2-фенил-4,8-диэтоксипирроло[c]тропилий перхлората (Iб)
Смесь 1,98 г (0,01 моль) 3,4-диацетилгексан-2,5-диона (II) и 0,93 г (0,01 моль) анилина нагревают при 170-180oC до прекращения выделения воды. Плав охлаждают, прибавляют 20 мл триэтилортоформиата и 1 мл 70%-ной хлорной кислоты. Раствор кипятят в течение 5-10 мин с отгонкой легкокипящих фракций, охлаждают, разбавляют равным объемом эфира, инициируют кристаллизацию и выделившиеся красные кристаллы отфильтровывают. Перекристаллизовывают из уксусной кислоты. Данные о элементном анализе, спектроскопии ИК и ПМР приведены в табл. 1 и 2.
Проводя реакцию аналогично, используя в качестве неорганической кислоты 1 мл серной кислоты получен гидросульфат 1,3-диметил-2-фенил-4,8-диметоксипирроло[c]тропилия (Iу), характеристики которого приведены в табл. 1 и 2.
Проводя реакцию аналогично, используя в качестве неорганической кислоты 1 мл бромистоводородной кислоты получен бромид 1,3-диметил-2-фенил-4,8-диметоксипирроло[c] тропилия (Iф), характеристики которого приведены в табл. 1 и 2.
Пример III. Получение 1,3-диметил-2-бензил-4,8-диметоксипирроло[c]тропилий перхлората (Iв)
Смесь 1,98 г (0,01 моль) 3,4-диацетилгексан-2,5-диона (II) и 1,07 г (0,01 моль) бензиламина нагревают на силиконовой бане при 140-145oC до прекращения выделения воды (3-5 мин). Плав охлаждают, прибавляют 20 мл триэтилортоформиата и 1 мл 70%-ной хлорной кислоты. Смесь нагревают до 35-40oC, выдерживают при этой температуре 5 мин. По охлаждении инициируют кристаллизацию. Очищают перекристаллизацией из нитрометана. Данные о элементном анализе, спектроскопии ИК и ПМР приведены в табл. 1 и 2.
Представленные в табл. 1 и 2 соединения (Iг-з, у-ц) получены аналогично соединениям (Iа-в) (примеры I-III).
Пример IV. Получение 1,3-диметил-2-фенил-4,8-диметоксипирроло[c]тропилий перхлората (Iа) однореакторно, с промежуточным выделением 1-фенил-2,5-диметил-3,4-диацетилпиррола (IVа)
Смесь 1,98 г (0,01 моль) 3,4-диацетилгексан-2,5-диона (II) и 0,93 г (0,01 моль) анилина нагревают на силиконовой бане при 170-180oC до прекращения выделения воды (3-5 мин). Плав охлаждают и перекристаллизовывают из 20 мл метанола, выделяя бесцветные кристаллы соединения IVа, характеристики которых приведены в примере VIII. К раствору 1,3 г (0,005 моль) соединения IVа в 10 мл триметилортоформиата прибавляют 0,5 мл 70%-ной хлорной кислоты. Раствор кипятят в течение 25-30 мин с отгонкой легкокипящих фракций, охлаждают, разбавляют равным объемом эфира, выделившиеся кристаллы отфильтровывают. Перекристаллизовывая из нитрометана получают 2,5 г (63,6%) соединения (Iа). Соединения (Iа), полученные по примеру I и IV аналогичны, проба смешения депрессии температуры плавления не дает.
Пример V. Получение 1,3-диметил-2,6-дифенил-4,8-диэтоксипирроло [c]тропилий перхлората (Iи)
Смесь 1,98 г (0,01 моль) 3,4-диацетилгексан-2,5-диона (II) и 0,93 г (0,01 моль) анилина нагревают на силиконовой бане при 170-180oC до прекращения выделения воды (3-5 мин). Плав охлаждают, растворяют в 4 мл уксусной кислоты и прибавляют при перемешивании 1,06 г (0,01 моль) бензальдегида и 5 мл (0,01 моль) 16%-ного раствора хлорной кислоты в уксусной кислоте (получен добавлением 57%-ной хлорной кислоты в рассчитанное количество уксусного ангидирида, охлаждаемого в ледяной бане), при этом наблюдая самопроизвольное разогревание реакционной смеси. После охлаждения массы до комнатной температуры (5-10 мин) прибавляют при перемешивании 20 мл триэтилортоформиата и нагревают реакционную смесь до начала кипения. После охлаждения выпавшие кристаллы отфильтровывают, промывают этилацетатом (2 раза по 10 мл) и эфиром (1 раза по 10 мл). Очищают перекристаллизацией из уксусной кислоты. Данные о элементном анализе, спектроскопии ИК и ПМР приведены в табл. 1 и 2.
Другие соединения общей формулы (Iк-т) получены аналогично соединению (Iи) (примеры I, II). Их константы также приведены в табл. 1 и 2.
Пример VI. Получение 1,3-диметил-4,8-диметоксипирроло[c]тропилий перхлората (Iс)
Смесь 1,98 г (0,01 моль) 3,4-диацетилгексан-2,5-диона (II) и 2,5 г (0,03 моль) ацетата аммония нагревают при 150-160oC до прекращения выделения воды (3-5 мин). Плав охлаждают, прибавляют 20 мл триметилортоформиата и 1 мл 70%-ной хлорной кислоты. Раствор кипятят в течение 25-30 мин, охлаждают, разбавляют равным объемом эфира, выделившиеся светло-коричневые кристаллы отфильтровывают. Перекристаллизовывают из нитрометана. Данные о элементном анализе, спектроскопии ИК и ПМР приведены в табл. 1 и 2.
1,3-Диметил-2-метил-4,8-диметоксипирроло[c] тропилий перхлората (Iт) получены аналогично соединению (Iс) из 3,4-диацетилгексан-2,5-диона и ацетата метиламмония (пример VI), его константы также приведены в табл. 1 и 2.
Ниже приведены примеры синтеза, выделены и охарактеризованы промежуточно образующиеся производные 1-R-2,5-диметил-3,4-диацетилпиррола (IV).
Пример VII. Получение 1-Фенил-2,5-диметил-3,4-диацетилпиррола (IVа)
Смесь 1,98 г (0,01 моль) 3,4-диацетилгексан-2,5-диона (II) и 0,93 г (0,01 моль) анилина нагревают на силиконовой бане при 170-180oC до прекращения выделения воды (3-5 мин). Плав охлаждают и перекристаллизовывают из 20 мл метанола, получая бесцветные кристаллы соединения IVа. Выход 2,3 г (88,5%), т. пл. 139-140oC. Найдено (%): C 75,01; H 6,78; N 5,53; C16H17NO2. Вычислено (%): C 75,26; H 6,71; N 5,49. Спектр ИК, v/см-1: 1120, 1286, 1526, 1606, 1633, 1680. Спектр ПМР (CDCl3, S, м.д.): 2,17с(6H), 2,43с(6H), 7,04-7,22м(5H).
Пример VIII. Получение 1-(4-Метилфенил)-2,5-диметил-3,4-диацетилпиррола (IVб)
Получают аналогично соединению IVа из 1,98 г (0,01 моль) 3,4-диацетилгексан-2,5-диона (II) и 1,07 г (0,01 моль) п-толуидина. Выход 2,18 г (81,0%), т. пл. 134-135oC. Найдено (%): C 75,23; H 7,11; N 5,17; C17H19NO2. Вычислено (%): C 75,81; H 7,12; N 5,20. Спектр ИК, v/см-1: 1166, 1273, 1513, 1566, 1640, 1673. Спектр ПМР (CDCl3, S, м. д.): 2,06с(6H), 2,39с(6H), 2,40с(3H), 7,01д(2H), 7,28д(2H).
Пример IX. Получение 1-(4-Метоксифенил)-2,5-диметил-3,4-диацетилпиррола (IVб)
Получают аналогично соединению IVа из 1,98 г (0,01 моль) 3,4-диацетилгексан-2,5-диона (II) и 1,2 г (0,01 моль) п-анизидина. Выход 2,2 г (77,2%), т. пл. 119-120oC. Найдено (%): C 72,21; H 6,52; N 4,59; C17H19NO3. Вычислено (%): C 71,56; H 6,71; N 4,91. Спектр ИК, v/см-1: 1166, 1260, 1513, 1580, 1646, 1673. Спектр ПМР (CDCl3, S, м.д.): 2,06с(6H), 2,40с(6H), 3,85с(3H), 6,98д(2H), 7,06д(2H).
Пример X. Получение 1-Бензил-2,5-диметил-3,4-диацетилпиррола (IVб)
Получают аналогично соединению IVа из 1,98 г (0,01 моль) 3,4-диацетилгексан-2,5-диона (II) и 1,07 г (0,01 моль) бензиламина. Выход 2,25 г (78,9%), т. пл. 83-84oC. Найдено (%): C 75,56; H 7,15; N 5,18; C17H19NO2. Вычислено (%): C 75,81; H 7,11; N 5,20. Спектр ИК, v/см-1: 1166, 1193, 1233, 1513, 1620, 1640, 1660. Спектр ПМР (CDCl3, S, м.д.): 2,24с(6H), 2,38с(6H), 5,03с(2H), 6,88д(2H), 7,21-7,32м(3H).
Пример XI. Получение 1-(4-Бромфенил)-2,5-диметил-3,4-диацетилпиррола (IVб)
Получают аналогично соединению IVа из 1,98 г (0,01 моль) 3,4-диацетилгексан-2,5-диона (II) и 1,8 г (0,01 моль) п-броманилина. Выход 2,8 г (83,8%), т. пл. 130-132oC. Найдено (%): C 57,41; H 4,75; Br 23,95; N 4,22; C16H16BrNO2. Вычислено (%): C 57,50; H 4,83; Br 23,91; N 4,19. Спектр ИК, v/см-1: 1160, 1280, 1533, 1566, 1649, 1686. Спектр ПМР (CDCl3, S, м.д.): 2,14с(6H), 2,40с(6H), 6,86д(2H), 7,25д(2H).
Пример XII. Получение 1-Метил-2,5-диметил-3,4-диацетилпиррола (IVб)
Получают аналогично соединению IVа из 1,98 г (0,01 моль) 3,4-диацетилгексан-2,5-диона (II) и 2,7 г (0,03 моль) ацетата N-метиламмония. Выход 1,45 г (76,3%), т.пл. 121-122oC. Найдено (%): C 68,61; H 7,30; N 7,36; C11H14NO2. Вычислено (%): C 68,72; H 7,34; N 7,29. Спектр ИК, v/см-1: 1206, 1286, 1540, 1673. Спектр ПМР (CDCl3, S, м.д.): 2,31с(6H), 2,33с(6H), 3,39с(3H).
Пример XIII. Получение 2,5-диметил-3,4-диацетилпиррола (IVб)
Получают аналогично соединению IVа из 1,98 г (0,01 моль) 3,4-диацетилгексан-2,5-диона (II) и 2,5 г (0,03 моль) ацетата аамония. Выход 1,35 г (75,0%), т. пл. 134-137oC. Найдено (%): C 66,93; H 7,35; N 7,94; C10H13NO2. Вычислено (%): C 67,02; H 7,31; N 7,82. Спектр ИК, v/см-1: 1286, 1620, 1686, 3166, 3286. Спектр ПМР (CDCl3, S, м.д.): 2,28с(6H), 2,38с(6H), 8,85с(1H).
Ниже приведены примеры использования солей 1,3-диметил-4,8-диалкокси-6-R-пирроло-(тиено-)[c] тропилия (I) как синтонов в простых одностадийных синтезах различных описанных ранее производных пирроло-(тиено-)[c]-4-тропона (XV) (А. А.Гинесина, Л.Н.Кивокурцева, А.В.Ельцов. ЖОрХ. 1969. N 5. С. 570-576; А.В.Ельцов, О.В.Кульбитская, Н.В.Огольцова. ЖОрХ. 1969. N 5. С. 2242-2283; А. А.Гинесина, А.В.Ельцов, ЖОрХ. 1969. Т. 39. С. 2601-2615; А.А.Гинесина, А.В.Ельцов. ЖОрХ. 1968. N 4. С. 1096-1104; З.Н.Тимофеева, А.В.Лизогуб, А.А.Гинесина, А.В.Ельцов. ЖОрХ. 1970. Т. 40. С. 2078-2086), являющихся потенциально биологически активными соединениями, реакцией соединений общей формулы (I) с нуклеофильными реагентами (вода, раствор ацетата натрия, водный метанол) (пример XIV-XVIII), а также синтез нового производного ряда азаазуленов - 1,3-диметил-4,8-диметоксиазаазулена (XXVI) (пример XIX).
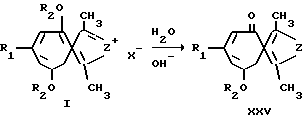
Пример XIV. Получение 1,3-диметил-2-фенил-8-метоксипирроло[c]-4-тропона (XXVа).
Суспензию 3,9 г (0,01 моль) соединения (Iа) в 20 мл воды кипятят с обратным холодильником 1 ч. Охлаждают, желтые кристаллы отфильтровывают и промывают водой. Очищают перекристаллизацией из водного (1:5) метанола. Выход 2,3 г (88,5%), т.пл. 164-166oC. Найдено (%): C 76,90; H 5,75; N 5,34; C17H15NO2. Вычислено (%): C 76,96; H 5,70; N 5,28. Спектр ИК, v/см-1: 1253, 1286, 1513, 1606, 1686. Спектр ПМР (DMSO-D6, S, м.д.): 1,42т(3H), 2,31с(3H), 2,36с(3H), 2,42с(3H), 4,05к(2H), 5,73д(2H), 6,05д(2H), 6,71к(1H), 7,11-7,35м(5H).
Пример XV. Получение 1,3-диметил-8-этоксипирроло[c]-4-тропона (XXVб)
К 3,45 г (0,01 моль) соединения (Iс) в 20 мл ацетона добавляют 0,012 моль ацетата натрия в 20 мл воды. Смесь кипятят с обратным холодильником 1 ч. Охлаждают, отгоняют ацетон, желтые кристаллы отфильтровывают и промывают водой. Очищают перекристаллизацией из водного (1:5) метанола. Выход 1,7 г (78,3%), т. пл. 146-147oC. Найдено (%): C 71,66; H 6,91; N 6,53; C13H15NO2. Вычислено (%): C 71,86; H 6,96; N 6,45. Спектр ИК, v/см-1: 1246, 1293, 1533, 1613, 1673. Спектр ПМР (DMSO-D6, S, м.д.): 1,38т(3H), 2,48с(3H), 2,50с(3H), 4,00к(2H), 5,59д(1H), 5,93д(1H), 6,70к(1H), 11,95с(1H).
Пример XVI. Получение 1,3-диметил-2-(4-метилфенил)-8-этоксипирроло[c]-4-тропона (XXVв)
К 4,35 г (0,01 моль) соединения (Iд) в 20 мл ацетона добавляют 0,012 моль ацетата натрия в 20 мл воды. Смесь кипятят с обратным холодильником 4-5 ч. Охлаждают, отгоняют ацетон, желтые кристаллы отфильтровывают и промывают водой. Очищают перекристаллизацией из метанола. Выход 2,5 г (80,6%), т.пл. 136-137oC. Найдено (%): C 78,02; H 6,93; N 4,64; C20H21NO2. Вычислено (%): C 78,14; H 6,89; N 4,56. Спектр ИК, v/см-1: 1246, 1280, 1533, 1606, 1673. Спектр ПМР (DMSO-D6, S, м.д.): 1,38т(3H), 2,30с(3H), 2,37с(3H), 2,40с(3H), 4,05к(2H), 5,70д(2H), 6,02д(2H), 6,77к(1H), 7,19д(2H), 7,39д(2H).
Пример XVII. Получение 1,3-диметил-2-бензил-8-этоксипирроло[c]-4-тропона (XXVг)
Получают аналогично соединению (XXVб) из 3,6 г (0,01 моль) соединения (Iт) и 0,012 моль ацетата натрия в 20 мл воды. Выход 1,8 г (78,3%), т.пл. 124-125oC. Найдено (%): C 72,64; H 7,45; N 6,18; C14H17NO2. Вычислено (%): C 72,70; H 7,41; N 6,06. Спектр ИК, v/см-1: 1253, 1266, 1540, 1620, 1680. Спектр ПМР (DMSO-D6, S, м.д.): 1,40т(3H), 2,60с(3H), 2,68с(3H), 3,56с(3H), 4,02к(2H), 5,65д(1H), 6,00д(1H), 6,70к(1H).
Пример XVIII. Получение 1,3-диметил-8-этокситиено[c]-4-тропона (XXVд)
К 3,6 г (0,01 моль) соединения (Iф) в 20 мл ацетона добавляют 0,012 моль ацетата натрия в 20 мл воды. Смесь нагревают при перемешивании на водяной бане до удаления ацетона (10 мин). Охлаждают до комнатной температуры, желтые кристаллы отфильтровывают и промывают водой. Очищают перекристаллизацией из водного (1:5) метанола. Выход 1,5 г (65,2%), т.пл. 130-131oC. Найдено (%): C 66,58; H 6,05; S 13,72; C13H14SO2. Вычислено (%): C 66,64; H 6,02; S 13,68. Спектр ИК, v/см-1: 1240, 1273, 1526, 1613, 1673. Спектр ПМР (DMSO-D6, S, м.д.): 1,34т(3H), 2,42с(3H), 2,49с(3H), 4,16к(2H), 5,61д(1H), 5,95д(1H), 6,22к(1H).
Ниже приведен пример синтеза из соединений (I) нового, неописанного ранее производного азаазуленовой системы - 1,3-диметил-4,8-диметоксиазаазулена (XXVI).

Пример XIX. Получение 1,3-диметил-4,8-диметоксиазаазулена (XXVI)
К раствору 3,5 г (0,01 моль) перхлората (Iс) в 10 мл нитрометана прибавляют 3,0 г безводного карбоната калия и перемешивают на магнитной мешалке 15-20 мин, наблюдая переход окраски раствора от красного к темно-синему. Перхлорат калия и избыток поташа отфильтровывают, фильтрат упаривают и остаток перекристаллизовывают из метанола. Выход (84,6%), т.пл. 176-177oC. Найдено (%): C 73,46; H 7,70; N 5,79; C15H19NO2. Вычислено (%): C 73,44; H 7,81; N 5,71. Спектр ИК, v/см-1: 1166, 1233, 1533, 1606. Спектр ПМР (Хлороформ-D6, S, м. д. ): 1,54т(6H), 2,86с(6H), 4,25к(4H), 6,18д(2H), 7,29к(1H).
Таким образом получены ранее неописанные соли ряда 1,3-диметил-4,8-диалкокси-6-R-пирроло-(тиено-)[c]тропилия общей формулы (I) с достаточно высокими выходами, которые могут быть использованы как синтоны в органическом синтезе, и в частности в синтезе новых потенциально биологически активных соединений пирроло-(тиено-)[c]тропилиевого, пирроло-(тиено-)[c]тропонового и азаазуленового ряда.
Все описанные соединения (I) получены одностадийно и с высоким (70-85%) выходом. Соли (I), а также их растворы в полярных и неполярных растворителях устойчивы при длительном хранении. Растворы солей (I) окрашены в интенсивный оранжево-красный цвет, а азаазулена (XXVI) в синий цвет.
Таким образом, соединения (I) являются новыми производными в новом ряду пирроло-(тиено-)[c]тропилиев, получаются из доступных исходных веществ простым, одностадийным, способом. Соединения (I) являются потенциально биологически активными веществами, стабильны, и вместе с тем обладают высокой химической активностью в реакциях с различными нуклеофильными реагентами, и могут быть использованы как синтоны в органическом синтезе для получения известных и новых потенциально биологически активных производных пирроло-(тиено-)[c]тропилиевого ряда, в частности пирроло-(тиено-)[c]тропона, и пирроло-(тиено-)[c]трополона и азаазулена.
Пример 1. Получение 1,3-диметил-4,8-диэтокситиено[c]тропилия перхлората (I ч).
Пропускают ток сероводорода в раствор 0,01 моль 3,4-диацетилгексан-2,5-диона в 20 мл уксусной кислоты при температуре 60-80oC в течение 30 мин, затем прибавляют 20 мл триэтилортоформиата, после чего по каплям добавляют 0,01 моль 70%-ной HClO4 и смесь кипятят 3-5 мин, охлаждают, разбавляют равным объемом эфира. Выделившийся продукт отфильтровывают и очищают перекристаллизацией из AcOH. Данные о элементном анализе, спектроскопии ИК и ПМР приведены в табл. 1 и 2.
Пример 2. Получение 1,3-диметил-4,8-диэтокси-6-(4-метоксифенил)тиено[c] тропилия перхлората (I ш).
Пропускают ток сероводорода в раствор 0,01 моль 3,4-диацетилгексан-2,5-диона в 20 мл AcOH при температуре 60-80oC в течение 30 мин, затем добавляют 5 мл (0,01 моль) 16%-ного раствора HClO4 в AcOH, 3 мл (0,03 моль) Ac2O и 1,1 г (0,01 моль) анисового альдегида. Нагревают при перемешивании на водяной бане (50-60oC) 10 мин, охлаждают, прибавляют 20 мл триалкилортоформиата и кипятят в течение 5 мин. Выделяют и очищают аналогично описанному в примере 1. Данные о элементном анализе, спектроскопии ИК и ПМР приведены в табл. 1 и 2.







Способ получения соединений формулы (I), где Z= S, N-H, N-R, R = (С1-С10)алкил, бензил, фенил, незамещенный или замещенный (С1-С10)алкилом, (С1-С10)алкокси, карбоэтокси-группой или атомом галогена; R1 = атом водорода, стирил, фенил, незамещенный или замещенный моно- или дигидрокси, моно или ди(С1-С10)алкокси, метилендиокси, ди(С1-С6)алкиламиногруппой; R2 = (С1-С10)алкил; Х= ClO4, HSO4, Br; заключается в том, что 3,4-диацетилгександион-2,5 - формулы (II) нагревают с сероводородом в уксусной кислоте или сплавляют с алкиламинами, ариламинами, их уксуснокислыми солями или ацетатом аммония, и образующиеся 2,5-диметил-3,4-диацетилпирролы (тиофены) однореакторно, или с промежуточным выделением из реакционной массы вводят во взаимодействие с триалкилортоформиатами и неорганической кислотой (для получения соединений I, где R1 =Н), или ароматическими альдегидами, R1 -СНО (значения R1 приведены выше) в присутствии хлорной кислоты с последующей обработкой триалкилортоформиатом (для получения соединений I, где R1 = стирил, фенил, незамещенный или содержащий заместители, принимающие вышеприведенные значения). Соединения формулы (I) являются потенциально биологически активными соединениями, обладают высокой реакционной способностью во взаимодействиях с нуклеофилами и являются синтонами для производства различных известных и новых потенциально биологически активных соединений ряда пирроло /тиено/-[с] тропилия и азаазулена. 6 з.п. ф-лы, 2 табл.

где z =S, N-H, N-R, где R = (С1-С10)алкил, бензил, фенил, незамещенный или замещенный (С1-С10)алкилом, (С1-С10)алкокси, карбоэтокси-группой или атомом галогена;
R1 = атом водорода, стирил, фенил, незамещенный или замещенный моно- или дигидрокси, моно- или ди(С1-С10)алкокси, метилендиокси, ди(С1-С6)алкиламиногруппой;
R2 = (С1-С10) алкил; Х = ClO4, HSO4, Br, отличающийся тем, что 3,4-диацетилгександион-2,5 (II)
вводят во взаимодействие или с сероводородом в уксусной кислоте, или с аминами R-NH2, где R имеет приведенные значения,
или их уксуснокислыми солями, или ацетатом аммония, а затем действуют неорганической кислотой НХ, где Х имеет приведенные значения, в присутствии триалкилортоформиата СН(OR2)3, где R2 имеет приведенные значения, или действуют хлорный кислотой в присутствии альдегидов R1 -СНО, где R1 имеет приведенные значения, и триалкилортоформиата.
| Ельцов А.В., Кивокурцева Л.Н., Гинесина А.А., ЖОрХ, 1968, т | |||
| IV, вып.5, с.907-914; Ельцов А.В., Гинесина А.А., ЖОрХ, 1967, т.III, вып.1, с.191-197; Vorkapic - Furac, j., Suprina M., Heterocyrles, 1989, n.29, c.1005-1009; Ельцов А.В., Гинесина А.А., ЖОрХ, 1968, т.IV, вып.6, с.1096-1104 | |||
| Дорофеенко Г.Н., Ткаченко В.В., ЖОрХ, 1972, т.8, вып.10, с.2188-2191 | |||
| Олехнович Е.П., Борошко С.Л., Бородкин Г.С, Коробка И.В., Минкин В.И., Олехнович Л.П., ЖОрХ, 1996 | |||
| Способ очистки нефти и нефтяных продуктов и уничтожения их флюоресценции | 1921 |
|
SU31A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Приспособление к паровозному реверсу | 1924 |
|
SU841A1 |
Авторы
Даты
1999-06-20—Публикация
1997-05-28—Подача