Изобретение относится к химической отрасли и может быть использовано при получении расплавов, используемых как сырье для получения металлического магния электролизом.
Известен способ получения расплава, содержащего безводный хлорид магния, в котором предусмотрена подача гидратированного MgCl2 в отдельную камеру с расплавом электролита, содержащим 10-55% MgCl2, при температуре выше нормальной температуры 750 -850oC электролитической ячейки, предпочтительно 800 - 850oC, для разложения гидратированного MgCl2 и повышения концентрации MgCl2 в отдельной камере до 50%. Образовавшийся при этом MgO можно ввести в реакцию с подаваемым в камеру таким хлорирующим реагентом, как газообразный HCl или Cl2. Обогащенный MgCl2 электролит периодически порциями передают в прилегающую камеру электролиза. Кроме того, необходимо вычерпывать образующийся в камере MgO содержащий шлак. Процесс протекает при температуре выше 750oC, при которой большая часть введенного гидратированного MgCl2 гидролизуется в MgO. Если в качестве хлорирующего агента использовать газообразный HCl, то при такой высокой температуре для понижения концентрации MgO в электролите до уровня, достаточно низкого для использования электролита в современных герметичных электролитических ячейках, нужно большое количество газа. Так, потребность в сухом HCl, получаемом из хлора, выделенного электролизом MgCl2, значительно превосходит 2 моля на моль MgCl2 в гидратированном MgCl2. Следовательно, газообразный HCl подлежит рециркуляции (1) (AU 120535).
Известен также способ получения расплава или электролита, содержащего безводный хлорид магния из гидратированного магния, включающий подачу гидратированного MgCl2 в плавильную печь с находящимся в ней расплавленным электролитом из электролитической ячейки (2) (JP 32-9052).
В этом способе подаваемый гидратированный MgCl2 и содержащий MgCl2 (25%) электролит вводят одновременно при температуре 750oC с сухим газообразным HCl, без которого 22% введенного MgCl2 реагирует с поступающей вместе с ним влагой, образуя MgO. При образовании MgO почти полностью подавляется вводом HCl с расходом, равным или слегка превышающем 2 моль/моль вводимого гидратированного MgCl2, получаемого с участием хлора, выделяемого при последующем электролизе MgCl2. Однако, при электролизе MgCl2 содержащего электролита расход графита достигает 13-15 кг/т получаемого металлического магния, что в 20-30 раз больше допустимого для современных герметичных электролитических ячеек для получения магния. Таким образом, в электролите по существу нет MgO, расход графита указывает на обратное, т.е. на высокую концентрацию MgO. Это весьма правдоподобно, ибо MgO легко осаждается в виде шлака при недостаточном перемешивании электролита, что и происходит при барботировании газообразного HCl. Образующийся шлакообразный MgO при 750oC все еще жидок и, следовательно, легко может быть ресуспендирован циркулирующим электролитом. Поэтому описанным способом нельзя получить электролит MgCl2, содержащий менее 0,1% MgO.
Известен также способ получения расплава или электролита, содержащего безводный хлорид магния из гидратированного магния, и получения металлического магния, включающий подачу гидратированного MgCl2 в плавильную печь с находящимся в ней расплавленным электролитом из электролитической ячейки (3) US 4308116.
Способ осуществляется в современных ячейках для электролитического получения магния, таких как монополярные и мультиполярные ячейки Alkan, именуемые "герметичными", ибо для предотвращения проникновения влажного воздуха они плотно закрыты. Эти так называемые герметичные ячейки предназначены для непрерывной работы в течение нескольких лет. Соответственно графитовые аноды не могут быть заменены, и шлак не может быть удален из ячейки без ее выключения. Поскольку восстановление герметичной ячейки весьма дорого, необходимо, чтобы подаваемый в нее исходный материал содержал очень мало, предпочтительно менее 0,1 мас.% MgO. Это обусловлено тем, что присутствующий в сырье или образующийся в ячейке из-за влажного воздуха MgO либо вступает в реакцию с графитом анодов, расходуя графит, либо образует MgO содержащий шлак.
Эти ячейки для электролиза MgCl2 обычно требуют, чтобы концентрация MgCl2 в расплавленном электролите была в пределах 10-20%, а в остальном электролит содержал смесь NaCI, CaCl2 и KCl в различных пропорциях, зависящих от чистоты подаваемого MgCl2. Типичный электролит содержит примерно 60% NaCI, 20% CaCl2, 0-5% KCl и 16-20% MgCl2.
Расходование графита увеличивает зазор между анодом и катодом. Это требует повышения рабочего напряжения в ячейке, которое обуславливает возрастание удельного расхода энергии на получение магния. Поэтому ячейку необходимо выводить из эксплуатации либо при чрезмерном возрастании этого показателя и переходе в неэкономичный режим, либо при невозможности поддержание теплового баланса ячейки. Любой образующийся в герметичной ячейке шлак тонет, образуя в конце концов цементообразную массу на ее дне. Избыток шлака настолько нарушает движение электролита в ячейке, что ее выводят из эксплуатации.
Из сказанного ясно, что гидратированный MgCl2 не подают в герметичные ячейки, ибо влага реагирует либо с MgCl2 или металлическим магнием, образуя MgO, либо непосредственно с анодом, расходуя графит. Это подтверждено статьей Dow Chemicals в Kirk-Othmer Encyclopedia Vol.14, pp. 579-616, где отмечено, что добавление порошка гидратированного MgCl2, содержащего 1,5-2,0 молей H2O на моль MgCl2, непосредственно в электролитическую ячейку специальной конструкции приводит к выделению шлакообразующего MgO, который во избежание его накопления и последующего ухудшения эффективности работы ячейки необходимо ежедневно удалять вручную. Часть привносимой с сырьем влаги также реагирует с анодами, вызывая очень высокий расход графита (около 0,1 т/т получаемого магния). Во избежание нарушений работы ячеек из-за интенсивного расходования графита в конструкции электролитических ячеек Доу предусмотрены расходуемые графитовые аноды, периодически вдвигаемые в ячейку для стабилизации зазора между анодом и катодом. Интенсивное расходование графитовых анодов в ячейках Доу обуславливает главную часть эксплуатационных затрат, а также невозможность создания ячейки Доу с малым зазором между анодом и катодом. Поэтому для них характерен высокий удельный расход энергии (более 15000 кВтч/т металлического магния против лишь примерно 10000 кВтч/т магния для современных герметичных ячеек). Далее отходящий из ячейки Доу газ содержит менее 30% Cl2 с заметными примесями H20, HCl, CO, CO2, H2 и N2, из которого нельзя получить хлор, пригодный для рециркуляции или продажи. Современные герметичные ячейки выделяют концентрированный (более 95%) хлорсодержащий газ.
Таким образом, недостатком описанных выше способов является то, что они не всегда пригодны для осуществления в современных герметичных электролитических ячейках для получения магния, ибо не понижают концентрацию MgO в обогащенном MgCl2 электролите до достаточно низкого (обычно не более 0,1% MgO в расчете на 100% MgCl2) уровня, необходимого для экономичной работы ячеек. Кроме того, удаление MgO, содержащего шлак, неприятно и неэффективно. Способы дороги и трудоемки.
Техническая задача, которую решает изобретение, состоит в снижении расхода графитового анода и существенном уменьшении шлакообразования в ячейке, снижении трудоемкости осуществления способа и его стоимости. Кроме того, в задачу данного способа входит получение электролита MgCl2 с необходимой весьма низкой концентрацией MgO и предотвращение нежелательного шлакообразования. Кроме того, очень важно снизить потребность в HCl до уровня значительно менее 2 моль/моль MgCl2, получаемого из гидратированного MgCl2 с применением выходящего из ячейки газообразного хлора так, чтобы обойтись без дорогостоящей системы осушки и рециркуляции HCl.
Указанная выше задача решается тем, что в способе получения расплава, или электролита, содержащего безводный хлорид магния, включающем подачу гидратированного MgCl2 в плавильную печь с находящимся в ней расплавленным электролитом из электролитической ячейки, одновременно с подачей MgCl2 в расплав вводят газ, содержащий безводный HCl, с расходом менее 2 молей HCl на моль MgCl2, получаемого из гидратированного MgCl2, и производят перемешивание расплава для диспергирования введенного газа и удержания MgO в суспендированном состоянии для дегидратации MgCl2 и реакции с MgO до достижения концентрации MgO не более 0,2% в расчете на 100% MgCl2 и образования обогащенного расплава, содержащего безводный MgCl2, при этом температуру в печи поддерживают в пределах 450-650oC, и тем, что расплав содержит не более 0,1% MgO в расчете на 100% MgCl2, и тем, что гидратированный MgCl2 представляет собой полученный распылительной сушкой MgCl2, и тем, что гидратированный MgCl2 содержит до 2,5 молей H2O на моль MgCl2, и тем, что газ, содержащий безводный HCl, заменяют одновременно вводимыми в расплав H2 и Cl2 содержащими газами, и тем, что гидратированный MgCl содержит до 5% (по массе) MgO, и тем, что обогащенный расплав безводного MgCl2 содержит от 15 до 60% (по массе) MgCl2, и тем, что отношение парциальных давлений HCl и H2O в газовой фазе находится в пределах от 0,5 до 1,5, и тем, что обогащенный безводный хлорид магния рециркулируют через одну или более электролитических ячеек для получения магния, и еще тем, что при получении металлического магния электролизом непосредственно из подаваемого гидратированного MgCl2 подачу гидратированного MgCl2 производят в отдельную плавильную печь, содержащую расплавленный электролит из электролитической ячейки для получения магния, с поддержанием температуры в печи в пределах от 450oC до 650oC до достижения концентрации MgCl2 в расплаве 15-60% по массе, при этом осуществляют одновременную подачу в расплав безводного HCl содержащего газа с расходом менее 2 молей HCl на моль MgCl2, получаемого из гидратированного MgCl2, и производят перемешивание расплава для диспергирования введенного газа и удержания MgO в суспендированном состоянии для дегидратации MgCl2 и понижения концентрации MgO с получением расплава, содержащего не более 0,2% MgO в расчете на 100% MgCl2, затем производят закачивание безводного MgCl2 содержащего расплава по меньшей мере в одну электролитическую ячейку для получения магния и получение металлического магния электролизом, и тем, что концентрация MgO в расплаве не превышает 0,1% в расчете на 100% MgCl2, и тем, что газ, содержащий безводный HCl, заменяют одновременно вводимыми в расплав H2 и Cl2 содержащими газами, а также тем, что при производстве металлического магния электролизом непосредственно из подаваемого гидратированного MgCl2 осуществляют подачу гидратированного MgCl2 в отделение электролитической ячейки для получения магния, с размещенным в ней расплавленным электролитом, при этом температуру в печи поддерживают в пределах от 450oC до 650oC, при этом осуществляют одновременную подачу в расплав через диспергирующее средство безводного HCl, содержащего газ с расходом менее 2 молей HCl на моль MgCl2, получаемого из гидратированного MgCl2, затем осуществляют перемешивание расплава для диспергирования введенного газа и удержания MgO в суспендированном состоянии для дегидратации MgCl2 и понижения концентрации MgO в расплаве до уровня не более 0,2% MgO в расчете на 100% MgCl2, в результате чего воздействие диспергирующего средства оказывается достаточным для перемещения расплава в электролитическую ячейку и получения металлического магния электролизом, и тем, что концентрация MgO в расплаве не превышает 0,1% в расчете на 100% MgCl2, и тем, что газ, содержащий безводный HCl, заменен одновременно вводимыми в расплав H2 и Cl2 содержащими газами.
Осуществление данного способа иллюстрируется чертежом.
Суть способа заключается в следующем.
Способ получения расплава или электролита из безводного MgCl2 с очень низкой концентрацией MgO, обычно 0,2% по массе, непосредственно из подаваемого гидратированного MgCl2 предусматривает подачу в плавильную печь, содержащую расплавленный электролит из электролитической ячейки, гидратированного MgCl2 при поддержании температуры в печи в пределах 450-660oC и одновременную подачу в расплав безводного HCl содержащего газа с расходом менее 2 молей HCl на моль MgCl2, получаемого из гидратированного MgCl2, перемешивание расплава для диспергирования введенного газа и удержания MgO в суспендированном состоянии для дегидратации MgCl2 и реакции с MgO до получения расплава, содержащего не более 0,2% MgO в расчете на 100% MgCl2 и обогащенного безводным MgCl2, для последующего использования в ячейке в качестве MgCl2 электролита.
Для решения поставленной задачи также существенным является процесс получения металлического магния электролизом, предусматривающий подачу гидратированного MgCl2 в отдельную плавильную печь, содержащую расплавленный электролит из электролитической ячейки для получения магния, с поддержанием температуры в печи в пределах от 450oC до 660oC до достижения концентрации MgCl2 в расплаве 15-60% по массе с одновременной подачей в расплав безводного HCl содержащего газа с расходом менее 2 молей HCl на моль MgCl2, получаемого из гидратированного MgCl2, и перемешивание расплава для диспергирования введенного газа и удержания MgO в суспендированном состоянии для дегидратации MgCl2 и понижения концентрации MgO с получением расплава, содержащего не более 0,2% MgO в расчете на 100% MgCl2, закачивание безводного MgCl2 содержащего расплава по меньшей мере в одну электролитическую ячейку для получения магния и получение металлического магния электролизом.
Для регулирования концентрации MgCl2 в электролите расплав электролита рециркулируют из электролитической ячейки в печь.
Получение металлического магния электролизом непосредственно из подаваемого гидратированного MgCl2 согласно изобретению предусматривает подачу в отделение электролитической ячейки для получения магния, содержащее расплавленный электролит, гидратированного MgCl2 при поддержании температуры в пределах от 450oC до 650oC с одновременной подачей в расплав через диспергирующее средство безводного HCl содержащего газа с расходом менее 2 молей HCl на моль MgCl2, получаемого из гидратированного MgCl2, и перемешивание расплава для диспергирования введенного газа и удержания MgO в суспендированном состоянии для дегидратации MgCl2 и понижения концентрации MgO в расплаве до уровня не более 0,2% MgO в расчете на 100% MgCl2, в результате чего воздействие диспергирующего средства оказывается достаточным для перемещения расплава в электролитическую ячейку.
В описанном выше способе концентрация MgO в расчете на 100% MgCl2 предпочтительна на уровне 0,1% или ниже.
Способ осуществляется следующим образом.
Расплав, содержащий безводный хлорид магния, или электролит с концентрацией MgO менее 0,2% (предпочтительно 0,1% и менее) получают непосредственно из подаваемого гидратированного MgCl2. Процесс протекает при температуре 450-650oC и требует расхода менее 2 молей сухого газообразного HCl, получаемого из выделяющегося из ячейки хлора, на моль MgCl2, получаемого из гидратированного MgCl2, и дает в результате обогащенный MgCl2, пригодный для использования в современных герметичных электролитических ячейках электролит, содержащий менее 0,2% MgO (предпочтительно 0,1% или менее) в расчете на 100% MgCl2, и, таким образом, исключающий образование шлака и потребность в его удалении.
Можно также использовать полученный распылительной сушкой MgCl2 с концентрацией по массе около 5% H2O и 5% MgO. Было установлено, что, подавая гидратированный MgCl2 непосредственно в расплав, содержащий 15-60% MgCl2 при температуре 450-650oC (в зависимости от точки плавления смеси), можно практически исключить образование MgO добавлением безводного HCl-содержащего газа, позволяющего поддерживать отношение парциальных давлений HCl/H2O в требуемых пределах. Также установлено, что MgO, содержащийся в подаваемом гидратированном MgCl2 или присутствующий в расплаве вследствие других реакций, быстро реагирует с HCl-содержащим газом с существенным снижением концентрации MgO до уровня менее 0,2% (по массе).
Способ осуществляют в любом из следующих вариантов:
(1) для получения расплава в отдельную печь, содержащую расплавленный электролит из электролитической ячейки для получения магния, при температуре, поддерживаемой в пределах от 450oC до 650oC, подают гидратированный MgCl2 и одновременно вводят в расплав безводный HCl-содержащий газ с расходом менее 2 молей HCl на моль MgCl2, получаемого из гидратированного MgCl2, используя для этого диспергирующее средство, описанное в патенте США 4.981.674 и включенное сюда ссылкой; получаемый в результате обогащенный безводным MgCl2 расплав, содержащий менее 0,2% MgO (по массе), подают обратно в электролитическую ячейку; с одной печью дегидратации могут быть соединены несколько электролитических ячеек, а каждая печь дегидратации может иметь несколько диспергирующих средств; или
(2) в имеющее специальную конструкцию отделение электролитической ячейки для получения магния, содержащее электролит из ячейки, при поддержании температуры в пределах от 450oC до 650oC подают гидратированный MgCl2 и (через диспергирующее описанное выше средство) HCl содержащий газ с расходом менее 2 молей HCl на моль MgCl2, получаемого из гидрата MgCl2. Наряду с диспергированием впрыскиваемой газовой смеси диспергирующее средство нагнетает расплав в реакционную секцию с последующей перекачкой расплава, обогащенного MgCl2, в главную зону электролитической ячейки.
Сущность способа не ограничена подачей безводного газообразного HCl через описанные выше диспергирующие средства. Часть газообразной HCl может быть введена через простые барботеры, пористые насадки или другие известные устройства для вдувания газов в жидкости. Однако при этом необходимо достаточно хорошее перемешивание, чтобы присутствующий в расплаве MgO не оседал, образуя шлак. Диспергирование газообразного HCl в расплаве предпочтительно для поддержания в нем требуемого парциального давления HCl/H2O. В зависимости от концентрации MgCl2 в расплаве предпочтительное отношение парциальных давлений HCl/H2O должно быть в пределах от 0,6 до 1,5.
Взамен HCl содержащего газа в качестве хлорирующего реагента в среду можно раздельно подавать газообразный H2 или водородсодержащий газ, например метан, пропан, аммиак и т.п., и газообразный хлор. В этом случае водород и хлор реагируют на выходе из диспергирующего средства, образуя безводный HCl в расплаве. Получение HCl на месте осуществления предпочтительно из-за исключения потребности в отдельной газогенераторной печи для синтеза HCl и из-за уменьшения расхода тепла на процесс вследствие экзотермичности реакции образования газообразного HCl.
Из экспериментальных данных следует, что производство металлического магния способом согласно изобретению существенно дешевле, чем другими используемыми в отрасли способами.
Воплощение способа будет далее показано на примерах, иллюстрирующих, но не ограничивающих объем изобретения. Все процентные соотношения - по массе.
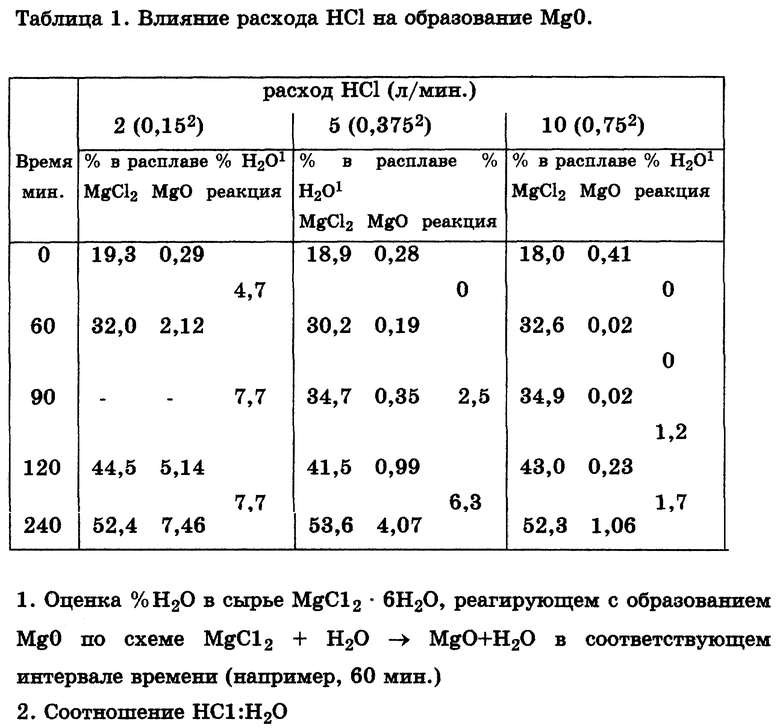
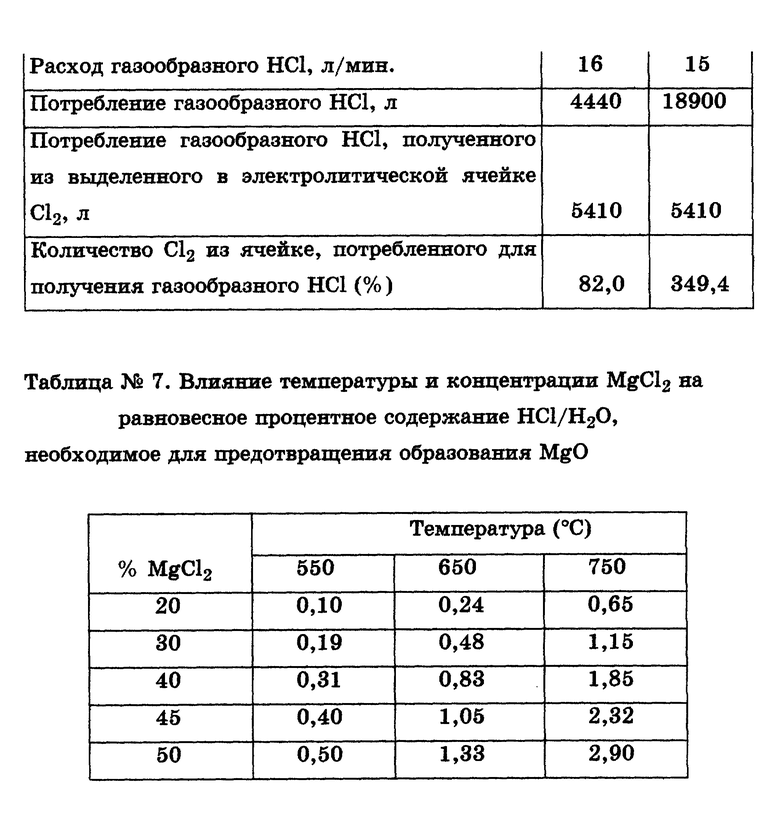
Пример 1. Оборудование для лабораторных испытаний показано на чертеже. Порошок MgCl2•6H2O непрерывно подают в MgCl2 содержащий расплав исходной массой 3-3,5 кг с расходом 20 г/мин. Результаты серии тестов при различных расходах газообразного HCl приведены в табл. 1 (табл. 1-8 см. в конце описания).
Испытания проводили при температуре 620oC с расплавом следующего приблизительного исходного состава: MgCl2 - 18%, NaCl 53%, CaCl2 - 23%, KCl - 6%, - в который непрерывно подавали MgCl2+6H2O с расходом 20 г/мин. Исходный расплав содержал также 0,2-0,4% MgO. Образцы расплава регулярно отбирали в течение всего испытания. После 4 ч работы испытания были прекращены. Полученный в итоге расплав имел следующий типичный состав:
MgCl2 - 53%, NaCl - 30%, CaCl2 - 15%, KCl - 3%. Результаты испытаний показали, что при расходе газообразного HCl 2 л/мин и отношении HCl:H2O = 0,15 концентрация MgO в расплаве постоянно повышалась в течение всего теста до конечного значения около 7,5%. Расчеты показывают, что 5-8% поступающей H2О реагируют с образованием MgO. При расходе газообразного HCl 5 л/мин и соотношении HCl: H2O = 0,375 в течение первых 60-90 мин теста или до достижения концентрации MgCl2 в расплаве примерно 30-35% MgO не образуется. При концентрации MgCl2 в расплаве >35% концентрация MgO существенно возрастает. При расходе газообразного HCl 10 л/мин и соотношении HCl:H2O=0,75 начальная концентрация MgO в расплаве (0,41%) быстро падает до очень низкого уровня (0,02%) и далее не возрастает, пока концентрация MgCl2 в расплаве не превзойдет 35%. Лишь тогда 1 - 2% содержащейся в подаваемом гидратированном MgCl2 воды вступает в реакцию с образованием MgO. Эти испытания показали, что вводимый в MgCl2, содержащий расплав газообразный HCl не только подавляет ведущую к образованию MgO реакцию H2О из сырого гидратированного MgCl2, но при определенных условиях может сам реагировать с присутствующим в расплаве MgO, понижая его концентрацию до весьма низкого уровня (<0,02 при 25% MgCl2 в электролите).
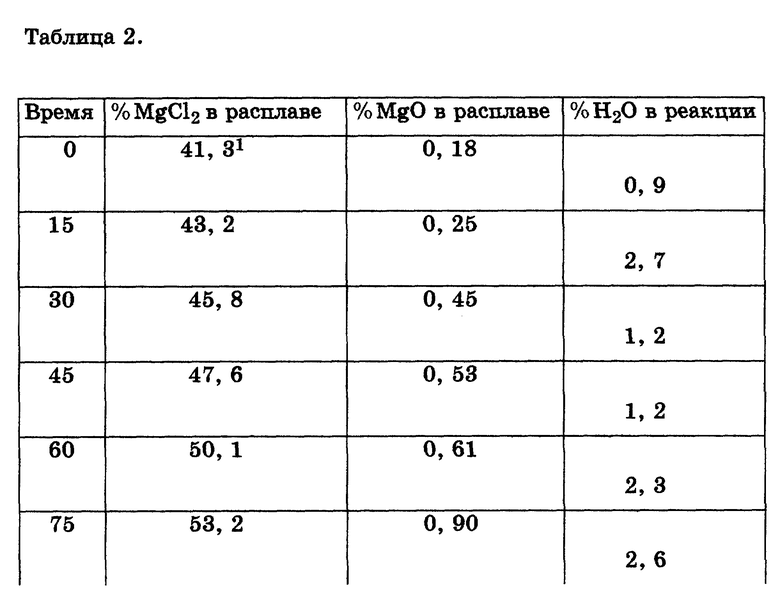
Из приведенной ниже табл. 2 следует, что процесс можно проводить при значительно более высоких (в пределах 40-60%) концентрациях MgCl2 и при температурах 500oC и ниже без образования существенного количества MgO в жидкой фазе. Кроме того, требуемое молярное соотношение газообразного HCl /H2O в подаваемом MgCl2 содержащем сырье, необходимое для предотвращения образования MgO, остается низким (в пределах 0,4-2%)в зависимости от температуры и состава расплава.
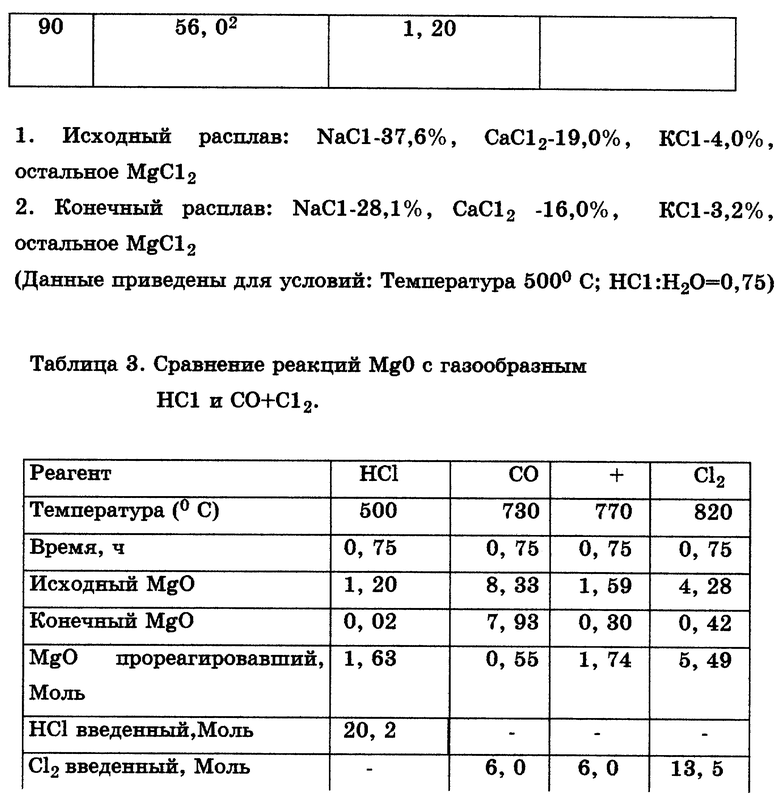
Интересно также отметить, что, как было установлено, реакция газообразного HCl с MgO, уже присутствующим в расплаве MgCl2, протекает очень быстро даже при температуре 500oC.
Табл. 3 показывает, что в расплаве с 56% MgCl2 концентрация MgO в ходе реакции (с HCl) при 500oC падает до 0,02% менее чем за 45 мин. Эта реакция идет значительно быстрее, чем реакция MgO в MgCl2 содержащем расплаве с углеродсодержащими реагентами и газообразным Cl2, скорость которой при температурах ниже примерно 730oC неприемлема для промышленного использования.
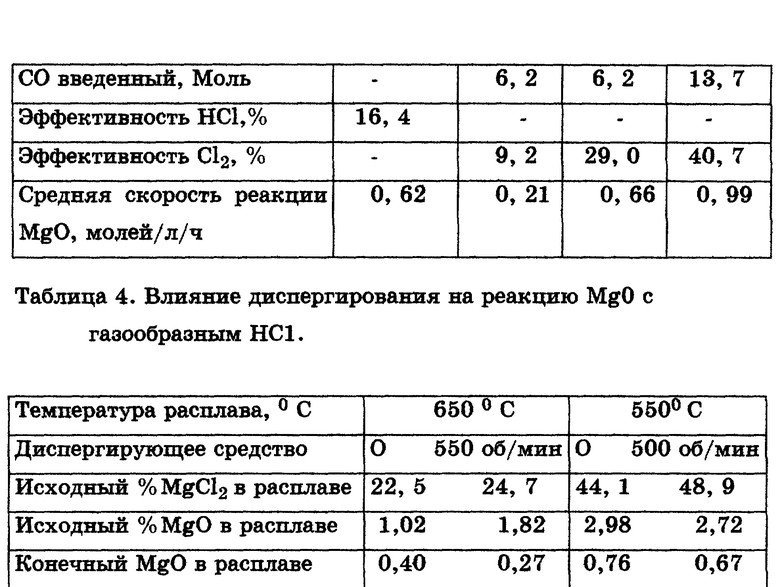
Воздействие введения газообразного HCl в MgCl2 содержащий электролит без перемешивания или диспергирования показано в табл. 4.
Эффективность газообразного HCl в этих случаях составляет менее 40%, а средняя скорость реакции - около 2,5 молей MgO в час. Кроме того, без перемешивания или диспергирования частицы MgO оседают в виде шлака так, что, несмотря на низкую (0,1-0,5% по массе) концентрацию MgO в пробах расплава, фактически в реакторе накапливается значительно большее количество MgO в виде подлежащего удалению шлака. Графитовая крыльчатка обеспечивает перемешивание, достаточное для удержания всех частиц MgO во взвешенном состоянии. В приведенном примере вращение крыльчатки со скоростью 500 об/мин повышает эффективность газообразного HCl более чем до 90%, существенно увеличивая при этом скорость реакции до 4,5-6,4 молей MgO в час.
Следующий пример показывает потребность в поддержании рабочей температуры значительно ниже 750oC во избежание высушивания газообразного HCl содержащего комплекса и в рециркуляции через печь хлорирования при концентрации MgCl2 в обогащенном электролите свыше 25%.
Пример 2.
Дигидрат MgCl2, содержащий 1% MgO, подают в печь хлорирования. Исходная концентрация MgCl2 в электролите около 20%, что близко к его концентрации в электролитической ячейке. Дигидрат MgCl2 подают в печь хлорирования с постоянным расходом 31,6 кг/мин в течение 30 мин, а сухой газообразный HCl вводят с расходом, необходимым для предотвращения или минимизации образования в электролите MgO. Через 30 мин концентрация MgCl2 в электролите возросла примерно до 45%, после чего подачу дигидрата прекратили, а подачу газообразного HCl для понижения остаточной концентрации MgO в электролите менее чем до 0,02% продолжали при пониженном расходе в течение 20 мин. Электролит с 45% концентрацией MgCl2, содержащий менее 0,02% MgO, был затем подан в электролитическую ячейку.
Сравнительные данные о потребности в сухом газообразном HCl приведены в табл. 5.
Таким образом, при рабочей температуре в печи хлорирования 550oC можно получить электролит, содержащий 45% MgCl2 и менее 0,01% MgO в расчете на 100% MgCl2, потребляя менее стехиометрически эквивалентного количества газообразного HCl. При 750oC реакция требует более чем трехкратного превышения стехиометрически эквивалентного количества газообразного HCl, что означает необходимость отбора из печи хлорирования влажного газообразного HCl, его охлаждения, сушки и возврата в печь.
Описанный процесс может быть также использован в непрерывном режиме, для чего необходима двухступенчатая печь хлорирования. В первой ступени гидратированный MgCl2 и расплавленный электролит из электролитической ячейки, содержащий 15-20% MgCl2, непрерывно подают в расплав для получения желаемого обогащенного MgCl2 электролита, содержащего 25-45% MgCl2. Сухой газообразный HCl на этой стадии вводят с расходом, необходимым для минимизации образования MgO, причем для ввода можно использовать различные хорошо известные средства, например трубки для вдувания или барботирования, пористые насадки, или вращающиеся распылители, или их комбинации. Получаемый в итоге электролит, содержащий 45% MgCl2 и 0,1-0,5% MgO, затем непрерывно подают во вторую ступень печи, куда через вращающийся распылитель для понижения концентрации MgO менее чем до 0,1% в расчете на 100% MgCl2 вводят сухой газообразный HCl. Сравнительные потребности в газообразном HCl для непрерывного процесса, протекающего при 550oC и 750oC, приведены в табл. 6.
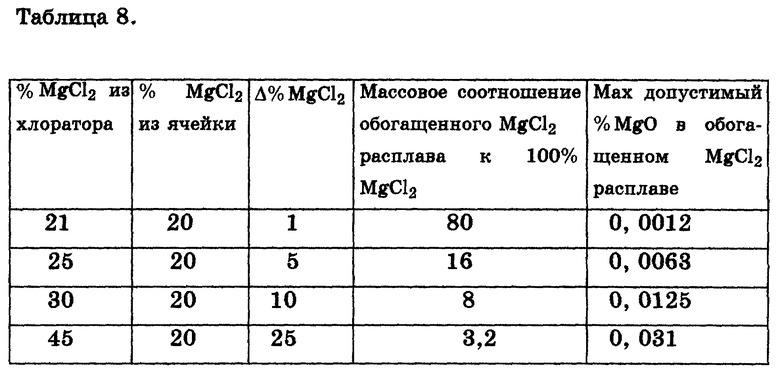
В табл. 7 показано влияние температуры в пределах 550-750oC концентрации MgCl2 при равновесном соотношении HCl/H2О во время подачи гидратированного MgCl2 в MgCl2 содержащий электролит (молярное соотношение NaCl:CaCl2 = 4,5: 1).
На практике для предотвращения образования чрезмерного количества MgO необходимо, чтобы соотношение HCl/H2O превышало равновесное на величину примерно до 50%. Концентрированные растворы MgCl2 могут быть высушены до дегидратации горячим воздухом в сушилке с псевдоожиженным придонным слоем без образования чрезмерных количеств (+1%) MgO. При условии, что подача дигидрата MgCl2 при максимальном отношении HCl/H2O возможна без потребности в осушке и рециркуляции газообразного HCl, максимальный уровень обогащения расплава при 550oC не ограничен, но при 650oC должен быть менее 45%, а при 750oC - менее 30% MgCl2. Так как для снижения остаточной концентрации MgO менее чем до 0,1% в расчете на 100% MgCl2 дополнительно требуются значительные количества HCl, на практике максимальный уровень обогащения, достижимый при температурах свыше 650oC без осушки и рециркуляции газообразного HCl, будет еще более ограничен. При концентрации MgCl2 в электролите из электролитической ячейки, равной 20%, работа при низком уровне обогащения MgCl2 увеличивает количество электролита, которое нужно передавать из электролитической ячейки в допустимый уровень печь хлорирования и обратно, и уменьшает до MgO в обогащенном электролите, подаваемом в электролитическую ячейку. Это можно видеть из табл. 8.
Так как при концентрации MgO ниже 0,3-0,5% скорость реакции остаточного MgO с газообразным HCl пропорциональна концентрации MgO в расплаве, габариты печи хлорирования для получения расплава с концентрацией MgO менее 0,01% будут очень большими.
Следовательно, предпочтительно работать при концентрациях MgO выше этой и при разнице между %MgCl2 не менее 5%, а предпочтительно 10% или выше.
Хотя изобретение было описано в связи с конкретными воплощениями, оно, разумеется, допускает дальнейшие модификации, и предполагается, что эта заявка включает любые изменения, использования и адаптации, следующие принципам изобретения, включая отклонения от сущности изобретения, остающиеся в практических рамках данной области техники в той мере, которая допустима с учетом основных особенностей, изложенных в описании и прилагаемой формуле изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОИЗВОДСТВА МАГНИЯ ИЗ ОКСИДНО-ХЛОРИДНОГО СЫРЬЯ | 1998 |
|
RU2118406C1 |
| СПОСОБ ПРОИЗВОДСТВА МАГНИЯ ИЗ ХЛОРМАГНИЕВОГО СЫРЬЯ | 2003 |
|
RU2230833C1 |
| СПОСОБ ПОЛУЧЕНИЯ МАГНИЯ И ХЛОРА ИЗ РАСТВОРОВ ХЛОРИСТОГО МАГНИЯ, СОДЕРЖАЩИХ ХЛОРИСТЫЙ АММОНИЙ | 2001 |
|
RU2200704C2 |
| СПОСОБ ПОЛУЧЕНИЯ МАГНИЯ В ПОТОЧНОЙ ЛИНИИ | 1995 |
|
RU2095480C1 |
| СПОСОБ ПОЛУЧЕНИЯ МАГНИЯ ИЗ КИСЛОРОДСОДЕРЖАЩЕГО СЫРЬЯ ЧЕРЕЗ АММОНИЕВЫЙ КАРНАЛЛИТ | 1998 |
|
RU2136786C1 |
| СПОСОБ ПРОИЗВОДСТВА МАГНИЯ | 2007 |
|
RU2354754C1 |
| СПОСОБ ПОЛУЧЕНИЯ МАГНИЯ | 1999 |
|
RU2158787C2 |
| СПОСОБ КОМПЛЕКСНОЙ ПЕРЕРАБОТКИ СИЛИКАТОВ МАГНИЯ | 2005 |
|
RU2290457C2 |
| СПОСОБ ПОЛУЧЕНИЯ БЕЗВОДНОГО ХЛОРИДА МАГНИЯ | 2007 |
|
RU2363657C2 |
| СПОСОБ ПОЛУЧЕНИЯ МАГНИЯ ИЗ СИНТЕТИЧЕСКОГО КАРНАЛЛИТА | 2001 |
|
RU2218452C2 |



Изобретение относится к способам получения содержащего безводный хлорид магния расплава или электролита непосредственно из гидратированного хлорида магния и получения металлического магния без существенного образования MgO, включающим подачу в плавильную печь, содержащую расплавленный электролит из электролитической ячейки, гидратированного MgCl2 при поддержании температуры в печи в пределах 450 - 650oC, одновременную подачу в расплав газа, содержащего безводный HCl, с расходом менее 2 молей HCl на моль MgCl2, получаемого из гидратированного MgCl2, перемешивание расплава для диспергирования введенного газа и удержания MgO в суспендированном состоянии для дегидратации MgCl2 и реакции с MgO до достижения концентрации MgO не более 0,2% в расчете на 100% MgCl2 и образования обогащенного расплава, содержащего безводный MgCl2, который может быть перекачан по меньшей мере в одну электролитическую ячейку для получения магния электролизом. Изобретение позволяет при получении металлического магния из безводного MgCl2 сводить к минимуму расход графитового анода и существенно уменьшить шлакообразование в ячейке. 6 с. и 9 з.п. ф-лы, 1 ил., 8 табл.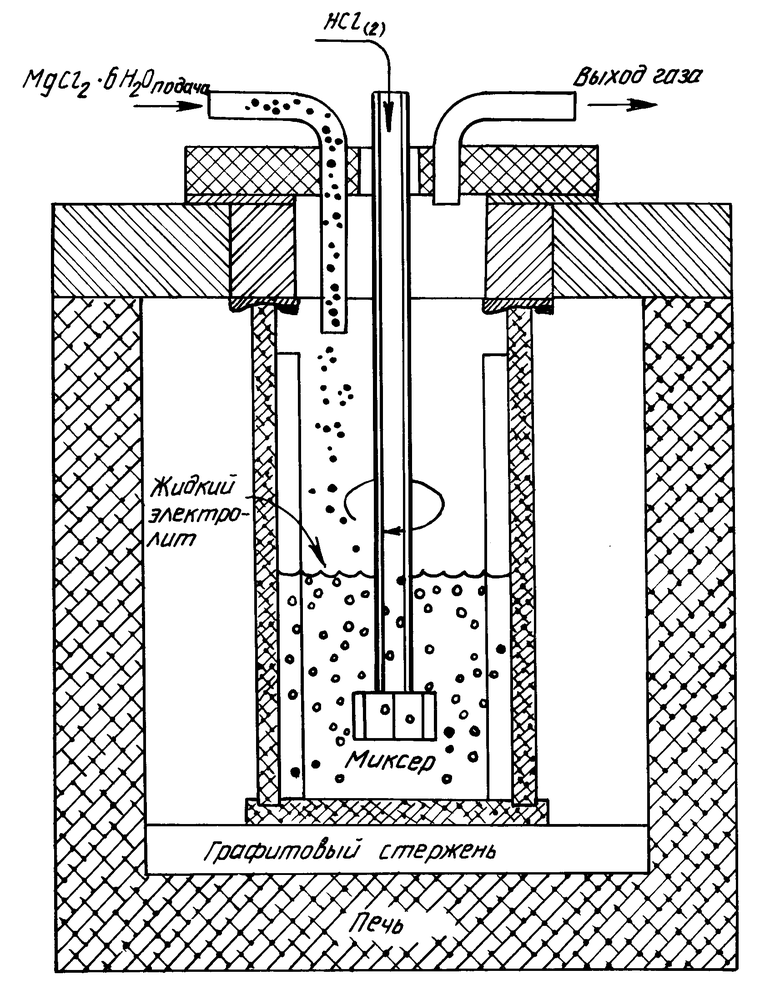
Приоритет по пунктам:
17.05.94 - по пп.1,2,3,5,6,7,8,10 и 11;
12.04.95 - по пп.4,9 и 12 - 15.
| US 4981674 A, 01.01.91 | |||
| US 4076602 A, 28.02.78 | |||
| Способ подготовки хлормагниевого сырья к электролизу | 1978 |
|
SU723005A1 |
| СПОСОБ ПОДГОТОВКИ ХЛОРМАГНИЕВОГО СЫРЬЯ | 0 |
|
SU379672A1 |
| СПОСОБ ПОДГОТОВКИ ХЛОРМАГНИЕВОГО СЫРЬЯ К ЭЛЕКТРОЛИЗУ | 0 |
|
SU380746A1 |
Авторы
Даты
1999-08-10—Публикация
1995-05-05—Подача