Изобретение относится к способу получения производных имидазола.
Были исследованы различные производные имидазола для применения их в медицине, и авторы данного изобретения обнаружили, что производные имидазола, имеющие арилтиогруппу в положении 5, эффективны в качестве антивирусного агента или агента против ВИЧ.
Известно, что в способе получения производных имидазола, имеющих замещенную тиогруппу, галогенированные производные имидазола подвергают реакции со смесью меркаптан/NaH/ДМФ после образования кольца имидазола (HETERO-CYCLES, Vol. 33, 1, 21-26 (1992)). Известно также, что производные имидазола подвергают реакции с дисульфидом в присутствии основания после галогенирования -СН-группы кольца имидазола (J. Chem. Perkin Trans. I. 1139-1145 (1989) и WO 96/10019). Эти способы, однако, не подходят для проведения такой реакции в промышленном масштабе, поскольку они требуют галогенирования -СН-группы кольца имидазола и применения сильного основания, такого как NaH или тому подобное. Как указано выше, до сих пор не известен способ получения производных имидазола, имеющих замещенную тиогруппу, который пригоден для удобного, экономически выгодного получения их в большом масштабе.
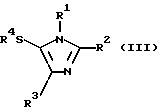
Авторы данного изобретения провели интенсивное исследование для разработки удобного, экономически выгодного получения в большом масштабе производных замещенных тиоимидазолов, таких как производные 5-арилтиоимидазолов, и достигли успеха в реакции производных имидазола следующей формулы (I) с тиогалогенидом формулы (II) в присутствии основания для получения производных имидазола, имеющих замещенную тиогруппу, формулы (III). Таким образом, данное изобретение было выполнено.
Соответственно этому данное изобретение предлагает способ получения соединения формулы (III)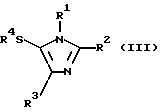
где R1 и R3, независимо, представляют водород или органическую группу; R2 представляет органическую группу и R4 представляет необязательно замещенный арил, который включает реакцию соединения формулы (I)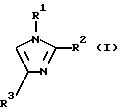
где R1, R2 и R3 такие, как определено выше, с соединением формулы (II):
R4-S-Hal (II)
где R4 такой, как определено выше, и Hal представляет галоген, в присутствии основания.
Предпочтительное осуществление данного изобретения включает способ, в котором органические группы в формуле (I) представляют необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный арил, необязательно замещенный тиоарил, необязательно замещенный гетероарил, необязательно замещенный гетероарилалкил, необязательно замещенный аралкил, необязательно замещенный ацил, необязательно замещенный карбамоил, необязательно замещенный алкоксикарбонил, -CH=NOH, -CH=NNH2 или -А-Х, где А представляет -СН2OСН2- или -СН2О- и Х представляет необязательно замещенный арил или -COR5, где R5 представляет необязательно замещенный алкил, необязательно замещенный алкокси, необязательно замещенный арил или необязательно замещенный амино.
Более предпочтительным осуществлением данного изобретения является (1) способ, в котором R1 представляет водород или необязательно замещенный гетероарилалкил; R2 представляет -А-Х, где А представляет -СН2ОСН2- или -СН2О- и Х представляет необязательно замещенный арил или -COR5, где R5 представляет необязательно замещенный алкил, необязательно замещенный алкокси, необязательно замещенный арил или необязательно замещенный амино, и R3 представляет необязательно замещенный алкил. В частности, предпочтителен способ получения соединения, где R1 представляет необязательно замещенный пиридилметил (особенно, пиридин-4-илметил). Особенно предпочтителен способ для соединений, где R2 представляет бензилоксиметил, ацетилоксиметил, бензоилоксиметил, метоксикарбонилоксиметил и карбамоилоксиметил.
Предпочтительным соединением формулы (II) является (2) 3,5-дихлорбензолсульфенилхлорид.
Предпочтительным основанием является (3) триэтиламин или N-метилморфолин.
Ниже дается определение терминам, использованным в данном описании.
Термин "органическая группа" относится к необязательно замещенному алкилу, необязательно замещенному алкенилу, необязательно замещенному арилу, необязательно замещенному арилтио, необязательно замещенному гетероарилу, необязательно замещенному гетероарилалкилу, необязательно замещенному аралкилу, необязательно замещенному ацилу, необязательно замещенному карбамоилу, необязательно замещенному ал-коксикарбонилу, -CH=NOH, -CH=NNH2, -A-X, где А представляет -СН2ОСН2- или -СН2O- и Х представляет необязательно замещенный арил или -COR5, где R5 представляет необязательно замещенный алкил, необязательно замещенный алкокси, необязательно замещенный арил или необязательно замещенный амино и тому подобное.
Термин "алкил" означает неразветвленный или разветвленный С1-С20-алкил, например метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, н-пентил, изопентил, н-гексил, н-гептил, н-октил, н-нонил, н-децил и тому подобное. Предпочтителен низший C1-С6-алкил.
"Алкильная" часть термина "алкокси" означает алкил, как определено выше, например метокси, этокси, пропокси, трет-бутокси и тому подобное.
Термин "алкенил" означает неразветвленный или разветвленный С2-С20-алкенил, например винил, аллил, пропенил, бутенил, пентенил, гексенил, гептенил и тому подобное. Предпочтителен низший С2-С7-алкенил.
Термин "арил" означает фенил или нафтил. Примеры необязательно замещенного арила включают, например, 3,5-дихлор-фенил, 2,4-дифторфенил, 3,5-дифторфенил, 3,5-диметилфенил, 3,5-диметоксифенил, 2,4,6-триметилфенил, 3,5-ди-трет-бутил-фенил, 4-метоксифенил, 4-бензилфенил, 4-гидроксифенил, 3,5-динитрофенил, 3-нитрофенил, 3,5-диаминофенил, 3-аминофенил и тому подобное.
Термин "гетероарил" означает 5-7-членную гетероциклическую группу, содержащую по меньшей мере один гетероатом (N, О или S), например пиридил (например, 4-пиридил), пиримидинил (например, 2-пиримидинил), пиридазинил (например, 3-пиридазинил), пиразинил (например, 2-пиразинил), тиенил (например, 2-тиенил), хинолил (например, 3-хинолил), имидазолил (например, 2-имидазолил), оксазолил (например, 2-ок-сазолил), тиазолил (например, 5-тиазолил) и тому подобное. Предпочтителен пиридил.
Термин "гетероарилалкил" означает определенный выше алкил, замещенный определенным выше гетероарилом, например пиридилметил (например, 4-пиридилметил), пиридилэтил (например, 1- или 2-(2-пиридил)этил), пиридилпропил (например, 3-(2-пиридил)пропил), тиенилметил (например, 2-тиенилметил), хинолилметил (например, 3-хинолилметил), имидазолилметил (например, 2-имидазолилметил) и тому подобное.
Термин "аралкил" означает вышеопределенный алкил, замещенный вышеопределенным арилом, например бензил, фенетил (например, 1-фенетил), нафтилметил, нафтилэтил (например, 2-нафтилэтил) и тому подобное.
Термин "ацил" означает алифатический или ароматический ацил, например ацетил, пропионил, пивалоил, бензоил и тому подобное.
"Необязательно замещенный карбамоил" может быть необязательно моно- или дизамещен заместителем, как определено ниже, например N-метилкарбамоил, N, N-диметилкарбамоил и тому подобное.
Термин "алкоксикарбонил" относится, например, к меток-сикарбонилу, этоксикарбонилу и тому подобное.
Термин "галоген" означает фтор, хлор, бром и йод. Предпочтителен хлор или бром.
"Необязательно замещенный амино" может быть необязательно моно- или дизамещен заместителем, как описано ниже, например метиламино, диметиламино и тому подобное.
Когда каждая группа, как описано выше, замещена, то заместитель относится, например, к алкилу (например, метилу и этилу), галогену (фтору, хлору, брому и йоду), ацилу (например, ацетилу и бензоилу) алкенилу (например, аллилу), циклоалкилу (например, циклопропилу), аралкилу (например, бензилу), необязательно замещенному амино (например, метиламино и диметиламино), гидрокси, оксо, алкокси (например, метокси и этокси), циано, карбокси, алкоксикарбонилу (например, метоксикарбонилу), нитро, ацилокси (например, ацетилокси), необязательно замещенному карбамоилу (например, N-метилкарбамоилу), необязательно замещенному карбамоилокси (например, N-этилкарбамоилокси) и тому подобное. Один или несколько заместителей могут быть в любом замещаемом положении(ях). Когда заместитель препятствует реакции, защитную группу можно ввести до реакции и затем удалить в любой подходящей стадии после реакции.
Соединение формулы (I), исходные материалы данного изобретения, включают известные соединения, их можно получить по способу, описанному в Международной патентной публикации WO 96/10019 и публикации нерассмотренного патента Японии 116242/1994. Соединение формулы (I), которое можно использовать в данном изобретении, представляет собой, например, 2-бензилоксиметил-4-изопропилимидазол, 2-бензилоксиметил-4 -изопропил-{1-(4-пиридилметил)}имидазол, 2-ацетилоксиметил-4-изопропил-{1-(4-пиридилметил)}имидазол, 2-бензоилоксиметил-4-изопропил-{ 1 -(4-пиридилметил)}имидазол, 2-метоксикарбонилоксиметил-4-изопропил-{ 1-(4-пиридилметил)} имидазол, 2-карбамоилоксиметил-4-изопропил-{1-(4-пиридилметил)}имидазол и тому подобное.
Соединение (II) коммерчески доступно или его получают реакцией соответствующего дисульфида (R4-S)2, где R4 представляет необязательно замещенный арил, который получают известными способами с газообразным хлором. Дисульфид представляет собой, например, бис-(3,5-дихлорфенил)дисульфид, бис-(4-хлорфенил)дисульфид, бис-(2-хлорфенил)дисульфид, бис-(4-нитрофенил)дисульфид, бис(2-нитрофенил)дисульфид, бис-(2,4-динитрофенил)дисульфид, бис(4-метоксифенил)дисульфид, бис(4-метилфенил)дисульфид, бис(2,4,6-триметилфенил)дисульфид, дифенилдисульфид и тому подобное. Количество газообразного хлора, которое используют для получения соединения (II), составляет 1-3 мольных эквивалента на дисульфид (R4-S)2. Реакцию можно проводить путем введения газообразного хлора при температуре -30. ..60oС в органический растворитель (например, тетрахлорметан, хлороформ, дихлорметан, толуол), в котором растворяют подходящее количество дисульфида.
Соединение формулы (II) представляет собой, например, 3,5-дихлорбензолсульфенилхлорид, 4-хлорбензолсульфенилхлорид, 2-хлорбензолсульфенилхлорид, 4-нитробензолсульфенилхлорид, 2-нитробензолсульфенилхлорид, 2,4-динитробензолсульфенилхлорид, 4-метоксибензолсульфенилхлорид, 4-метилбензолсульфенилхлорид, 2,4,6-триметилбензолсульфенилхлорид и тому подобное.
В качестве основания для реакции соединения (I) с соединением (II) используют, например, триэтиламин, N-метил-морфолин, пиридин, N,N-диметиланилин, N,N-диизопропил-N-этиламин, бутиллитий, диазабициклоундецен и тому подобное. В качестве растворителя используют, например, ацетонитрил, толуол, дихлорметан, хлороформ, диметилформамид, нитрометан, бензол, тетрагидрофуран и тому подобное.
В реакции данного изобретения количество основания составляет 0,1-3 мольных эквивалента, предпочтительно 1-2 мольных эквивалента, на соединение (I) и количество соединения (II) составляет 1-3 мольных эквивалента, предпочтительно 1-2 мольных эквивалента, на соединение (I). Температура реакции может быть -30. ..60oС, предпочтительно 0...10oС. Время реакции может быть 0,5-24 ч, предпочтительно 0,5-3 ч. Соединение (I) можно обычно добавлять к соединению (II) с перемешиванием, и наоборот. Основание либо смешивают с соединением (I) заранее либо добавляют в конце.
Следующие примеры предлагаются для дальнейшей иллюстрации данного изобретения и не должны рассматриваться как ограничение его объема.
Значения следующих аббревиатур в примерах приводятся ниже.
Me - метил
Ph - фенил
Вn - бензил
ТЭА - триэтиламин
ДМФ - N,N-диметилформамид
Ссылочный пример 1
3,5-Дихлорбензолсульфенилхлорид (2)
Бис-(3,5-дихлорфенил)дисульфид, 15,0 г (42,1 ммоль), растворяют в тетрахлорметане (60 мл). Раствор по каплям добавляют к раствору 9,0 г (126,9 ммоль) газообразного хлора в тетрахлорметане (50 мл) при -10oС. Смесь выдерживают 20 мин при той же температуре, затем через нее барботируют высушенный газообразный азот для удаления избыточного хлора. Полученную смесь концентрируют при пониженном давлении, получая 18,6 г (выход количественный) целевого продукта (2) в виде красного масла.
1H ЯМР (CDCl3-TMC) δ м.д.: 7,32 (т, J=1,8 Гц, 1Н), 7,43 (д, J=1,8 Гц, 2Н).
Ссылочный пример 2
3,5-Дихлорбензолсульфенилхлорид (2)
Бис (3,5-дихлорфенил)дисульфид, 30,0 г (84,2 ммоль), растворяют в толуоле (90 мл). В раствор вводят 11,9 г (167,8 ммоль) газообразного хлора при охлаждении льдом в течение 1 ч. В смесь при той же температуре барботируют высушенный газообразный азот для удаления избыточного хлора, получая раствор целевого соединения (2) в толуоле. Выход 99,7%.
Пример 1
2-Бензилоксиметил-5-(3,5-дихлорфенилтио)-4-изопропил-1H-имидазол (3)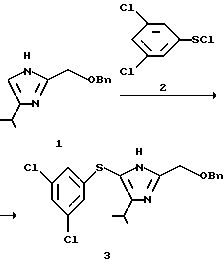
2-Бензилоксиметил-4-изопропил-1Н-имидазол (1), 550 мг (2,4 ммоль), описанный как ссылочный пример 1 в WO 96/10019, растворяют в смеси 360 мг (3,6 ммоль) триэтиламина и 4 мл ацетонитрила. К раствору добавляют 930 мг (4,4 ммоль) 3,5-дихлорбензолсульфенилхлорида (2) при комнатной температуре. Смесь перемешивают в течение 30 минут при комнатной температуре и в нее добавляли 15 мл воды и 15 мл толуола. Слой толуола отделяют, промывают два раза 10 мл воды и концентрируют при пониженном давлении. Полученное желтое масло кристаллизуют с применением 10 мл диизопропилового простого эфира, фильтруют и сушат, получая 800 мг целевого продукта (3) в виде бледно-желтых кристаллов. Выход 82%.
1H ЯМР (CDCl3-TMC) δ м.д.: 1,22 (д, J=7,2 Гц, 6Н), 3,64 (отдельн, 1Н), 4,62 (с, 2Н), 4,67 (с, 2Н), 6,92 (шир.с, 2Н), 7,07 (шир.с, 1H), 7,36 (с, 5Н), 9,20 (б, 1H).
Пример 2
2-Бензилоксиметил-5-(3,5-дихлорфенилтио)-4-изопропил-1-(пиридин-4-ил)метил-1H-имидазол (5)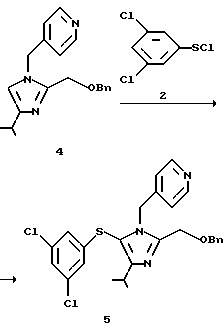
2-Бензилоксиметил-4-изопропил-1-(пиридин-4-ил)-1Н-имидазол (4), 10,0 г (31,1 ммоль), растворяют в толуоле (50 мл). Раствор по каплям добавляют к 24,7 г раствора в толуоле 8,0 г (37,05 ммоль) 3,5-дихлорбензолсульфенилхлорида (2) при охлаждении льдом в течение 30 минут. К смеси при охлаждении льдом в течение 1 ч по каплям добавляют 3,5 г (34,6 ммоль) триэтиламина, и смесь перемешивают при той же температуре в течение 1,5 ч. К смеси добавляют 25 мл воды и слой толуола отделяют. Слой толуола промывают 25 мл воды, и каждый водный слой экстрагируют 10 мл толуола. Слои толуола собирают, концентрируют при пониженном давлении, кристаллизуют с использованием 50 мл диизопропилового простого эфира, фильтруют и сушат, получая 12,6 г целевого продукта (5) в виде бледно-желтых кристаллов. Выход 81,3%.
1Н ЯМР (СDСl3) δ м.д.: 1,30 (д, J=7,2 Гц, 6Н), 3,08-3,22 (м, 1H), 4,52 (с, 2Н), 4,62 (с, 2Н), 5,16 (с, 2Н), 6,65 (д, J=1,8 Гц, 2Н), 6,79 (д, J=6,0 Гц, 2Н), 7,03 (т, J=1,8 Гц, 1Н), 7,18-7,36 (м, 5Н), 8,38 (д, J=6,0 Гц, 2Н).
Ссылочный пример 3
2-Ацетилоксиметил-4-изопропил-1-(пиридин-4-ил)метил-1Н-имидазол (7а)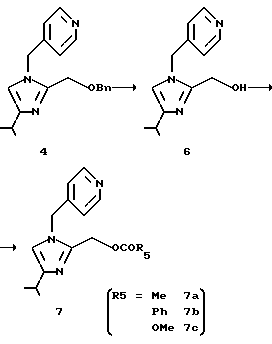
Соединение (4), 20,0 г (62,2 ммоль), суспендируют в 100 мл 35% водной хлористо-водородной кислоты. Раствор нагревают при 85oС и перемешивают в течение 1 ч. Реакционную смесь охлаждают до комнатной температуры и к ней добавляют 100 мл воды и 44 мл толуола. Водный слой отделяют, нейтрализуют водным 30% гидроксидом натрия и перемешивают после добавления 30 мл этилацетата. Полученную суспензию фильтруют, промывают холодной водой и сушат, получая 11,7 г 2-гидрокси-метил-4-изопропил-1-(пиридин-4-ил)-1H-имидазола (6). Выход 81,4%.
1H ЯМР (СDСl3) δ м.д.: 1,16 (д, J=7,0 Гц, 6Н), 2,68-2,89 (м, 1Н), 4,59 (с, 2Н), 5,23 (с, 2Н), 6,51 (с, 1Н), 7,03 (д, J=6,0 Гц, 2Н), 8,55 (д, J=6,0 Гц, 2Н).
К раствору 3,49 г (15 ммоль) вышеполученного гидроксисоединения (6), 35 мл дихлорметана и 1,83 г (18 ммоль) триэтиламина по каплям добавляют 1,32 г (17 ммоль) ацетилхлорида при охлаждении льдом, и смесь перемешивают в течение 1 ч при охлаждении льдом. К ней добавляют воду и слой дихлорметана отделяют, концентрируют и очищают колоночной хроматографией на силикагеле (элюирование смесью этилацетат: метанол = 10:1), получая 3,34 г целевого соединения (7а). Выход 81,1%.
1H ЯМР (СDСl3) δ м.д.: 1,26 (д, J=7,0 Гц, 6Н), 1,85 (с, 3Н), 2,88-3,05 (м, 1Н), 5,11 (с, 2Н), 5,15 (с, 2Н), 6,64 (с, 1Н), 6,95 (д, J=6,0 Гц, 2Н), 8,59 (д, J=6,0 Гц, 2Н).
В соответствии с тем же способом, описанным выше, дают реагировать 1,16 г (5 ммоль) вышеполученного гидроксисоединения (6), 12 мл дихлорметана, 0,86 г (8,5 ммоль) триэтиламина и 1,16 г (8,3 ммоль) бензоилхлорида, получая 1,65 г целевого соединения (7b). Выход 93,2% (элюирование: этилацетатом).
1H ЯМР (СDСl3) δ м.д.: 1,34 (д, J=7,0 Гц, 6Н), 2,90-3,10 (м, 1Н), 5,29 (с, 2Н), 5,45 (с, 2Н), 6,74 (с, 1Н), 6,99 (д, J=6,0 Гц, 2Н), 7,30-7,90 (м, 5Н), 8,55 (д, J=6,0 Гц, 2Н).
В соответствии с тем же способом, описанным выше, дают реагировать 1,16 г (5 ммоль) вышеполученного гидроксисоединения (6), 12 мл дихлорметана, 0,76 г (7,5 ммоль) триэтиламина и 0,70 г (7,4 ммоль) метилхлорформиата, получая 0,40 г целевого соединения (7с), метоксикарбонилоксипроизводного. Выход 27,6%.
1H ЯМР (CDCl3) δ м. д.: 1,25 (д, J=7,0 Гц, 6Н), 2,80-3,00 (м, 1Н), 3,70 (с, 3Н), 5,17 (с, 2Н), 5,18 (с, 2Н), 6,64 (с, 1Н), 6,97 (д, J=6,0 Гц, 2Н), 8,59 (д, J=6,0 Гц, 2Н).
Пример 3
2-Ацетилоксиметил-5-(3,5-дихлорфенилтио)-4-изопропил-1-(пиридин-4-ил)метил-1H-имидазол (8)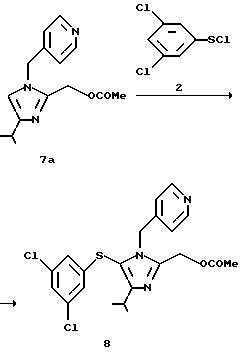
К 1,88 г раствора 0,97 г (4,5 ммоль) соединения (2) в толуоле по каплям в течение 30 минут добавляют 4 мл раствора 0,87 г (3,2 ммоль) соединения (7а) в ацетонитриле при охлаждении льдом. К раствору в течение 15 мин по каплям добавляют раствор 0,46 г (4,5 ммоль) триэтиламина и 0,5 мл ацетонитрила, и смесь перемешивают при охлаждении льдом в течение 2 ч. Реакционную смесь концентрируют при пониженном давлении и экстрагируют этилацетатом. Экстракт промывают водой, концентрируют при пониженном давлении и очищают колоночной хроматографией на силикагеле (элюирование этилацетатом), получая 1,17 г целевого продукта (8) в виде кристаллов. Выход 82%. Т. пл. 133...135oС.
1H ЯМР (CDCl3-TMC) δ м. д. : 1,31 (д, J=6,0 Гц, 6Н), 1,85 (с, 3Н), 3,18-3,30 (м, 1Н), 5,18 (с, 2Н), 5,19 (с, 2Н), 6,69 (д, J=2,0 Гц, 2Н), 6,78 (д, J=6,0 Гц, 2Н), 7,05 (д, J=2,0 Гц, 1Н), 8,45 (д, J=6,0 Гц, 2Н).
Ссылочный пример 4
2-Гидроксиметил-5-(3,5-дихлорфенилтио)-4-изопропил-1-(пиридин-4-ил)метил-1Н-имидазол (9)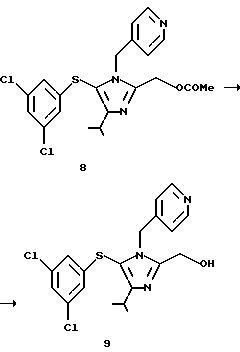
К 3,5 мл суспензии в этаноле 0,35 г (0,77 ммоль) соединения (8), полученного в примере 3, добавляют 0,82 мл 1 н. водного гидроксида натрия. Реакционную смесь перемешивают в течение 30 минут, концентрируют при пониженном давлении и экстрагируют этилацетатом. Экстракт промывают водой, и концентрируют при пониженном давлении, получая 0,31 г целевого продукта (9). Выход 96,9%.
Ссылочный пример 5
2-Карбамоилоксиметил-4-изопропил-1 -(пиридин-4-ил)метил-1H-имидазол (10)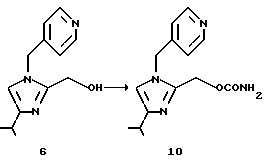
Гидроксисоединение (6), 15,0 г (64,9 ммоль), суспендируют в 150 мл ацетонитрила. К раствору по каплям добавляют 5,2 г (142,5 ммоль) безводной хлористо-водородной кислоты в 42 мл этилацетата при комнатной температуре. Смесь охлаждают до 0oС в атмосфере азота и к ней при охлаждении в течение 45 минут добавляют 22,0 г (155,4 ммоль) хлорсульфонилизоцианата. Реакционную смесь перемешивают при той же температуре в течение 1 ч и к ней добавляют 13,5 мл воды и 13,5 мл 35% водной хлористо-водородной кислоты. Смесь перемешивают при 45oС в течение 1 ч, охлаждают до комнатной температуры и нейтрализуют 20% водным карбонатом натрия. Смесь сохраняют неподвижной и разделяют. Органический слой промывают водой, и водный слой экстрагируют этилацетатом. Органический слой собирают, концентрируют и сушат. К остатку добавляют 80 мл диизопропилового простого эфира и раствор перемешивают при комнатной температуре в течение 1 ч. Полученную суспензию фильтруют, промывают диизопропиловым простым эфиром и сушат, получая 14,8 г (выход 83,2%) целевого соединения (10).
1H ЯМР (CDCl3-TMC) δ м.д.: 1,25 (д, J=7,0 Гц, 6Н), 2,80-3,00 (м, 1Н), 4,95 (шир. с, 2Н), 5,10 (с, 2Н), 5,20 (c, 2Н), 6,63 (с, 1Н), 6,97 (д, J=5,2 Гц, 2Н), 8,57 (д, J=5,0 Гц, 2Н).
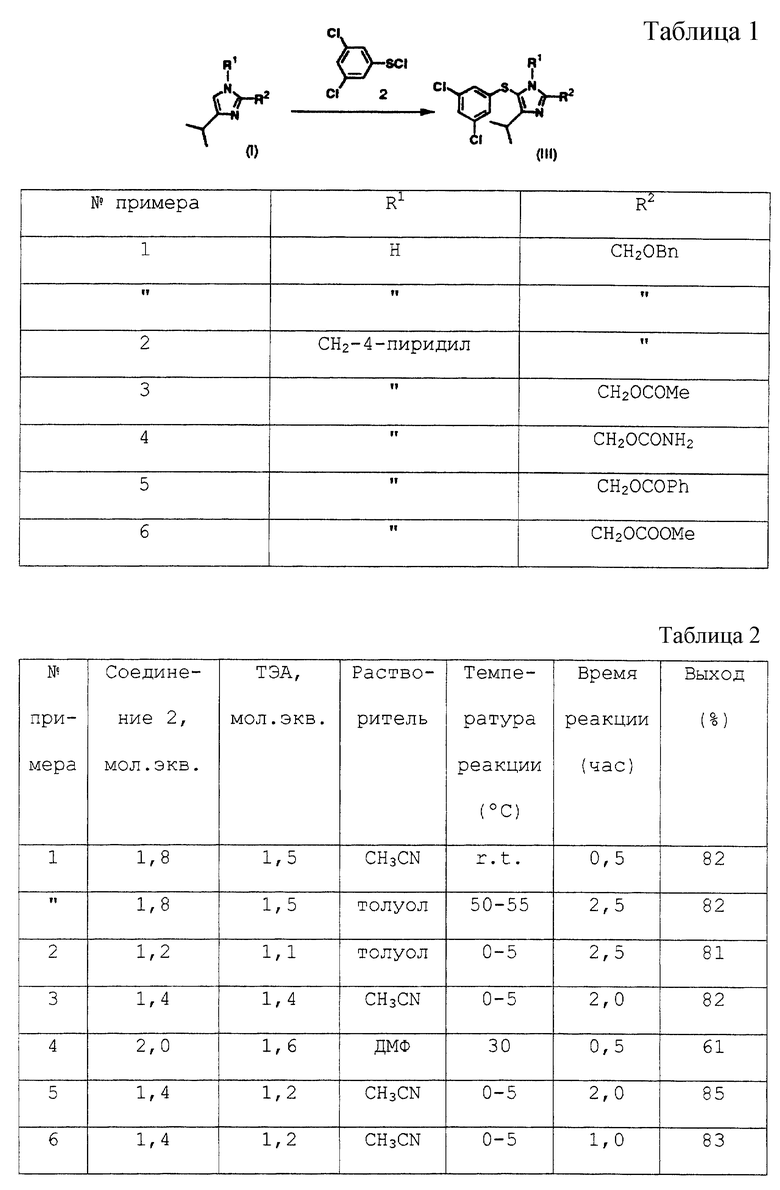
Пример 4
2-Карбамоилоксиметил-5-(3,5-дихлорфенилтио)-4-изопропил-1-(пиридин-4-ил)метил-1H-имидазол (11)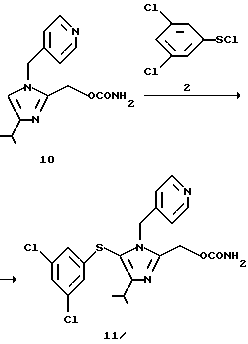
Соединение (10), 250 мг (0,91 ммоль), растворяют в 4 мл N,N-диметилформамида. Раствор охлаждают до -30oС в атмосфере азота. К раствору попеременно добавляют четыре раза 150 мг раствора 77 мг (0,36 ммоль) соединения (2) в толуоле и 150 мг раствора 36 мг (0,36 мг) триэтиламина в толуоле и дополнительно добавляют 150 мг раствора 77 мг (0,36 ммоль) соединения (2) в толуоле. Реакционную смесь перемешивают при -30oС в течение 30 минут и в нее добавляют этилацетат и водный гидрокарбонат натрия. Целевой продукт (11) экстрагируют этилацетатом. К экстракту добавляют разбавленную водную хлористо-водородную кислоту и целевой продукт снова растворяют в водном слое. Водный раствор нейтрализуют водным гидрокарбонатом натрия и экстрагируют этилацетатом. Экстракт сушат над безводным сульфатом натрия и концентрируют при пониженном давлении, получая масляный остаток. Масляный остаток растворяют в 0,9 мл метанола и к раствору в течение 1-2 минут при комнатной температуре добавляют 0,7 мл воды, получая осадок. Суспензию перемешивают в течение 30 минут при комнатной температуре, дополнительно перемешивают в течение 30 минут при охлаждении льдом, фильтруют, промывают 50% водным метанолом и сушат, получая 250 мг целевого соединения (11) в виде белых кристаллов. Выход 61%.
Т. пл. 88oС (разлож.).
1H ЯМР (CDCl3-TMC) δ м.д.: 1,32 (д, J=6,9 Гц, 6Н), 3,17 (отдельн, 1Н), 4,53 (б, 2Н), 5,21 (с, 2Н), 5,27 (с, 2Н), 6,69 (д, J=1,6 Гц, 2Н), 6,82 (д, J=5,2 Гц, 2Н), 7,06 (т, J=1,6 Гц, 1Н), 8,46 (б, 2Н).
Элементный анализ (C20H20Cl2N4O2S • 0,5 H2O)
Вычислено (%): С 52,16; Н 4,61; N 12,17; S 6,96; Cl 15,42.
Найдено (%): С 52,45; Н 4,72; N 11,73; S 7,08; Cl 14,81.
Соль соединения (11) с 2НСl: т. пл. 214...222oС (разложение).
Ссылочный пример 6
(I) 2,2-Дихлор-3-метилмасляный альдегид (13)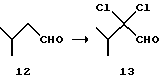
В смесь 192 г (2,23 моль) изовалерианового альдегида (12) и 230 мл N, N-диметилформамида вводят 316 г (4,46 моль) хлора при 60oС. Смесь охлаждают, смешивают с 384 мл воды и разделяют. Органический слой промывают 350 г водного гидрокарбоната натрия, и каждый слой экстрагируют 115 мл толуола. Органический слой собирают, получая 440 г раствора целевого соединения (13) в толуоле. (Выход 75%).
1H ЯМР (CDCl3-TMC) δ м.д.: 1,15 (д, J=6,6 Гц, 6Н), 2,56 (отдельн, J=6,6 Гц, 1Н), 9,24 (с, 1Н).
(II) 1,4-Дибензилокси-2-бутен (15)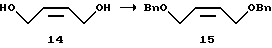
К 127,8 г 48% водного гидроксида натрия добавляют 3,3 г (10 ммоль) бромида тетра-н-бутиламмония, и смесь нагревают до 60oС. К этой смеси добавляют 30,0 г (340 ммоль) 2-бутен-1,4-диола (14), к ней затем добавляют по каплям при 80±15oС 94,8 г (743 ммоль) бензилхлорида. Смесь перемешивают при той же температуре в течение 2 ч. Реакционную смесь охлаждают и разделяют после добавления 90 мл воды. К органическому слою добавляют рассол, подкисленный серной кислотой. Раствор нейтрализуют водным гидрокарбонатом натрия, разделяют, смешивают с этилацетатом, и концентрируют при пониженном давлении, получая 104,5 г (количественный выход) масляного остатка, являющегося целевым продуктом (15).
1H ЯМР (CDCl3-TMC) δ м.д.: 4,05 (д, J=3,8 Гц, 2Н), 4,48 (с, 2Н), 5,78 (м, 2Н), 7,31 (м, 10Н).
Бензилоксиуксусный альдегид (16)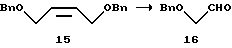
Полученный выше 1,4-дибензилокси-2-бутен (15), 104,5 г (340 ммоль), растворяют в 1458 мл метанола. Раствор охлаждают до -60oС в атмосфере азота. В него вводят озон при -60oС до тех пор, пока не исчезает исходный материал, и затем избыточное количество газообразного озона удаляют барботированием газообразного азота. К раствору по каплям при -60oС добавляют 550 мл раствора 107,2 г (409 ммоль) трифенилфосфина в этилацетате, чтобы восстановить промежуточный продукт реакции. Реакционную смесь нагревают до комнатной температуры и концентрируют при пониженном давлении, получая 321,6 г (количественный выход) масляной смеси фосфористого соединения и целевого продукта (16).
(III) 2-Бензилоксиметил-4-изопропил-1Н-имидазол (17)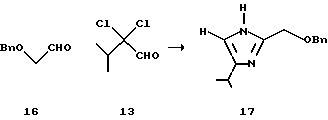
268 г (приблизительно 0,57 моль) масляного остатка, полученного в (II) бензилоксиуксусного альдегида, и 183 г (0,70 моль) экстракта, полученного в (I) 2,2-дихлор-3-метилмасляного альдегида (13) смешивают с 276 мл ацетонитрила. К смеси добавляют 25% водный аммиак. Смесь перемешивают при 45oС в течение 8 ч, экстрагируют 213 мл толуола и разделяют, получая 725 г экстракта (выход 70%) целевого продукта (17). Соединение (17) можно кристаллизовать с использованием гексана.
1H ЯМР (CDCl3-TMC) δ м.д.: 1,23 (д, J=6,8 Гц, 6Н), 2,88 (отдельн., J=6,8 Гц, 1Н), 4,51 (с, 2Н), 4,58 (с, 2Н), 6,65 (д, J=1,0 Гц, 1Н), 7,1-7,4 (м, 5Н).
(IV) Гидрохлорид 4-хлорметилпиридина (19)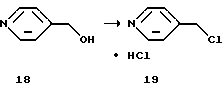
4-Гидроксиметилпиридин (18), 54,4 г (0,50 моль), растворяют в 202 мл ацетонитрила. Раствор добавляют по каплям при 50oС к смеси 65,3 г (0,55 моль) тионилхлорида и 109 мл ацетонитрила. Смесь перемешивают при той же температуре в течение 1 ч, затем охлаждают до комнатной температуры, получая суспензию (количественный выход) целевого продукта (19).
1H ЯМР (DMSO-TMC) δ м.д.: 5,09 (с, 2Н), 8,09 (д, J=6,6 Гц, 2Н), 8,94 (д, J=6,6 Гц, 2Н).
(V) Динитрат 2-бензилоксиметил-4-изопропил-1-(пиридин-4-ил)метил-1Н-имидазола (20)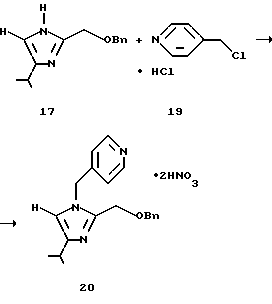
725 г (приблизительно 0,40 моль) экстракта, полученного в (III), 2-бензилоксиметил-4-изопропил-1Н-имидазола (17) нейтрализуют водной серной кислотой, смешивают с суспензией (приблизительно 0,50 моль) полученного в (IV) гидрохлорида 4-хлорметилпиридина (19) и воды и затем подщелачивают водным гидроксидом натрия. Смесь разделяют, водный слой экстрагируют 65 мл толуола и собирают органический слой. Органический слой концентрируют до 830 мл, смешивают с 62,6 г гидроксида натрия и перемешивают при 40oС в течение 5 ч. Реакционную смесь смешивают с 226 мл воды и разделяют. Водный слой экстрагируют 65 мл толуола и собирают органический слой. Органический слой смешивают с 348 г 20% водной серной кислоты и водный слой отделяют. Органический слой экстрагируют 65 мл воды и водный слой собирают. Водный слой смешивают с 282 г 20% водного гидроксида натрия и экстрагируют 130 мл этилацетата. Органический слой промывают солевым раствором и каждый водный слой экстрагируют 65 мл этилацетата. Органический слой собирают, концентрируют при пониженном давлении и сушат. Остаток смешивают с 523 мл этилацетата и 131 мл метанола, кристаллизуют добавлением 82,9 г (0,89 моль) концентрированной серной кислоты, фильтруют и сушат, получая 161,3 г целевого соединения (20) в виде, бледно-желтых кристаллов. Выход 90%.
Т.пл. 155oС (разложение).
Целевое соединение (20) в свободной форме можно кристаллизовать с использованием диизопропилового простого эфира.
1H ЯМР (CD3OD-TMC) δ м.д.: 1,34 (д, J=7,0 Гц, 6Н), 3,08 (отдельн., J=7,0 Гц, 1Н), 4,86 (с, 2Н), 4,89 (с, 2Н), 5,78 (с, 2Н), 7,16 (м, 2Н), 7,28 (м, 2Н), 7,49 (д, J=1,0 Гц, 1Н), 7,74 (д, J=6,8 Гц, 2Н), 8,67 (д, J=6,8 Гц, 2Н).
2-Бензилоксиметил-5-(3,5-дихлорфенилтио)-4-изопропил-1-(пиридин-4-ил)метил-1H-имидазол (5)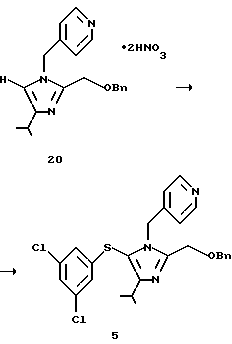
Динитрат 2-бензилоксиметил-4-изопропил-1-(пиридин-4-ил)-1H-имидазола (20), 13,9 г (31 ммоль), суспендируют в 50 мл толуола и 12 мл воды. Раствор нейтрализуют 30% водным гидроксидом натрия. Слой толуола промывают 40 мл воды, концентрируют и сушат. Остаток растворяют в 50 мл толуола. Раствор добавляют по каплям к 24,7 г раствора 7,9 г (37 ммоль) 3,5-дихлорбензолсульфенилхлорида (2) в толуоле. К смеси по каплям добавляют в течение 1 ч при охлаждении льдом 3,5 г (34 ммоль) триэтиламина. Смесь перемешивают при той же температуре в течение 2,5 ч и смешивают с 25 мл воды. Слой толуола отделяют и промывают 25 мл воды и водный слой снова экстрагируют 10 мл толуола. Слои толуола собирают и концентрируют при пониженном давлении. Остаток кристаллизуют с использованием диизопропилового простого эфира, фильтруют и сушат, получая 13,0 г целевого соединения (5) в виде бледно-желтых кристаллов. Выход 84%.
1H ЯМР (СDСl3) δ м.д.: 1,30 (д, J=7,2 Гц, 6Н), 3,08-3,22 (м, 1Н), 4,52 (с, 2Н), 4,62 (с, 2Н), 5,16 (с, 2Н), 6,65 (д, J=1,8 Гц, 2Н), 6,79 (д, J=6,0 Гц, 2Н), 7,03 (т, J=1,8 Гц, 1Н), 7,18-7,36 (м, 5Н), 8,38 (д, J=6,0 Гц, 2Н).
2-Гидроксиметил-5-(3,5-дихлорфенилтио)-4-изопропил-1 -(пиридин-4-ил)метил-1H-имидазол (9)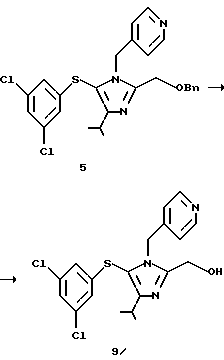
К соединению (5) добавляют 50 мл водной концентрированной хлористо-водородной кислоты. Смесь нагревают при 90oС в течение 2 ч и затем охлаждают. К смеси добавляют 50 мл воды и 20 мл толуола. Водный слой отделяют и нейтрализуют 30% водным гидроксидом натрия. Соединение (9) экстрагируют 50 мл этилацетата и слой этилацетата промывают 30 мл воды. Каждый водный слой экстрагируют 20 мл этилацетата. Слой этилацетата собирают и концентрируют при пониженном давлении, получая масляный остаток. К масляному остатку медленно добавляют 50 мл диизопропилового простого эфира. Полученную суспензию перемешивают при комнатной температуре в течение 30 минут, фильтруют, промывают 30 мл диизопропилового простого эфира и сушат, получая 10,4 г соединения (9) в виде белых кристаллов. Выход из соединения (20): 82%.
2-Карбамоилоксиметил-5-(3,5-дихлорфенилтио)-4-изопропил-1- (пиридин-4-ил)метил-1Н-имидазол (11)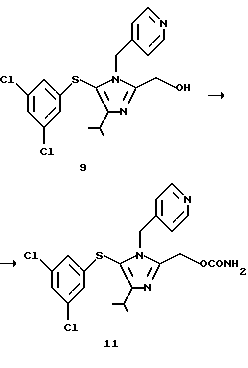
Гидроксисоединение (9), 2,00 г (4,9 ммоль), суспендируют в 20 мл этилацетата, и раствор охлаждают до -30oС в атмосфере азота. К раствору по каплям добавляют в течение 30 мин 1,66 г (11,4 ммоль) хлорсульфонилизоцианата в атмосфере азота при -30o, и смесь перемешивают при той же температуре в течение 1 ч. К смеси добавляла по каплям 2 мл воды и смесь нагревают до 0oС. К смеси добавляют 2 мл 35% водной хлористо-водородной кислоты и 4 мл метанола и раствор перемешивают при 40oС в течение 1 ч. Смесь охлаждают до комнатной температуры и нейтрализуют 20% водным карбонатом натрия. Органическую фазу отделяют, промывают водой, концентрируют и сушат. К остатку при комнатной температуре добавляют 6 мл метанола, после чего 6 мл воды. Полученную суспензию фильтруют, промывают 6 мл 50% водного метанола и сушат, получая 2,06 г (выход 93,2%) соединения (11).
1H ЯМР (СDСl3-ТМС) δ м.д.: 1,32 (д, J=6,9 Гц, 6Н), 3,17 (отдельн, 1Н), 4,53 (б, 2Н), 5,21 (с, 2Н), 5,27 (с, 2Н), 6,69 (д, J=1,6 Гц, 2Н), 6,82 (д, J=5,2 Гц, 2Н), 7,06 (т, J=1,6 Гц, 1Н), 8,46 (б, 2Н).
Элементный анализ (С20Н20Сl2N4O2S • 0,5Н2О)
Вычислено (%): С 52,16; Н 4,61; N 12,17; S 6,96; Cl 15,42.
Найдено (%): С 52,45; Н 4,72; N 11,73; S 7,08; Cl 14,81.
Соль соединения (11) с 2НСl: т.пл. 214...222oС (разложение).
Примеры 5-6
Соединения, описанные ниже, были получены тем же способом, как описано выше, для установления условий реакции.
В таблицах указаны полученные соединения (табл. 1) и условия их получения (табл. 2).
Данное изобретение предлагает способ получения производных имидазола (III), которые можно использовать в качестве антивирусного агента и агента против ВИЧ, который пригоден для удобного, экономически выгодного получения их в больших масштабах.
Изобретение относится к усовершенствованному способу получения соединения формулы III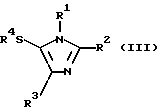
где R1 - водород или гетероарилалкил, R2 - группа, выбранная из СН2-О-аралкила, СН2ОСО-алкила, СН2ОСОNН2, СН2ОСОРh, СН2ОСOО-алкила; R3 - С3-алкил; R4 - дихлорфенил, включающему взаимодействие соединения формулы I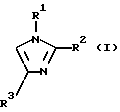
где R1, R2 и R3 такие, как определено выше, с соединением формулы II: R4-S-Hal, где R4 - такой, как определенно выше, и Hal представляет собой галоген, в присутствии основания. Предлагаемый способ прост, может быть использован при промышленном получении соединений формулы III, которые могут быть использованы в качестве антивирусного агента и агента против ВИЧ. 3 з. п. ф-лы, 2 табл.
где R1 представляет водород или гетероарилалкил;
R2 представляет группу, выбранную из СН2O-аралкила, CH2OCO-алкила, СН2ОСОNН2, СН2ОСОРh, СН2ОСOО-алкила;
R3 представляет С3-алкил;
R4 представляет дихлорфенил,
включающий взаимодействие соединения формулы I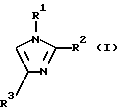
где R1, R2 и R3 имеют вышеуказанные значения,
с соединением формулы II
R4-S-Hal
где R4 имеет вышеуказанные значения;
и Hal представляет галоген,
в присутствии основания.
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
| Способ получения 5 (4)-тиопроизводных имидазола | 1972 |
|
SU437764A1 |
| СПОСОБ ПОГРУЗКИ КОРОТКОМЕРНЫХ ЛЕСОМАТЕРИАЛОВ | 0 |
|
SU293742A1 |
| СПОСОБ ПОЛУЧЕНИЯ М-ЗАМЕЩЕННБ1Х ИЛИ НЕЗАМЕЩЕННЫХ | 0 |
|
SU298196A1 |
| Устройство для сопряжения измерительного прибора с цифровой вычислительной машиной | 1975 |
|
SU552601A1 |
| ЕР 0786455 А1, 04.04.1996. | |||
Авторы
Даты
2002-09-10—Публикация
1997-12-19—Подача