Изобретение относится к новым уреидопроизводным нафталинфосфоновых кислот, способу их получения, содержащим их фармацевтическим композициям и их применению в медицине.
В международной заявке PCT/EP/00014 описаны уреидопроизводные поли-4-амино-2-карбокси-1-метилпирролов.
Теперь нами найдено, что новые производные нафталинфосфоновых кислот и узкий отобранный класс новых нафталинфосфоновых кислот, находящихся в пределах объема общей формулы PCT/EP 91/00014, но где они конкретно не описаны, обладают ценными биологическими свойствами.
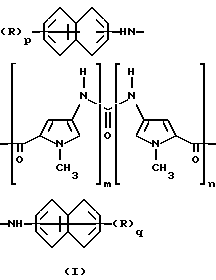
В соответствии с этим, предметом настоящего изобретения являются новые уреидопроизводные нафталинфосфоновых кислот, имеющие следующую формулу (I)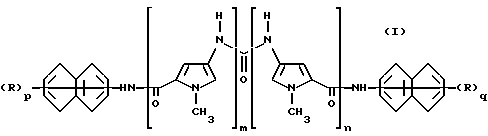
где каждый из m и n , которые имеют одинаковые значения, является целым числом от 1 до 4; каждый из p и q, которые имеют одинаковые значения, является целым числом от 1 до 3, каждая из групп R, которые имеют одинаковые значения, представляет собой свободную или этерифицированную группу фосфоновой кислоты, и фармацевтически приемлемые соли этих производных.
Свободные, превращенные в соли или этерифицированные фосфоногруппы [(HO)2PO-группы] могут быть у одного или обеих фенильных частей (ядер бензола) нафталиновой группы.
Замещенные нафтиловые группы предпочтительно являются 1-, 2-, 3- или 4-нафтиловыми группами, типично 3- или 4-нафтиловыми группами. Когда нафтиловые группы замещены тремя свободными, этерифицированными или превращенными в соль фосфоновыми кислотными группами, то эти фосфоновые кислотные заместители предпочтительно находятся в положениях 1, 5 и 7, 2, 5 и 6 или 2, 5 и 7. Когда они замещены двумя свободными, этерифицированными или превращенными в соль фосфоновыми кислотными группами, то эти заместители находятся предпочтительно в положениях 1 и 5, 1 и 6, 1 и 7 или 5 и 7. Когда они замещены одной свободной, этерифицированной или превращенной в соль фосфоновой кислотной группой, то этот заместитель предпочтительно находится в положении 1, 3, 5 или 6. Настоящее изобретение включает в свой объем все возможные изомеры, стереоизомеры и их смеси и метаболиты и метаболические предшественники или биопредшественники соединений формулы (I).
Как указано выше, настоящее изобретение включает в свой объем также эфиры и фармацевтически приемлемые соли кислот формулы (I).
Только одна или обе из двух кислотных функций (гидроксигрупп) каждой фосфоногруппы [(HO)2PO-группы] могут быть превращены в соль и/или этерифицированы.
В солях настоящего изобретения предпочтительно только одна из двух кислотных функций каждой фосфоногруппы находится в форме соли, тогда как в эфирах настоящего изобретения обе кислотные функции каждой фосфоногруппы предпочтительно находятся в этерифицированной форме.
Эфиры кислот формулы (I) являются, например, алкиловыми и арилалкиловыми эфирами, имеющими алкил с цепью нормального или разветвленного строения. Более предпочтительны C1-C6-алкиловые и фенил-C1-C6-алкиловые эфиры, обычно метиловые, этиловые, пропиловые, изопропиловые, бутиловые, бензиловые и фенилэтиловые эфиры.
Примерами фармацевтически приемлемых солей являются соли с неорганическими основаниями, например гидроксидами натрия, калия, кальция и алюминия, или органическими основаниями, например лизином, аргинином, N-метилглюкамином, триэтиламином, триэтаноламином, дибензиламином, метилбензиламином, ди-(2-этилгексил) амином, пиперидином, N-этилпиперидином, N,N-диэтиламиноэтиламином, N-этилморфолином, β- -фенетиламином, N-бензил -β- фенетиламином, N-бензил-N,N-диметиламином и другими приемлемыми органическими аминами. Предпочтительные натриевые и калиевые соли.
Как указано выше, настоящее изобретение включает в свой объем также фармацевтически приемлемые биопредшественники (по другому известные как пролекарственные производные) соединений формулы (I), т.е. соединения, которые имеют формулу, отличающуюся от указанной выше формулы (I), но которые, тем не менее, при введении человеку превращаются непосредственно или ненепосредственно in vivo в соединение формулы (I).
Предпочтительными соединениями формулы (I) являются те соединения, у которых каждый из m и n является числом 2; каждый из p и q является числом 2 и каждая из групп R, которые имеют одинаковые значения, является свободной или C1-C6-алкил- или фенил-C1-C6-алкилэтерифицированной фосфоновой кислотной группой, и их фармацевтически приемлемые соли.
Примерами предпочтительных соединений изобретения являются: карбонилбис-3-({4-[(4-aминoпиppoл-1-мeтил-2-карбонил)амино]-1- метилпиррол-2-карбонил} (амино)нафталин-1,5-дифосфоновая кислота;
карбонилбис-4-({ 4-[(4-aминoпиppoл-1-мeтил-2- кapбoнил)амино]-1-метилпиррол-2-карбонил}амино)нафталин-1,7- дифосфоновая кислота;
карбонилбис-3-({ 4-[(4-aминoпиppoл-1-мeтил-2-кapбoнил) амино]-1-метилпиррол-2-карбонил}амино)нафталин-1,6-дифосфоновая кислота;
карбонилбис-4-({ 4-[(4-aминoпиppoл-1-мeтил-2-кapбoнил) амино]-1-метилпиррол-2-карбонил}амино)нафталин-1,6-дифосфоновая кислота;
карбонилбис-3-({ 4-[(4-aминoпиppoл-1-мeтил-2-кapбoнил) амино]-1-метилпиррол-2-карбонил}амино)нафталин-5,7-дифосфоновая кислота;
карбонилбис-2-({ 4-[(4-aминoпиppoл-1-мeтил-2-кapбoнил) амино]-1-метилпиррол-2-карбонил}амино)нафталин-1,5-дифосфоновая кислота;
карбонилбис-1-({4-[(4-аминопиррол-1-метил-2-карбонил)амино]- 1-метилпиррол-2-карбонил}амино)нафталин-5,7-дифосфоновая кислота;
карбонилбис-4-({4-[(4-аминопиррол-1-метил-2-карбонил)амино]- 1-метилпиррол-2-карбонил}амино)нафталин-5,7-дифосфоновая кислота;
карбонилбис-1-({ 4-[(4-аминопиррол-1-метил-2- карбонил)амино]-1-метилпиррол-2-карбонил}амино)нафталин-5,6- дифосфоновая кислота;
карбонилбис-4-({4-[(4-аминопиррол-1-метил-2-карбонил)амино]- 1-метилпиррол-2-карбонил}амино)нафталин-5,6-дифосфоновая кислота;
карбонилбис-4-({4-[(4-аминопиррол-1-метил-2-карбонил)амино]- 1-метилпиррол-2-карбонил}амино)нафталин-2,5-дифосфоновая кислота;
карбонилбис-4-({ 4-[(4-aминoпиppoл-1-мeтил-2- кapбoнил)амино]-1-метилпиррол-2-карбонил}амино)нафталин-6,7- дифосфоновая кислота;
карбонилбис-4-({4-[(4-аминопиррол-1-метил-2-карбонил)амино]- 1-метилпиррол-2-карбонил}амино)нафталин-2,6-дифосфоновая кислота;
карбонилбис-4-({ 4-[(4-aминoпиppoл-1-мeтил-2- кapбoнил)амино] -1-метилпиррол-2-карбонил}амино)нафталин-2,7- дифосфоновая кислота;
карбонилбис-1-({ 4-[(4-аминопиррол-1-метил-2- карбонил)амино] -1-метилпиррол-2-карбонил}амино)нафталин-5- фосфоновая кислота;
карбонилбис-4-({ 4-[(4-аминопиррол-1-метил-2- карбонил)амино] -1-метилпиррол-2-карбонил}амино)нафталин-5- фосфоновая кислота;
карбонилбис-4-({ 4-[(4-аминопиррол-1-метил-2-карбонил) амино] -1-метилпиррол-2-карбонил}амино)нафталин-6-фосфоновая кислота;
карбонилбис-1-({ 4-[(4-aминoпиppoл-1-мeтил-2- кapбoнил)амино] -1-метилпиррол-2-карбонил}амино)нафталин-6- фосфоновая кислота;
карбонилбис-4-({ 4-[(4-aминoпиppoл-1-мeтил-2- кapбoнил)aминo] -1-метилпиррол-2-карбонил}амино)нафталин-2,5,6- трифосфоновая кислота;
карбонилбис-4-({ 4-[(4-аминопиррол-1-метил-2- карбонил)амино] -1-метилпиррол-2-карбонил}амино)нафталин-1,5,7- трифосфоновая кислота;
карбонилбис-3-({ 4-[(4-аминопиррол-1-метил-2- карбонил)амино] -1-метилпиррол-2-карбонил}амино)нaфтaлин- 1,5,7-тpифocфoнoвaя кислота;
карбонилбис-3-{ [4-[(4-аминопиррол-1-метил-2-карбонил) -амино]-1-метилпиррол-2-карбонил} амино)-1-метилпиррол-2- карбонил] амино)нафталин-1,5-дифосфоновая кислота;
карбонилбис-4-{[4-({4-[(4-аминопиррол-1-метил-2- карбонил)-амино]-1-метилпиррол-2-карбонил} амино -1-метилпиррол- 2-карбонил]амино}нафталин-1,7-дифосфоновая кислота;
карбонилбис-1-{ [4-({4-[(4-аминопиррол-1-метил-2- карбонил)-амино]-1-метилпиррол-2-карбонил} амино)-1-метилпиррол- 2-карбонил]амино}нафталин-5,7-дифосфоновая кислота;
карбонилбис-4-{ [4-({4-[(4-aминoпиppoл-1-мeтил-2-кapбoнил)- амино]-1-метилпиррол-2-карбонил} амино-1-метилпиррол-2- карбонил] амино}нафталин-5,7-дифосфоновая кислота;
карбонилбис-3-{[4-({4-[(4-аминопиррол-1-метил-2-карбонил)-амино]-1- метилпиррол-2-карбонил} амино)-1-метилпиррол-2- карбонил]амино}нафталин-1,5,7-трифосфоновая кислота; и их C1-C6-алкиловые и фенил-C1-C6-алкиловые эфиры и фармацевтически приемлемые соли.
Конкретно предпочтительными являются метиловые, этиловые и бензиловые эфиры и натриевые и калиевые соли приведенных в качестве примеров конкретных соединений настоящего изобретения.
Соединения формулы (I) и их фармацевтически приемлемые соли затем будут именоваться также как "соединения настоящего изобретения" или как "активные агенты настоящего изобретения".
Соединения изобретения и их соли можно получить способом, предусматривающим реакцию соединения формулы II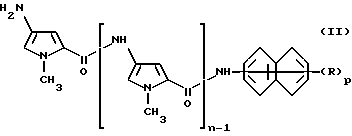
где n, p и R имеют указанные выше значения, или соли его с соединением формулы (III)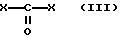
где каждая из групп X, которые имеют одинаковые или разные значения, является легко удаляемой группой, и последующее, если нужно, превращение соединения формулы (I) в другое соединение формулы (I) и/или, если нужно, превращение полученного таким образом соединения формулы (I) в соль, и/или, если нужно, получение свободной кислоты формулы (I) из ее эфира или соли, и/или, если нужно, этерификацию кислоты формулы (I).
Соль соединения формулы (II) может быть солью с органическими или неорганическими основаниями, например, указанными выше для фармацевтически приемлемых солей настоящего изобретения. Предпочтительны натриевые и калиевые соли.
Предпочтительными примерами легко удаляемых групп в соответствии со значением X являются атомы галогена, в частности хлора, или другие легко замещаемые группы, например имидазолил, триазолил, п-нитрофеноксигруппа или трихлорфеноксигруппа.
Реакция соединения формулы (II) или его соли с соединением формулы (III) является аналогом известной реакции, ее можно проводить в соответствии с хорошо известными методами, например, в соответствии с условиями, описанными в органической химии для этого рода реакций, т.е. для синтеза производных карбамида. Когда в соединении формулы (III) X представляет собой атом галогена, например хлора, реакцию предпочтительно проводят при молярном соотношении соединения формулы (II) или его соли и соединения формулы (III) от около 1:0,5 до около 1:4.
В соответствии с предпочтительным вариантом настоящего изобретения, когда соединение формулы (III) является фосгеном, в качестве источника фосгена в соответствии с известными методами можно применять трихлорметилкарбонат или трихлорметилхлорформиат.
Реакцию предпочтительно проводят в органическом растворителе, например хлористом метилене, дихлорэтане, хлороформе, толуоле или диметилсульфоксиде, гексаметилфосфотриамиде, диметилацетамиде или диметилформамиде, или их водных смесях, или в смесях вода/диоксан, вода/толуол или вода/хлористый метилен, в присутствии органического основания, например триэтиламина, диизопропилэтиламина или пиридина, или неорганического основания, например бикарбоната натрия или ацетата натрия, или обычного буфера, известного в настоящей области химии. Температура реакции может варьировать от около -10o до около 50o и время реакции может варьировать от около 1 до около 24 час.
Соединения формулы (I), полученные в соответствии с указанными выше способами, можно очищать обычными методиками, например хроматографией на колонках с силикагелем или оксидом алюминия и/или перекристаллизацией из органического растворителя, например низших алифатических спиртов или диметилформамиде или их смесей или содержащих воды смесей.
Аналогично этерификацию или превращение в соль кислоты формулы (I) можно проводить известными в органической химии методами.
Соединения формулы (II) и их соли представляют собой новые соединения и являются также объектом настоящего изобретения.
Соединения формулы (II) и их соли можно получить способом, аналогичным известным способам.
Например, соединение формулы (II) можно получить восстановлением соединения формулы (IV) или его соли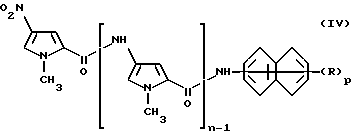
где n, p и R имеют указанные выше значения, методиками, известными в органической химии.
Соединения формулы (IV) можно получить реакцией амина формулы (V) или его соли.
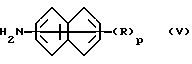
где R и p имеют указанные выше значения, с соединением формулы (VI)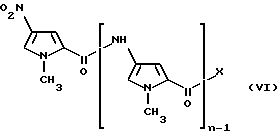
где n и X имеют указанные выше значения.
Реакция амина формулы (V) или его соли с соединением формулы (VI) является также хорошо известным способом получения.
Альтернативно, соединение формулы (IV), у которого является числом 2, 3 или 4, можно получить многостадийным способом, содержащим реакцию соединения формулы (VII)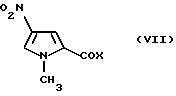
где X имеет указанные выше значения, с амином формулы (V) или его солью, как указано выше. В результате реакции, которую можно проводить в соответствии с известными методиками, получают соединение формулы (VIII) или его соль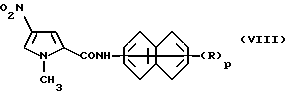
где R и p имеют указанные выше значения.
Соединение формулы (VIII) или его соль восстанавливают в соответствии с известными методиками, получая соединение формулы (IX) или его соль.
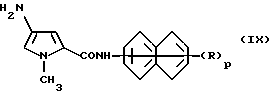
где p и R имеют указанные выше значения, которое, в свою очередь, реакцией с указанным выше соединением формулы (VII) превращают в указанное выше соединение формулы (IV), где n является числом 2. Если нужно получить соединение формулы (IV), у которого n является числом 3 или 4, требуются стадии дальнейшего восстановления и ацилирования.
Соединения формулы (VI) являются известными соединениями или их можно получить, например, методиками, указанными в Heterocycles, vol. 27, N 8, р. 1945-52 (1988).
Соединения формулы (VII) являются известными продуктами или их легко получить известными методиками.
Указанные выше амины формулы (V) и их соли представляют собой новые соединения и также являются объектом настоящего изобретения.
Амин формулы (V) или его соль можно получить восстановлением нитропроизводного формулы (X) или его соли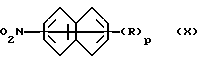
где R и p имеют указанные выше значения, в соответствии с известными методиками.
Нитропроизводное формулы (X) можно получить нитрованием пригодной свободной, этерифицированной или превращенной в соль моно-, ди- или трифосфоновой кислоты ряда нафталина. В свою очередь, эту свободную, этерифицированную или превращенную в соль кислоту можно получить реакцией производного нафталина, замещенного 1, 2 или 3 трифторметансульфонатными группами или атомами галогена, например брома или иода, соответственно, с ди-C1-C6-алкил-, диарил-, например дифенил-, или диарилалкил-, например дифенил-C1-C6-алкилфосфитом, в присутствии органического агента основного характера, например триэтиламина, диизопропиламина или пиридина, и подходящего каталитического агента, например тетракистрифенилфосфинпалладия(О), -платины (О) или -никеля (О), при температуре в пределах от около 0oC до около 150oC.
Производное нафталина, замещенное 1, 2, или 3 трифторметансульфонатными группами, можно получить реакцией моно-, ди- или тригидроксизамещенного производного нафталина, соответственно, с реакционноспособным производным трифторметансульфокислоты, например хлорангидридом или ангидридом, в присутствии органического агента основного характера, например пиридина или триэтиламина, в случае проведения реакции в органическом инертном растворителе, например хлористом метилене, диэтиловом эфире или толуоле.
Соли соединений формул (IV), (V), (VIII), (IX) или (X) могут быть солями с органическими или неорганическими основаниями, например основаниями, указанными выше для соединений формулы (I), причем предпочтительны натриевые и калиевые соли.
Фармакология
Новые нафталинфосфоновые кислоты формулы (I) и их фармацевтически приемлемые соли в соответствии с настоящим изобретением действуют непосредственно в качестве антилентивирусных средств, в частности, против вируса иммунодефицита человека (ВИЧ).
Найдено, что, например, характерные соединения изобретения, карбонилбис-3-({4-[(4-аминопиррол-1-метил- 2-карбонил)амино]-1-метилпиррол-2-карбонил} амино)-нафталин-1,5-дифосфоновая кислота и карбонилбис-4-({4-[(4-aминoпиppoл-1-мeтил- 2-кapбoнил)амино]-1-мeтилпиppoл-2-карбонил}амино)-нафталин-1,7- дифосфоновая кислота, активны в биологическом тесте, описанным в I. Natl. Cancer Inst., 81, 557-586 (1989).
Человека, страдающего от лентивирусной инфекции, таким образом можно лечить методом, предусматривающим введение ему эффективного количества одного из соединений настоящего изобретения. Таким образом, соединения изобретения можно применять для лечения инфекционного заболевания, вызываемого лентивирусами, в частности вирусом иммунодефицита человека, особенно ВИЧ-1 или ВИЧ-2.
Соединения настоящего изобретения можно также применять для получения лекарственного препарата, используемого при лечении человека, страдающего лентивирусным инфекционным заболеванием. Этот препарат можно применять в качестве антилентивирусного средства, например анти-ВИЧ-1- или анти-ВИЧ-2-средства. Этот препарат можно также применять для ослабления симптомов индуцированного лентивирусом заболеваний человека, страдающего лентивирусным инфекционным заболеванием.
В частности соединения настоящего изобретения можно применять для получения средства, которое используют при лечении человека, который имеет сероположительное заболевание, стресс или патологию в результате инфицирования лентивирусом, в частности ВИЧем, или который страдает таким индуцированным заболеванием, как, например, синдром лимфоденопатии (LS), заболевание, вызванное связанным со СПИД комплексом (ARC), СПИД или саркома Kaposi. Состояние пациента можно, таким образом, облегчить или улучшить.
В этих терапевтических применениях соединения изобретения можно вводить обычным способом, например парентерально, например внутривенной инъекцией или инфузией, внутримышечно, подкожно, местно или перорально, предпочтительно внутривенной инъекцией или инфузией. Дозировка зависит от возраста, массы тела и состояния пациента и способа введения соединения. Пригодная доза для соединений изобретения, например карбонилбис-3-({4-[(4- аминопиррол-1-метил-2-карбонил)амино] -1-метилпиррол-2-карбонил} амино)-нафталин-1,5-дифосфоновой кислоты или ее фармацевтически приемлемой соли, при введении взрослым людям составляет от около 0,5 до около 300 мг при введении 1-4 раза вдень.
Соединения изобретения можно применять в способе лечения указанных выше патологических состояний, предусматривающем как отдельное, так и фактическое совместное введение композиции, содержащей соединение формулы (I) или его фармацевтически приемлемую соль, и фармацевтической композиции, содержащей другие фармацевтически активные средства. Настоящее изобретение предлагает также продукты, содержащие соединение формулы (I) или его фармацевтически приемлемую соль и второе фармацевтически активное средство, в виде комбинированного препарата для раздельного, одновременного или последовательного применения при лечении человека, страдающего лентивирусным инфекционным заболеванием, в частности, вызванным ВИЧем. Второе активное средство обычно представляет собой лекарственное средство, которое влияет на патогенез ВИЧ-индуцированных болезней.
Соединения настоящего изобретения можно применять,например, с различными активными средствами, в частности с теми, которые воздействуют на обратную транскриптазу, антимикробными и противоопухолевыми средствами или смесями двух или более таких средств. Представляющие интерес лекарственные средства включают ненуклеозидные ингибиторы обратной транскриптазы, например невиралин; производные нуклеозидов, например зидовудин и диданозин; ацикловир; рибавирин; аскорбиновую кислоту; ингибиторы протеаз; цитокин, например 1L-1, 1L-2, 1L-3 или 1L-4; факторы роста; интерфероны, например альфа- или гамма-интерфероны; противоопухолевые средства, например доксорубицин, дауномицин, эпирубицин, 4'-иоддоксорубицин, метоксиморфолинодоксорубицин, идарубицин, этопозид, фторурацил, мелфалан, циклофосфамид, блеомицин, винбластин и митомицин; иммуномодулирующие средства, в частности иммуностимуляторы, гамма-глобулины, иммуноглобулины и моноклональные антитела, антибиотики и антимикробные продукты.
Типично антимикробные средства могут включать пенициллин в сочетании с аминогликозидом (например, гентамицином или тобрамицином).
Однако можно применять несколько хорошо известных дополнительных средств, например цефалоспорин.
Доза введения этих лекарственных средств будет изменяться в зависимости от состояния болезни пациента. Схема приема лекарственного средства должна, следовательно, подгоняться, в частности, к состоянию пациента, его восприимчивости и ассоциированным способам лечения, которые обычны для любой терапии, ее может быть следует корректировать в соответствии с изменениями в состоянии пациента и/или в свете других клинических условий.
Фармацевтическая композиция, применяемая в изобретении, может содержать соединение формулы (I) или его фармацевтически приемлемую соль в качестве активного вещества в сочетании с одним или несколькими фармацевтически приемлемыми наполнителями и/или носителями. Фармацевтические композиции обычно получают стандартными методиками, их вводят в фармацевтически приемлемой форме. Например, растворы для внутривенной инъекции или инфузии могут содержать в качестве носителя, например, стерильную воду или, что предпочтительно, они могут быть в форме стерильных водных изотонических солевых растворов. Суспензии или растворы для внутримышечных инъекций могут содержать вместе с активным соединением фармацевтически приемлемый носитель, например стерильную воду, оливковое масло, этилолеат, гликоли, например пропиленгликоль, и, при желании, пригодное количество гидрохлорида лидокаина.
В форме для местного применения, например кремах, лосьонах или пастах для применения при дерматологическом лечении, активный компонент можно смешать с обычными масляными или эмульгирующими наполнителями.
Твердые пероральные формы, например таблетки и капсулы, могут содержать вместе с активным соединением разбавители, например лактозу, декстрозу, сахарозу, целлюлозу, кукурузный крахмал и картофельный крахмал; смазывающие вещества, например диоксид кремния, тальк, стеариновую кислоту, стеарат магния или кальция и/или полиэтиленгликоли; связывающие агенты, например крахмалы, аравийскую камедь, желатин, метилцеллюлозу, карбоксиметилцеллюлозу, поливинилпирролидон; дезагрегирующие средства, например крахмал, альгиновую кислоту, альгинаты, натриевую соль гликолята крахмала, вспенивающие смеси; красители; подслащивающие вещества; смачивающие средства; например лецитин, полисорбаты, додецилсульфаты; и, в общем, нетоксичные и фармакологически неактивные вещества, применяемые в фармацевтических готовых препаративных формах. Эти фармацевтические препараты можно приготовлять известным образом, например при помощи способов смешивания, гранулирования, таблетирования, образования оболочки из сахара или пленки.
Приведенные ниже примеры иллюстрируют, но не ограничивают настоящее изобретение.
Пример 1
Октаэтиловый эфир карбонилбис-3-({ 4-[(4-аминопиррол-1- метил-2-карбонил)амино] -1-метилпиррол-2-карбонил} амино)- нафталин-1,5-дифосфоновой кислоты.
В охлажденный льдом раствор тетраэтил-3-[1-метил-2- пирролкарбоксамидо-4-(1-метил-4-амино-2-пирролкарбоксамидо)] нафталин-1,5-дифосфоната (4,23 г, 6,08 ммоля, в виде гидрохлорида) и триэтиламина (3,5 мл, 25 ммоля) в хлористом метилене (100 мл, не содержит этанол) добавляли по каплям при перемешивании раствор трихлорметилкарбоната (325 мг, 1,09 ммоля) в хлористом метилене (10 мл). После выдерживания в течение 3 час при комнатной температуре всю реакционную смесь промывали H2O, 1N HCl, раствором NaHCO3, сушили и выпаривали при пониженном давлении.
Неочищенный остаток очищали флаш-хроматографией на силикагеле 60 (CH2Cl2-CH3OH, 90:10).
Твердый остаток переносили в этилацетат, фильтровали и сушили, получая заглавное соединение (3,11 г, т. пл. 195-205oC) в виде твердого микрокристаллического бледно-коричневого вещества.
1H ЯМР-спектр (200 МГц, DMSO-d6):10,45, 9,88 (два синглета, 2H), 9,23 (д, 1H, I=1,1 Гц), 8,7-8,5 (м, 2H), 8,17 (с, 1H), 8,12 (ддд, 1H, I=1,1 Гц, I= 7,2 Гц, I= 15,8 Гц), 7,63 (ддд, 1H, I=3,7 Гц, I=7,2 Гц, 08,6 Гц), 7,35, 7,27 (два дублета, 2H, I=1,8 Гц), 7,03, 6,84 (два дублета, 2H, I=1,8 Гц), 4,2-3,9 (м, 8H), 3,84, 3,89 (два синглета, 6H), 1,3-1,1 (м, 12H).
Масс-спектр (-) FAB: (M-H)=1344.
Пример 2
Октаэтиловый эфир карбонилбис-4-({4-[(4-аминопиррол-1- метил-2-карбонил)амино]-1-метилпиррол-2-карбонил}амино)- нафталин-1,7-дифосфоновой кислоты.
Способом, описанным в примере 1, с применением 780 мг гидрохлорида тетраэтил-4-[1-метил-2-пирролкарбоксамидо-4-(1-метил- 4-амино-2-пирролкарбоксамидо)]-нафталин-1,7- дифосфоната в качестве исходного соединения получали заглавное соединение в виде оранжевого твердого вещества (270 мг, 36%).
1H ЯМР-спектр (200 МГц, DMSO-d6): 9.91, 10,30 (два синглета, 2H), 8,94 (д, 1H, I=15,8 Гц), 8,0-8,3 (м, 3H), 7,7-8,0 (м, 2H), 3,32, 7,37 (два дублета, 2H, I=11,8 Гц), 6,84, 7,03 (два дублета, 2H, I=1,8 Гц), 3,9-4,2 (м, 8H), 3,85, 3,84 (два синглета, 6H), 1,1- 1,3 (м, 12H).
Масс-спектр (-)FAB: (M-H)=1344.
Аналогичным образом можно получить этиловые эфиры следующих соединений:
карбонилбис-3-({ 4-[(4-аминопиррол-1-метил-2- карбонил)амино]-1-метилпиррол-2-карбонил}амино)нафталин-1,6- дифосфоновоп кислоты;
карбонилбис-4-({ 4-[(4-aминoпиppoл-1-мeтил-2- кapбoнил)амино] -1-метилпиррол-2-карбонил}амино)нафталин-1,6- дифосфоновой кислоты;
карбонилбис-3-({ 4-[(4-aминoпиppoл-1-мeтил-2- кapбoнил)амино] -1-метилпиррол-2-карбонил}амино)нафталин-5,7- дифосфоновой кислоты;
карбонилбис-2-({ 4-[(4-aминoпиppoл-1-мeтил-2-кapбoнил) амино] -1-метилпиррол-2-карбонил}амино)нафталин-1,5-дифосфоновой кислоты;
карбонилбис-1-({ 4-[(4-аминопиррол-1-метил-2- карбонил)амино] -1-метилпиррол-2-карбонил}амино)нафталин-5,7- дифосфоновой кислоты;
карбонилбис-4-({ 4-[(4-аминопиррол-1-метил-2- карбонил)амино] -1-метилпиррол-2-карбонил}амино)нафталин-5,7- дифосфоновой кислоты;
карбонилбис-1-({ 4-[(4-aминoпиppoл-1-мeтил-2- кapбoнил)амино] -1-метилпиррол-2-карбонил}амино)нафталин-5,6- дифосфоновой кислоты;
карбонилбис-4-({ 4-[(4-аминопиррол-1-метил-2-карбонил)амино] - 1-метилпиррол-2-карбонил}амино)нафталин-5,6-дифосфоновой кислоты;
карбонилбис-4-[{ 4-[(4-aминoпиppoл-1-мeтил-2- кapбoнил)амино] -1-метилпиррол-2-карбонил}амино)нафталин-2,5- дифосфоновой кислоты;
карбонилбис-4-({ 4-[(4-aминoпиppoл-1-мeтил-2- кapбoнил)амино] -1-метилпиррол-2-карбонил}амино)нафталин-6,7-дифосфоновой кислоты;
карбонилбис-4-({ 4-[(4-аминопиррол-1-метил-2- карбонил)амино] -1-метилпиррол-2-карбонил}амино)нафталин-2,6- дифосфоновой кислоты;
карбонилбис-4-({ 4-[(4-аминопиррол-1-метил-2-карбонил) амино] -1-метилпиррол-2-карбонил}амино)нафталин-2,7-дифосфоновой кислоты;
карбонилбис-1-({ 4-[(4-аминопиррол-1-метил-2- карбонил)амино] -1-метилпиррол-2-карбонил}амино)нафталин-5- фосфоновой кислоты;
карбонилбис-4-({ 4-[(4-аминопиррол-1-метил-2- карбонил)амино] -1-метилпиррол-2-карбонил}амино)нафталин-5- фосфоновой кислоты;
карбонилбис-4-({ 4-[(4-аминопиррол-1-метил-2- карбонил)амино] -1-метилпиррол-2-карбонил}амино)нафталин-6- фосфоновой кислоты;
карбонилбис-1-({ 4-[(4-аминопиррол-1-метил-2- карбонил)амино] -1-метилпиррол-2-карбонил}амино)нафталин-6- форсфоновой кислоты;
карбонилбис-4-({ 4-[(4-аминопиррол-1-метил-2- карбонил)амино] -1-метилпиррол-2-карбонил}амино)нафталин-2,5,6- трифосфоновой кислоты;
карбонилбис-4-({ 4-[(4-аминопиррол-1-метил-2- карбонил)амино] -1-метилпиррол-2-карбонил}амино)нафталин-1,5,7- трифосфоновой кислоты и
карбонилбис-3-({ 4-[(4-aминoпиppoл-1-мeтил-2- кapбoнил)амино] -1-метилпиррол-2-карбонил}амино)нафталин-1,5,7-трифосфоновой кислоты.
Пример 3
Карбонилбис-3-({ 4-[(4-аминопиррол-1-метил-2- карбонил)амино] -1-метилпиррол-2-карбонил} амино)нафталин-1,5- дифосфоновая кислота и ее тетранатриевая соль
В охлажденный льдом раствор октаэтилового эфира примера 1 (1,00 г, 0,74 ммоля) в сухом CH3CN (100 мл) по каплям при перемешивании добавляли раствор бромтриметилсилана (10 мл) в CH3CN (10 мл). После выдерживания 24 часа при комнатной температуре при пониженном давлении выпаривали органические летучие компоненты. Остаток переносили в ацетон и добавляли воду (500 мг), разбавленную (CH3)2CO (10 мл). После перемешивания в течение 4 час образованную микрокристаллическую часть отделяли фильтрованием, промывали ацетоном, метанолом, простым эфиром и сушили в вакууме, получая заглавное соединение (779 мг).
Элементный анализ:
C45H44N10O17P4
Рассчит., %: C 48,22, H 3,96, N 12,50, O 24,27, P 11,05
Найдено, %: C 44,46, H 4,26, N 11,18, P 9,48
1H ЯМР-спектр (200 МГц, DMSO-d6, T=50oC): δ 9,74, 10,23 (два синглета, 2H), 9,07 (с, 1H), 8,72 (д, 1H, I=8,5 Гц), 8,47 (дд, 1H, I= 1,9 Гц, I=16,9 Гц), 8,05 (дд, 1H, I=7,1 Гц, I=15,6 Гц), 8,01 (с, 1H), 7,48 (ддд, 1H, I=3,2 Гц, I= 7,l Гц, I=8,5 Гц), 6,83, 7,00, 7,25, 7,31 (четыре дублета, 4H, I=1,8 Гц), 3,85, 3,89 (два синглета, 6H).
Полученную таким образом кислоту (650 мг, 0,58 ммоля) растворяли в воде (50 мл) и нейтрализовали NaHCO3 (195 мг, 2,32 ммоля) до pH 6,5-7.
Раствор фильтровали, концентрировали при пониженном давлении до небольшого объема и сушили вымораживанием, получая микрокристаллическую бледно-коричневую соль.
Элементный анализ;
C45H40N10Na4O17P4 (1208,70), найденный (рассчитанный): N 9,88 (11,59)%; потери при сушке (100oC) 12,75%.
1H ЯМР-спектр (200 МГц, D2O + NaOD): δ 8,76 (м, 2H), 8,02 (м,2H), 7,47 (м, 1H), 6,61, 6,84, 6,99, 7,22 (четыре дублета, 4H, I=1,9 Гц), 3,76, 3,84 (два синглета, 6H).
Пример 4
Карбонилбис-4-({ 4-[(4-аминопиррол-1-метил-2-карбонил) амино] -1-метилпиррол-2-карбонил} амино) нафталин-1,7-дифосфоновая кислота и ее тетранатриевая соль
Способом, описанным в примере 3, с применением 197 мг октаэтилового эфира карбонилбис-4-({ 4-[(4-аминопиррол-1-метил-2- карбонил)амино] -1-метилпиррол-2-карбонил} амино)-нафталин-1,7- дифосфоновой кислоты в качестве исходного соединения получали заглавное соединение в виде оранжевого твердого вещества (160 мг, 98%).
1H ЯМР-спектр (200 МГц, DMSO-d6, T = 50oC): δ 9,78, 10,05 (Два синглета, 2H), 9,13 (д, 1H, I = 15,6 Гц), 8,0-8,2 (м, 3H), 7,6-7,9 (м, 2H), 6,85, 7,01, 7,29, 7,33 (четыре дублета, 4H, I=1,8 Гц), 3,85, 3,86 (два синглета, 6H).
Нейтрализацией кислоты NaHCO3 получали заглавную тетранатриевую соль в виде бледно-коричневого твердого вещества (163 мг, 98%).
1H ЯМР-спектр (200 МГц, D2O + NaOD, T=50oC): δ 9,04 (д, 1H, I= 14 Гц), 8,03 (дд, 1H, I= 7,4 Гц, I= 13,7 Гц), 7,7-8,0 (м, 2H), 7,34 (дд, 1H, I= 2,3 Гц, I= 7,4 Гц), 6,78, 6,99 (два синглета, 2H),3,80, 3,85 (два синглета, 6H).
Элементный анализ:
C45H40N10Na4O17P4 рассчит., %; C 44,72, H 3,33, N 11,59
найдено, %: C 34,33, H 3,50, N 8,58
Аналогичным образом можно получить следующие соединения в виде их свободных кислот и натриевых солей:
карбонилбис-3-({ 4-[(4-аминопиррол-1-метил-2-карбонил) амино] -1-метилпиррол-2-карбонил}амино)нафталин-1,6-дифосфоновую кислоту;
карбонилбис-4-({ 4-[(4-аминопиррол-1-метил-2- карбонил)амино] -1-метилпиррол-2-карбонил}амино)нафталин-1,6- дифосфоновую кислоту;
карбонил-3-({ 4-[(4-aминoпиppoл-1-мeтил-2-кapбoнил)aминo] -1- метилпиррол-2-карбонил}амино)нафталин-5,7-дифосфоновую кислоту;
карбонилбис-2-({ 4-[(4-aминoпиppoл-1-мeтил-2-кapбoнил)aминo] - 1-метилпиррол-2-карбонил}амино)нафталин-1,5-дифосфоновую кислоту;
карбонилбис-1-({ 4-[(4-аминопиррол-1-метил-2- карбонил)амино] -1-метилпиррол-2-карбонил}амино)нафталин-5,7- дифосфоновую кислоту;
карбонилбис-4-({ 4-[(4-аминопиррол-1-метил-2-карбонил) амино] -1-метилпиррол-2-карбонил}амино)нафталин-5,7-дифосфоновую кислоту;
карбонилбис-1- ({ 4-[(4-aминoпиppoл-1-мeтил-2-кapбoнил) амино]-1-метилпиррол-2-карбонил}амино)нафталин-5,6- дифосфоновую кислоту;
карбонилбис-4-({ 4-[(4-aминoпиppoл-1-мeтил-2-кapбoнил) амино] -1-метилпиррол-2-карбонил}амино)нафталин-5,6-дифосфоновую кислоту;
карбонилбис-4-({ 4-[(4-aминoпиppoл-1-мeтил-2- кapбoнил)амино] -1-метилпиррол-2-карбонил}амино)нафталин-2,5- дифосфоновую кислоту;
карбонилбис-4-({ 4-[(4-aминoпиppoл-1-мeтил-2- кapбoнил)амино] -1-метилпиррол-2-карбонил} амино] -1-метилпиррол-2- карбонил амино)нафталин-6,7-дифосфоновую кислоту;
карбонилбис-4- ({4-[(4-aминoпиppoл-1-мeтил-2-кapбoнил)амино]-1-метилпиррол-2- карбонил}амино)нафталин-2,6-дифосфоновую кислоту;
карбонилбис-4- ({ 4-[(4-aминoпиppoл-1-мeтил-2-кapбoнил) амино]-1-метилпиррол-2-карбонил}амино)нафталин-2,7-дифосфоновую кислоту;
карбонилбис-1-({ 4-[(4-aминoпиppoл-1-мeтил-2-кapбoнил) амино] -1-метилпиррол-2-карбонил}амино)нафталин-5-фосфоновую кислоту;
карбонилбис-4-({ 4-[(4-аминопиррол-1-метил-2- карбонил)амино] -1-метилпиррол-2-карбонил}амино)нафталин-5- фосфоновую кислоту;
карбонилбис-4-({ 4-[(4-аминопиррол-1-метил- 2-карбонил)амино] -1-метилпиррол-2-карбонил}амино)нафталин-6- фосфоновую кислоту;
карбонилбис-1-({ 4-[(4-аминопиррол-1-метил-2-карбонил) амино] -1-метилпиррол-2-карбонил}амино)нафталин-6-фосфоновую кислоту;
карбонилбис-4-({ 4-[(4-аминопиррол-1-метил-2-карбонил) амино] -1-метилпиррол-2-карбонилу}амино)нафталин-2,5,6- трифосфоновую кислоту;
карбонилбис-4-({ 4-[(4-aминoпиppoл-1-мeтил-2- кapбoнил)амино] -1-метилпиррол-2-карбонил}амино)нафталин-1,5,7- трифосфоновую кислоту и
карбонилбис-3- ({ 4-[(4-aминoпиppoл-1-мeтил-2-кapбoнил) амино]-1-метилпиррол-2-карбонил}амино)нафталин- 1,5,7-трифосфоновую кислоту.
Пример 5
Гидрохлорид тетраэтил-3-[1-метил-2-пирролкарбоксамидо-4-(1- метил-4-амино-2-пирролкарбоксамидо)]нафталин-1,5-дифосфоната
Teтpaэтил-3-[1-мeтил-2-пиppoлкapбoкcaмидo-4-(1-метил-4- нитро-2-пирролкарбоксамидо)] нафталин-1,5-дифосфонат (4,50 г, 6,52 ммоля), растворенный в метаноле (350 мл) и водной 1N HCl (7,0 мл), гидрировали с применением 5% Pd/C (500 мг) в аппарате Парра до прекращения поглощения H2. После отделения катализатора метанол выпаривали при пониженном давлении. Остаток переносили в диэтиловый эфир, отделяли микрокристаллический твердый продукт фильтровали, промывали и сушили при 60oC при пониженном давлении, получая заглавное соединение (4,43 г, 96%) в виде гидрохлорида.
Элементный анализ:
C30H40ClN5O8P2 найдено (рассчитано), %: C 49,93 (51,76), H 5,93 (5,79), Cl 5,00 (5,09), N 9,61 (10,06)
Масс-спектр (-) FAB: (M-H) = 658.
1H ЯМР-спектр (400 Мгц): δ 10,13, 10,46 (два синглета, 2H), 9,85 (ш, с., 3H), 9,23 (с, 1H), 8,60 (д, lH, I= 8,5 Гц), 8,56 (дд, 1H, I = 2,0 Гц, I= 17,3 Гц) 8,12 (дд, 1H, I = 7,3 Гц, I = 17.0 Гц), 7,64 (ддд, 1H, I = 3,5 Гц, I= 7,3 Гц, I= 8,5 Гц), 7,26, 7,36 (два дублета, 2H, I= 1,8 Гц), 7,00, 7,10 (два дублета, 2H, 7 = 2,0 Гц), 4,00-4,2 (м, 8H), 3,89 (с, 6H), 1,2-1,3 (м, 12 Н).
Пример 6
Гидрохлорид тетраэтил-4-[1-метил-2-пирролкарбоксамидо-4- (1-метил-4-амино-2-пирролкарбоксамидо)]нафталин-1,7- дифосфоната
Способом, описанным в примере 5, с применением 1,0 г тетраэтил-4-[1-метил-2-пирролкарбоксамидо-4-(1-метил-4-нитро-2- пирролкарбоксамидо)]нафталин-1,7-дифосфоната в качестве исходного соединения получали заглавный продукт в виде коричневого твердого вещества (0,95 г, 94%).
1H ЯМР-спектр (80 МГц, DMSO-d6): δ 10,3 (с, 1H), 10,15 (с, 1H), 10,1 (ш. , 3H), 8,95 (д, 1H), 7,65-8,4 (м, 4H), 7,3- 7,4 (м, 2H), 7,0-7,15 (м, 2H), 3,9-4,3 (м, 8H), 3,9 (с, 3H), 3,85 (с, 3H), 1,1-1,4 (м, 12H).
Пример 7
Тетраэтил-3-[1-метил-2-пирролкарбоксамидо-4-(1-метил-4- нитро-2-пирролкарбоксамидо)]нафталин-1,5-дмфосфонат
В смесь тетраэтил-3-(1-метил-4-амино-2- пирролкарбоксамидо)нафталин-1,5-дифосфоната (7,3 моля) в виде гидрохлорида и триэтиламина (3,5 мл, 25 ммоля) в CH2Cl2 (100 мл, не содержит этанол) при охлаждении ледяной баней добавляли по каплям хлорангидрид 1-метил-4-нитро-2-пирролкарбоновой кислоты (1,41 г, 7,5 ммоля) в 15 мл CH2Cl2. После выдерживания смеси 1 час во льду и 1 час при комнатной температуре органическую фазу промывали кислотой и раствором (NaHCO3) сушили (Na2O4) и выпаривали при пониженном давлении. Неочищенный остаток, снова растворенный в этаноле (20 мл), обрабатывали для индуцирования образования кристаллов. Кристаллизацию завершали добавлением диэтилового эфира (20 мл), и образованный твердый кристаллический желтый продукт отделяли фильтрованием, промывали смесью этанола и диэтилового эфира (1: 1) и супили при 50oC при пониженном давлении, получая заглавное соединение (4,50 г, т. пл. 163 - 168oC, выход 89%).
Элементный анализ:
C30H37N5O10P2 Найдено (рассчитано), O: П 9,85 (10,16)
Масс-спектр (-) FAB: (M-H) = 688.
1H ЯМР-спектр (400 МГц, DMSO-d6) δ 10,34, 10,49 (два синглета, 2H), 9,23 (с, 1H), 8,61 (d, 1H, I= 8,4 Гц), 8,57 (дд, 1H, I = 2,0 Гц, I= 17,6 Гц), 8.12 (дд, 1H, I= 7,0 Гц, I= 16,1 Гц), 7,63 (ддд, 1H, I= 4,2 Гц, I= 7,0 Гц, I= 8,4 Гц), 7,60, 8,19 (два дублета, 2H, I = 1,8 Гц), 7,26, 7,37 (два дублета, 2H, I= 1,8 Гц), 4,0-4,2 (м, 8H), 3,90, 3,96 (два синглета, 6H), 1,1-1,3 (м, 12H).
Пример 8
Тетраэтил-4-[1-метил-2-пирролкарбоксамидо-4-(1-метил-4- нитро-2-пирролкарбоксамидо)]нафталин-1,7-дифосфонат
Способом, описанным в примере 7, с применением 1,84 г гидрохлорида тетраэтил-4-(1-метил-4-амино-2- пирролкарбоксамидо)нафталин-1,7-дифосфоната в качестве соединения получали 1,89 г заглавного соединения (выход 85%).
1H ЯМР-спектр (200 МГц, DMSO-d6): δ 10,34, 10,37 (два синглета, 2H), 8,94 (д, 1H, I = 16,0 Гц), 8,1-8,3 (м, 2H), 7,7-7,9 (м, 2H), 7,62, 8,20 (два дублета, 2H, I=2,1 Гц), 7,32, 7,40 (два дублета, 2H, I=1,9 Гц), 3,9-4,2 (м, 8H), 3,86, 3,97 (два синглета, 6H), 1,1-1,3 (м, 12H).
Масс-спектр (-)FAB (M-H) = 688
Пример 9
Тетраэтил-3-(1-метил-4-амино-2-пирролкарбоксамидо)нафталин- 1,5-дифосфонат
Тетраэтил-3-(1-метил-4-нитро-2-пирролкарбоксамидо)-нафталин- 1,5-дифосфонат (4,15 г, 7,31 ммоля), растворенный в метаноле (150 мл) и 1 N HCl (7,5 мл) гидрировали в присутствии 5% Pd/C в аппарате Парра до прекращения поглощения водорода. После отделения катализатора фильтрованием с применением ускорителя фильтрованием метанол выпаривали при пониженном давлении и остаток сушили в вакууме и направляли на ацилирование без дальнейшей очистки.
1H ЯМР-спектр (80 Мгц, CDCl3): δ 9,6 (с, 1H), 9,05 (м, 1H), 8,67 (дд, 1H, I= 1,9 Гц,I= 17,6 Гц), 8,67 (д, 1H, I= 8,6 Гц), 8,12 (дд, 1H, I= 6,5 Гц, I= 15,9 Гц), 7,75 (с, 1H), (м, 1H), 6,87 (с, 1H), 3,9- 4.4 (м, 8H), 3,75 (с, 3H), 1,0-1,4 (м, 12 Н).
Пример 10
Гидрохлорид тетраэтил-4-(1-метил-4-амино-2- пирролкарбоксамидо)нафталин-1,7-дифосфоната
Способом, описанным в примере 9, с применением 1,89 г тетраэтил-4-(1-метил-4-нитро-пирролкарбоксамидо)нафталин- 1,7-дифосфоната в качестве исходного соединения получали 1,84 г заглавного соединения в виде коричневого твердого вещества (выход 96%).
1H ЯМР-спектр (80 МГц, DMSO-d6): δ 10,45 (с, 1H), 10,2 (ш., 3H), 8,95 (д, 1H), 7,65 - 8,4 (м, 4H), 7,2-7,35 (м, 2H), 3,8-4,4 (м, 11H), 1.1-1,4 (м, 12H).
Пример 11
Тетраэтил-3-(1-метил-4-нитро-2-пирролкарбоксамидо)нафталин- 1,5-дифосфонат
В охлажденный льдом раствор полугидрата гидрохлорида тетраэтил-3-аминонафталин-1,5-дифосфоната (3,75 мг, 8,14 ммоля) и триэтиламина (3,75 мл, 27 ммоля) в CH2Cl2 (60 мл, не содержит этанол) добавляли по каплям хлорангидрид 1-метил-4-нитро-2- пирролкарбоновой кислоты (1,89 г, 10 ммоля) в 15 мл CH2Cl2.
После выдерживания 4 часа при комнатной температуре органическую фазу промывали водой, 1 N HCl, 5%-ным раствором NaHCO3, сушили (Na2O4) и выпаривали при пониженном давлении до небольшого объема и затем очищали флаш-хроматографией на силикагеле 60 (CH2Cl2-CH3OH, 95:5). Твердый остаток переносили в диэтиловый эфир, фильтровали и сушили, получая заглавное соединение (4,17 г, т. пл. 250,5-252,5oС, выход 90%).
Элементный анализ:
C24H31N3O9P2, найдено (рассчитано), %: C 50,87 (50,79), H 5,53 (5,51), N 7,35 (7,40).
1H ЯМР-спектр (80 МГц, CDCl3): δ 9,77 (с, 1H), 9,23 (д, 1H, I=2,2 Гц), 8,65 (дд, 1H, I=1,4 Гц, I= 8,4 Гц), 8,55 (дд, 1H, I= 2,2 Гц, I= 17,4 Гц), 8,13 (ддд, 1H, I= 1,4 Гц, I= 7,3 Гц, I= 16,0 Гц), 7,3-7,7 (м, 3H), 3,9- 4,5 (м, 8H), 3,87 (с, 3H), 1,1-1,6 (м, 12H).
Масс-спектр E1 (М)+ = 567.
Пример 12
Тетраэтил-4- (1-метил-4-нитро-2-пирролкарбоксамидо) нафталин- 1,7-дифосфонат
Способом, описанным в примере 11, с применением 2,0 г гидрохлорида тетраэтил-4-аминонафталин-1,7-дифосфоната в качестве исходного соединения получали 2,63 г неочищенного заглавного соединения, которое перекристаллизовали из бензола для выделения 1,90 г микрокристаллического белого твердого продукта (т. пл. 204- 205oC, 76%).
1H ЯМР-спектр (200 МГц, CDCl3): δ 9,89 (с, 1H), 8,85 (дд, 1H, I=1,5 Гц, I= 15,9 Гц), 7,9-8,1 (м, 2H), 7,79 (дд, 1H, I = 3,4 Гц,I=7,9 Гц), 7,67, 8,05 (два дублета, 2H, I= 1,8 Гц), 7,52 (ддд, 1H, I=1,5 Гц, I= 8,7 Гц, I=11,6 Гц), 4,0-4,3 (м, 8H), 4,04 (с, 3H), 1,2-1,4 (м, 12H).
Масс-спектр E1 (М)+ = 567.
Пример 13
Тетраэтил-3-аминонафталин-1,5-дифосфонат
Тетраэтил-3-нитронафталин-1,5-дифосфонат (4,00 г, 9,0 ммоля), растворенный в метаноле (150 мл) и 1 N водном растворе HCl (10 мл), перемешивали с H2 в присутствии 5% Pd/C в аппарате Парра до прекращения поглощения H2. После отделения катализатора фильтрованием с применением ускорителя фильтрования метанол выпаривали при пониженном давлении. Остаток перемешивали с этанолом (10 мл) и диэтиловым эфиром (50 мл) и образованный кристаллический твердый продукт отделяли фильтрованием, промывали и сушили, получая заглавный продукт, выделенный в виде полугидрата гидрохлорида (3,78 г, разлагается при 230-240oC, выход 91%).
Элементный анализ:
C18H28ClN6 P2 • H2O, найдено (рассчитано), %: C 46,99 (46,91), H 6,32 (6,34), N 3,02 (3,04).
1H ЯМР-спектр (80 МГц, CDCl3): δ 8,3 (ш, с, 3H), 9,03 (д, 1H, I= 2,1 Гц), 8,77 (д, 1H, I= 8,5 Гц), 8,50 (дд, 1H, I= 2,1 Гц, I= 16,6 Гц), 8,26 (ддд, 1H, I= 1,3 Гц, I= 7,2 Гц, I = 15,6 Гц), 7,65 (ддд, 1H, I=3,9 Гц, I = 7,2 Гц, I=8,5 Гц), 3,9-4,5 (м, 8H), 1,3-1,5 (м, 12H).
Пример 14
Гидрохлорид тетраэтил-4-аминонафталин-1,7-дифосфоната
Способом, описанным в примере 13, с применением 2,7 г тетраэтил-4-нитронафталин-1,7-дифосфоната получали 2,6 г заглавного продукта в виде бледно-желтого твердого вещества (выход 94%).
1H ЯМР-спектр (80 МГц, CDCl3 + D2O): δ 8,9 ( с, 1H), 8,1 (дд, 1H), 7,65-7,95 (м, 2H), 6,85 (дд, 1H), 3,9-4,4 (м, 8H), 1,2-1,5 (м, 12H).
Пример 15
Тетраэтил-3-нитронафталин-1,5-дифосфонат
Тетраэтилнафталин-1,5-дифосфонат (10,21 г, 25,5 ммоля) растворяли по частям в охлажденной льдом 96%-ной H2SO4 и по каплям в раствор добавляли сульфонитрующую смесь (2,5 мл, 90%-ной HNO3 в 7,5 мл 96%-ной H2SO4) в течение 15 мин.
После выдерживания при охлаждении льдом реакционную смесь выливали в смесь льда и воды и смесь экстрагировали этилацетатом. Органический экстракт промывали водой, раствором NaHCO3 сушили, концентрировали при пониженном давлении до 20 мл и разбавляли 30 мл циклогексана. После охлаждения льдом образованный кристаллический твердый продукт отделяли фильтрованием, промывали и сушили, получая заглавное соединение (8,48 г, т. пл. 117-118,5oC, выход 74,7%).
Элементный анализ:
C18 H25NO8P2 найдено (рассчитано), %: C 48,31 (48,54), H 5,64 (5,66), N 2,98 (3,14).
1H ЯМР-спектр (80 МГц, CDCl3): δ 9,75 (дд, 1H, I= 2,3 Гц, I=1,0 Гц), 8,97(дд, 1H, I= 2,3 Гц, I= 16,6 Гц), 8,93 (м, 1H), 8,46 (ддд, 1H, I= 1,3 Гц, I= 7,1 Гц, I= 15,9 Гц), 7,85 (ддд, 1H, I = 3,6 Гц, I= 7,1 Гц, I= 8,4 Гц), 3,9-4,6 (м, 8H), 1,38 (т, 12H, I= 7,2 Гц). Масс-спектр E1 (М)+ = 445.
Пример 16
Тетраэтил-4-нитронафталин-1,7-дифосфонат
1,7-Дитрифторметансульфонат-4-нитронафталин (266 мг, 0,57 ммоля), диэтилфосфит (315 мг, 2,28 ммоля) и триэтиламин (345 мг, 3,42 ммоля) растворяли в 20 мл CH3CN в атмосфере N2.
C одной порцией добавляли тетракис(трифенилфосфин)-палладий (О) (50 мг, 0,043 ммоля) и полученную смесь кипятили с обратным холодильником в течение 2 час.
После охлаждения растворитель удаляли при пониженном давлении и остаток снова растворяли в этилацетате, промывали водой, разбавленной соляной кислотой, раствором NaHCO3, сушили и выпаривали в вакууме. После очистки колоночной хроматографией (на диоксиде кремния, в качестве элюента применяли смесь этилацетат/метанол, 96: 4) получали заглавный продукт в виде желтого твердого вещества (198 мг, т. пл. 54 - 57oC, выход 78%).
1H ЯМР-спектр (80 МГц, CDCl3) δ 9,15 (дд, 1H), 7,9-8,6 (м, 4H), 4,0-4,5 (м, 8H), 1,1-1,5 (м, 12H).
Пример 17
Тетраэтилнафталин-1,5-дифосфонат
Нафталин-1,5-дитрифторметансульфонат (16,46 г, 40 ммоля) (получен обработкой 1,5-дигидроксинафталина ангидридом трифторметансульфоксилоты в пиридине, т. пл. 112-113oC), диэтилфосфит (13,81 г, 100 ммоля), сухой N,N-диизопропилэтиламин (15,51 г, 120 ммоля), тетракис(трифенилфосфино) палладий (О) (1,00 г, 0,86 ммоля) в 50 мл сухого N,N-диметилформамида нагревали при 95-100oC в течение 3 час. После охлаждения реакционную смесь выливали в воду и экстрагировали этилацетатом. Органический экстракт промывали водой, разбавленной кислотой, раствором NaHCO3, сушили, (NaSO4), концентрировали при пониженном давлении до 50 мл и разбавляли 25 мл диэтилового эфира. После охлаждения льдом образованный твердый кристаллический продукт отделяли фильтрованием, промывали диэтиловым эфиром и сушили, получая заглавный продукт (12,23 г, т. пл. 169-171oC, выход 76,4%).
Элементный анализ:
C18H26O6P2, найдено (рассчит.), %: C 53,74 (54,00), H 6,53 (6,55).
Масс-спектр E1 (М)+ = 400.
1H ЯМР-спектр (80 МГц, CDCl3): δ 8,82 (дд, 2H, I=8,7 Гц, I= 1,2 Гц), 8,30 (ддд, 2H, I=1,2 Гц, I= 6,9 Гц, I=15,6 Гц), 7,65 (ддд, 2H, I= 3,9 Гц, I= 6,9 Гц, I=8,7 Гц), 3,9-4,5 (м, 8H), 1,32 (т, 12H, I=7,2 Гц).
Пример 18
1,7-Дитрифторметансульфонат-4-нитронафталин
Нафталин-1,7-дитрифторметансульфонат (2,12 г, 5 ммолей) (получен обработкой 1,7-дигидроксинафталина ангидридом трифторметансульфокислоты в пиридине) добавляли небольшими порциями в 90%-ную азотную кислоту (12,5 мл), охлажденную до -10oC (баня со смесью льда и соли).
Полученную реакционную смесь перемешивали 30 мин и затем выливали в 100 г смеси лед/вода и экстрагировали диэтиловым эфиром.
Органический экстракт промывали водой, раствором NaHCO3, водой и сушили.
Растворитель удаляли при пониженном давлении и остаток очищали флаш-хроматографией (диоксид кремния). Элюированием смесью циклогексан/этилацетат (90: 10) выделили заглавный продукт в виде бледно-желтого твердого кристаллического вещества (1.96 г, выход 83%).
1H ЯМР-спектр (80 МГц, CDCl3): δ 8,8 (д. 1H, I=9,6 Гц), 8,3 (д, 1H, I= 8,8 Гц), 8,1 (д, 1H, I= 2,8 Гц), 7,65-7,85 (м, 2H).
Пример 19
Октаэтиловый эфир кapбoнилбиc-3-({ 4-[(4-aминoпиppoл-1-мeтил- 2-карбонил)амино] -1-метилпиррол-2-карбонил}амино)-1- метилпиррол-2-карбонил]амино} нафталин-1,5-дифосфоновой кислоты.
Тетраэтил-3-[1-метил-2-пирролкарбоксамидо-4-(1-метил-4- амино-2-пирролкарбоксамидо)нафталин-1,5-дифосфонат в виде гидрохлорида (920 мг, 1,32 ммоля), растворенный в диметилформамиде, и 4,4'-карбонилбис-[2-(N-имидазолкарбонил)-4-амино-1- метилпиррол] (250 мг, 0,62 ммоля) нагревали 3 часа при 50 - 70oC до полного растворения производного имидазола. Диметилформамид выпаривали при пониженном давлении, остаток растворяли в CH2Cl2 и промывали водой, 0,5 N HCl, 5%-ным раствором NaHCO3, насыщенным раствором NaCl, сушили Na2SO4 и выпаривали при пониженном давлении.
Неочищенный остаток очищали флаш-хроматографией на силикагеле, элюируя смесью CH2Cl2/этанол, 85:15). Получали заглавное соединение в виде бледно-коричневого твердого кристаллического вещества (710 мг, выход 68%).
1H ЯМР-спектр (200 МГц, 10,46, 10,00, 9,83 (три синглета, 3H), 9,24 (с, 1H), 8,7-8,5 (м, 2H), 8,21 (с, 1H), 8,12 (ддд, 1H,I= 1,2, I=7,1 Гц, I= 16,8 Гц), 7,64 (ддд, 1H, I= 3, Гц, I= 8,7 Гц), 7,35, 7,28, 7,24, 7,08, 7,02, 6,81 (шесть дублетов, 6H, I=1,7 Гц), 4,3-4,0 (м, 8H), 3,89, 3,86, 3,83 (три синглета, 9Н), 1,4-1,2 (м, 12H).
Масс-спектр (-) FAB (M-H) = 1587.
Пример 20
Октаэтиловый эфир карбонилбис-4-{(4-({4-[(4-аминопиррол-1-метил-2-карбонил)амино] -1-метилпиррол-2-карбонил} амино)-1- метилпиррол-2-карбонил] амино}нафталин -1,7-дифосфоновой кислоты.
Гидрохлорид тетраэтил-4-[1-метил-2-пирролкарбоксамидо-4- (1-метил-4-амино-пирролкарбоксамидо)] нафталин-1,7-дифосфоната (172 мг, 2,48 ммоля) и 4,4'-карбонилбис-[2-(N- имидазолкарбонил)-4-амино-1-метилпиррол] (503 мг, 1,24 ммоля) суспендировали в сухом диметилформамиде (30 мл) и суспензию перемешивали при 70oC в течение 2,5 часа. Растворитель выпаривали при пониженном давлении и остаток хроматографировали на колонке с силикагелем при элюировании смесью хлористый метилен/этанол (4:1), получая заглавное соединение в виде бледно-желтого твердого продукта (600 мг).
1H ЯМР-спектр (80 МГц, DMSO-d6): δ 1,25 (м, 12H, 4-CH2CH3), 3,7-4,3 (м, 17H, 4-CH2CH3 + 3-CH3), 6,8, 7,0, 7,1, 7,2 (четыре дублета, 4H, пирролы), 7,35 (с, 2H, пирролы), 7,6-8,4 (м, 5H, 2+3+5+6+NHCO уреида), 8,95 (д, 1H, 8), 9,8,10,0, 10,25 (три синглета, 3H, 3-CONH).
Масс-спектр (-) FAB (M-H) = 1588.
Аналогичным образом можно получить следующие соединения в виде свободных кислот и натриевых солей:
карбонилбис-1-{ [4-({4-[(4- aминoпиppoл-1-мeтил-2-кapбoнил)-амино]-1-метилпиррол-2-карбонил} амино)-1-метилпиррол-2-карбонил]амино}нафталин-5,7-дифосфоновую кислоту;
карбонилбис-4-{ [4-({4-[(4-аминопиррол-1-метил-2- карбонил)-амино]-1-метилпиррол-2-карбонил}амино]-1- метилпиррол-2-карбонил]амино}нафталин-5,7-дифосфоновую кислоту и
кapбoнилбиc-3-{ (4-{ [4-[{(4-aминoпиppoл-1-мeтил-2-кapбoнил)-амино]- 1-метилпиррол-2-карбонил} амино)-1-метилпиррол-2-карбонил] амино} нафталин-1,5,7-трифосфоновую кислоту;
Пример 21
Карбонилбис-3-{ [4-({ 4-[{(4-аминопиррол-1-метил-2- карбонил)-амино]-1-метилпиррол-2-карбонил} амино)-1-метилпиррол- 2-карбонил] амино} нафталин-1,5-дифосфоновая кислота и ее тетранатриевая соль
Октаэтиловый эфир, полученный в примере 19 (620 мг, 0,39 ммоля), в CH2Cl2 (50 мл, не содержит этанол) обрабатывали бромтриметилсиланом (3,9 мл, 30 ммоля), как описано в примере 3. После обработки реакционной смеси получали заглавную кислоту в виде бледно-коричневого кристаллического продукта (540 мг).
1H ЯМР-спектр (200 МГц, DMSO-d6): δ 10,32, 9,98 (три синглета, 3H), 9,08 (с, 1H), 8,68 (д, 1H, I= 8,9 Гц), 8,48 (дд, 1H, I= 2,2 Гц, I= 17,1 Гц), 8,1 (ш. с, 1H), 8,04 (ддд, 1H, I=1,3 Гц, I = 7,1 Гц, I= 15,8 Гц), 7,50, 7,26, 7,24, 7,06, 7,01, 6,81 (шесть дублетов, 6H, I= 1,7 Гц), 3,88, 3,86, 3,83 (три синглета, 9H).
Масс-спектр (-) FAB (M-H) = 1363.
Полученную таким образом кислоту (520 мг) растворяли в воде (50 мл) и нейтрализовали 0,5 N NaOH до pH 6.0. Раствор фильтровали, концентрировали до небольшого объема при пониженном давлении и сушили вымораживанием, получая микрокристаллическую бледно-коричневую соль.
Элементный анализ:
C57H52Na4O19P4 (1452,95), найдено (рассчитано), %: C 39,08 (47,11), H 5,11 (3,61), N 11,08 (13,50), потери при сушке 16,00%.
1H ЯМР-спектр (400 МГц, DMSO-d6): такой же, как у свободной кислоты
Масс-спектр (-) FAB (M-H) = 1451, (M-Na) = 1429.
Пример 22
Карбонилбис-4-{[4-({4-[{(4-амино-1-метилпиррол-2-карбонил)- амино]-1-метилпиррол-2-карбонил} амино)-1-метилпиррол-2- карбонил]амино}нафталин-1,7-дифосфоновая кислота и ее тетранатриевая соль
Октаэтиловый эфир карбонилбис-4-{ [4-({ 4-[(4-амино-1- метилпиррол-2-карбонил)амино] -1-метилпиррол-2-карбонил} амино) -1-метилпиррол-2-карбонил] амино} нафталин-1,7-дифосфоновой кислоты (578 мг, 0,364 ммоля) растворяли в сухом хлористом метилене (75 мл) и при перемешивании в атмосфере азота при 0oC добавляли по каплям бромтриметилсилан (4,54 мг, 35 ммоля). Всю смесь перемешивали при 0oC в течение 1 часа и затем при комнатной температуре 66 час. Растворитель выпаривали, остаток суспендировали в ацетоне (100 мл) и обрабатывали смесью вода/ацетон (1:5) (6 мл). Суспензию перемешивали при комнатной температуре 3 часа и затем фильтровали, получая заглавный продукт в виде свободной кислоты (490 мг, коричневое твердое вещество).
1H ЯМР-спектр (80 МГц, DMSO-d6): δ 3,7-4,0 (м, 9H, 3-CH3), 6,8 7,0, 7,1, 7,2 (четыре дублета, 4H, пирролы), 7,35, (м, 2H, пирролы), 7,6-8,3 (м, 5H, 2+3+5+6+NHCO уреида). 9,1 (д, 1H, 8), 9,8, 10,0, 10,15 (три синглета, 3H, 3- CONH).
Масс-спектр (-) FAB (M-H) = 1363.
Полученную таким образом кислоту (480 мг, 0,352 ммоля) растворяли в воде (20 мл) и нейтрализовали бикарбонатом натрия (118 мг, 1,406 ммоля). Раствор тетранатриевой соли фильтровали и сушили вымораживанием, получая заглавное соединение в виде мягкого твердого вещества (515 мг).
1H ЯМР-спектр (400 МГц, DMSO-d6 + CF3COOH): δ 3,84, 3,86, 3,87 (три синглета, 9Н, 3-NCH3), 6,81, 7,03, 7,10, 7,24, 7,32, 7,37 (шесть дублетов, I= 1,7 Гц, 6H, пирролы), 7,72 (дд, I = 2,4 Гц, I=7.9 Гц, 1H, 3), 7,77 (м, 1H, 6), 8,10 (м, 2H, 5+2), 8,3 (ш, с, 1H, NHCO уреида), 9,10 (д, I=15,4, 1H, 8), 9,85, 10,02, 10,19 (три синглета, 3H, 3-CONH).
Масс-спектр (-) FAB (M+H+2Na) = 1407.
Аналогичным образом можно получить следующие соединения в виде свободных кислот и натриевых солей:
карбонилбис-1-{[4-({4-[{(4- аминопиррол-1-метил-2-карбонил)-амино]-1-метилпиррол-2-карбонил} амино)-1-метилпиррол-2-карбонил]амино}-нафталин-5,7- дифосфоновую кислоту;
карбонилбис-4-{ [4-({ 4-[(4-aминoпиppoл- 1-мeтил-2-кapбoнил)-амино]-1-метилпиррол-2-карбонил} амино)-1- метилпиррол-2-карбонил] амино} нафталин-5,7-дифосфоновую кислоту и
карбонилбис-3-{[4-({4-[{(4-аминопиррол-1-метил-2-карбонил)- амино]-1-метилпиррол-2-карбонил} амино)-1-метилпиррол-2- карбонил] амино} нафталин-1,5,7-трифосфоновую кислоту.
Пример 23
4,4'-Карбонилбис-4-амино-1-метилпиррол-2-карбоновая кислота и 4,4'-карбонилбис-[2-(N-имидазолкарбонил)-4-амино-1- метилпирразол].
В раствор 4-амино-1-метилпиррол-2-карбоновой кислоты (4,00 г, 22,6 ммоля, в виде гидрохлорида), бикарбоната натрия (7,56 г, 90 ммоля) в воде (75 мл) и 1,4-диоксане (25 мл) добавляли по каплям раствор бис (трихлорметил) карбоната (1,25 г, 4,2 ммоля) в 1,4- диоксане (10 мл) при перемешивании и охлаждении льдом. Реакционную смесь подкисляли до pH 1-2 разбавленной соляной кислотой, осажденный белый продукт отделяли фильтрованием, промывали водой и сушили, получая заглавную кислоту (3,89 г, выход 95%).
1H ЯМР-спектр (DMSO-d6) δ 12,1 (ш., 1H, обмен с D2O), 8,2 (с, 1H, обмен с D2O ), 7,12 (д, 1H), 6,62 (д, 1H), 3,80 (с, 3H).
В раствор указанной выше кислоты (3,29 г, 10,75 ммоля) в диметилформамиде (50 мл) по частям при перемешивании при комнатной температуре добавляли N, N'-карбонилдиимидазол (5,80 г, 32,6 ммоля). Через 4 часа осажденный твердый продукт отделяли фильтрованием, промывали диметилфомамидом, диэтиловым эфиром и сушили, получая заглавное соединение (3,90 г, выход 90%).
1H ЯМР-спектр (DMSO-d6): δ 8,75 (ш., с, 1H), 8,25 (м, 1H), 7,70 (т, 1H), 7,52 (д, 1H), 7,13 (м, 1H), 6,80 (д, 1H), 3,90 (с, 3H).
Пример 24
Внутримышечная инъекция 40 мг/мл
Инъецируемый фармацевтический препарат можно приготовить растворением 40 г тетранатриевой соли карбонилбис-3-({4-[(4- аминопиррол-1-метил-2-карбонил) амино)-1-метилпиррол-2-карбонил} амино)нафталин-1,5-дифосфоновой кислоты в воде для инъекции (1000 мл) и последующим запаиванием в ампулы на 1-10 мл.
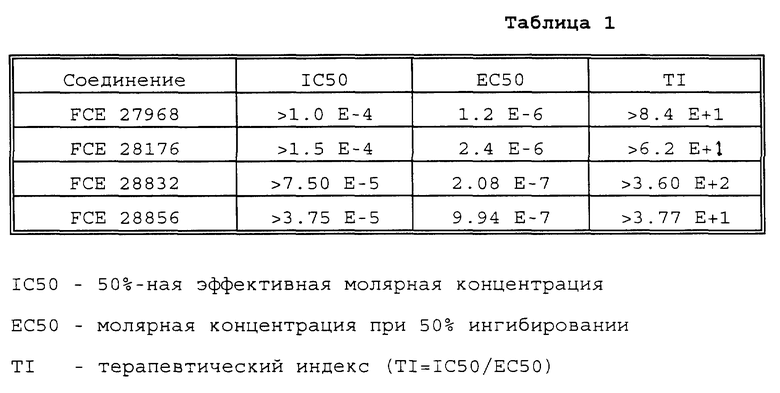
В целях определения типов биологической активности соединений ниже представлены данные биологических исследований (табл. 1) для группы представленных в изобретении соединений, проведенных в соответствии с методикой, описанной в I.NatI. Cancer lnst.8i, 557- 586 (1986).
Приведенные выше результаты показывают, что четыре представленные соединения обладают противовирусной активностью и поэтому являются полезными в качестве антивирусных агентов, в частности анти-ВИЧ агентов.
Соединение FCE 27968 является первым соединением первоначального п. 4 формулы изобретения, соединение FCE 28176
является вторым соединением того же пункта формулы изобретения. Соединение FCE 28832 можно найти на стр. 48 строки 1-3, а соединение FCE 28856 - на стр. 48 строки 4-6 описания заявки.
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО НА ОСНОВЕ БИОЛОГИЧЕСКИ АКТИВНЫХ УРЕИДОПРОИЗВОДНЫХ ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИИ, ВЫЗВАННОЙ ЛЕНТИВИРУСОМ | 1994 |
|
RU2142798C1 |
| ПРОИЗВОДНЫЕ АЗА-АНТРАЦИКЛИНОНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1996 |
|
RU2159245C2 |
| ПРОИЗВОДНЫЕ 2-АМИНО-4-ФЕНИЛ-4-ОКСОМАСЛЯНОЙ КИСЛОТЫ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2139850C1 |
| БИОЛОГИЧЕСКИ АКТИВНЫЕ ПОЛИМЕРСВЯЗАННЫЕ АНТРАЦИКЛИНЫ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ, СПОСОБЫ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2145965C1 |
| АНТРАЦИКЛИНОВЫЙ ГЛИКОЗИД, СПОСОБ ЕГО ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1992 |
|
RU2118328C1 |
| СПОСОБ ПОЛУЧЕНИЯ 9-АМИНОКАМПТОТЕЦИНА И СУЛЬФОНИЛОКСИПРОИЗВОДНЫЕ 9-НИТРО- ИЛИ 9-АМИНО-20(S)-КАМПТОТЕЦИНА | 1994 |
|
RU2137774C1 |
| СВЯЗУЮЩИЙ АГЕНТ ДЛЯ БИОАКТИВНЫХ ПРЕПАРАТОВ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1991 |
|
RU2116087C1 |
| ПРОИЗВОДНЫЕ 5-[(2H-ПИРРОЛ-2-ИЛИДЕН)МЕТИЛ]-2,2'-БИ-1H-ПИРРОЛА, ОБЛАДАЮЩИЕ ИММУНОМОДЕЛИРУЮЩЕЙ АКТИВНОСТЬЮ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1994 |
|
RU2145957C1 |
| ПОЛИМЕРНЫЙ КОНЪЮГАТ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2149646C1 |
| ПРОИЗВОДНЫЕ 3'-АЗИРИДИНО-АНТРАЦИКЛИНА, СПОСОБЫ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2149163C1 |
Соединения формулы I, где каждый из m и n - целое число 1-4; р, q - целое число 1-3; R - свободная или этерифицированная группа фосфоновой кислоты, и их фармацевтически приемлемые соли могут быть использованы в качестве антилентивирусного средства. 2 c. и 4 з.п. ф-лы, 1 табл.
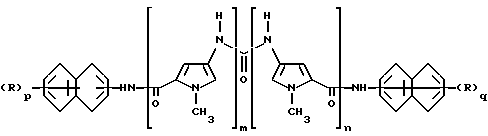
где каждый из m и n, которые имеют одинаковые значения, является целым числом от 1 до 4; каждый из p и q, которые имеют одинаковые значения, является целым числом от 1 до 3, и каждая из групп R, которые имеют одинаковые значения, представляет собой свободную или этерифицированную группу фосфоновой кислоты, и их фармацевтически приемлемые соли.
карбонил бис-4-({4-[(4-аминопиррол-1-метил-2-карбонил)амино]-1-метилпиррол-2-карбонил}амино)нафталин-1,7-дифосфоновой кислоты;
карбонил бис-3-({4-[(4-аминопиррол-1-метил-2-карбонил)амино]-1-метилпиррол-2-карбонил}амино)нафталин-1,6-дифосфоновой кислоты;
карбонил бис-4-({4-[(4-аминопиррол-1-метил-2-карбонил)амино]-1-метилпиррол-2-карбонил}амино)нафталин-1,6-дифосфоновой кислоты;
карбонил бис-3-({4-[(4-аминопиррол-1-метил-2-карбонил)амино]-1-метилпиррол-2-карбонил}амино)нафталин-5,7-дифосфоновой кислоты;
карбонил бис-2-({4-[(4-аминопиррол-1-метил-2-карбонил)амино]-1-метилпиррол-2-карбонил}амино)нафталин-1,5-дифосфоновой кислоты;
карбонил бис-1-({4-[(4-аминопиррол-1-метил-2-карбонил)амино]-1-метилпиррол-2-карбонил}амино)нафталин-5,7-дифосфоновой кислоты;
карбонил бис-4-({4-[(4-аминопиррол-1-метил-2-карбонил)амино]-1-метилпиррол-2-карбонил}амино)нафталин-5,7-дифосфоновой кислоты;
карбонил бис-1-({4-[(4-аминопиррол-1-метил-2-карбонил)амино]-1-метилпиррол-2-карбонил}амино)нафталин-5,6-дифосфоновой кислоты;
карбонил бис-4-({4-[(4-аминопиррол-1-метил-2-карбонил)амино]-1-метилпиррол-2-карбонил}амино)нафталин-5,6-дифосфоновой кислоты;
карбонил бис-4-({4-[(4-аминопиррол-1-метил-2-карбонил)амино]-1-метилпиррол-2-карбонил}амино)нафталин-2,5-дифосфоновой кислоты;
карбонил бис-4-({4-[(4-аминопиррол-1-метил-2-карбонил)амино]-1-метилпиррол-2-карбонил}амино)нафталин-6,7-дифосфоновой кислоты;
карбонил бис-4-({4-[(4-аминопиррол-1-метил-2-карбонил)амино]-1-метилпиррол-2-карбонил}амино)нафталин-2,6-дифосфоновой кислоты;
карбонил бис-4-({4-[(4-аминопиррол-1-метил-2-карбонил)амино]-1-метилпиррол-2-карбонил}амино)нафталин-2,7-дифосфоновой кислоты;
карбонил бис-1-({4-[(4-аминопиррол-1-метил-2-карбонил)амино]-1-метилпиррол-2-карбонил}амино)нафталин-5-фосфоновой кислоты;
карбонил бис-4-({4-[(4-аминопиррол-1-метил-2-карбонил)амино]-1-метилпиррол-2-карбонил}амино)нафталин-5-фосфоновой кислоты;
карбонил бис-4-({4-[(4-аминопиррол-1-метил-2-карбонил)амино]-1-метилпиррол-2-карбонил}амино)нафталин-6-фосфоновой кислоты;
карбонил бис-1-({4-[(4-аминопиррол-1-метил-2-карбонил)амино]-1-метилпиррол-2-карбонил}амино)нафталин-6-фосфоновой кислоты;
карбонил бис-4-({4-[(4-аминопиррол-1-метил-2-карбонил)амино]-1-метилпиррол-2-карбонил}амино)нафталин-2,5,6-трифосфоновой кислоты;
карбонил бис-4-({4-[(4-аминопиррол-1-метил-2-карбонил)амино]-1-метилпиррол-2-карбонил}амино)нафталин-1,5,7-трифосфоновой кислоты;
карбонил бис-3-({4-[(4-аминопиррол-1-метил-2-карбонил)амино]-1-метилпиррол-2-карбонил}амино)нафталин-1,5,7-трифосфоновой кислоты;
карбонил бис-3-{/4-[(4-аминопиррол-1-метил-2-карбонил)амино]-1-метилпиррол-2-карбонил} амино)-1-метилпиррол-2-карбонил} амино)нафталин-1,5-дифосфоновой кислоты;
карбонил бис-4-{/4-/{(4-[4-аминопиррол-1-метил-2-карбонил)амино]-1-метилпиррол-2-карбонил} амино)-1-метилпиррол-2-карбонил] амино} нафталин-1,7-дифосфоновой кислоты;
карбонил бис-1-{ [4-/{(4-[4-аминопиррол-1-метил-2-карбонил)амино]-1-метилпиррол-2-карбонил} амино)-1-метил-2-карбонил] амино}нафталин-5,7-дифосфоновой кислоты;
карбонил бис-4-{ [4-({4-[(4-аминопиррол-1-метил-2-карбонил)амино]-1-метилпиррол-2-карбонил} амино)-1-метилпиррол-2-карбонил]амино}нафталин-5,7-дифосфоновой кислоты;
карбонил бис-3-{ [4-({4-[(4-аминопиррол-1-метил-2-карбонил)амино]-1-метилпиррол-2-карбонил} амино)-1-метилпиррол-2-карбонил]амино}нафталин-1,5,7-трифосфоновой кислоты и их C1-C6-алкиловых и фенил-C1-C6-алкиловых эфиров и фармацевтически приемлемых солей.
| Способ получения производных дистамицина А или их гидрохлоридов | 1987 |
|
SU1528316A3 |
| Способ получения гидрохлоридов поли-4-аминопиррол-2-карбоксамидопроизводных | 1986 |
|
SU1544185A3 |
| Огнетушитель | 0 |
|
SU91A1 |
Авторы
Даты
1999-09-10—Публикация
1995-02-08—Подача