Изобретение относится к ветеринарии, в частности к ветеринарной иммунологии, и может быть использовано при оценке состояния фагоцитарного звена иммунного статуса сельскохозяйственных животных.
Известен способ постановки фагоцитарной реакции по Кост и Стенко "Гематология животных и рыб" - М. "Колос" 1969 - с.206-207.
Способ заключается в том, что небольшое количество крови животного сразу после взятия вносят в рабочий раствор гепарина, перемешивают и добавляют равный объем взвеси тест-микроба в физрастворе. Смесь тщательно перемешивают и помещают в термостат при 39oC. После 15 - 20 минутной экспозиции приготавливают мазок, окрашивают, микроскопируют. Недостатком данного способа является то, что интенсивность фагоцитоза и конечный результат реакции полностью зависят от времени, прошедшего с момента взятия крови до внесения в нее тест-микроба, так как клетки крови вне организма погибают в течение 2-3 часов. При обследовании сельскохозяйственных животных, непосредственно в племенных хозяйствах, взятие крови и доставка проб в лабораторию часто требует более длительного времени, таким образом, тест-микроб вносится со значительным опозданием, когда часть лейкоцитов уже не способна фагоцитировать.
В практических условиях при транспортировке крови сложно сохранять температурный режим 37. ..39oC, особенно в холодное время года. При изменении температуры на 4-5o лейкоциты погибают.
Техническим недостатком постановки реакции является то, что в лаборатории в кровь поверх лейкоцитов вносят микробные клетки. Лейкоциты в стабилизированной крови из-за своей относительно большой массы выпадают в осадок быстрее бактерий. Микробы в верхнем слое смеси даже при тщательном перемешивании остаются недоступными для фагоцитов.
При общепринятом способе только небольшую часть крови из каждой пробы используют в реакции, при этом из одних проб поступает больше осадка (клеток крови), из других - надосадочной части. Кровь переливают посредством пипеток, при этом часть фагоцитов повреждается. Вышеперечисленные недостатки влияют на конечный результат реакции.
Цель изобретения - повышение точности и упрощение способа.
Поставленная цель достигается тем, что в известном способ постановки фагоцитарной реакции крови сельскохозяйственных животных, включающем приготовление микробной взвеси, взятие крови, изготовление мазка, микроскопирование, микробную взвесь после изготовления вносят в раствор цитрата натрия, подогревают до температуры 37-39oC и кровь наслаивают на нее в процессе взятия от животного. При этом исключается необходимость хранения и транспортировки проб. Контакт между фагоцитами и микробными клетками наступает в первые секунды после взятия крови, поэтому лейкоциты в момент реакции максимально активны.
При взятии крови поверх культуры тест-микроба лейкоциты опускаются через слой насыщенной микробной взвеси и контактируют с максимальным количеством бактерий, все фагоциты участвуют в реакции, увеличивается аттракция.
Пробирки для взятия крови служат одновременно и для постановки реакции, поэтому кровь не переливают через пипетки, фагоциты остаются неповрежденными. Способ осуществляется следующим образом:
Смыв суточной культуры золотистого стафилококка с мясо-пептонного агара вносят в количестве 1 мл в сухие пробирки с мерными делениями от 0,5 до 5,0 мл и с ватно-марлевыми пробками. Концентрация тест-микроба 2 млрд/мм3 физраствора (по оптическому стандарту). В каждую пробирку добавляют по 0,5 мл 5%-ного раствора лимонно-кислого натрия (однозамещенного) на физрастворе, получают объем 1,5 мл. Закрытые пробирки хранят не дольше суток. Перед взятием крови пробирки с тест-микробом помещают в штативе в теплую воду с температурой 38-39oC.
Взятие крови в пробирки производят непосредственно из кровеносного сосуда до деления, соответствующего трем мл., т.е. 1,5 мл крови поверх микробной взвеси. Содержимое пробирки перемешивают круговыми вращениями. На 15 минут помещают пробы в воду при 37-39oC и контролируют термометром. Записывают время взятия каждой пробы и время приготовления мазка. Мазок делают в полевых условиях с помощью шлифованного стекла через 15 минут после начала реакции. Для приготовления мазка используют одну каплю из осадочной части смеси, фиксируют спирт-эфиром 10 минут.
Мазки в специальных закрытых ванночках доставляют в лабораторию, где их окрашивают по Романовскому и микроскопируют.
Результаты реакции учитывают по формулам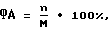
где ФА - фагоцитарная активность лейкоцитов,
n - количество нейтрофилов, фагоцитировавших кокки;
M - количество микробных клеток, захваченных всеми подсчитанными нейтрофилами.
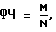
где ФЧ - фагоцитарное число;
N - всего подсчитано нейтрофилов в мазке.
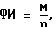
где ФИ - фагоцитарный индекс.
Пример 1.
У племенных хряков в течение двух часов были взяты 30 проб крови для оценки иммунного статуса. Реакция была проведена общепринятым способом. В пробирки с 0,1 мл стабилизирующего раствора брали кровь в количестве 2-3 мл, перемешивали и помещали пробы в теплую воду. После взятия проб их в термосе доставили в лабораторию. В лаборатории по 0,5 мл крови из каждой пробы переливали в сухие стерильные пробирки, затем вносили поверх крови микробную взвесь, перемешивали полученную смесь и инкубировали ее в термостате при температуре +39oC, таким образом, контакт фагоцитов с бактериями наступил только через 3 часа после взятия первой пробы, не все лейкоциты остались жизнеспособными к моменту начала реакции.
После инкубирования смеси приготавливали мазки, микроскопировали, учитывали результат реакции. Установлено, что только 32,0% нейтрофилов фагоцитировали в среднем по 1,5 бактерии, обнаружено большое количестве) клеток крови, разрушенных в результате перевозки проб и при переливании крови через пипетки. В пяти мазках, приготовленных из проб, взятых первыми по времени, нет ни одного фагоцитировавшего лейкоцита, так как за 3 часа хранения и транспортировки все клетки крови погибли (см. табл. 1). В остальных 25 пробах фагоцитарная активность лейкоцитов находилась в обратной зависимости от времени переживания клеток крови вне организма животного (r = -0,810).
В результате того, что микробная взвесь была внесена в стабилизированную кровь с уже осевшими форменными элементами, в верхней части пробы бактерии не встретили потенциальных фагоцитов, а в нижней - осадочной части проб лейкоциты находились в недостаточно насыщенной микробной среде и у них не было возможности присоединить и захватить максимальное количество бактерий. При учете результатов это выражалось следующим образом: в среднем в каждом мазке было обнаружено всего 280 присоединенных бактерий, их них только 62 - в стадии захвата. Такая способность фагоцитов не соответствует физиологической норме.
Пример 2.
У 30 племенных хряков фагоцитарная реакция была проведена предлагаемым способом - непосредственно на месте взятия крови. Тест-микроб был заранее внесен в пробирки с цитратом натрия по 2 млрд мт в каждую. Затем в эти пробирки брали кровь из периферических кровеносных сосудов уха до отметки, соответствующей объему 3 мл. Помещали в теплую воду +39oC, записывали время взятия каждой пробы и время приготовления мазка из нее. Каждый мазок приготавливали точно в назначенное для него время - через 15 минут после начала реакции в соответствующей пробирке.
Мазки высушивали и фиксировали в полевых условиях. В лаборатория их окрашивали и микроскопировали.
При учете результатов было установлено, что 48,4% нейтрофилов поглотили по 3,6 бактериальных клетки, то есть вдвое больше, чем при постановке реакции общепринятым способом (см. табл. 2). Во всех пробах результаты реакции были близкими и не зависели от того, раньше или позже была взята проба. Влияние временного фактора было полностью устранено. В мазках не было обнаружено разрушенных или поврежденных лейкоцитов, так как кровь не переливали и не перевозили, в отличие от известного способа.
В результате того, что кровь поступала в пробирки поверх микробной взвеси, а не наоборот, улучшился контакт фагоцитов с бактериальными клетками. Значительно большее количество микроорганизмов присоединялось к лейкоцитам (в среднем в каждом мазке обнаружено 552 присоединенных бактерии, из них 267 в стадии захвата). Таким образом, при постановке реакции предлагаемым способом были лучше учтены физические особенности клеток крови и бактерий, в т. ч. масса, размер, а также химические свойства (хемотаксис), способность стафилококка длительное время сохраняться в растворе цитрата иттрия.
Более точная оценка состояния иммунного статуса племенных животных позволяет с высокой достоверностью выявлять животных, предрасположенных к заболеваниям и своевременно выбраковывать производителей, ухудшающих резистентность стада.
Применение предлагаемого способа позволит повысить сохранность новорожденного молодняка, снизить восприимчивость животных к бактериальной микрофлоре и сохранить высокую продуктивность стада.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ БАКТЕРИЦИДНОЙ АКТИВНОСТИ СЫВОРОТКИ КРОВИ СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ | 2000 |
|
RU2189040C2 |
| СПОСОБ СОЧЕТАННОЙ ОЦЕНКИ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ НЕЙТРОФИЛОВ ПЕРИФЕРИЧЕСКОЙ КРОВИ ПРИ ВОЗДЕЙСТВИИ ВОЗБУДИТЕЛЯ БРУЦЕЛЛЕЗА | 1997 |
|
RU2133471C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ФАГОЦИТАРНОЙ АКТИВНОСТИ НЕЙТРОФИЛОВ ПРИ ПОМОЩИ МИКРОБИОЛОГИЧЕСКОГО ПОДХОДА | 2019 |
|
RU2727880C1 |
| СПОСОБ ИССЛЕДОВАНИЯ ФАГОЦИТОЗА В ЦЕЛЬНОЙ КРОВИ | 1992 |
|
RU2054172C1 |
| Способ определения фагоцитарной активности нейтрофилов | 1988 |
|
SU1615614A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ФАГОЦИТАРНОЙ АКТИВНОСТИ НЕЙТРОФИЛОВ ПЕРИФЕРИЧЕСКОЙ КРОВИ ЖИВЫХ ОРГАНИЗМОВ | 2003 |
|
RU2242763C1 |
| Способ иммунодиагностики инфекции | 1990 |
|
SU1789927A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ФАГОЦИТАРНОЙ АКТИВНОСТИ НЕЙТРОФИЛОВ ПОЛОСТИ РТА | 1993 |
|
RU2093827C1 |
| СПОСОБ ДИАГНОСТИКИ НАРУШЕНИЯ ФАГОЦИТОЗА У ДЕТЕЙ | 2021 |
|
RU2754799C1 |
| Способ оценки фагоцитарной активности нейтрофилов | 1989 |
|
SU1749834A1 |
Изобретение относится к ветеринарии, в частности к ветеринарной иммунологии. Микробную взвесь после изготовления вносят в раствор цитрата натрия, подогревают до температуры 37-39°С и кровь наслаивают на нее в процессе взятия от животного, готовят мазок. При этом исключается необходимость хранения и транспортировки проб в лабораторию, что обеспечивает повышение точности и упрощение способа. 2 табл.
Способ постановки фагоцитарной реакции крови сельскохозяйственных животных, включающий приготовление микробной взвеси, взятие крови, изготовление мазка, микроскопирование, отличающийся тем, что микробную взвесь после приготовления вносят в раствор цитрата натрия, подогревают до температуры 37-39oC и кровь наслаивают на нее в процессе взятия от животного.
| Кост и др | |||
| Гематология животных и рыб | |||
| - М.: "Колос", 1969, с.206-207 | |||
| СПОСОБ ОПРЕДЕЛЕНИЯ АКТИВИРОВАННЫХ ЛИМФОЦИТОВ В КРОВИ | 1992 |
|
RU2080597C1 |
| СПОСОБ ОЦЕНКИ СОСТОЯНИЯ АНТИЭНДОТОКСИНОВОГО ИММУНИТЕТА В ОТНОШЕНИИ ГРАМОТРИЦАТЕЛЬНЫХ БАКТЕРИЙ (ЛПС - ТЕСТ - ИФА) | 1994 |
|
RU2088936C1 |
| СПОСОБ ОЦЕНКИ РЕЗИСТЕНТНОСТИ ОРГАНИЗМА | 1995 |
|
RU2104542C1 |
| СПОСОБ ДИАГНОСТИКИ ГОНОРЕИ | 1991 |
|
RU2029954C1 |
Авторы
Даты
1999-09-20—Публикация
1998-06-01—Подача