Изобретение относится к ветеринарной вирусологии и биотехнологии, касается нового штамма вируса герпеса индеек (ВГИ), который может быть использован для изготовления вакцины против болезни Марека.
Болезнь Марека (БМ) - высококонтагиозное, лимфопролиферативное, злокачественное заболевание птиц, вызываемое вирусом из рода Herpesvirus. БМ регистрируется во всех странах мира, где развито промышленное птицеводство, в том числе и в нашей стране, вызывая большие экономические потери. Болезнь характеризуется образованием единичных (в начальной стадии) и множественных опухолей во внутренних органах, коже, мышцах, а также изменениями центральной и периферической нервной системы. Вирус болезни Марека (ВБМ) повреждает иммунокомпетентные органы (селезенку, тимус, клоакальную сумку) и обладает таким образом иммунодепрессивной активностью, что приводит к снижению общей резистентности птиц и повышению их чувствительности к другим болезням. В связи с этим БМ довольно часто протекает в ассоциации с другими заболеваниями.
Важным средством предупреждения БМ и снижения потери от заболевания является вакцинопрофилактика. Для специфической профилактики используют вакцины трех типов: из аттенуированных штаммов ВБМ (серотип 1), из природно-ослабленного непатогенного ВБМ (серотип 2) и из штаммов ВГИ (серотип 3). Серотип 1 включает все онкогенные вирусы и аттенуированные варианты, серотип 2 - все природно-ослабленные ВБМ, серотип 3 - антигенно родственные ВБМ вирусы герпеса индеек.
Известен аттенуированный штамм CVI-988 ВБМ (серотип 2), используемый для изготовления вакцины (1).
Недостаток данного штамма состоит в том, что он не устраняет носительства вирулентного вируса и вакцина на его основе сохраняет умеренную вирулентность для высокочувствительных линий цыплят.
Известен также штамм SB-1 ВБМ (серотип 2), используемый для изготовления вакцины (2).
Недостаток данного штамма состоит в том, что он также не устраняет носительства вирулентного вируса и вакцина на его основе не устраняет опасность поражения лимфатических органов птиц высоковирулентными онкогенными штаммами ВБМ.
Известен также штамм "ВНИВИП" ВБМ, используемый для изготовления вакцины против БМ и представляющий собой апатогенный генетически однородный вирусный материал, культивируемый в культуре куриных эмбриональных фибробластов с титром 1 • 105 - 6 • 105 ФОЕ/см3. Штамм "ВНИВИП" депонирован в коллекции вирусов НИИ вирусологии им. Д.И.Ивановского ГКВ N 2223 (3).
Недостаток данного штамма состоит в том, что изготовленная на его основе вакцина не обладает достаточно высокой иммуногенной активностью в хозяйствах с высоким уровнем заболеваемости БМ.
Наиболее близким предлагаемому изобретению по совокупности существенных признаков является штамм FC-126 ВГИ (серотип 3), используемый для изготовления вакцины против БМ (4).
Недостаток данного штамма состоит в его низкой иммуногенной активности.
В задачу создания настоящего изобретения входило получение нового штамма ВГИ, обладающего высокой иммуногенной активностью и пригодного для изготовления вакцины против БМ.
Технический результат от использования предлагаемого изобретения заключается в получении высокоиммуногенного штамма ВГИ, пригодного для изготовления вакцины против БМ.
Указанный технический результат достигнут созданием штамма "ВНИИЗЖ/N 110" ВГИ. Штамм "ВНИИЗЖ/N 110" является новым, ранее неизвестным. Исходный вирус для получения штамма "ВНИИЗЖ/N 110" выделен в 1998 году из эпителия перьевых фолликулов СПФ-цыплят, иммунизированных вируссодержащим материалом из штамма FC-126 ВГИ. Производственный штамм "ВНИИЗЖ/N 110" ВГИ получен методом перемежающихся пассажей через организм СПФ-цыплят и культуру клеток фибробластов СПФ-эмбрионов кур. Штамм "ВНИИЗЖ/N 110" ВГИ представляет собой апатогенный генетически однородный вирусный материал, легко культивируемый в культуре куриных эмбриональных фибробластов с высокой биологической активностью (титр вируса 2,0- 3,0 • 106 ФОЕ/см3) и вызывающий напряженный иммунитет по сравнению со штаммом FC-126 у привитой птицы.
Штамм "ВНИИЗЖ/N 110" ВГИ депонирован в коллекции микроорганизмов Всероссийского государственного научно-исследовательского института контроля, стандартизации и сертификации ветеринарных препаратов (ВГНКИ) 18.12.98 г. под регистрационным номером "ВНИИЗЖ/N 110-ДЕП".
По сравнению с прототипом штамм "ВНИИЗЖ/N 110" обладает более высокой биологической, антигенной и иммуногенной активностью в нативном виде. Экспериментально подтверждена его возможность использования для приготовления вакцины против БМ. Штамм "ВНИИЗЖ/N 110" ВГИ обеспечивает получение живой вакцины против БМ, создающей защиту птиц против указанного возбудителя заболевания.
Сущность изобретения пояснена на графическом материале (фиг. 1), на котором представлена нуклеотидная последовательность фрагмента гена gB 966-1296 штамма "ВНИИЗЖ/N 110" ВГИ (жирным шрифтом отмечены его нуклеотидные отличия от штамма - прототипа FC-126).
Штамм "ВНИИЗЖ/N 110" ВГИ характеризуется следующими признаками и свойствами.
Морфологические признаки
Штамм "ВНИИЗЖ/N 110" ВГИ относится к семейству Herpesviridae, роду Herpesvirus, серотипу 3. На основании сравнительного электронно-микроскопического изучения производственного штамма FC-126 ВГИ и штамма "ВНИИЗЖ/N 110" при репродукции их в культурах клеток установлена идентичность характеристик обоих штаммов. Эти вирусы проходили онтогенетический цикл развития в нуклеоплазме, а в цитоплазме - завершающие стадии морфогенеза. Внутриядерный цикл развития включает стадии виропласта, нуклеоида, сборку нуклеокапсида, формирование наружной суперкапсидной мембраны. Наиболее частой формой, присутствующей на всех стадиях культивирования, является нуклеокапсид с нуклеоидом, представленным плотным образованием, заключенным в капсидную белковую оболочку. При электронно-микроскопическом исследовании штамм "ВНИИЗЖ/N 110" представлен типичными для вирусов герпеса группами B вирионами, имеющими икосаэдрическую форму, нуклеокапсид содержит 2-нитевую ДНК. В ядре пораженной клетки вирион имеет величину 90-100 нм, в цитоплазме размер его увеличивается за счет белковой оболочки до 180-200 нм. Оболочка состоит из 162 капсомеров, расположенных в кубической симметрии.
Антигенные свойства
По своим антигенным свойствам штамм "ВНИИЗЖ/N 110" ВГИ относится к серотипу 3. При введении в организм вызывает латентно протекающую вирусемию. Антитела к данному вирусу обнаруживают в крови цыплят к 14-21-дневному сроку с дальнейшим нарастанием к 40-60 дню. При вакцинации вирус индуцирует образование специфических антител, выявляемых в РДП и ИФА. Активность в РСК не установлена. Концентрированный антиген "ВНИИЗЖ/N 110" реагирует в РДП со специфическими сыворотками ВГИ и ВБМ. Выявляются общие антигены с ВБМ в прямой и непрямой РИФ. При разрушении клетки вступает в реакцию с антителами к ВГИ и ВБМ в РН. В ИФА вступает в реакцию с антителами к ВГИ и ВБМ.
Биотехнологические характеристики
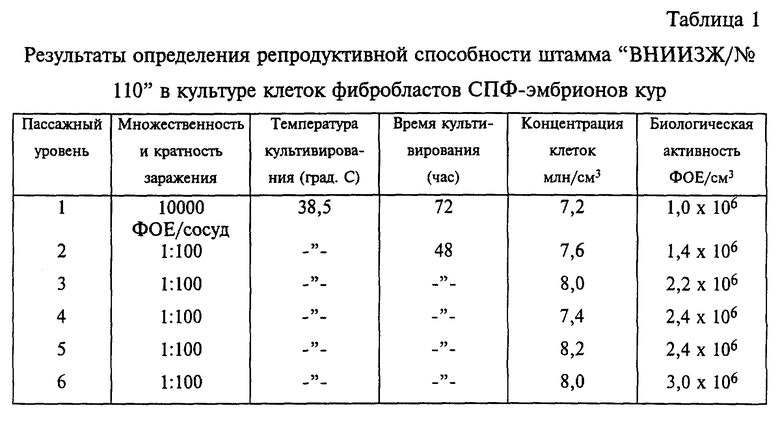
Штамм "ВНИИЗЖ/N 110" активно размножается в СПФ-эмбрионах кур и в первично-трипсинизированной культуре фибробластов СПФ-эмбрионов кур. Трипсинизацию эмбрионов и культивирование фибробластов проводят по общепринятым методикам с использованием смеси сред на основе ГЛА, Игла и 199, взятых в равных частях, с добавлением 10% эмбриональной сыворотки КРС. Клетки фибробластов выращивают во флаконах емкостью 50 см3 и 100 см3 (Повицкого), в матрасах емкостью 1,5 дм3 и в роллерных 3-литровых сосудах. Посевная концентрация для флаконов и матрасов составляет 400-500 кл/см3, для роллерных сосудов от 1,2 до 1,5 млн.кл/см3. При размножении в культуре фибробластов вирус проявляет ярко выраженный цитопатический эффект - образование характерных фокусов, состоящих из рефрактильных округлых клеток (поликариоцитов). Размеры фокуса достигают 0,1-0,2 мм. При проведении последовательных пассажей в культуре фибробластов СПФ-эмбрионов кур инфекционный титр вируса увеличивался и достигал 2,0-3,0•106 ФОЕ/см3 (фокусообразующих единиц).
При заражении 6-суточных СПФ-эмбрионов кур в желточный мешок штамм "ВНИИЗЖ/N 110" вызывает их гибель до 20% на 3-5 сутки инкубации. У павших эмбрионов отмечают отставание в росте, гепатиты, увеличение селезенки и почек. На хориоаллантоисной оболочке образуются мелкие бляшки серовато-белого цвета звездчатой формы размером до 1 мм в небольших количествах. У эмбрионов развивается гепатит. Штамм "ВНИИЗЖ/ 110" ВГИ предназначен для использования в качестве сырья для изготовления живой вакцины против БМ.
Результаты определения репродуктивной способности штамма "ВНИИЗЖ/N 110" в культуре клеток фибробластов СПФ-эмбрионов кур представлены в таблице 1.
Хемо- и генотаксономическая характеристика
Штамм "ВНИИЗЖ/N 110" является ДНК-содержащим вирусом с молекулярной массой 108-120•106 Д. Нуклеиновая кислота представлена двухцепочечной линейной молекулой. Содержание G+C - 46%. Вирион состоит из нуклеоида, икосаэдрического капсида, асимметрично расположенного вокруг капсида электронно-плотного материала, обозначаемого как тегумент, и липопротеидной оболочки. Вирионная ДНК участвует в образовании белков-предшественников в инфицированных клетках. Предшественники в свою очередь расщепляются с образованием более стабильных структурных и неструктурных полипептидов вируса. Основными антигенными белками являются гликопротеины A (gA) и В (gB). Гликопротеин В играет важную роль в индукции защитного иммунитета и является высококонсервативным среди герпесвирусов. Он представляет собой комплекс трех гликопротеинов: gp 49, gp 60 и gp 100.
Проведено определение первичной структуры фрагмента гена gB вируса с помощью полимеразно-цепной реакции (ПЦР) и секвенирования амплифицированного фрагмента. Изучение нуклеотидной последовательности генома штамма "ВНИИЗЖ/N 110" методом секвенирования по Сенсеру показало, что фрагмент гена gB 966-1296Н имеет 2 нуклеотидные замены в позициях 1038Н "C" на "T", 1200Н "A" на "G" и одну замену в позиции 1175Н с "T" на "C" в отличие от штамма FC-126, представленного в международном ген-банке. Таким образом, штамм "ВНИИЗЖ/N 110" отличается от штамма FC-126 по трем нуклеотидным основаниям, однако все три мутации не приводят к заменам соответствующих аминокислот. Гомология нуклеотидной структуры исследованного фрагмента штаммов FC- 126 и "ВНИИЗЖ/N 110" составляет 99,1%. Результаты исследований представлены на прилагаемом графическом материале.
Устойчивость к внешним факторам
Устойчивость штамма "ВНИИЗЖ/N 110" ВГИ к физическим и химическим факторам характеризуется следующими данными. Центрифугирование при 50000 g осаждает вирус в течение 1 час. В пределах pH 4-10 вирус чувствителен к эфиру.
Вирус выдерживает неоднократное замораживание - оттаивание и воздействие ультразвуком в течение 10 мин. Полная термоинактивация вируса происходит при 4oC через 2 недели хранения, при 20-25oC - через 4 дня, при 37oC - через 18 часов и при 60oC - за 10 мин.
Хранение и консервирование
Вирус сохраняется в клеточно-ассоциированном виде в смеси из равных объемов сред на основе гидролизата лактальбумина (ГЛА), Игла и 199 с 20% сыворотки КРС и 10% диметилсульфоксида в герметически запаянных ампулах в жидком азоте при - 196oC в течение 24 месяцев.
Патогенные свойства
Не вызывает инфекции у птиц, контагиозность не установлена. Лабораторные и домашние животные к вирусу не чувствительны.
Иммуногенность штамма
Штамм вызывает иммунитет в дозе 1000 ФОЕ у 90-98% цыплят в производственных условиях. Иммуногенность не меняется в течение 5 последовательных пассажей.
Дополнительные признаки и свойства
Штамм "ВНИИЗЖ/N 110" ВГИ свободен от контаминации бактериальной и грибковой флорой, чужеродными вирусами и микоплазмами, безвреден в 10-кратной дозе для суточных цыплят.
На основании полученных данных можно утверждать, что штамм "ВНИИЗЖ/N 110" ВГИ является оригинальным, в таксономическом отношении новым, ранее неизвестным изолятом ВГИ.
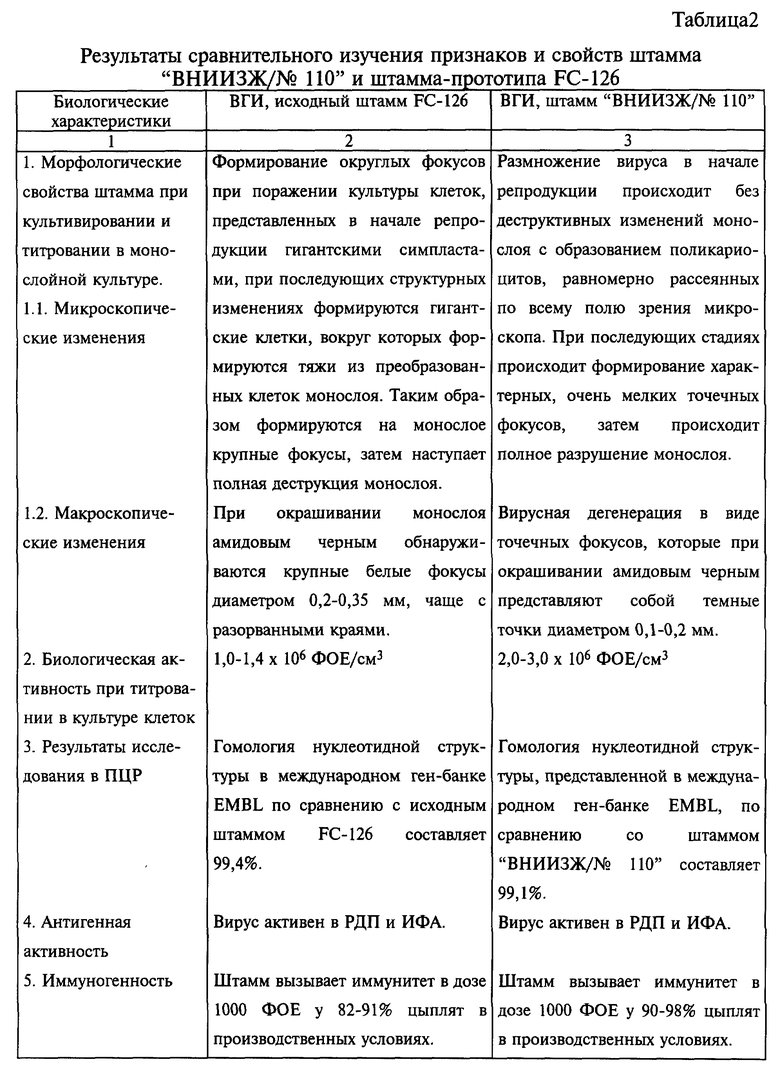
В таблице 2 приведены результаты сравнительного изучения признаков и свойств штамма "ВНИИЗЖ/N 110" и штамма-прототипа FC-126.
По мнению заявителя, предлагаемый штамм соответствует условиям патентоспособности "новизна" и "изобретательский уровень".
Сущность предлагаемого изобретения пояснена примерами его исполнения.
Пример 1. Получение штамма
Штамм "ВНИИЗЖ/N 110" ВГИ получен методом перемежающихся пассажей вируса через организм СПФ-цыплят и культуру фибробластов СПФ-эмбрионов кур. Для этого односуточным СПФ-цыплятам вводили ВГИ в количестве 1000 ФОЕ/0,2 см3 и через 10 суток выделяли вирус из содержимого перьевых фолликул. С этой целью маховые перья извлекали механически, затем в стерильных условиях из перьевых окончаний содержимое выдавливали в диспергирующий раствор и проводили расщепление ткани в течение 3-5 минут на магнитной мешалке. Затем прекращали действие дисперганта добавлением эмбриональной сыворотки (2% от объема жидкости). Жидкость центрифугировали, надосадок удаляли, осадок с эпителиальными клетками перьевых фолликул наносили на монослой суточных культур клеток куриных фибробластов СПФ-эмбрионов. На монослой, выращенный в 50 см3 флаконах, вносили примерно 5000 клеток перьевых фолликул. Через 3 суток провели "слепой" пассаж, т.е. клетками, снятыми с одного флакона без признаков дегенерации монослоя, инокулировали 2 флакона с культурой. Через 48 часов в этих флаконах отмечали первые очаги ЦПД вируса, которое характеризовалось появлением поликариоцитов по всему монослою. Спустя 24 часа после этого провели третий пассаж. Заражение в этом случае проводили из расчета 1:5. Материалом 3 пассажа после определения титра вируса заражали СПФ-цыплят в дозе 10000 ФОЕ/0,2 см3. Спустя 10 суток от них получали содержимое перьевых фолликул, затем провели 3 пассажа в культуре клеток фибробластов СПФ-эмбрионов кур. Третий цикл перемежающихся пассажей проводили аналогично двум предыдущим. Таким образом провели три цикла перемежающихся пассажей через организм СПФ-цыплят и культуру клеток фибробластов СПФ-эмбрионов кур. В результате проведенных работ ВГИ изменил ряд важных фенотипических признаков, в частности время и характер морфологических изменений пораженных клеток куриных фибробластов, и приобрел новые биологические свойства, что привело к росту его урожайности в процессе дальнейшего пассирования в отличие от исходного штамма FC-126. Об этом свидетельствуют приведенные в таблице 1 результаты определения репродуктивной способности вновь полученного штамма в культуре куриных фибробластов в течение шести непрерывных пассажей. Исходным материалом для этого служила клеточно-ассоциированная вирусная суспензия с активностью 1,0•106 ФОЕ/см3, полученная в третьем цикле перемежающихся пассажей. Множественность заражения на первом пассаже составляла 10000 ФОЕ на 3-литровый роллерный сосуд с 3-суточным монослоем, содержащим около 300 млн кл/см3. Последующие пассажи проводили из расчета 1:100 при поражении 70% монослоя.
Модифицированному ВГИ было присвоено авторское наименование: штамм "ВНИИЗЖ" ВГИ.
Полученный штамм был подвергнут всестороннему контролю в соответствии с Руководством МЭБ по стандартным диагностическим методам и вакцинам (1996) и на уровне 3 пассажа заложен на хранение в жидкий азот в качестве матровой расплодки.
Матровая расплодка штамма "ВНИИЗЖ" оказалась стерильной, контаминация микоплазмами и чужеродными вирусами отсутствовала.
Материал безвреден для суточных СПФ-цыплят, специфичен, биологическая активность штамма составила 3,0•103 ФОЕ/см3.
Пример 2. Приготовление вакцины из штамма "ВНИИЗЖ/N 110" ВГИ
Вакцину готовят следующим образом. Вакцинный штамм "ВНИИЗЖ/N 110" хранят в сосудах Дьюара с жидким азотом (-196oC). При изготовлении вакцины производят рассев расплодки в культуре куриных эмбриональных фибробластов. Для этого берут 3-7 ампул с вакцинным штаммом вируса, титр которого должен быть не менее 1 • 105 ФОЕ/см3. После извлечения из азота ампулы немедленно помещают в воду с температурой 35-37oC до полного оттаивания. После оттаивания содержимого ампул горлышки ампул тщательно обтирают спиртом, обжигают и отбивают запаянные концы стерильным корнцангом. Пипеткой аккуратно берут содержимое ампул, объединяют и разводят (или используют без разведения) питательной средой, содержащей смесь сред на основе ГЛА, Игла и 199, взятых в равном соотношении, из расчета, чтобы в каждом 1 см3 содержалось 10000 ФОЕ. Затем сливают из роллерных флаконов с 24-48-часовой культурой клеток ростовую среду и заменяют ее поддерживающей с 2% сыворотки КРС. В поддерживающую среду вносят вируссодержащую суспензию в количестве 100-150 ФОЕ/см3 площади флакона. Флаконы с зараженной культурой помещают в роллерную установку со скоростью вращения 8- 10 об/час в термальной комнате (термостате) при температуре 39-40oC на 3 суток. К моменту съема клеток типичные фокусные поражения на культуре клеток должны быть отчетливо видны под микроскопом.
Поддерживающую среду удаляют осторожно, не допуская смывания клеток со стекла, в сосуды вносят подогретый до 30-37oC 0,125-0,25% раствор трипсина из расчета 0,07-0,1 см3/см2 площади флакона. Монослой смачивают раствором трипсина 2-3 мин, затем раствор трипсина сливают, флаконы вращают со скоростью до 20 об/мин при комнатной температуре 5-7 мин, после чего в сосуды в тех же объемах вносят поддерживающую питательную среду без сыворотки. Энергичным покачиванием клетки отслаивают от стекла и суспендируют в среде, после чего проводят 2 пассаж. С этой целью инфицированными клетками, собранными с одного роллерного флакона, заражают свежий монослой из расчета 1: 5-1:10, т.е. 5-10 роллерных флаконов, и культивируют монослой до съема вируса и проведения 3 пассажа 48 часов. Сосуды с клеточными культурами, зараженными вирусом первого пассажа, помещают в роллерные установки в термальной комнате при 39-40oC. Характер специфического вирусного поражения монослоя, зараженного вирусом первого пассажа, несколько отличается от поражений, вызываемых вирусом второго пассажа. При культивировании вируса первого пассажа отмечают очаговое (фокусное) поражение монослоя. Вирус второго пассажа поражает гораздо большую часть клеток: в культуре клеток на 50-70% монослоя образуются симпласты и поликариоциты (крупные многоядерные клетки), которые легко можно увидеть под микроскопом. Сбор клеток, инфицированных вирусом второго пассажа, осуществляется методом, описанным для вируса первого пассажа. Клеточносвязанным вирусом второго пассажа заражают монослойные культуры клеток (3 пассаж вируса) из расчета 1:50-1:100 и затем их инкубируют 48-72 часа. По окончании периода инкубации в термальной комнате при 39-40oC проводят сбор инфицированных клеток. Для этого инфицированные монослои обрабатывают 0,125-0,25% раствором трипсина, т.е. так же, как и при съеме вируса первого и второго пассажей. После удаления трипсина во флаконы вносят поддерживающую среду с 20% сыворотки КРС и 10% диметилсульфоксида. Объем среды для сбора и суспендирования клеток составляет 0,02 -0,04 см3/см2 площади флакона. Собранные суспензии инфицированных клеток объединяют в общем объеме. Концентрация клеток в суспензии должна быть 5-10 млн/см3. Собранную суспензию инфицированных клеток разливают по 1-2 см3 в предварительно маркированные ампулы, которые закрывают стерильной ватой, запаивают в пламени газовой горелки и помещают в холодильник (2-4oC) на 40-60 мин. Затем ампулы выдерживают 40-60 мин при -40oC, после этого ампулы с вакциной немедленно погружают в жидкий азот.
Полученную таким образом вакцину контролируют на стерильность и инфекционную активность. Титр вируса в вакцине должен быть не ниже 1 • 105 ФОЕ/см3. По титру устанавливают количество иммунизирующих доз в 1 см3. За одну прививную дозу принимают 1000 ФОЕ. Срок годности вакцины при условии хранения ее в жидком азоте 12 месяцев. Вирусвакцина жидкая культуральная применяется с профилактической целью. Вакцинируют цыплят в первые часы после выборки из выводных шкафов непосредственно в инкубатории. Вакцину в дозе 1000 ФОЕ/0,2 см3 вводят цыплятам внутримышечно в верхнюю треть бедра.
Пример 3.
Сравнительная оценка эффективности вакцины из штамма "ВНИИЗЖ/N 110" и вакцины из штамма FC-126.
Изучение эффективности указанных вакцин проводили на суточных цыплятах. Для этого было сформировано 4 группы цыплят. Цыплят 1 группы в количестве 50 голов вакцинировали вакциной из штамма "ВНИИЗЖ/N 110" в дозе 1000 ФОЕ/0,2 см3. Цыплят 2 группы в количестве 50 голов вакцинировали вакциной из штамма-прототипа FC-126 в дозе 1000 ФОЕ/0,2 см3. Цыплят в 3 группе в количестве 51 головы заражали вирулентным штаммом "Конкур". Цыплят 4 группы в количестве 48 голов использовали в качестве контроля содержания опыта. Через 14 дней цыплят в 1 и 2 группах заражали вирулентным штаммом "Конкур". Результаты опыта приведены в таблице 3.
Приведенные в таблице 3 данные свидетельствуют о возможности изготовления вакцины против БМ из штамма "ВНИИЗЖ/N 110" для специфической профилактики БМ.
Таким образом, приведенная выше информация свидетельствует о выполнении при использовании предлагаемого изобретения следующей совокупности условий:
- штамм "ВНИИЗЖ/N 110" ВГИ, воплощающий предлагаемое изобретение, предназначен для использования в сельском хозяйстве, а именно в ветеринарной вирусологии и биотехнологии;
- для предлагаемого изобретения в том виде, как оно охарактеризовано в независимом пункте формулы изобретения, подтверждена возможность его осуществления с помощью описанных в заявке или известных до даты приоритета средств и методов;
- штамм "ВНИИЗЖ/N 110" ВГИ, полученный в соответствии с предлагаемым изобретением, обладает высокой иммуногенной активностью и пригоден для изготовления вакцины против БМ.
Следовательно, предлагаемое изобретение соответствует условию патентоспособности "промышленная применимость".
Источники информации, принятые во внимание при составлении описания
1. Борисович Ю.Ф., Кириллов Л.В. Ветеринарные препараты. Справочник /Под ред. Осидзе Д.Ф. - М: Колос, 1981, с. 140-144.
2. Сюрин В. Н. и др. Вирусные болезни животных. - М: ВНИТИБП, 1998, с. 689-721.
3. Патент России N 2059404, A 61 K 39/255, 10.05.96
4. Сюрин В. Н. и др. Вирусные болезни животных. - М: ВНИТИБП, 1998, c. 716-721 (прототип).
5. Witter R.L. et.al. Pathogenicity of variant Marek's disease virus isolatis in vaccinated chickens. Av. Dis., 1980, 24, 1, 210-230.
6. Коровин Р. Н., Зеленский В.М. Опухолевые болезни птиц. - М.: Колос, 1984, 223 с.
7. Патент России N 2059414, A 61 K 39/255, 10.05.96
8. Патент России N 2085583, A 61 K 39/255, 27.07.97
9. Коровин Р.Н., Лох B.A. и др. К диагностике острой формы болезни Марека. Тез. докл. 2 Всесоюзн. конф. молодых ученых по ветеринарии 14-17 дек. 1971 г. - M.: 1971, с. 90 и 91.
10. Слепенко Т.Е., Токарик Э.Ф. и др. Получение и титрование свободного от клеток вируса герпеса индеек. Тр. ВГНКИ, - 1975, 21, с. 9-54.
11. Слепенко Т.Е., Лукина B.A. и др. Размножение вакцинного вируса в организме цыплят, привитых вакциной против болезни Марека. Перед. научно-производ. опыт в биол. пром. - M.: 1980, с. 5.
12. Слепенко Т.Е., Лукина B.A. и др. Изучение репродукции вируса герпеса индеек в эпителии перьевых фолликулов вакцинированных цыплят. Тез. докл. Всесоюз. научи, конф. "Разработка, апробации и гос. контроль вет. препаратов". - М.: 1981, с. 31.
13. Лукина B.A., Коровин Р.Н. и др. Стабильность штаммов вируса герпеса индеек по некоторым показателям эффективности вакцины против болезни Марека. Перед, научн.- производ. опыт в биол. пром. - М.: 1987, 24 с.
14. Коровин Р.Н. Особенности эпизоотологии болезни Марека и организации мер борьбы с ней в птицеводческих хозяйствах промышленного типа. Автореф. дис на соис. уч. степ. д-ра вет. наук, - Л., 1989, 34 с.
15. Лукина B.A., Палома-Баррос Е.В. Определение активности иммуногенных сывороток крови кур к вирусам герпеса индеек и болезни Марека. Научн. основы производства вет. препаратов. - М.; 1989, с. 55-62.
16. Bulow V., Biggs P.M. Differentiation between strains of Marek's disease virus and turkey herpesvirus by immunofluorescene assays. Avian Pathol, 1975, 4, 133-146.
17. Witter R.L., Lee L.F. Poluvalent Marek's disease vaccines. Safety, efficacy and protective synergism in chickens with maternal antibodies. Av. Pathol, 1984, 13, 75-92.
18. Bulou V. Von cpizootologi of Marek's disease. Proc. 19 th World's Poulty Congr. Amsterdam, Netterlands, 1992, 286-292.
19. OIE. Manuel of Stand. for Diagnostic Test and Vaccines. Paris, 1996, 723 p.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВИРУСВАКЦИНА ПРОТИВ БОЛЕЗНИ МАРЕКА И СПОСОБ ЕЕ ИЗГОТОВЛЕНИЯ | 1999 |
|
RU2144378C1 |
| БИВАЛЕНТНАЯ ВАКЦИНА ПРОТИВ БОЛЕЗНИ МАРЕКА И СПОСОБ ЕЕ ИЗГОТОВЛЕНИЯ | 1999 |
|
RU2144377C1 |
| СУХАЯ ВИРУСВАКЦИНА ПРОТИВ БОЛЕЗНИ МАРЕКА И СПОСОБ ЕЕ ИЗГОТОВЛЕНИЯ | 1999 |
|
RU2144376C1 |
| ШТАММ № 3004/№ 109 ВИРУСА БОЛЕЗНИ МАРЕКА ДЛЯ ИЗГОТОВЛЕНИЯ ВАКЦИННЫХ ПРЕПАРАТОВ | 2001 |
|
RU2199583C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ВИРУСВАКЦИНЫ ПРОТИВ БОЛЕЗНИ МАРЕКА | 2001 |
|
RU2209635C2 |
| ВИРУСВАКЦИНА ПРОТИВ БОЛЕЗНИ МАРЕКА | 2001 |
|
RU2205660C2 |
| ПРОИЗВОДСТВЕННЫЙ ШТАММ "ВЛАДИМИР" ВИРУСА ГЕРПЕСА ИНДЕЕК ДЛЯ ИЗГОТОВЛЕНИЯ ВИРУСВАКЦИНЫ ПРОТИВ БОЛЕЗНИ МАРЕКА | 2007 |
|
RU2336303C1 |
| ВИРУСВАКЦИНА ПРОТИВ БОЛЕЗНИ МАРЕКА | 2009 |
|
RU2410117C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИВАЛЕНТНОЙ ВАКЦИНЫ ПРОТИВ БОЛЕЗНИ МАРЕКА | 2000 |
|
RU2203681C2 |
| СПОСОБ ИЗГОТОВЛЕНИЯ СУХОЙ ПОЛИВАЛЕНТНОЙ ВИРУСВАКЦИНЫ ДЛЯ ПРОФИЛАКТИКИ БОЛЕЗНИ МАРЕКА И СУХАЯ ПОЛИВАЛЕНТНАЯ ВИРУСВАКЦИНА ДЛЯ ПРОФИЛАКТИКИ БОЛЕЗНИ МАРЕКА | 2005 |
|
RU2327488C2 |


Изобретение предназначено для ветеринарной вирусологии и биотехнологии. Получен новый вакцинный штамм "ВНИИЗЖ/ 110-ДЕП" вируса герпеса индеек. Штамм обладает высокой иммуногенной активностью против вируса болезни Марека. Штамм депонирован в коллекции микроорганизмов ВГНКИ под номером "ВНИИЗЖ/ 110-ДЕП". Вакцина на основе указанного штамма используется для профилактики болезни Марека у цыплят суточного возраста. Изобретение повышает длительность и напряженность иммунитета у вакцинированной птицы. 1 ил., 3 табл.
Штамм вируса герпеса индеек сем.Herpesviridae, род Herpesvirus, серотип 3 (коллекция ВГНКИ "ВНИИЗЖ/ 110 - ДЕП") для изготовления вакцины против болезни Марека.
| ШТАММ ВИРУСА ГЕРПЕСА КУР КАК КОМПОНЕНТ ДЛЯ ИЗГОТОВЛЕНИЯ БИВАЛЕНТНОЙ ВАКЦИНЫ ПРОТИВ БОЛЕЗНИ МАРЕКА | 1995 |
|
RU2085583C1 |
| ШТАММ ВИРУСА ГЕРПЕСА КУР КАК КОМПОНЕНТ ДЛЯ ИЗГОТОВЛЕНИЯ БИВАЛЕНТНОЙ ВАКЦИНЫ ПРОТИВ БОЛЕЗНИ МАРЕКА | 1995 |
|
RU2085582C1 |
| RU 2059414 C, 10.05.96 | |||
| RU 2059404 C, 10.05.96 | |||
| US 5686287 A, 11.10.97. | |||
Авторы
Даты
2000-01-20—Публикация
1999-06-28—Подача