В настоящее время существуют разнообразные иммунологические методы изучения иммунного ответа. Наиболее перспективными являются биохемилюминесцентные методы, позволяющие непосредственно определять функциональные изменения активности клеток в процессе иммунных реакций, в отличие от классических, оценивающих лишь результаты иммунного взаимодействия. Один из хемилюминесцентных методов предложен Н.И. Якуба с соавторами с целью оценки специфичности антигенного взаимодействия на иммунокомпетентные клетки (Якуба Н.И., и др. Новое применение метода биохемилюминесценции для изучения специфического клеточного иммунитета. // Всесоюзное совещание по хемилюминесценции г. Юрмала, 11-13 мая 1990 г, Тезисы докладов, Рига-латв. Унив. - 1990 г, с. 69).
Способ заключается в введении в суспензию лейкоцитов частиц латекса, что приводит к усилению хемилюминесценции лейковзвеси за счет неспецифической активации фагоцитов, в то время как нагруженные антигеном частицы определяют специфичность взаимодействия с сенсибилизированными фагоцитами и в большей степени активируют фагоциты, что сопровождается более интенсивной вспышкой хемилюминесценции. Метод позволяет определить изменения рецепторного аппарата клеток, но сложность формирования комплексов латекс-антиген и изолированная оценка лишь фагоцитарного звена иммунного ответа ограничивают его использование в целях диагностики.
Еще одним способом изучения функциональной активности клеток является определение спонтанной и стимулированной иммунными комплексами хемилюминесценции полиморфно-ядерных лейкоцитов. (Клебанов Г.И., Корейкина М.В., Активация полиморфно-ядерных лейкоцитов крови больных ишемической болезнью сердца и инфарктом миокарда // Кислородные радикалы в химии, биологии и медицине. Сб. Рига - РМИ 1988 с. 132-152). Сформированные из лиофилизированного иммуноглобулина G человека и моноспецифических антител кролика против IgG человека, меченных ФИТЦ, иммунные комплексы специфически активируют фагоциты и изменяют кинетику хемилюминесцентного ответа, что улавливается прибором.
Недостатком данного метода является узкое назначение: определение фагоцитарной активности ПМД лишь по отношению к одному антигену.
В качестве прототипа был взят иммунохемилюминесцентный метод выявления специфического аллергена при антопической бронхиальной астме.
Способ основан на инкубации сыворотки больного и исследуемого аллергена в концентрации 5-10 PNV /мл, последующем добавлении указанной смеси к суспензии мононуклеарных клеток пациента и регистрации взаимодействия клеток с образовавшимися в сыворотке иммунными комплексами методом люминолзависимой хемилюминесценции.
Этапы выполнения способа включают:
- приготовление среды для измерения хемилюминесценции, содержащей 110 мМ NaCI, 20 мМ трис-НС (pH 7,6); 5 мМ глюкозы, 2,5, MgCl2; 0,65 мМ люминола,
- приготовление растворов исследуемых аллергенов путем разведения в 5% растворе глюкозы до концентрации 5-10 PNV/мл,
- выделение мононуклеарных клеток из венозной крови в одноступенчатом градиенте плотности фиколл-верографина (1,077 г/см3),
- приготовление иммунных комплексов путем инкубации сыворотки больного с раствором исследуемых аллергенов в соотношении 5:1,
- изменение спонтанной хемилюминесценции 50 мкл суспензии мононуклеарных клеток (2•106/мл) при введении ее в термостатируемую при 37oC измерительную кювету прибора, содержащую 800 мкл среды. После выхода кривой интенсивности свечения на плато в кювету добавляют 20 мкл смеси сыворотки больного с исследуемым аллергеном и определяют максимум интенсивности свечения активизированных мононуклеарных клеток.
Недостатками данного метода являются:
- неполная оценка иммунного ответа организма, неучитывающая заключительную эффекторную базу этого ответа, направленную на разрушение и элиминацию антигенного материала из организма по средствам фагоцитоза (В.П. Шабалин, Л. Д. Серова, 1988 г.).
Без оценки функциональной активности фагоцитов также невозможно определить патогенность иммунных комплексов, циркулирующих в организме, и их биологических аналогов сформированных in vitro, так как именно полиморфно-ядерные лейкоциты инактивируют соединения антиген-антитело, блокируя запуск цепи патологических реакций. Только в случае неполноценности фагоцитарного звена иммунные комплексы оказывают повреждающее воздействие на ткани организма, вызывая манифестацию процесса.
Наличие высокого содержания специфических антител в сыворотке и сенсибилизированных к определенному антигену лимфоцитов еще не дают права говорить об этиологическом значении данного антигена в развитии аллергической реакции, так как иммунные комплексы являются также продуктом нормаргической реакции организма на антиген и проявляют патогенность только при несвоевременной элиминации фагоцитами.
Наши исследования были направлены на создание модельной системы, позволяющей одновременно оценить напряженность гуморального иммунитета и завершенность иммунного ответа по уровню активации фагоцитов.
В процессе формирования иммунного ответа выделяют афферентную фазу (распознавание антигена и активации иммуннокомпетентных клеток, центральную фазу и эффекторную (Шабалин В. Н., Серова Л.Д., 1988 г), направленную на разрушение и элиминацию антигенного материала из организма. Реактивность организма определяются конечной фазой иммуннного ответа и зависит от выполнения полиморфно-ядерными лейкоцитами фагоцитарной функции.
Сформированные in vitro иммунные комплексы специфически активируют мононуклеарные клетки в процессе распознавания антигеном материала и в то же время являются специфическим объектом фагоцитоза для полиморфно-ядрных лейкоцитов. Специфичность антигенного воздействия, оценивается по кратности нарастания интенсивности хемилюминесцентного ответа суспензии лейкоцитов в сравнении со спонтанным уровнем хемилюминесценции клеток.
Этапы выполнения способа.
1. Подготовка среды для хемилюминесценции.
Реакционная смесь включает в себя 400 мкл фосфатного буфера (pH 7,6), 100 мкл MgSO4 (0,37 мМ), 200 мкл люминола (0,65 мМ). Буфер необходим для поддержания кислотно-основного состояния среды, изменения которой происходят в процессе активной жизнедеятельности клеток. Повышенное потребление глюкозы через гексозомонофосфатный шунт наблюдается у всех фагоцитов при активации фагоцитоза и связано с усиленным потреблением кислорода в системе НАДФН оксидазы.
Ионы Mg необходимы для усиления рецепторных способностей - фагоцитов. Люминол вводится для усиления естественных, фотохимических процессов, протекающих в живых клетках, но из-за низкой интенсивности трудноуловимых.
2. Приготовление лейковзвеси.
Лейковзвесь готовят из цельной гепаринизированной крови методом лизиса эритроцитов.
Для анализа 1 мл венозной крови вносят в пробирку, содержащую 100 мкл разведенного гепарина (1:12 физ.р-ра). Этого объема достаточно для проведения анализа с 5-7 разведениями аллергена.
В дальнейшем каждые 300 мкл крови гемолизируют 3 мл 0,083% MH4Cl раствора, начиная с экспозиции в 40 с и уменьшая ее до 20 с, 10 с и 1 с соответственно. Прекращение действия хлористого аммония добиваются введением в смесь 7 мл фосфатного буфера (pH 7,2) с последующей отмывкой клеток путем центрифугирования при 1 000 об/мин в течение 7 мин. Лизис проводят до полного визуального исчезновения эритроцитов.
Необходимую для исследования концентрацию клеток в суспензии 2•106 кл/мл доводят фосфатным буфером.
3. Формирование иммунных комплексов.
Получают сыворотку больного из 3 мл негепаринизированной венозной крови отстаиванием и последующим центрифугированием при 200 g в течение 10 мин.
Готовят растворы исследуемых антигенов путем разведения стандартных антигенов в 5% растворе глюкозы в различных соотношениях.
В лунки иммунологического планшета разливают по 100 мкл сыворотки больного, добавляют по 20 мкл раствора антигена и инкубируют в термостате при температуре 37oC в течение 30-40 мин. Это время необходимо, для образования в среде иммунных комплексов, при условии содержания в сыворотке специфических антител. Концентрация в сыворотке C3b фракции комплемента, выполняющей роль опсонина в иммунном агрегате, вполне достаточна для включения в иммунный комплекс.
4. Этап определения спонтанной и активированной хемилюминесценции суспензии клеток складывается из введения 50 мкл готовой лейковзвеси в термостатируемую кювету прибора, содержащую 800 мкл реакционной среды и последующем измерении хемилюминесценции клеток. После выхода кривой интенсивности свечения клеток на станционарный уровень вносят 20 мкл сыворотки из иммунологического планшета и определяют динамику изменения интенсивности свечения на протяжении 7-8 минут.
В качестве контроля измеряют хемилюминесценцию лейковзвеси с аутологической сывороткой без антигена и раствора антигена без сыворотки.
Определяя уровень спонтанной хемилюминесценции невозбужденных клеток оценивают суммарное значение интенсивности свечения за каждые 30 с, а не максимальное значение интенсивности за единицу времени, так как именно сумма является интегральным показателем, определяющим уровень функционирования клеток, и не зависит от случайно совпавших во времени выбросов в межклеточную среду возбужденных частиц.
Кинетика естественной хемилюминесценции клеток выражается в постепенном усилении интенсивности свечения и дальнейшем выходе на стационарный уровень.
Увеличение хемилюминесценции связано с протеканием в попавших в новые условия клетках адаптационных процессов, а выход интенсивности свечения на плато говорит о наступившем равновесии между утилизацией кислорода и выделением АФК в межклеточную среду.
Если в результате инкубации сыворотки с антигеном сформировались иммунные комплексы, являющиеся специфическими активаторами фагоцитоза, их введение в клеточную среду вызывает значительное и продолжительное во времени усиление ХЛ, фиксируемое прибором.
Использование различных концентраций антигена в условиях инкубации с сывороткой приводят к формированию нескольких классов иммунных комплексов.
При небольшом избытке концентрации антител над антигенами образуются крупнорешетчатые иммунные комплексы, в наибольшей степени активирующие фагоциты. Эквивалентные количества антител и антигенов образуют средних размеров, хорошо растворимые иммунные комплексы, в меньшей степени активизирующие фагоциты.
Минимальной возможностью активировать фагоциты обладают мелкодисперстные иммунные комплексы, которые образуются при взаимодействии избытка антигенов с низкими концентрациями антител и оказывают прямое токсическое действие на фагоциты.
В используемой модели по мере увеличения разведения антигена (то есть уменьшения его концентрации) у сенсибилизированных лиц ожидается проявление сначала мелкодисперсных, а затем крупнорешетчатых иммунных комплексов. Соответственно, интенсивность хемилюминесцентного ответа специфически активированных фагоцитов будет увеличиваться по мере снижения концентрации антигена.
Примеры конкретного выполнения способа.
Обследована группа рабочих биохимзавода в количестве 40 человек на степень сенсибилизации к антигену кормовых дрожжей-продуцентов.
Исходный раствор антигена содержал 0,33 г/л общего белка, что в пересчете на единицы белкового азота составляет 5.555 PNV в 1 мл.
Для анализа были приготовлены следующие разведения антигена в 5% растворе глюкозы 1:5.000, 1:50.000, 1:150.000, 1:300.000.
В зависимости от характера хемилюминестентного ответа пациенты были разбиты на группы:
1) с высокой степенью сенсибилизации и яркими клиническими проявлениями аллергического характера,
2) с высокой степенью сенсибилизации и развернутой картиной общесоматического заболевания (иммунные маски),
3) здоровые лица, контактирующие с кормовыми дрожжами,
4) группа доноров из числа лиц 18-25 лет, не имеющих по роду деятельности контакта с дрожжами.
При анализе графиков интенсивности свечения взвеси активированных фагоцитов обнаружено, что после введения в лейковзвесь сыворотки, инкубированной с аллергеном, интенсивность свечения быстро возрастает, а затем постепенно снижается. Подобная динамика хемилюминесцентного ответа прослеживается во всех случаях введения стимуляторов в клеточную среду.
Основной оценочной характеристикой специфичности реакции являются кратность прироста суммарной интенсивности свечения активированных клеток (К), которая определяется отношением уровня максимальной интенсивности хемилюминесцентного ответа гранулоцитов на введение иммунных комплексов (IАГ) к уровню спонтанной хемилюминесценции гранулоцитов в стандартных условиях (IСП)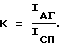
Кратность прироста различна при использовании разных концентраций антигена для формирования иммунных комплексов. Кривая, отражающая динамику хемилюминесцентного ответа гранулоцитов на концентрацию антигена 1:5.000 обозначается цифрой 1, 1:50.000 - цифрой 2, 1:100.000 - цифрой 3.
Анализ хемилюминесцентного ответа одного из доноров, не контактирующего с кормовыми дрожжами, продемонстрирован на фиг. 1. Кратность прироста интенсивности свечения клеток при разведении антигена 1:5.000 составила 1,57 раза, при разведении 1:50.000 - 1,23 раза, при разведении 1:1000.000 - 1,19 раза. Максимальный уровень интенсивности свечения наблюдался на 5 мин при концентрации антигена 1:5.000 и на третьей минуте при концентрациях 1:50.000 и 1:100.000, то есть наступал быстрее.
Концентрация антигена, взятого для анализа, и интенсивность свечения взаимосвязаны. Чем меньше разведения антигена, то есть чем выше его концентрация, тем сильнее и продолжительнее во времени реагируют на него клетки. Это может быть объяснено присутствием в инкубированной сыворотке у каждого пациента небольшого количества иммунных комплексов. Их образование связано с взаимодействием антигенных частиц (антигенов) и неспецифических антител, которые существуют в любой сыворотке и вступают в перекрестные реакции с антигеном. При увеличении разведения антигена количество образующихся иммунных комплексов снижается и, следовательно, меньшее количество фагоцитов активируется. Интенсивность хемилюминесцентного ответа уменьшается, максимум свечения достигается быстрее.
Таким образом, характер иммунного ответа говорит об отсутствии специфической сенсибилизации к кормовым дрожжам, а прирост хемилюминесцентного ответа обусловлен активацией фагоцитоза небольшим количеством иммунных комплексов, концентрация которых уменьшается по мере разведения антигена.
У всех обследованных рабочих с яркими клиническими проявлениями аллергии отмечается прирост хемилюминесценции клеток в ответ на введение инкубированной с антигеном сыворотки. Кратность прироста при отдельных разведениях антигена составляет 5-10 раз, причем увеличение, интенсивности свечения связано с уменьшением исходной концентрации антигена, у доноров увеличение интенсивности свечения не превышает 1,5-2,0 раз.
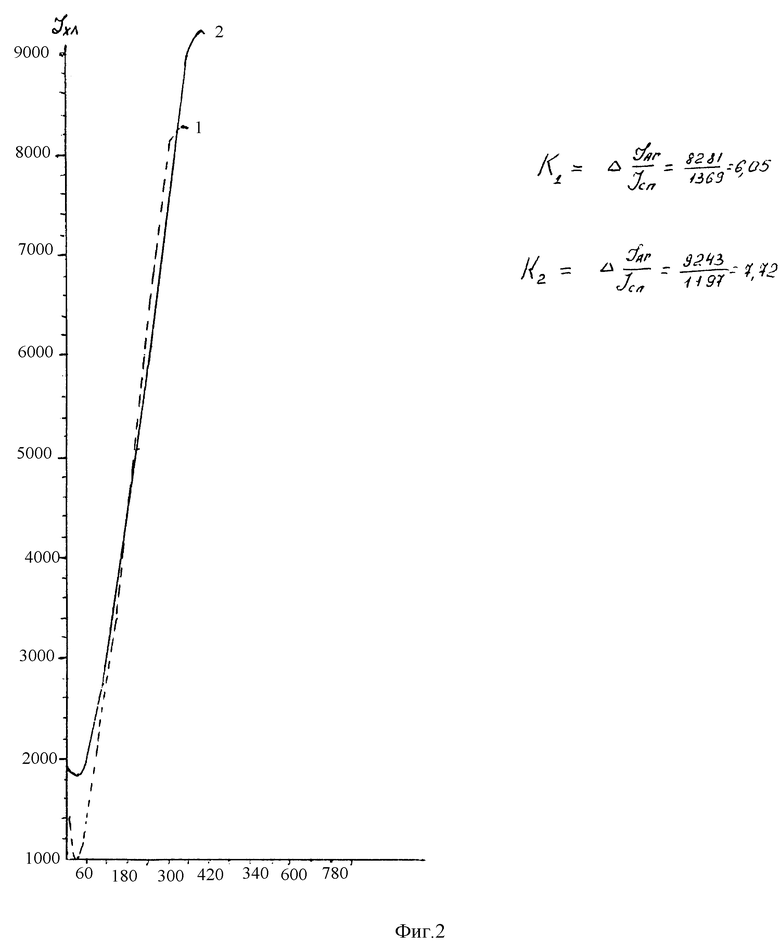
Анализ хемилюминесцентного ответа гранулоцитов больной с ярко выраженной аллергической симптоматикой показывает (фиг.2), что кратность прироста интенсивности свечения при разведении аллергена 1:50.000 выше, чем при разведении 1: 5.000 и составляет 7,72 и 6,05 раз, соответственно. Это достоверно выше, чем у доноров.
Скорость нарастания интенсивности свечения составляет 4-6 мин, что определяет достаточно высокую функциональную активность фагоцитов и косвенно свидетельствует о возможной реализации защитных механизмов при попадании в организм ксенобиотиков.
Заключение: характер иммунного ответа предполагает высокий уровень сенсибилизации к кормовым дрожжам и, следовательно, именно дрожжи могли стать причиной проявления аллергических заболеваний у данной больной.
Хемилюминесцентный ответ гранулоцитов рабочего, контактирующего породу профессиональной деятельности с низкими концентрациями кормовых дрожжей, не отмечающего жалоб на аллергические проявления, но страдающего хроническими воспалительными заболеваниями желудка, кишечника, анализируется следующим образом (фиг.3).
Характер иммунного ответа пациента отличается своеобразностью при разведении аллергена 1:5.000, прирост интенсивности хемилюминесценции составляет 1,43 раза (в пределах нормы), но при разведении 1:50.000 наблюдается резкий скачок интенсивности свечения в 6,9 раз. Следовательно, в сыворотке больного присутствуют специфические антитела, но иммунный ответ на данном этапе не реализуется в форме аллергической реакции, хотя такая возможность не исключается при снижении функциональной активности фагоцитов.
Заключение: сенсибилизация к кормовым дрожжам средней степени, при снижении резистентности организма возможно развитие аллергических реакций.
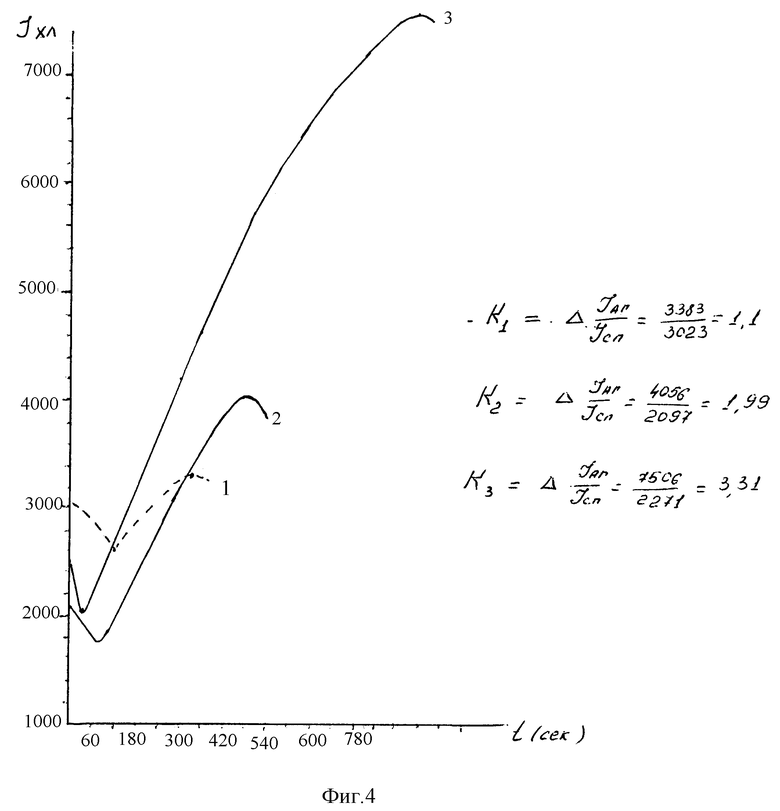
Пример оценки результата представлен третьей группой (фиг.4). Клинически здоровый рабочий, контактирующий на протяжении 12 лет с высокими концентрациями кормовых дрожжей, отвечал закономерным увеличением кратности прироста интенсивности свечения клеток на уменьшение концентрации антигена, при разведении 1:5.000 кратность прироста составила 1,1 раза, при разведении 1: 50.000 - 1,99 раза, при разведении 1:75.000 - 2,9 раза, при разведении 1: 100.000 - 3,1 раза.
Таким образом, динамика изменения интенсивности свечения говорит о наличии в сыворотке специфических антител к кормовым дрожжам, но в очень низкой степени.
Заключение: сенсибилизация к кормовым дрожжам в низкой степени, реактивность организма высокая, прогноз благоприятный.
Наиболее показательными при оценке сенсибилизации организма являются результирующие кривые на графиках зависимости кратности прироста хемилюминесцентного ответа гранулоцитов от исходной концентрации раствора антигена, используемой при формировании иммунных комплексов (фиг.5, фиг.6).
При наличии сенсибилизации организма кратность прироста хемилюминесцентного ответа гранулоцитов увеличивается по мере снижения концентрации антигена (разведения 1:5,000, 1:50.000, 1:100.000), и кривая идет вверх.
Причем уровень сенсибилизации определяется высотой расположения результирующей кривой, чем выше кривая, тем выраженнее степень сенсибилизации организма к антигену кормовых дрожжей.
У несенсибилизированных лиц (группа доноров) вход результирующей кривой противоположен, с уменьшением концентрации антигена снижается и уровень хемилюминесцентного ответа гранулоцитов.
Таким образом, предлагаемый способ отличается рядом преимуществ:
1) достигнуто увеличение чувствительности способа в 100 раз по сравнению с прототипом,
2) появилась возможность выявления ранних стадий специфической сенсибилизации организма за счет смены воспринимающего звена хемилюминесцентной реакции, в то время как сенсибилизированные после первой встречи с антигеном клоны мононуклеаров (лимфоциты) находятся в периферической крови в следовых количествах, содержание гранулоцитов, также определяющих специфичность взаимодействия с антигеном, всегда велико,
3) использование различных разведений антигена при формировании иммунных комплексов и анализ хемилюминесцентного ответа гранулоцитов позволяет косвенно судить о концентрации специфических антител в сыворотке, в малых разведениях исходного раствора антигена, при относительном избытке концентрации антигена над антителами образуются мелкодисперсные токсичные для клеток иммунные комплексы, а при недостатке антигена образуются крупнорешетчатые иммунные комплексы, в значительно большей степени активирующие гранулоциты и вызывающие многократное увеличение хемилюминесцентного ответа.
4) способ отличается высокой достоверностью результатов за счет исключения ложноположительных реакций ходом результирующей кривой зависимости кратности прироста хемилюминесцентного ответа гранулоцитов от концентрации антигена, у сенсибилизированых лиц при снижении концентрации антигена кратность хемилюминесцентного ответа гранулоцитов увеличивается, а у несенсибилизированных лиц - уменьшается.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ РАННЕЙ (ДОНОЗОЛОГИЧЕСКОЙ) ДИАГНОСТИКИ РАЗВИТИЯ СЕНСИБИЛИЗАЦИИ К АЛЛЕРГЕНАМ ВОЗДУХА РАБОЧЕЙ ЗОНЫ ПТИЦЕВОДЧЕСКОГО КОМПЛЕКСА | 2011 |
|
RU2470298C2 |
| СПОСОБ АЛЛЕРГОДИАГНОСТИКИ ПО ПОКАЗАТЕЛЯМ ХЕМИЛЮМИНЕСЦЕНТНОГО СВЕЧЕНИЯ НЕЙТРОФИЛОВ | 2004 |
|
RU2289138C2 |
| Способ определения иммунологической реактивности организма | 1988 |
|
SU1629848A1 |
| СПОСОБ ДИАГНОСТИКИ IN VITRO СПЕЦИФИЧЕСКОЙ СЕНСИБИЛИЗАЦИИ ОРГАНИЗМА К БАКТЕРИАЛЬНЫМ АЛЛЕРГЕНАМ | 2014 |
|
RU2587327C2 |
| Способ определения специфического аллергена при атопической бронхиальной астме | 1985 |
|
SU1335878A1 |
| Способ определения сенсибилизации организма бактериальными аллергенами | 1988 |
|
SU1532875A1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ РАННЕГО СКРЫТОГО СИФИЛИСА И ЛОЖНОПОЛОЖИТЕЛЬНЫХ СЕРОЛОГИЧЕСКИХ РЕАКЦИЙ КРОВИ НА СИФИЛИС | 1998 |
|
RU2157539C2 |
| СПОСОБ ПРИЖИЗНЕННОЙ ДИАГНОСТИКИ ТУБЕРКУЛЕЗА | 2004 |
|
RU2296334C2 |
| СПОСОБ ДИАГНОСТИКИ СИФИЛИСА | 1994 |
|
RU2084894C1 |
| СПОСОБ ВЫЯВЛЕНИЯ IN VITRO НЕПЕРЕНОСИМОСТИ ПИЩЕВЫХ АНТИГЕНОВ | 2001 |
|
RU2206092C2 |



Способ может быть использован в медицине, а именно в иммунологии. Готовят лейковзвеси из крови больного, формируют иммунные комплексы путем инкубации сыворотки крови больного с антигеном кормовых дрожжей убывающей концентрации с последующей регистрацией хемилюминесцентного ответа гранулоцитов при контакте их со специфическими иммунными комплексами, а наличие сенсибилизации организма определяют ходом результирующей кривой зависимости кратности прироста хемилюминесцентного ответа гранулоцитов от концентрации антигена и при снижении кратности прироста хемилюминесцентного ответа гранулоцитов констатируют отсутвие сенсибилизации организма, при снижении концентрации антигена и увеличении кратности прироста хемилюминесцентного ответа гранулоцитов относительно исходного уровня диагностируют сенсибилизацию организма, а чем выше кратность прироста хемилюминесценции, тем выраженнее степень сенсибилизации. Способ высокочувствителен и точен. 6 ил.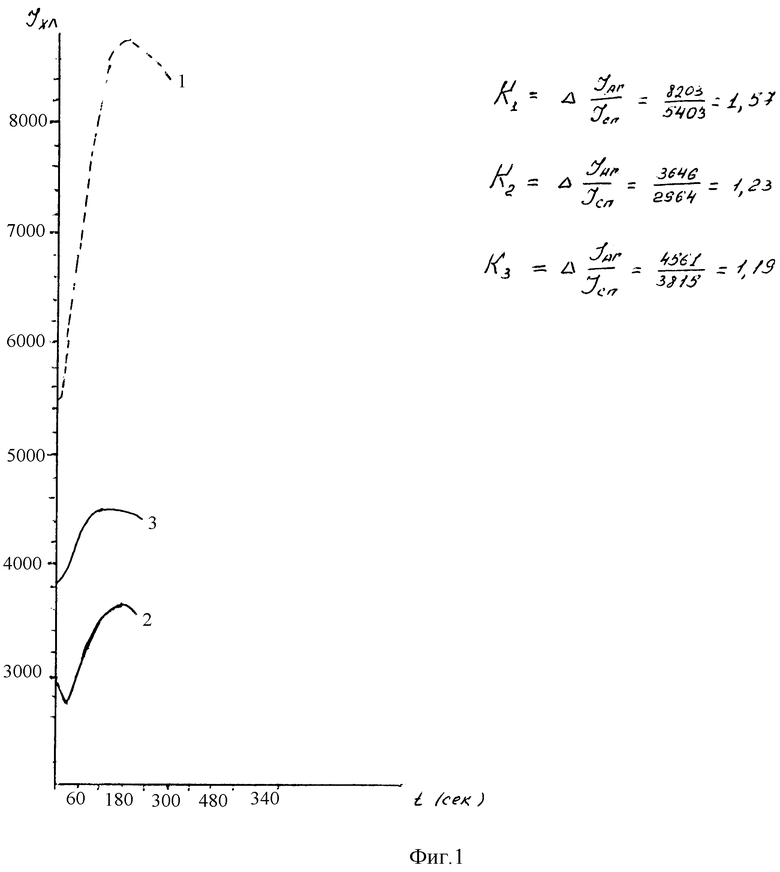
Способ диагностики специфической сенсибилизации промышленным аллергеном организма рабочих гидролизно-дрожжевого производства, включающий приготовление лейковзвеси из крови больного, формирование иммунных комплексов путем инкубации сыворотки крови больного с антигеном с последующей регистрацией хемилюминесцентного ответа гранулоцитов при контакте их по специфическими иммунными комплексами, отличающийся тем, что формирование иммунных комплексов проводят путем использования убывающей концентрации антигена кормовых дрожжей, а наличие сенсибилизации организма определяют ходом результирующей кривой зависимости кратности прироста хемилюминесцентного ответа гранулоцитов от концентрации антигена и при снижении кратности прироста хемилюминесцентного ответа гранулоцитов констатируют отсутствие сенсибилизации организма, при снижении концентрации антигена и увеличении кратности прироста хемилюминесцентного ответа гранулоцитов относительно исходного уровня диагностируют сенсибилизацию организма, а чем выше кратность прироста хемилюминесценции, тем выраженнее степень сенсибилизации.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Якуба Н.И | |||
| и др | |||
| Новое применение метода хемилюминесценции для изучения специфического клеточного иммунитета | |||
| III Всесоюзное совещание по хемилюминесценции г.Юрмала | |||
| - Рига: Латвийский университет, 1990, с.69 | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Клебанов Г.И | |||
| и др | |||
| Активация полиморфно-ядерных лейкоцитов крови больных ишемической болезнью сердца и инфарктом миокарда | |||
| Кислородные радикалы в химии, биологии и медицине | |||
| Рига, 1988, с.132-152 | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Фрадкин В.А | |||
| Диагностика аллергии реакциями нейтрофилов крови | |||
| - М.: Медицина, 1985, с.119-132. | |||
Авторы
Даты
2000-02-27—Публикация
1994-06-29—Подача