Изобретение относится к области медицины и пригодно для лечения ревматизма, ревматических воспалительных заболеваний, болезни Адисона, острой недостаточности коры надпочечников, бронхиальной астмы, острых и хронических аллергических заболеваний, гепатита, печеночной комы, гипогликемических состояний, заболеваний почек, системы кроветворения, кожных и глазных заболеваний, системных заболеваний соединительной ткани.
Среди средств, регулирующих метаболические процессы, заметное место занимает преднизолон или прегнадиен-1,4-триол-11β, 17α, 21-дион-3,20 [Машковский М.Д. Лекарственные средства, т. 1, изд. 12-е, М., 1993, с.670]. Соединение является синтетическим аналогом природного глюкокортикостероида - гидрокортизона и оказывает выраженное противовоспалительное и противоаллергическое действие, обладает противошоковой и иммунодепрессивной активностью, влияет на различные виды обмена: повышает уровень глюкозы в крови, оказывает катаболическое действие, способствует перераспределению жировой ткани, вызывает задержку ионов натрия и воды в организме, повышает артериальное давление, снижает возможность образования рубцовой ткани.
Преднизолон, как и большинство субстанций лекарственных средств, не обладает способностью к прямому таблетированию. Поэтому для создания стабильной в течение достаточно долгого времени, удовлетворяющей фармакопейным требованиям лекарственной формы необходимо применять вспомогательные вещества в количествах, определяемых фармацевтической и терапевтической целесообразностью.
Известны различные лекарственные формы, содержащие преднизолон - мази, гели, аэрозоли, таблетки, растворы для внутривенного введения и другие.
В патенте РФ N 2093185, заявлен 11.05.94, описана мазь, содержащая в качестве действующего вещества преднизолон. В патенте США N 3711602, 1973, описаны препараты преднизолона для местного применения в виде примочек, мазей, суппозиториев.
В патенте Великобритании N 862376, 1961, описана фармацевтическая композиция, наиболее близкая по составу к предлагаемой, которая содержит преднизолон и вспомогательные вещества, мас.%:
Преднизолон - 5,7
Гидроксид алюминия (сухой) - 5,7
Дифосфат кальция - 52,6
Сахароза - 17,2
Эмульгирующий агент - 5,7
Стеариновая кислота - 11,4
Стеариновокислый кальций - 1,7
Для получения таблеток указанного состава смешивают преднизолон, дикальцийфосфат, гель гидроксида алюминия, стеариновую кислоту и эмульгирующий агент (бычья желчь), смесь увлажняют сахарным сиропом, влажную пасту гранулируют и сушат при 60oC. Сухой материал пропускают через сетку 20 меш (диаметр отверстий 0,84 мм), опудривают стеаратом кальция и таблетируют.
Однако введение в состав гидроокиси алюминия существенно увеличивает время высвобождения активного ингредиента. Кроме того, суммарное содержание стеариновой кислоты и ее соли (13,1% от общей массы таблетки) многократно превышает предел, допустимый ГФ XI - не более 1%.
Задачей данного изобретения является создание твердой лекарственной формы препарата для регуляции метаболических процессов, удовлетворяющей всем требованиям на фармацевтическое средство и устойчивой в течение достаточно длительного времени (не менее 2-х лет), а также простого и одновременно технологичного способа ее получения, позволяющего получать качественный продукт.
Поставленная цель достигается тем, что фармацевтическая композиция, регулирующая метаболические процессы, содержит в качестве действующего вещества терапевтически эффективное количество преднизолона и в качестве вспомогательных веществ - глюкозу или сахарозу, крахмал, стеариновую кислоту и/или ее соль в следующем соотношении, мас.ч.:
Глюкоза или сахароза - 1,0
Крахмал - 1,12-1,77
Стеариновая кислота и/или ее соль - 0,003-0,03,
при этом массовое соотношение преднизолона и глюкозы или сахарозы составляет 1: 6,8-72,0 соответственно.
Заявляемое соотношение ингредиентов является оптимальным, найдено экспериментально и обеспечивает необходимое качество композиции, ее соответствие требованиям ГФ XI и срок годности более 2 лет.
Введение в состав глюкозы или сахарозы в указанной пропорции к активному ингредиенту существенно повышает стабильность лекарственной формы в ходе хранения, что позволяет достичь приемлемого срока годности нового состава (свыше 2 лет). Совместное применение в качестве вспомогательных веществ глюкозы или сахарозы, крахмала, стеариновой кислоты и/или ее соли в заявляемых долях обеспечивает при удовлетворительной прочности быстрое высвобождение преднизолона из лекарственной формы (см. чертеж, где показана кривая растворения таблеток преднизолона, пример 1).
Несоблюдение найденных соотношений ингредиентов не позволяет получить необходимое качество и стабильность композиции при хранении.
Предлагаемая фармацевтическая композиция выполняется в виде твердой лекарственной формы, предпочтительно в форме таблеток, что позволяет обеспечить максимальную технологичность последующей фасовки и точность дозирования действующего вещества. Содержание активного ингредиента в единичной дозе определяется терапевтической целесообразностью и высшей разовой дозой преднизолона (15 мг) и может составлять от 0,5 до 15 мг. Однако эти пределы не являются строго лимитированными.
Способ получения заявляемой фармацевтической композиции включает смешивание преднизолона, крахмала и глюкозы или сахарозы и увлажнение полученной смеси с последующим влажным гранулированием, сушкой, сухим гранулированием и опудриванием гранул. Для придания композиции формы таблетки полученный после опудривания состав прессуют на таблеточной машине. Использование при получении гранулята в качестве целевых добавок к активному ингредиенту смеси крахмала и глюкозы или сахарозы обеспечивает хорошую адгезию преднизолона и вспомогательных веществ, что способствует существенному повышению прочности таблетки. Кроме того, это позволяет использовать в качестве гранулирующей жидкости воду без добавления связующих веществ, что значительно упрощает технологический процесс. Опудривание гранулята смесью крахмала и стеариновой кислоты и/или ее соли в массовом соотношении 1: (0,01-0,09) приводит к повышению адгезии между гранулятом и опудривающей смесью, что способствует дальнейшему повышению прочности таблеток. Количество вводимого на стадии опудривания крахмала составляет 10,5-19,0% от общей массы крахмала, содержащегося в лекарственной форме. Изменение этого соотношения ухудшает текучие свойства гранулята и затрудняет нормальное проведение процесса таблетирования.
Сушку влажных гранул проводят при температуре 30-45oC. Повышение температуры сушки сверх указанного интервала очень сильно ухудшает внешний вид конечной лекарственной формы, а снижение многократно увеличивает время проведения данной операции. Оптимальная остаточная влажность гранул после сушки составляет 2-4%. Более высокое влагосодержание вызывает слипание гранул, тем самым затрудняя проведение опудривания и таблетирования, а при уменьшении влажности возрастает отбраковка таблеток (сколы, расслоение).
Полученный фармацевтический состав соответствует требованиям ГФ XI (по внешнему виду, распадаемости, растворению, однородности дозирования и другим показателям), стабилен при хранении и имеет срок годности более 2 лет.
Изобретение иллюстрируется следующими примерами (см. таблицу).
Пример 1. Смесь просеянных порошков преднизолона (10,0 г), сухого картофельного крахмала (244,5 г) и сахарозы (200,0 г) увлажняют 100 г дистиллированной воды, перемешивают до равномерного распределения влаги, гранулируют на установке для получения гранулята через сетку с диаметром отверстий 2,5 мм и сушат до остаточной влажности 2-4%. Сухое гранулирование проводят на установке для получения гранулята из сухих смесей через сетку с диаметром отверстий 2 мм. Измельченный гранулят опудривают смесью 43,5 г картофельного крахмала и 1,49 г стеариновой кислоты и таблетируют. Получают 485 г таблеток со средней массой 0,25 г, которые удовлетворяют требованиям на фармацевтическое средство.
Массовое соотношение преднизолон: сахароза составляет 1: 20.
Пример 2. Смешивают просеянные порошки преднизолона (25,0 г), глюкозы (170,0 г) и крахмала (242,6 г). Последующие операции выполняют аналогично примеру 1, с тем отличием, что в качестве опудривающего агента используют смесь 56,9 г крахмала, 3,5 г стеариновой кислоты и 1,44 г стеарата кальция. Полученные таблетки (484,5 г) удовлетворяют требованиям на фармацевтическое средство.
Массовое соотношение преднизолон: глюкоза составляет 1:6,8.
Пример 3. Аналогично примеру 1 получают таблетки из 1,25 г преднизолона. Общий расход остальных ингредиентов: сахарозы - 90 г, крахмала - 158,3 г, из них 24,0 г загружают в смеси со стеариновой кислотой на стадии опудривания, стеариновой кислоты - 0,25 г. Выход таблеток, удовлетворяющих требованиям на фармацевтическое средство, составляет 242,0 г.
Массовое соотношение преднизолон: сахароза составляет 1:72.
Пример 4. Аналогично примеру 1 получают таблетки из 5,0 г преднизолона, 115 г глюкозы, 128,55 г крахмала (из них 13,55 г на опудривание) и 1,22 г стеарата кальция. Выход составляет 242,5 г. Таблетки удовлетворяют требованиям на фармацевтическое средство.
Массовое соотношение преднизолона и глюкозы составляет 1:23 соответственно.
Пример 5 выполняют аналогично примеру 4, с тем отличием, что вместо глюкозы используют сахарозу, а вместо стеарата кальция стеарат магния.

Изобретение может быть использовано в медицине для лечения ревматизма, ревматических воспалительных заболеваний, болезни Адисона, острой недостаточности коры надпочечников и др. Фармацевтическая композиция содержит эффективное количество преднизолона и фармацевтически приемлемые вспомогательные вещества: глюкозу или сахарозу, крахмал, стеариновую кислоту и/или ее соль. Массовое соотношение этих вспомогательных веществ соответственно 1 : 1,12 - 1,77 : 0,003 - 0,03. Массовое соотношение преднизолон : глюкоза или сахароза равно 1 : 6,8 - 72,0. Композиция может быть в форме таблетки. Способ получения композиции включает смешивание преднизолона со вспомогательными компонентами, увлажнение смеси, влажное гранулирование, сушку, сухое гранулирование, опудривание гранул и их формование. Опудривание гранул осуществляют смесью крахмала, стеариновой кислоты и/или ее соли при массовом соотношении компонентов этой смеси 1 : (0,01 - 0,09). Количество крахмала для опудривания равно 10,5 - 19,0% от его содержания в композиции. Композиция устойчива в течение не менее 2 лет. Ее состав обеспечивает быстрое высвобождение преднизолона из лекарственной формы. 2 с. и 2 з.п. ф-лы, 1 ил., 1 табл.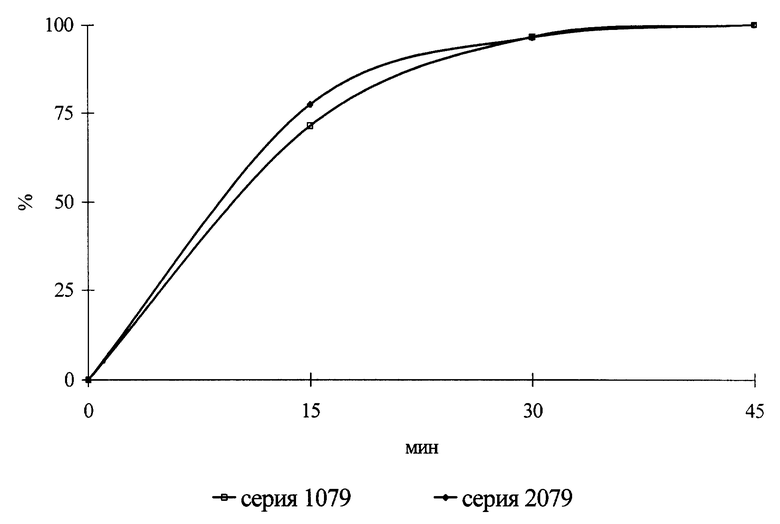
| Приемник дискретной информации для симплексных каналов связи | 1980 |
|
SU862376A1 |
| КОМПОЗИЦИИ С ЗАМЕДЛЕННЫМ (ПРОЛОНГИРОВАННЫМ) ВЫСВОБОЖДЕНИЕМ | 1990 |
|
RU2093148C1 |
| Козловой кран | 1980 |
|
SU874586A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ПРОТЕОЛИТИЧЕСКОЙ АКТИВНОСТИ В ВЕРХНИХ ОТДЕЛАХ ПИЩЕВАРИТЕЛЬНОГО ТРАКТА ПОСРЕДСТВОМ СУБСТРАТНОЙ ЦЕПОЧКИ | 1995 |
|
RU2123695C1 |
| GB 1458675 A, 15.12.1976 | |||
| Водовыпуск из подземного трубопровода | 1987 |
|
SU1588837A1 |
Авторы
Даты
2000-07-27—Публикация
1999-12-14—Подача