Настоящее изобретение относится к высокомолекулярным протеинам нетипируемых haemophilus.
Предпосылки создания изобретения
Нетипируемые Haemophilus influenzae представляют собой некапсулированные микроорганизмы, которые характеризуются отсутствием у них реактивности с антисыворотками против известных капсулированных антигенов H. influenzae.
Эти микроорганизмы обычно обитают в верхних дыхательных путях человека и зачастую являются ответственными за инфекционные заболевания, такие как отит среднего уха, синусит, конъюнктивит, бронхит и пневмония. Так как эти организмы не имеют полисахаридной капсулы, на них не действуют существующие вакцины Haemophilus influenzae типа b /Hib/, которые направлены на Hib - бактериальные капсульные полисахариды. Однако, нетипируемые штаммы продуцируют поверхностные антигены, которые могут индуцировать убивающие бактерии антитела. Два из основных протеинов внешних мембран - P2 и P6 - идентифицированы в качестве мишеней бактерицидной активности сыворотки человека. Однако, показано, что последовательность протеина P2 является переменной, в частности, в штаммах нетипируемых Haemophilus. Таким образом, вакцина на основе P2 не будет защищать от всех штаммов организма.
Предварительно Barenkamp et al. /Pediatr. Infect. Des. J., 9:333-339, 1990/ идентифицирована группа высокомолекулярных /HMW/ протеинов, которые, как оказалось, являются главными мишенями антител, присутствующих в рекомвалесцентной сыворотке человека. Проверка серии выделений из среднего уха показала присутствие одного или двух таких протеинов в большинстве штаммов. Однако, на момент подачи настоящего изобретения, структуры этих белков были неизвестны, так же, как и чистые изоляты таких протеинов.
Краткое изложение сущности изобретения
Авторы изобретения, направив свои усилия на дальнейшую характеризацию высокомолекулярных /HMW/ протеинов Haemophilus, клонировали, экспрессировали и секвенировали гены, кодирующие два иммунодоминантных HMW протеина /обозначаемые HMW1 и HMW2/ из штамма прототипа нетипируемых Haemophilus, и клонировали, экспрессировали и почти полностью секвенировали гены, кодирующие два дополнительных иммунодоминантных HMW протеина /обозначаемых HMW3 и HMW4/ из другого штамма нетипируемых Haemophilus.
Следовательно, в соответствии с одной особенностью изобретения, предлагается изолированный и очищенный ген, кодирующий высокомолекулярный протеин штамма нетипируемых Haemophilus, в частности, ген, кодирующий протеин HMW1, HMW2, HMW3 или HMW4, а также любой вариант или фрагмент такого протеина, который сохраняет иммунологическую способность защищать от заболевания, вызываемого штаммом нетипируемых Haemophilus. В соответствии с другой особенностью, изобретение предлагает высокомолекулярный протеин нетипируемых Haemophilus influenzae, который кодируется этими генами.
Краткое описание чертежей
Фиг. 1 A-G представляет собой ДНК-последовательность гена, кодирующего протеин HMW1 /SEQIDNO:1/;
фиг. 2 A-B представляет собой выведенную аминокислотную последовательность белка HMW1 /SEQIDNO:2/;
фиг. 3 A-G представляет собой ДНК-последовательность гена, кодирующего протеин HMW2 /SEQIDNO:3/;
фиг. 4 A-B представляет собой выведенную аминокислотную последовательность HMW2 /SEQIDNO:4/;
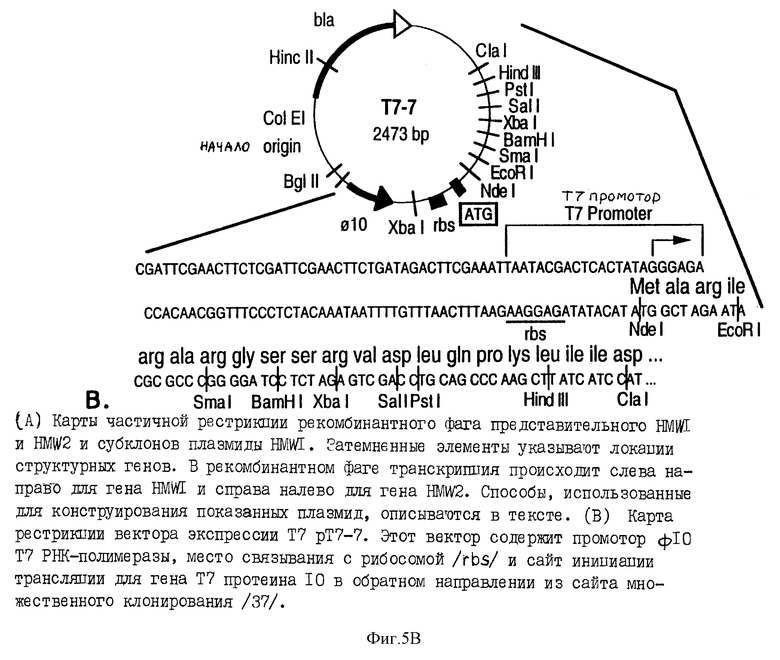
фиг. 5A представляет рестрикционные карты характерных рекомбинантных фагов, которые содержат структурные гены HMW1 и HMW2, причем месторасположение структурных генов указывается темными полосами;
фиг. 5B показывает рестрикционную карту T7 вектора экспрессии pT7-7;
фиг. 6 A-L содержит ДНК-последовательность генного кластера для гена hmwI /SEQIDNO: 5/, включающего нуклеотиды с 351 по 4958 /OPFa/ /как на фиг. 1/, а также двух следующих за ним дополнительных генов в 3'-фланкирующем районе, включающем ORFsb нуклеотиды 5114-6748, и с - нуклеотиды 7062-9011;
фиг. 7 A-L содержит ДНК-последовательность генного кластера для гена hmw2 /SEQIDNO:6/, включая нуклеотиды с 792 по 5222 /ORFa/ /как на фиг. 3/, а также двух следующих за ним дополнительных генов в 3'-фланкирующем районе, включающем ORFsb, нуклеотиды 5375-7009, и с - нуклеотиды 7249-9198;
фиг. 9 A-F представляет частичную /неполную/ ДНК- последовательность гена, кодирующего протеин HMW3 /SEQIDNO:7/;
фиг. 9 A-F представляет неполную ДНК-последовательность гена, кодирующего протеин HMW4 /SEQIDNO:8/; и
фиг. 10 A-L представляет собой таблицу сравнения выведенной аминокислотной последовательности протеинов HMW1, HMW2, HMW3 и HMW 4.
Подробное описание изобретения
Показано, что ДНК-последовательности генов, кодирующих HMW1 и HMW2, представленные на фиг. 1 и фиг. 3 соответственно, являются идентичными примерно на 80%, причем идентичны первые 1259 пар оснований. Полученные аминокислотные последовательности двух HMW протеинов, показанные на фиг. 2 и фиг. 4 соответственно, являются идентичными примерно на 70%. Более того, кодированные протеины являются антигенно родственными гемагглютинину филаментов Bordetella pertussis. Найдено, что моноклональное антитело, полученное против гемагглютинина филаментов /FHA/ Bordetella pertussis, распознает оба высокомолекулярных протеина. Эти данные наводят на мысль, что HMW и FHA протеины могут выполнять подобные биологические функции. Полученные аминокислотные последовательности протеинов HMW1 и HMW2 показывают, что они имеют сходство с последовательностью протеина FHA. Кроме того, показано, что эти антигенно родственные протеины получают, главным образом, из нетипируемых штаммов Haemophilus. Антисыворотка, найденная против протеина, экспрессированного геном HMW1, распознает как протеин HMW2, так и FHA B pertussis. Настоящее изобретение включает выделенный и очищенный высокомолекулярный протеин нетипируемых Haemophilus, который антигенно связан с FHA B. pertussis, который может быть получен из природных источников или продуцирован рекомбинантно.
Фаговую геномную библиотеку известного штамма нетипируемых Haemophilus получают стандартными способами, и библиотеку скринируют для клонов, экспрессирующих высокомолекулярные протеины, используя антисыворотку против HMW с высоким титром. Ряд сильно реактивных клонов ДНК очищают в колонии /plaque-purified/ и субклонируют в плазмиду экспрессии T7. Обнаружено, что все они экспрессируют либо один, либо другой из двух высокомолекулярных протеинов, обозначенных HMW1 и HMW2, со средней молекулярной массой 125 и 120 кда /килодальтон/, соответственно, кодированные открытыми рамками считывания с 4,6 кв и 4,4 кв, соответственно.
Затем характеризуют репрезентативные клоны, экспрессирующие либо HMW1, либо HMW2, и выделяют, очищают и секвенируют гены. ДНК-последовательность HMW1 показана на фиг. 1, а соответствующая выведенная аминокислотная последовательность - на фиг. 2. Подобным образом, ДНК-последовательность HMW2 показана на фиг. 3, и соответствующая выведенная аминокислотная последовательность - на фиг. 4. Частичная очистка выделенных протеинов и анализ N-концевой последовательности указывают, что экспрессированные протеины являются усеченными, так как их последовательность начинается с остатка номер 442 генных продуктов полной длины как для HMW1, так и для HMW2.
Исследования субклонирования, касающиеся генов hmwI и hmw2, показывают, что правильный процессинг HMW протеинов требует продуктов дополнительных следующих за ними генов. Обнаружено, что как ген hmwI, так и ген hmw2 фланкированы двумя дополнительными, следующими за ним открытыми рамками считывания /ORFS/, обозначенными b и c, соответственно /см. фиг. 6 и 7/.
ORF b имеют длину 1635 bp /пар оснований/, простираясь от нуклеотида 5114 до 6748 в случае hmwI, и от нуклеотида 5375 до нуклеотида 7009 в случае hmw2, с 99% идентичностью с выведенными аминокислотными последовательностями. Выведенные аминокислотные последовательности демонстрируют сходство с выведенными аминокислотными последовательностями двух генов, которые кодируют протеины, требуемые для секреции и активации гемолизинов P.mirabilis и S. marcescens.
OPFs имеют длину 1950 bp, простираясь от нуклеотида 7062 до нуклеотида 9011 в случае hmwI, и от нуклеотида 7249 до нуклеотида 9198 в случае hmw2, с 96% идентичностью с выведенными аминокислотными последовательностями. ORF hmwI c предшествует ряду прямых тандемных повторов 9bp. В плазмидных субклонах прерывание ORF hmwI, b или c приводит в результате к неполному процессингу и секреции структурного гена hmwI.
Выделены и очищены два высокомолекулярных протеина, и показано, что они частично предохраняют от отита среднего уха - на шиншиллах, и функционируют как адгезины. Эти результаты показывают возможность применения таких высокомолекулярных протеинов и структурно-близких протеинов других нетипируемых штаммов Haemophilus influenzae в качестве компонентов вакцин против нетипируемых Haemophilus influenzae.
Так как предлагаемые здесь протеины являются хорошими перекрестно-реактивными антигенами и присутствуют в большинстве штаммов нетипируемых Haemophilus, очевидно, что такие HMW протеины могут стать существенными составными частями универсальной вакцины против Haemophilus. Действительно, эти протеины могут быть использованы не только в качестве защитных антигенов против отита, синусита и бронхита, вызываемых штаммами нетипируемых Haemophilus, но также могут быть использованы в качестве носителей для защитных Hib полисахаридов в конъюгированной вакцине против менингита. Протеины также могут быть использованы в качестве носителей для других антигенов, гаптенов и полисахаридов других организмов, с тем, чтобы индуцировать иммунитет к таким антигенам, гаптенам и полисахаридам.
Нуклеотидные последовательности, кодирующие два высокомолекулярных протеина различных штаммов нетипируемых Haemophilus /обозначенные HMW3 и HMW4/, разъяснены в значительной степени и представлены на фиг. 8 и фиг. 9. HMW3 имеет молекулярную массу 125 кда, в то время как HMW4 имеет молекулярную массу 123 кда. Эти высокомолекулярные протеины являются антигенно родственными протеинам HMW1 и HMW2 и FHA. Анализ последовательности HMW3 выполнен приблизительно на 85% и на 95% - для HMW4, с короткими фрагментами на 5' - концах каждого гена, которые должны быть секвенированы.
Фиг. 10 содержит сравнение выведенных аминокислотных последовательностей четырех идентифицированных здесь высокомолекулярных протеинов. Как можно видеть при таком сравнении, можно обнаружить участки с идентичной пептидной последовательностью, причем HMW3 больше походит на HMW1, и HMW4 больше походит на HMW2. Эта информация весьма наводит на мысль о значительной гомологии первичных структур сравниваемых высокомолекулярных протеинов различных штаммов нетипируемых Haemophilus.
Кроме того, сконструированы мутанты штаммов нетипируемых H.influenzae, которые являются дефицитными по экспрессии HMW1 или HMW2, или того и другого, и проверены на способность прилипать к выращенным эпителиальным клеткам человека. Кластеры генов hmwI hmw2 экспрессированы в E.coli и проверены на их прилипание in vitro. Результаты такого экспериментирования демонстрируют, что как HMW1, так и HMW2 являются посредниками при прикреплении и, следовательно, являются адгезинами, и что эта функция существует даже в отсутствие других поверхностных структур H.influenzae.
Вместе с выделением и очисткой высокомолекулярных протеинов авторы изобретения могут определить главные защитные эпитопы путем обычного эпитопного картирования и синтезировать соответствующие этим детерминантам пептиды, которые вводят в полностью искусственные или рекомбинантные вакцины. Соответственно, изобретение также включает синтетический пептид, имеющий аминокислотную последовательность, соответствующую по крайней мере одному защитному эпитопу высокомолекулярного протеина нетипируемых Haemophilus influenzae. Такие пептиды имеют различную длину и составляют части высокомолекулярных протеинов, которые могут быть использованы, либо непосредственно, либо как составная часть конъюгата, для индуцирования иммунитета к родственным организмам и, таким образом, для составления вакцин для защиты от соответствующих заболеваний.
Настоящее изобретение также предлагает любой вариант или фрагмент протеинов, которые сохраняют возможную иммунологическую способность защищать от заболевания, вызываемого штаммами нетипируемых Haemophilus. Варианты могут быть сконструированы путем частичных делеций или мутаций генов и экспрессией образующихся в результате модифицированных генов, чтобы получить разновидности протеинов.
Примеры.
Пример 1
Выделяют штаммы 5 и 12 нетипируемых H. influenzae в виде чистой культуры из жидкости среднего уха ребенка с острым отитом среднего уха. Хромосомную ДНК штамма 12, обеспечивающую гены, кодирующие протеины HMW1 и HMW2, готовят путем частичного расщепления Sau 3A хромосомной ДНК и фракционирования в градиенте плотности сахарозы. Фракции, содержащие фрагменты ДНК в интервале от 9 до 20 kbp, объединяют в общий фонд и получают библиотеку легированием в λEMBL3. Легированные смеси упаковывают in vitro и размножают на планшете в лизогене P2 E.coli LE392.
Для исследований субклонирования плазмиды ДНК из репрезентативного рекомбинантного фага субклонируют в плазмиду экспрессии pT7-7, содержащую промотор ф10 РНК-полимеразы Т7 сайт связывания с рибосомой и сайт инициации трансляции для протеина 10, предшествуемые множественному клонирующему сайту /см. фиг. 5B/.
Анализ ДНК-последовательности выполняют методом дидезокси, и секвенируют обе нити гена HMW1 и одну нить гена HMW2.
Выполняют вестерн-иммуноблот-анализ, чтобы идентифицировать рекомбинантные протеины, которые продуцируются клонами реактивных фагов. Фаговые лизаты, выращенные в клетках LE392, или колонии, отобранные непосредственно с газона клеток LE392 на планшетах УТ, растворяют в загрузочном буфере для гель- электрофореза перед электрофорезом. Электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия /SDS/ выполняют в гелях Лэммли, модифицированных 7,5% или 11% полиакриламида. После переноса протеинов на нитроцеллюлозные пластинки, пластинки последовательно зондируют образцом сыворотки человека с абсорбированными E.coli, содержащим антитело с высоким титром к высокомолекулярным протеинам, и затем вторым антителом - козьим антииммуноглобулином человека G/IgG/, конъюгированным щелочной фосфатазой. Сыворотка здоровых взрослых людей содержит антитело с высоким титром, нацеленное против поверхностных доступных высокомолекулярных протеинов нетипируемых H. influenzae. Один образец такой сыворотки используют в качестве скрининговой антисыворотки после пространного поглощения клеток E.coli LE392.
Чтобы идентифицировать рекомбинантные протеины, которые продуцируются E. coli, трансформированными рекомбинантными плазмидами, представляющие интерес плазмиды используют для трансформации E.coli BL21(DE3) pLyss. Трансформированные штаммы выращивают до A600 0,5 в литре питательной среды, содержащей 50 мкг ампциллина на мл. Затем добавляют IPTG /изопропилтио-галактозид/ до концентрации 1 мМ. Через один час клетки собирают, и при воздействии ультразвука получают гомогенат клеток. Концентрацию протеина в образцах определяют методом с бицин-хониной кислотой. Гомогенаты клеток, полученные при воздействии ультразвука, с общим содержанием протеина 100 мкг, растворяют в буфере для образца для электрофореза, подвергают электрофорезу в полиакриламидном геле в присутствии SDS и переносят на нитроцеллюлозу. Нитроцеллюлозу затем последовательно зондируют образцом сыворотки взрослого человека с абсорбированными E.coli и, после этого, вторым антителом - козьим анти(IgG человека), конъюгированного с щелочной фосфатазой.
Выполняют также вестерн-иммуноблот-анализ, чтобы определить, гомологичны или гетерологичны экспрессированные штаммами нетипируемых H.influenzae высокомолекулярные протеины, антигенно родственные протеину, кодируемому клонированным геном HMW1 /rHMW1/. Гомогенаты бактериальных клеток, полученные при воздействии ультразвука, растворяют в буфере для электрофореза, подвергают электрофорезу в полиакриламидном геле в присутствии SDS и переносят на нитроцеллюлозу. Нитроцеллюлозу зондируют последовательно антисывороткой с поликлональным rHMW1 кролика и затем - вторым антителом - козьим анти (IgG-кролика), кинъюгированным с щелочной фосфатазой.
И наконец, выполняют вестерн-иммуноблот-анализ, чтобы определить, являются ли протеины, экспрессированные штаммами нетипируемых Haemophilus, антигенно родственными нитеобразным гемагглютинкаут филаментам Bordetella pertussis. Для зондирования вестерн-блотингом гомогенатов клеток, полученных при воздействии ультразвука, используют моноклональное антитело ХЗС, антитело-мышиный иммуноглобулин G /IgG/, которое распознает гемагглютинин филаментов. Для детекции используют второе антитело - козий анти (IgG мыши).
Чтобы генерировать антисыворотку с рекомбинантным протеином, E.coli BL21 (DE3)/pLyss трансформируют с pHMW1-4, и экспрессию рекомбинантного протеина индуцируют IPTG, как описано выше. Получают гомогенат бактериальных клеток при воздействии ультразвука, и разделяют его центрифугированием на супернатант и осадок при 10000 х g в течение 30 мин. Рекомбинантный протеин отделяется с осадком. Кролика иммунизируют подкожно по двухнедельной программе 1 мг протеина из полученной осажденной фракции, и первую дозу дают с полным адъювантом Фрейнда, а следующие дозы - с неполным адъювантом Фрейнда. Перед применением вестерн-блот-анализа антисыворотку интенсивно абсорбируют полученными при воздействии ультразвука гомогенатами клеток штамма хозяина E.coli, трансформированного только вектором клонирования.
Чтобы оценить обмен антигенными детерминантами между HMW1 и нитеобразным гемагглютинином филаментов, планшеты ферментного иммуносорбентного анализа /ELISA/ /Costar, Cambridge, Mass/ покрывают 60 мкл раствора (4-ug/мл) нитеобразного гемагглютинина в физиологическом растворе, забуференном фосфатом Дульбекко, на каждую ячейку, в течение 2 часов при комнатной температуре. Ячейки блокируют в течение 1 часа 1% бычьим сывороточным альбумином в физиологическом растворе, забуференном фосфатом Дульбекко, перед добавлением сыворотки для разбавления. Антисыворотку последовательно разбавляют 0,1% Brij /Sigma, St. Louis, MO./ в физиологическом растворе, забуференном фосфатом Дульбекко, и инкубируют в течение 3 часов при комнатной температуре. После промывания планшеты инкубируют с антителом - козьим анти (IgG кролика), конъюгированным с пероксидазой /Bio-Rad/, в течение 2 часов при комнатной температуре, и затем проявляют 2,2'- азинобис(3-этил-бензтиазолин-6-сульфоновой кислотой) /Sigma/ при концентрации 0,54 мг/мл в буферном 0,1 М растворе цитрата натрия, pH 4,2, содержащем 0,03% H2O2. Абсорбцию считывают на устройство для автоматизированной ELISA.
Рекомбинантный фаг, экспрессирующий HMW1 или HMW2, извлекают следующим образом. Геномную библиотеку штамма 12 нетипируемых H. influenzae скринируют для клонов, экспрессирующих высокомолекулярные протеины, с образцом сыворотки человека, с абсорбированными E.coli, содержащим антитела с высоким титром, нацеленные против высокомолекулярных протеинов.
Многочисленные сильно реактивные клоны идентифицируют вместе с менее реактивными клонами. Очищают двадцать сильно реактивных клонов и проверяют вестерн-блот-способом на экспрессию рекомбинантных протеинов. Каждый из сильно реактивных клонов экспрессирует один или два типа высокомолекулярных протеинов, обозначенных HMW1 и HMW2. Главные полосы иммунореактивных протеинов в лизатах HMW1 и HMW2 перемещаются со средними молекулярными массами 125 и 120 кда, соответственно. Кроме основных полос каждый лизат содержит минерные полосы протеинов с большей молекулярной массой. Видимые в лизатах HMW2 полосы протеинов с молекулярной массой менее 120 кда наблюдаются нерегулярно и предположительно представляют продукты протеолитического разложения. Лизаты LE392, зараженные одним клонирующим вектором λEMBL3, являются нереактивными при иммунологическом скринировании тем же образцом той же сыворотки. Таким образом, наблюдаемая активность не обусловливается протеинами перекрестно-реактивных E. coli или протеинами, кодированными λEMBL3. Более того, рекомбинантные протеины не являются просто неспецифически связывающими иммуноглобулин, так как протеины не являются реактивными при связывании с одним козьим анти (IgG человека), с нормальными сыворотками кролика, или с сывороткой от многих здоровых младенцев.
Репрезентативные клоны, экспрессирующие рекомбинантные протеины - либо HMW1, либо HMW2 - характеризуются далее. Рестрикционные карты двух типов фагов отличаются друг от друга, включая участки структурных генов, кодирующих HMW1 и HMW2. Фиг. 5A доказывает рестрикционные карты репрезентативного рекомбинантного фага, который содержит структурные гены HMW1 или HMW2. Локализации структурных генов указываются темными полосами.
Субклоны плазмиды HMW1 конструируют, используя плазмиду экспрессии T7-7 /фиг. 5A и 5B/. Субклоны плазмиды HMW2 также конструируют, и результаты с этими последними субклонами подобны результатам, наблюдаемым с конструкциями HMW1.
Приблизительная локализация и направление транскрипции структурного гена HMW1 сначала определяют, используя плазмиду pHMW1 /фиг. 5A/. Эту плазмиду конструируют, вставляя фрагмент 8,5-kb BamHI-Sal1 из λHMW1 в BamHI-Sal1 - разрез pT7-7. E.coli, трансформированные pHMW1, экспрессируют иммунореактивный рекомбинантный протеин со средней молекулярной массой 115 кда, который сильно индуцируется IPTG. Этот протеин значительно меньше основного протеина c массой 125 кда, экспрессированного исходным фагом, что указывает, что он либо экспрессируется как гибридный протеин, либо усекается по карбоксильным концам.
Чтобы более точно локализовать 3' - конец структурного гена, конструируют дополнительные плазмиды с прогрессивными делециями из 3' - конца конструкции pHMW1. Плазмиду pHMW1-1 конструируют путем переваривания pHMW1 с PstI, выделения образующегося в результате фрагмента 8,8 kb и повторного легирования. Плазмиду pHMW2 конструируют путем переваривания pHMW1 с Hind III, выделения образующегося в результате фрагмента 7,5 kb, и повторного легирования. Е. coli, трансформированные либо плазмидой pHMW1-1, либо pHMW1-2, также экспрессирует иммунореактивный рекомбинантный протеин со средней молекулярной массой 115 кда. Эти результаты указывают, что 3' - конец структурного гена является 3'- концом сайта Hind III.
Для более точной локализации 5'- конца гена конструируют плазмиды pHMW1-4 и pHMW1-7. Плазмиду pHMW1-4 конструируют клонированием фрагмента 5,1-kb BamHI-Hind III из λHMW1 в полученную плазмиду pT7-7, содержащую предшествующий фрагмент 3,8-kb EcoRI-BamHi. E. coli, трансформированные pHMW1-4, экспрессируют иммунореактивный протеин со средней молекулярной массой приблизительно 160 кда. Хотя продуцирование протеина индуцируется IPTG, уровня продуцирования протеина в этих трансформантах значительно ниже, чем с трансформантами pHMW1-2, описанными выше. Плазмиду pHMW1-7 конструируют путем переваривания pHMW1-4 с NdeI и SpeI. Выделяют фрагмент в 9,0 kbp, генерированный таким двойным перевариванием, затупляют концы и снова лигируют. E.coli, трансформированные pHMW1-7, также экспрессирует иммунореактивный протеин со средней молекулярной массой 160 кда - протеин, идентичный по размеру протеину, экспрессированному трансформантами pHMW1-4. Результаты указывают, что инициирующий кодон для структурного гена HMW1 представляет собой 3' сайта SpeI. Анализ-ДНК-последовательности подтверждает этот вывод.
Как отмечалось выше, клоны фага λ HMW1 экспрессируют основную иммунореактивную полосу в 125 кда, в то время как клоны плазмиды HMW1 pHMW1-4 и pHMW1-7, которые содержат, как полагают, гены полной длины, экспрессируют иммунореактивный протеин приблизительно со 160 кда. Это расхождение в размерах является несогласующимся. Одно из возможных объяснений этого заключается в том, что дополнительный ген или гены, необходимые для коррекции процессинга генного продукта HMW1, утрачиваются в процессе субклонирования. Чтобы адресовать эту возможность, конструируют плазмиду pHMW1-14. Эту конструкцию генерируют перевариванием pHMW1 с NdeI и MluI, и встраиванием фрагмента 7,6-к pbp NdeI-MluI, выделенного из pHMW1-4. Такая конструкция будет содержать ген HMW1 полной длины, так же, как и ДНК 3' гена HMW1, который присутствует в исходном фаге HMW1. E.coli, трансформированные этой плазмидой, экспрессируют главные иммунореактивные протеины со средней молекулярной массой 125 и 160 кда, а также дополнительные продукты разложения. Полосы 125- и 160-кда являются идентичными главным и второстепенным иммунореактивным полосам, определяемым в лизатах фага HMW1. Интересно, что конструкция pHMW1-14 также экспрессирует значительные количества протеина в условиях отсутствия индуцирования - ситуация, которая не наблюдается в предыдущих конструкциях.
Соотношение между протеинами 125- и 160-кда иногда остается неясным. Анализ последовательности, описанный ниже, показывает, что ген HMW1 будет предсказывать кодируемый протеин 159 кда. Полагают, что протеин 160-кда является предшествующей формой зрелого протеина 125-кда, причем конверсия одного протеина в другой зависит от продуктов двух прямонаправленных генов.
Анализ последовательности гена HMW1 /фиг. 1/ показывает 4608-bp открытой рамки считывания /ORF/, начинающиеся с кодона ATG в нуклеотиде 351 и заканчивающиеся терминирующим кодоном TAG в нуклеотиде 4959. Предполагаемое место связывания рибосомы с последовательностью AGGAG отстоит на 10 bp от предполагаемого инициирующего кодона. Пять других находящихся в рамке считывания АТУ кодона располагаются в 250 bp, начала ORF, но ни одному из них не предшествует типичный сайт связывания рибосомы. 5' - фланкирующая область ORF содержит ряд прямых тандемных повторов, с последовательностью 7-bp ATCTTTC, повторенной 16 раз. Эти тандемные повторы терминируют 100 bp 5' предполагаемого инициирующего кодона. Присутствуют характерные черты обращенного повтора 8-bp rho-независимого терминатора транскрипции, начинаясь в нуклеотиде 4983, 25 bp 3' предполагаемой терминации трансляции. Во всех трех рамках считывания присутствует множество терминирующих кодонов как в прямом, так и в обратном направлении ORF. Полученная аминокислотная последовательность протеина, кодированного геном HMW1 /фиг. 2/, имеет молекулярную массу 159000, в хорошем соответствии со средними молекулярными массами протеинов, экспрессированных трансформантами HMW1-4 и HMW1-7. Полученная аминокислотная последовательность амино-концов не показывает характерных свойств типичной сигнальной последовательности. Сайт BamHI, используемый при генерации pHMW1, включает пары оснований нуклеотидной последовательности с 1743 по 1748. Хотелось бы утверждать, что ORF в прямом направлении сайта BamHI кодирует протеин 111 кда, в хорошем соответствии со 115 кда, приблизительно подсчитанными для средней молекулярной массы гибридного протеина, кодированного pHMW1.
Последовательность гена HMW2 /фиг. 3/ состоит из 4431 пары оснований в ORF, начинающихся с кодона ATG в нуклеотиде 352 и кончающихся терминирующим кодоном TAG в нуклеотиде 4783. Первые 1259 пар оснований ORF гена HMW2 идентичны парам оснований гена HMW1. После этого последовательности начинают расходиться, но в целом идентичны на 80%. За исключением единственного добавленного основания в нуклеотиде 93 последовательности HMW2, 5'-ограничивающие области генов HMW1 и HMW2 идентичны для 310 пар оснований в обратном направлении от соответственных инициирующих кодонов. Таким образом, гену HMW2 предшествует тот же набор тандемных повторов и тот же предполагаемый сайт связывания рибосомы, который направляет 5' гена HMW1. Отмечается, что предполагаемый терминатор транскрипции идентичен терминатору, идентифицированному 3' ORF HMW1, начиная с нуклеотида 4804. Расхождение в длине двух генов объясняется главным образом разрывом в 186 пар оснований в последовательности HMW2, начиная с нуклеотида в позиции 3839. Полученная аминокислотная последовательность протеида, кодированного геном HMW2 /фиг. 4/, имеет молекулярную массу 155000 и на 71% идентична аминокислотной последовательности, полученной из гена HMW1.
Полученные аминокислотные последовательности как гена HMW1, так и гена HMW2 /фиг. 2 и 4/ демонстрируют сходство последовательностей с полученной аминокислотной последовательностью гемагглютинина филаментов Bordetella pertussis, поверхностно ассоциированного протеина этого организма. Первоначальные и оптимизированные показатели TFASTA для сравнения последовательности HMW-1 и нитеобразного гемагглютинина составляют 87 и 186 соответственно, с размером шага /Wordsize/ 2. Показатель Z для сравнения составляет 45,8. Первоначальные и оптимизированные показатели для сравнения последовательности HMW-2 и нитеобразного гемагглютинина составляют 68 и 196, соответственно. Показатель Z для последнего сравнения составляет 48,7. Величины первоначальных и оптимизированных показателей TFACTA и показателей Z наводят на мысль, что между генными продуктами HMW-1 и HMW-2 и нитеобразным гемагглютинином филаментов существует существенная биологическая связь. Когда полученные аминокислотные последовательности генов HMW-1, HMW-2 и нитеобразного гемагглютинина выстраивают в ряд и сравнивают, наиболее заметно сходство в аминоконцах трех последовательностей. Двенадцать из первых 22 аминокислот в предсказанных пептидных последовательностях являются идентичными. Кроме того, последовательности демонстрируют обычные участки из пяти аминокислот, Asn-Pro-Asn-Gly-Ile, и некоторые более кроткие участки с идентичной последовательностью в первых 200 аминокислотах.
Пример 2.
Для дальнейшего выяснения связи HMW-1 и нитеобразного гемагглютинина проводят испытания способности антисыворотки, полученной против рекомбинантного протеина HMW-4 / rHMW1/ распознавать очищенный нитеобразный гемагглютинин. Антисыворотка rHMW1 демонстрирует, по ELISA, способность взаимодействовать с нитеобразным гемагглютинином в зависимости от дозы. Сыворотка предварительно иммунизированного кролика имеет минимальную реактивность в этом испытании. Антисыворотку rHMW1 также проверяют вестерн-блот-анализом, и в этой системе также обнаруживают слабую, но положительную реактивность по отношению к нитеобразному гемагглютинину.
Чтобы идентифицировать нативный протеин Haemophilus, соответствующий генному продукту HMW1, и определить степень, до которой протеины, антигенно связанные с продуктом клонированного гена HMW1, являются обычными среди других штаммов нетипируемых H.influenzae, набор штаммов Haemophilus скринируют антисывороткой rHMW1 вестерн-блот-анализом. Антисыворотка распознает в гомологичном штамме 12 как полосу протеина 125-, так и 120-кда, предполагаемых зрелых протеиновых продуктов генов HMW1 и HMW2, соответственно.
При использовании для скринирования гетерологичных штаммов нетипируемых H. influenzae антисыворотка rHMW1 распознает высокомолекулярные протеины в 75% 125 эпидемиологически несвязанных штаммов. Вообще, антисыворотка реагирует с одной или двумя протеиновыми полосами в области 100 - 150 кда в каждом из гетерологичных штаммов по рисунку, подобному, но не идентичному, рисунку, наблюдаемому в гомологичном штамме.
Моноклональное антитело ХЗС представляет собой мышиный IgG, нацеленный против гемагглютинина филаментов B.pertussis. Это антитело может ингибировать связывание клеток B.pertussis с клетками яичника китайского хомяка и клетками HeLa в культуре и будет ингибировать гемагглютинацию эритроцитов очищенными гемагглютинином филаментами. Выполняют вестерн-блот-анализ, при котором проверяют действие этого антитела на тот же набор штаммов нетипируемих H. influenzae, который обсуждался выше. Моноклональное антитело ХЗС распознает оба высокомолекулярных протеина в штамме 12 нетипируемых H.influenzae, которые распознаются антисывороткой к рекомбинантным протеинам. Кроме того, моноклональное антитело распознает протеиновые полосы в субпанели гетерологичных штаммов нетипируемых H.influenzae, которые идентичны полосам, распознаваемым антисывороткой к рекомбинантному протеину. Иногда оказывается, что моноклональное антитело к гемагглютинину филаментов распознает только одну из двух полос, которые распознаются антисывороткой к рекомбинантному протеину. В общем, моноклональное антитело ХЗС распознает полосы высокомолекулярных протеинов, идентичные полосам, распознаваемым антисывороткой rHMW1, приблизительно в 35% нашей коллекции штаммов нетипируемых H.influenzae.
Пример 3
Конструируют мутанты, дефицитные по экспрессии HMW1, HMW2 или обоих протеинов, чтобы проверить роль этих протеинов в бактериальном прилипании. Используют следующую стратегию. Переваривают pHMW1-14 /см. пример 1, фиг. 5A/, с BamHI, и затем лигируют к канамициновой кассете, выделенной на фрагменте в 1,3-kb BamHl из pUC4K. Полученную в результате плазмиду /pHMW1-17/ переводят в линейную форму перевариванием с XbaI и трансформируют в штамм 12 нетипируемых H.influenzae, с последующим отбором колоний, устойчивых к канамицину. Саузерн- анализ ряда таких колоний наглядно показывает две популяции трансфомантов, одну с инсерцией в структурный ген HMW1, и другую - с инсерцией в структурный ген HMW2. Отбирают по одному мутанту из каждого из этих классов для дальнейших исследований.
Мутанты, дефицитные при экспрессии обоих протеинов, извлекают, используя следующую процедуру. После делеции 2,1-kb фрагмента ДНК между двумя сайгами EcoRI, охватывающего участок 3' структурного гена в pHMW-15, вставляют канамициновую кассету из pUC4K, как фрагмент в 1,3 kb EcoRI. Получающуюся в результате плазмиду /pHMW1-16/ переводят в линейную форму перевариванием с XbaI и трансформируют в штамм 12, снова с последующим отбором колоний, устойчивых к канамицину. Саузерн-анализ отобранных проб этих колоний наглядно показывает, что в семи случаях из восьми имеет место инсерция как в локус HMW1, так и в локус HMW2. Один такой мутант отбирают для дальнейших исследований.
Чтобы подтвердить подразумеваемые фенотипы, мутантные штаммы проверяют вестерн-блот-анализом с поликлональной антисывороткой к рекомбинантному протеину HMW1. Родительский штамм экспрессирует как протеин 125-kg, так и протеин 120-kg. В противоположность этому, мутант HMW2 не способен экспрессировать протеин 120-kg, а мутант HMW1 не способен экспрессировать протеин 125-kg. Двойной мутант не экспрессирует ни тот, ни другой протеин. В других отношениях, исходя из целых клеточных лизатов, профилей наружных мембран и морфологии колоний, дикий типовой штамм и мутанты идентичны друг с другом. Просвечивающая электронная микроскопия демонстрирует, что ни один из четырех штаммов не экспрессирует пили.
Проверяют способность штамма дикого типа 12 прилипать к эпителиальным клеткам Chang. При таких испытаниях бактерии инокулируют в питательную среду и дают возможность вырасти до плотности ~2•109 КОЕ/мл. Приблизительно 2•107 КОЕ инокулируют на монослои эпителиальных клеток, и чашки осторожно центрифугируют при 165xg в течение 5 минут, чтобы облегчить контакт между бактериями и эпителиальной поверхностью. После инкубации в течение 30 минут при 37oC в 5% CO2 монослои промывают 5 раз PBS /ЗФР/, чтобы удалить неприлипшие организмы, и обрабатывают трипсином с ЭДТА /0,05% трипсина, 0,5% ЭДТА/ в PBS, чтобы избавить их от пластиковой подложки. Содержимое ячеек перемешивают, и на планшетах проводят разбавление на твердой среде, чтобы получить число налипших бактерий на монослой. Вычисляют прилипание, в процентах, путем деления числа налипших КОЕ на число инокулированных КОЕ.
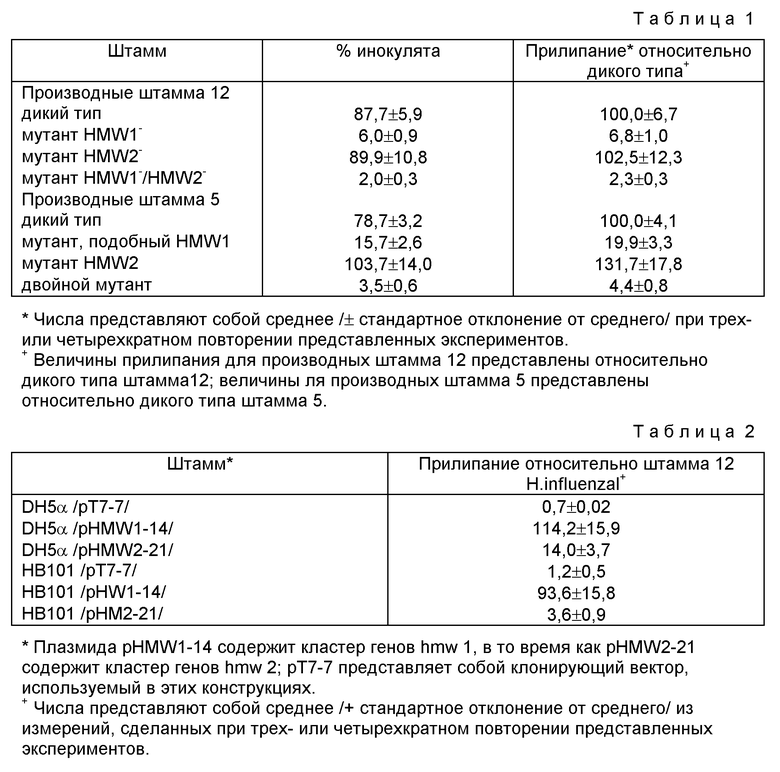
Как следует из приведенной ниже табл. 1 /таблицы даются в конце текста описания/, этот штамм прилипает весьма эффективно, с почтя 90% связыванием инокулята с монослоем. Прилипание мутанта, экспрессирующего HMW1, но не HMW2 /HMW2/, также весьма эффективно и сравнимо с прилипанием штамма дикого типа. И напротив, связывание штаммом, экспрессирующим HMW2, но дефицитным по экспрессии HMWT /HMWT-/, снижается в 15 раз по сравнению с диким типом. Прилипание двойного мутанта (HMW1-/HMW2-) снижается даже больше, примерно в 50 раз по сравнению с диким типом, и примерно в 3 раза при сравнении с мутантом HMW1. При совместном рассмотрении, эти результаты наводят на мысль, что как протеин HMW1, так и протеин HMW2 влияют на присоединение к эпителиальным клеткам. Интересно, что оптимальная адгезия к этому виду клеток, оказывается, требует HMW1, но не HMW2.
Пример 4
Используя плазмиды pHMW1-16 и pHMW1-17 /см. пример 3/ и следующую далее схему, подобную схеме, использованной для штамма 12, как описано в примере 3, выделяют три мутанта штамма 5 нетипируемых Haemophilus, включая один с геном канамицина, инсертированным в hmwI-подобный /обозначенный hmw3/ локус, второй с инсерцией в hmw2-подобный /обозначенный hmw4/ локус и третий - с инсерцией в оба локуса. Как утверждается, вестерн-блот-анализ демонстрирует, что мутант с инсерцией канамициновой кассеты в hmwI - подобный локус теряет экспрессию 125-kg протеина HMW3, в то время как мутант с инсерцией в hmw2-подобный локус теряет способность экспрессировать 123-kg протеин HMW4. Мутант с двойной инсерцией неспособен экспрессировать ни тот, ни другой высокомолекулярный протеин.
Как показано ниже в табл. 1, дикий типовой штамм 5 демонстрирует высокую степень прилипания, с почти 80% прилипанием инокулята на монослой. Прилипание мутанта, дефицитного по экспрессии HMW2-подобного протеина, также является весьма высоким. В противоположность этому, прилипание мутанта, не способного экспрессировать HMW2-подобный протеин, уменьшается в 5 раз по сравнению с диким типом, а связывание двойным мутантом уменьшается даже в большей степени (приблизительно в 25 раз). Проверка окрашенных по Giesma образцов подтверждает эти наблюдения /не показано/. Таким образом, результаты, полученные для штамма 5, подтверждают данные, полученные для штамма 12 и протеинов HMW1 и HMW2.
Пример 5
Чтобы подтвердить адгезионную функцию протеинов HMW1 и HMW2 и проверить действие HMW1 и HMW2 независимо от других поверхностных структур H.influenzae, кластеры генов hmwI и hmw2 вводят в E.coli DH5α, используя плазмиды pHMW1-14 и pHMW2-21, соответственно. В качестве контроля, клонирующий вектор pT7-7 также трансформируют в E.coli DH5α. Вестерн-блот-анализ показывает, что E. coli DH5α, содержащий гены hmwI, экспрессирует 125-кда протеин, в то время, как тот же самый штамм с генами hmw2 экспрессирует протеин 120 kga E. coli DH5α, содержащие pT7-7, неспособны взаимодействовать с антисывороткой к рекомбинантному HMW1. Трансмиссионная электронная микроскопия не обнаруживает пили или другие поверхностные привески ни в одном из штаммов E.coli.
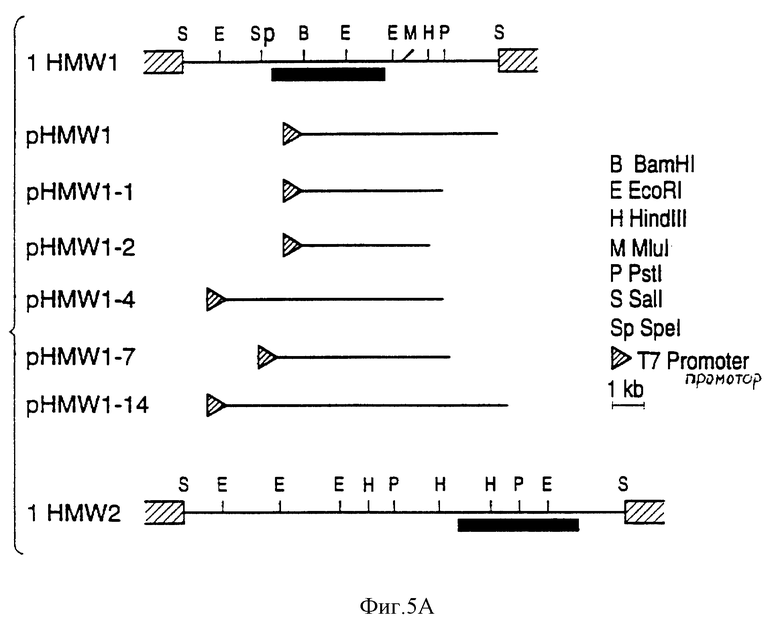
Прилипание штаммов E.coli определяют количественно и сравнивают с прилипанием штамма 12 дикого типа нетипируемых H.influenzae. Как показано ниже в табл. 2, прилипание E.coli DH5α, содержащих только вектор, составляет менее 1% прилипания для штамма 12. В противоположность этому, E.coli DH5α с кластером генов hmwI показывает уровень прилипания, сравнимый с прилипанием для штамма 12. Прилипание E.coli DH5α, содержащих гены hmw2, приблизительно в 6 раз меньше, чем связывание штаммом 12, но в 50 раз выше прилипания E. coli DH5α с одним pT7-7. Эти результаты показывают, что протеины HMW1 и HMW2 способны независимо служить промежуточным звеном при связывании коньюнктивальных клеток Chang. Эти результаты, вместе с результатами для мутантов H. influenzae, приведенными в примерах 3 и 4, служат дальнейшими доказательствами того, что, в случае эпителиальных клеток Chang, HMW1 является более эффективным адгезином, чем HMW2.
Эксперименты с E.coli HB101, включающими pT7-7, pHMW1-14 или pHMW2-21, подтверждают результаты, полученные с производными DH5α /см. табл.2/.
Пример 6
Выделяют HMW1 и HMW2 и очищают от штамма 12 нетипируемых H.influenzae /NTHI/ следующим образом. Нетипируемые бактерии Haemophilus из чистой замороженной культуры "штрихуют" на шоколадную пластину и выращивают в течение ночи при 37oC в термостате с 5% CO2. Культуру, выращенную на шоколадной пластине, инокулируют в 50 мл закваски из бульона с сердечно-мозговым экстрактом /BHI/, с добавлением гемина и НАД, по 10 мкг/мл каждого. Закваску выращивают до тех пор, пока оптическая плотность /O.D. - 600 нм/ не достигнет 0,6-0,8, и затем бактерии в закваске используют для инокулирования шести 500-мл колб, в которые добавлен BHI, используя 8-10 мл на колбу. Бактерии выращивают в 500 мл колбах еще в течение 5-6 часов - время, за которое оптическая плотность достигает 1,5 или большей величины. Культуры центрифугируют при 10000 об/мин в течение 10 минут.
Бактериальные осадки снова суспендируют в растворе для экстракции общего объема 250 мл, содержащем 0,5 М NaCl, 0,01 М Na2 ЭДТА, 0,01 М триса, 50 мкм 1,10-фенантролина, pH 7,5. Клетки не обрабатывают ультразвуком или каким-либо иным измельчающим способом. Вновь суспендированные клетки выдерживают на льду при 0oC в течение 60 минут. Вновь суспендированные клетки центрифугируют при 10000 об/мин в течение 10 минут при 4oC, чтобы удалить большинство интактных клеток и клеточные осколки. Супернатант собирают и центрифугируют при 100000xg в течение 60 минут при 4oC. Супернатант снова собирают, и проводят диализ в течение ночи при 4oC против 0,01 М фосфата натрия, pH 6,0.
Образец центрифугируют при 10000 об/мин в течение 10 минут при 4oC, чтобы удалить нерастворимые осколки, выпавшие в осадок в процессе диализа. Супернатант вносят в колонку с 10 мл карбоксиметилсефарозы, которая предварительно уравновешена 0,01 М фосфатом натрия, pH 6. После внесения в колонку, эту колонку промывают 0,01 М фосфатом натрия. Протеины элюируют из колонки с градиентом 0 - 0,5 М KCl в 0,01 М фосфата Na, pH 6, и собирают фракции для проверки на геле. Готовят кумасси-гели колоночных фракций, чтобы идентифицироватъ эти фракции, содержащие высокомолекулярные протеины. Фракции, содержащие высокомолекулярные гели, объединяют и концентрируют до объема 1 - 3 мд, для внесения в колонку для гель-фильтрации.
Колонку для гель-фильтрации с сефарозой CL-4B уравновешивают солевым раствором, забуференным фосфатом, pH 7,5. Концентрированный образец высокомолекулярного протеина вносят в колонку для гель- фильтрации, и собирают колоночные фракции. Готовят кумасси-гели на колоночных фракциях, чтобы идентифицировать фракции, содержащие высокомолекулярные протеины. Колоночные фракции, содержащие высокомолекулярные протеины, объединяют.
Протеины тестируют, чтобы определить, будут ли они защищать от экспериментального отита среднего уха, вызываемого гомологичным штаммом.
Шиншиллам в течение трех месяцев делают подкожные инъекции 40 мкм смеси протеинов HMW1 и HMW2 в адъюванте Фрейнда. Через месяц после последней инъекции проводят контрольное заражение животных интрабуллярной инокуляцией 300 КОЕ штамма 12NTHI.
Инфекция развивается у 5 из 5 контрольных животных против 5 из 10 иммунизованных животных. У зараженных животных среднегеометрическое число бактерий в жидкости среднего уха через 7 дней после заражения составляет 7,4•106 для контрольных животных и 1,3•105 для иммунизованных животных.
Сравнивают титры сывороточных антител после ииммунизации у зараженных и незараженных животных. Однако, инфекция у иммунизованных животных однородно ассоциируется с появлением бактерий с супрессирующим эффектом в экспрессии HMW протеинов, наводя на мысль о бактериальной селекции в ответ на иммунологическое давление.
Хотя эти данные показывают, что защита после иммунизации не является полной, они наводят на мысль, что HMW адгезинные протеины являются потенциально важными защитными антителами, которые могут заключать в себе один компонент многокомпонентной вакцины против NTHI.
Пример 7
Из HMW1 получают ряд синтетических пептидов. К этим пептидам подбирают антисыворотку. Показано, что антипептидная антисыворотка к пептиду HMW1-P5 распознает HMW1. Пептид HMW1-P5 перекрывает аминокислоты с 1453 по 1481 HMWT, имеет последовательность VDEVIEAKRILEKVKDLSDEEREALAKLG |SEQ ID NO:9|, и представляет основания 1498-1576 на фиг. 10.
Эти данные показывают, что ДНК-последовательность и производный протеин прерываются в правильной рамке считывания, и что могут быть продуцированы пептиды, производные от последовательности, которые будут иммуногенными.
Краткое изложение раскрытия сущности изобретения
Если кратко изложить сущность изобретения, то настоящее изобретение предлагает высокомолекулярные протеины нетипируемых Haemophilus, гены, кодирующие эти протеины, и вакцины, включающие такие протеины. В пределах объема настоящего изобретения возможны модификации.
В таблице 1 показано влияние мутации высокомолекулярных протеинов на прилипание к эпителиальным клеткам Cnahd нетипируемых H.influenzae.
В таблице 2 показано прилипание E.coli DH5α и HB101 с кластерами генов hmwI или hmw2.


































































Изобретение относится к генной инженерии. Представлены гены, кодирующие высокомолекулярный протеин HMW1, HMW2, HMW3, HMW4 штамма нетипируемых Haemophilus influenzae. Нуклеотидные последовательности генов приведены в описании. Представлены кластеры генов с нуклеотидными последовательностями, приведенными в описании. Представлены выделенные и очищенные высокомолекулярные протеины. Аминокислотные последовательности приведены в описании. Представлен синтетический полипептид. Аминокислотная последовательность приведена в описании. 11 с.п. ф-лы, 10 ил., 2 табл.
| INFECTION and IMMUNITY, VOL 56(1) 1988, E.j | |||
| HANSEN "IMMUNE ENHANCEMENT of PULMONARY CLEARANCE on NONTYPABLE HAEMOPHILUS INALUENZAE", p | |||
| Затвор для дверей холодильных камер | 1920 |
|
SU182A1 |
| INFECTION and IMMUNITY, VOL | |||
| Устройство для устранения мешающего действия зажигательной электрической системы двигателей внутреннего сгорания на радиоприем | 1922 |
|
SU52A1 |
| BARENKAMP, "PROTECTION BY SERUM ANTIBODIES IN EXPERIMENTAL NONTYPABLE HAEMOPHILUS INFLUENZAE OTITIS MEDIA", p | |||
| Устройство для выпуска сточных вод в реки | 1923 |
|
SU572A1 |
| PROCEEDINGS OF THE NATIONAL ACADEMY OF SCIENCES USA, VOL | |||
| Капельная масленка с постоянным уровнем масла | 0 |
|
SU80A1 |
| YOUNG et al | |||
| "EFFICIENT ISOLATION OF GENES BY USING ANTIBODY PROBES", p.1194-1198 | |||
| ЩЕЛКУНОВ С.Н | |||
| КОНСТРУИРОВАНИЕ ГИБРИДНЫХ МОЛЕКУЛ ДНК, НОВОСИБИРСК, НАУКА, 1987, С | |||
| Способ получения суррогата олифы | 1922 |
|
SU164A1 |
Авторы
Даты
2000-10-20—Публикация
1993-03-16—Подача