Настоящее изобретение относится к химерному антителу человека/мыши, содержащему вариабельную область (V-область) моноклонального антитела мыши против белка, родственного паращитовидному гормону, и константную область (С-область) антитела человека; к очеловеченному антителу, в котором гипервариабельные участки, V-областей легкой цепи (L-цепь) и тяжелой цепи (Н-цепь) моноклонального антитела мыши против белка, родственного паращитовидному гормону (PTHrP), трансплантированы в антитело человека; к L- и Н-цепям указанного антитела, а также к полипептиду, который имеет V-область, состоящую из L- или Н-цепи указанного антитела.
Настоящее изобретение относится также к ДНК, содержащей последовательность оснований, кодирующую вышеуказанное антитело, в частности, его V-область, и к ДНК, кодирующей L- или Н-цепь, образующую V-область. Настоящее изобретение далее относится к рекомбинантному вектору, содержащему данную ДНК, и к хозяину, трансформированному указанным вектором.
Кроме того, настоящее изобретение относится к способам получения химерных и очеловеченных антител против PTHrP. Настоящее изобретение далее относится к фармацевтической композиции и лекарственному средству для подавления гиперкальциемии или улучшения при гипофосфатемии, которое содержит антитело против PTHrP в качестве активного ингредиента.
Предпосылки изобретения
Гиперкальциемия, обусловленная злокачественной опухолью, является серьезным осложняющим симптомом, обнаруженным у 5-20% всех субъектов, имеющих злокачественную опухоль. Это считается терминальным симптомом злокачественной опухоли и неизбежно ведет к смерти субъекта при отсутствии соответствующего лечения. Контролирование гиперкальциемии может в значительной степени повлиять на прогноз и качество жизни субъекта, поэтому его назначение очень велико.
Как правило, гиперкальциемию у субъектов, имеющих злокачественную опухоль, можно грубо классифицировать как гуморальную гиперкальциемию злокачественного заболевания (ННМ), возникающую под воздействием опухолеобразующих гуморальных факторов резорбции костной ткани, и как локальную остеолитическую гиперкальциемию (LOH), возникающую в результате местного воздействия опухоли, перенесенной или инфильтрованной в костную ткань. Считается, что в случае гуморальной гиперкальциемии злокачественного заболевания, содержание потока кальция повышается из-за резорбции костной ткани или из-за остеолизации, ведущих к гиперкальцемии в сочетании с ухудшением способности почек выводить кальций (S.Wada and N.Nagata, Internal Medicine, 69, 644-648).
Симптомы гиперкальциемии обычно проявляютя при концентрации кальция в сыворотке более 12 мг/мл; хотя ее неспецифические симптомы, такие как анорексия (отсутствие аппетита), тошнота и рвота, наблюдаются уже на ранней стадии злокачественного заболевания. По мере развития гиперкальциемии у субъекта снижается способность концентрировать воду вследствие поражения почечных периферических канальцев, что ведет к повышенному выделению мочи (полиурии), при этом анорексия и тошнота сопровождаются обезвоживанием организма из-за недостаточного поглощения воды.
Мозелей Дж.М. и др. обнаружили, что одним из гуморальных факторов, вызывающих гуморальную гиперкальциемию злокачественного заболевания, является белок, родственный паращитовидному гормону (РТН) (далее определяется как "PTHrP") (Proc. Natl. Acad. Sci., USA (1987) 8-4, 5048-5052).
Вслед за этим был выделен ген, кодирующий PTHrP (Suva L.J. et al.. Science (1987) 237, 893). Анализ этого гена показал наличие трех типов PTHrP человека, имеющих 139, 141 и 173 аминокислоты, вследствие поочередного сплайсинга этого гена, и присутствие в крови различных фрагментов в результате ограниченного расщепления PTHrP (1-139) с полной структурой (Baba, H., Clinical Calcium (1995)5,229-223). В PTHrP 8 аминокислот из N-концевых 13 аминокислот идентичны указанным аминокислотам паращитовидного гормона. Из этого следует, что аминокислотный сайт, соответствующий положениям 14-34, имеет пространственную структуру, которая также подобна паращитовидному гормону. Таким образом, PTHrP и РТН связываются с общим рецептором РТН/PTHrP по крайней мере в N-концевой области (Jueppner, H. et al., Science (1991) 254, 1024-1026; Abou-Samra, A-B. et al, Proc. Natl. Acad. Sci., USA (1992) 89, 2732-2736.
Как известно, PTHrP продуцируется разными опухолевыми тканями, при этом установлено, что PTHrP вырабатывается не только в опухоли, но и в разных нормальных тканях начиная с плода и кончая взрослыми субъектами. К таким тканям относятся кожа, центральная нервная система, матка, плацента, молочные железы в период лактации, щитовидная железа, пара-щитовидная железа, надпочечник, печень, почки и мочевой пузырь (Burtis, W.J., Clin. Chem. (1992) 38, 2171-2183; Stew-art. A.F. & Broadus, A.E., J.Clin. Endocrmol. (1991)71, 1410-1414). Кроме того, считается, что PTHrP играет важную роль в метаболической регуляции кальция, содержание которого выше у плода и новорожденного, чем у матери.
Известно, что рецепторы РТН/PTHrP находятся главным образом в костях и почках (C.Shigeno, Clinical Calcium (1995) 5, 355-359) и активируют несколько систем внутриклеточной передачи сигналов путем связывания PTHrP с рецепторами. Одним из них является аденилатциклаза, а другим - фосфолипаза С. Активация аденилатциклазы увеличивает концентрацию внутриклеточного циклического аденозинмонофосфата (уАМФ), активирующего протеинкиназу А. Фосфолипаза С расщепляет фосфатидилинозитол-4,5-бисфосфонат с образованием инозитол-1,4,5-трифосфоната и диацилглицерола. В указанных системах передачи сигналов используется G-белок (Coleman, D.T. et al., Biochemical mechanisms of parathyroid hormone action. In: "The parathyroids" (Bilezikian, J.P. et al), Raven Press, New York (1994) 239).
Под воздействием этих систем передачи сигналов PTHrP вызывает гиперкальциемию и гипофосфатемию, снижает способность резорбцию фосфата почками, увеличивает выделения уАМФ почками и определяет другие подобные процессы, которые имеют место в случае гиперкальциемии злокачественного заболевания (ННМ).
Таким образом, установлено, что PTHrP имеет непосредственное отношение к гиперкальциемии, обусловленной злокачественной опухолью. Для лечения гиперкальциемии, связанной со злокачественной опухолью, используют кальцитонин, стероидные средства, индометацин, неорганические соли фосфата, бифосфонаты и тому подобные средства, а также средства для восполнения жидкости. Однако для указанных средств характерно снижение эффективности при длительном применении, возникновение серьезных побочных эффектов и медленное проявление их фармакологического действия, поэтому необходимы новые лекарственные средства, обладающие более сильным терапевтическим действием и менее выраженными побочными эффектами.
Кукрейя С.С. и др. (Kukreja, S.C. et al.) сообщили, что для лечения гиперкальциемии, обусловленной злокачественной опухолью, они использовали нейтрализующую антисыворотку против PTHrP. При введении этой антисыворотки бестимусным мышам, которым были трансплантированы клетки рака легкого или гортани человека, вызывающего гиперкальциемию, наблюдалось снижение содержания кальция в крови и уровня уАМФ в моче (J.Clin. Invest. (1988) 82, 1798-1802). Каньи Сато и др. сообщили, что при введении антитела против PTHrP (1-34) "голым" мышам, которым была имплантирована PTHrP-продуцирующая опухоль человека, симптомы гиперкальциемии стали менее выраженными и срок жизни мышей существенно увеличился (J.Bone &. Mine. Res. (1993) 8, 849-860). Далее, в открытой публикации заявки на патент Японии №4-228089 описываются химерные антитела мыши/человека против PTHrP человека (1-34).
Моноклональные антитела мыши оказывают в организме человека сильное иммуногенное действие (иногда оно определяется как "антигенное"), что ограничивает использование моноклональных антител для лечения людей. Например, антитело мыши, введенное человеку, может быть метаболизировано как чужеродное вещество; поэтому период полувыведения антитела мыши из организма человека является относительно коротким, и оно не оказывает требуемого действия. Кроме того, повышение уровня вырабатывающихся в организме человека антител против мыши (НАМА), при введении антител мыши может вызвать иммунные реакции, которые неприемлемы или опасны для пациента, например, сывороточные болезни и другие аллергические реакции. Поэтому моноклональные антитела мыши часто непригодны для введения людям.
Чтобы решить эти проблемы, были разработаны методы, направленные на снижение иммуногенности нечеловеческих антител, в частности, моноклональных антител мыши. Одним из таких методов является создание химерного антитела, в котором вариабельная область (V-область) выделена из моноклонального антитела мыши и константная область (С-область) выделена из соответствующего антитела человека.
Поскольку полученное химерное антитело имеет интактную вариабельную область исходного антитела мыши, можно ожидать, что данное химерное антитело будет связываться с антигеном с той же специфичностью, что и исходное антитело мыши. Кроме того, такое химерное антитело имеет значительно меньшую часть аминокислотной последовательности, полученной у животного; из вышесказанного следует, что иммуногенность этого антитела должна быть ниже по сравнению с исходным антителом мыши. Хотя химерное антитело связывается со своим антигеном подобно исходному моноклональному антителу мыши, характеризуясь при этом более низкой иммуногенностью, некоторые иммунные реакции на вариабельную область мыши по-прежнему могут иметь место (LoBuglip, A.F. et al., Proc. Natl. Acad. Sci. USA, 86, 4220-4224, 1989).
Второй метод уменьшения иммуногенности антител мыши является более сложным, но, как считается, позволяет еще больше снизить потенциальную иммуногенность антител мыши. В соответствии с этим методом в вариабельную область человека трансплантируют только гипервариабельный участок (CDR) вариабельной области антитела мыши с целью создания реконструированной вариабельной области человека. При необходимости в вариабельную область человека можно трансплантировать частичную аминокислотную последовательность каркасной области (FR), содержащей гипервариабельные участки в вариабельной области антитела мыши, с целью создания структуры гипервариабельных участков в реконструированной вариабельной области человека, которая ближе структуре исходного антитела мыши.
Затем эти очеловеченные реконструированные вариабельные области человека соединяют с константными областями человека. В окончательно реконструированном очеловеченном антителе чужеродными аминокислотными последовательностями являются только гипервариабельные участки и очень небольшая часть каркасной области. Гипервариабельные участки состоят из гипервариабельной аминокислотной последовательности и не имеют каких-либо видоспецифичных последовательностей. Поэтому очеловеченное антитело, содержащее гипервариабельные участки мыши, обладает не более сильной иммуногенностью, чем натуральное антитело человека, содержащее гипервариабельные участки человека.
Использование очеловеченных антител рассматривается в следующих ссылках: Riechmann, L. et al., Nature, 332, 323-327, 1988; Verhoeye, M. et al., Science, 239, 1534-1536, 1988; Kettleborough, C.A. et al. Protein Engng, 4, 773-783, 1991; Maeda, H. et al., Human Antibodies and Hybridoma, 2, 124-134, 1991; German, S.D. et al., Proc. Natl. Acad. Sci. USA, 88, 4181-4185, 1991; Tempest, P.R. et al., Bio/Technology, 9, 266-271, 1991; Co, M.S. et al., Proc. Natl. Acad. Sci. USA, 88, 2869-2873, 1991; Carter, P. et al., Proc. Natl. Acad. Sci. USA, 89, 4285-4289, 1992; Co, M.S. et al., J. Immunol, 148, 1149-1154, 1992 and Sato, К. et al., Cancer Res., 53, 851-856, 1993.
Хотя считается, что очеловеченные антитела должны быть полезны для лечебных целей, в вышеуказанных ссылках отсутствуют какие-либо упоминания об очеловеченном антителе против PTPrH. Кроме того, до сих пор не разработан стандартизированный метод, который мог быть применен к любым антителам для получения очеловеченных антител; поэтому существует необходимость в создании эффективных методов получения очеловеченного антитела, характеризующегося достаточной активностью связывания и нейтрализации специфического антигена (см., например, Sato, К. et al., Cancer Res., 53, 851-856, 1993).
Краткое изложение существа изобретения
Объектом настоящего изобретения является химерное антитело человека/мыши, содержащее вариабельную область (V-область) моноклонального антитела мыши против PTPrH и константную область (С-область) антитела человека; очеловеченное антитело, в котором гипервариабельные участки V-областей легкой цепи (L-цепи) и тяжелой цепи (Н-цепи) моноклонального антитела мыши против PTPrH трансплантированы в антитело человека; L- и Н-цепи указанного антитела, а также полипептид, содержащий V-область, состоящую из L- или Н-цепи указанного антитела.
Другим объектом настоящего изобретения является получение ДНК, содержащей последовательность оснований, кодирующую вышеуказанное антитело, в частности, его V-область, и ДНК, кодирующей L- или Н-цепь, содержащего полипептида, содержащего V-область. Еще одним объектом настоящего изобретения является создание рекомбинантного вектора, содержащего указанную ДНК, и хозяина, трансформированного указанным вектором. Еще одним объектом настоящего изобретения являются способы получения химерных и очеловеченных антител против PTPrH. Еще одним объектом настоящего изобретения является получение антитела против PTPrH, обладающего сильной нейтрализующей активностью. Еще одним объектом настоящего изобретения является создание фармацевтической композиции и средства для подавления гиперкальциемии, или улучшения при гипофосфатемии и алкалозе содержащего антитело или очеловеченное антитело против PTPrH в качестве активного ингредиента.
В результате всестороннего исследования, направленного на достижение вышеуказанных целей, авторами настоящего изобретения было получено антитело с низкой иммуногенностью моноклональных антител мыши против PTPrH в организме человека; так было завершено данное изобретение.
Объектом настоящего изобретения является химерная L-цепь, содержащая С-область L-цепи антитела человека и V-область L-цепи моноклонального антитела мыши против PTPrH. V-область L-цепи содержит одну аминокислотную последовательность, выраженную последовательностью с идентификационным №45, и С-область L-цепи включает Сλ-область.
Объектом настоящего изобретения является также химерная Н-цепь, содержащая С-область Н-цепи антитела человека и V-область Н-цепи моноклонального антитела мыши против PTPrH. V-область Н-цепи содержит аминокислотную последовательность, выраженную последовательностью с идентификационным №46, и С-область включает Сγ 1-область.
Кроме того, объектом настоящего изобретения является химерное моноклональное антитело против PTPrH, содержащее указанную химерную L-цепь и указанную химерную Н-цепь.
Объектом настоящего изобретения далее является полипептид, имеющий V-область L-цепи очеловеченного антитела, которая содержит каркасные области 1-4 V-области L-цепи антитела человека и гипервариабельные участки 1-3 V-области L-цепи моноклонального антитела мыши против PTPrH. Гипервариабельные участки 1-3 содержат аминокислотные последовательности, выраженные соответственно последовательностями с идентификационными №№59-61; каркасные области 1-3 получены из каркасных областей 1-3 антитела человека HSU03868 и каркасная область 4 получена из каркасной области 4 антитела человека S25755; или каркасные области 1-3 по существу идентичны каркасным областям 1-3 антитела человека HSU03868, и каркасная область 4 по существу идентична каркасной области 4 антитела человека S25755.
Термин "по существу идентичный" означает, что каркасные области антитела человека, используемые в очеловеченном антителе, могут иметь делеции, замены и/или добавления аминокислот, необходимые для образования гипервариабельных участков моноклонального антитела мыши, в результате чего очеловеченное антитело должно обладать активностью, которая эквивалентна активности моноклонального антитела мыши.
Таким образом, настоящее изобретение относится к полипептиду, имеющему V-область L-цепи очеловеченного антитела, в которой 36-я и 49-я аминокислоты в каркасных областях в соответствии с рекомендациями Кабата (Kabat, E.A. et al., US Dept. Health and Human Services, US Government Printing Offices, 1991) являются соответственно тирозиновой и аспарагиновой кислотой.
Настоящее изобретение относится также к полипептиду, имеющему V-область L-цепи очеловеченного антитела, которая содержит аминокислотную последовательность, выраженную любой последовательностью с идентификационными №№48-51.
Настоящее изобретение далее относится к полипептиду, имеющему V-область L-цепи очеловеченного антитела, где 45-я и 87-я аминокислоты в каркасных областях в соответствии с рекомендациями Кабата являются соответственно лизином и изолейцином.
Настоящее изобретение далее относится к полипептиду, имеющему V-область L-цепи очеловеченного антитела, которая содержит аминокислотную последовательность, выраженную любой последовательностью с идентификационными №№52-55.
Настоящее изобретение далее относится к полипептиду, имеющему V-область Н-цепи очеловеченного антитела, которая содержит каркасные области 1-4 V-области Н-цепи V-области антитела человека и гипервариабельные участки 1-3 V-области Н-цепи V-области моноклонального антитела мыши против PTPrH человека. Гипервариабельные участки 1-3 содержат аминокислотные последовательности, выраженные соответственно последовательностями с идентификационными №№62-64, каркасные области 1-4 выделены из каркасных областей 1-4 антитела человека, относящегося к человеческой подгруппе III (HSG III, Kabat, E.A. et al., US Dept. Health and Human Services, US Government Printing Offices, 1991), в частности, из каркасных областей 1-4 антитела человека S31679 соответственно, или они по существу идентичны каркасным областям 1-4 антитела человека S31679, соответственно.
Кроме того, настоящее изобретение относится к полипептиду, имеющему V-область Н-цепи очеловеченного антитела, которая содержит аминокислотную последовательность, выраженную последовательностью с идентификационным №56.
Настоящее изобретение относится также к L-цепи очеловеченного антитела против PTHrP человека, которая содержит полипептид, имеющий V-область L-цепи указанного очеловеченного антитела, и полипептид, имеющий С-область L-цепи антитела человека. С-область включает Сλ-область, каркасные области 1-3 по существу идентичны каркасным областям 1-3 антитела человека HSU03868, каркасная область 4 по существу идентична каркасной области 4 антитела человека S25755, и аминокислотные последовательности гипервариабельных участков 1-3 выражены соответственно последовательностями с идентификационными №№59-61.
Настоящее изобретение далее относится к Н-цепи очеловеченного антитела против PTHrP человека, которая содержит полипептиды, имеющие С-область Н-цепи и V-область Н-цепи указанного антитела человека. С-область включает Сγ 1-область, каркасные области 1-4 выделены из каркасных области 1-4 антитела человека, относящегося к HSGIII, и гипервариабельные области 1-3 содержат аминокислотные последовательности, выраженные соответственно последовательностями с идентификационными №№62-64.
Настоящее изобретение далее относится к антителу против PTHrP со слабой антигенностью и высокой нейтрализующей активностью. Антитело против PTHrP включает антитело человека, очеловеченное антитело, химерное антитело и приматированное антитело, которые можно использовать для лечения заболеваний человека. Указанное антитело характеризуется низкой константой диссоциации. Кроме того, антитело по настоящему изобретению обладает высокой нейтрализующей активностью благодаря низкой константе диссоциации, поэтому его можно использовать для лечения заболеваний человека.
Антитело по настоящему изобретению имеет константу диссоциации, равную 1,86×10-7 [М] или меньше, константу скорости диссоциации, равную 1,22×10-1 [1/сек] или меньше, и константу скорости ассоциации, равную 6,55×104 [1/М.сек] или больше. Эти константы можно измерить с помощью анализа Скатчарда, используя меченные радиоактивным изотопом лиганды или резонансный сенсор поверхностного плазмона.
Настоящее изобретение далее относится к ДНК, содержащей последовательность оснований, кодирующую V-область L-цепи или V-область Н-цепи моноклонального антитела мыши против PTHrP человека. V-область L-цепи и V-область Н-цепи содержат аминокислотные последовательности, выраженные соответственно последовательностями с идентификационными №№45-46;
ДНК, кодирующая V-область L-цепи, содержит, например, последовательность оснований, выраженную последовательностью с идентификационным №65, и ДНК, кодирующая V-область Н-цепи, содержит последовательность оснований, выраженную последовательностью с идентификационным №57.
Настоящее изобретение далее относится к ДНК, кодирующей указанную химерную L- или Н-цепь. ДНК, кодирующая L-цепь, содержит, например, последовательность оснований, выраженную последовательностью с идентификационным №65, и ДНК, кодирующая Н-цепь, содержит последовательность оснований, выраженную последовательностью с идентификационным №57.
Настоящее изобретение относится также к ДНК, содержащей последовательность оснований, кодирующую V-область L-цепи или V-область Н-цепи указанного очеловеченного антитела. ДНК, содержащая последовательность оснований, кодирующую V-область L-цепи, выражена любой последовательностью с идентификационными №№66-74, и ДНК, содержащая последовательность оснований, кодирующую V-область Н-цепи, выражена последовательностью с идентификационным №58.
Настоящее изобретение относится также к ДНК для V-области L-цепи очеловеченного антитела, которая содержит последовательность оснований, кодирующую аминокислотную последовательность, выраженную любой последовательностью с идентификационными №№47-55. Указанная ДНК содержит последовательность оснований, выраженную одной из последовательностей с идентификационными №№66-74.
Настоящее изобретение далее относится к ДНК для V-области Н-цепи очеловеченного антитела, которая кодирует аминокислотную последовательность, выраженную последовательностью с идентификационным №56. Указанная ДНК содержит последовательность оснований, выраженную последовательностью с идентификационным №58.
Настоящее изобретение далее относится к рекомбинантному вектору, содержащему любые указанные ДНК.
Настоящее изобретение относится также к трансформанту, преобразованному с помощью указанного рекомбинантного вектора.
Кроме того, настоящее изобретение относится к способу получения химерного или очеловеченного антитела против белка, родственного паращитовидному гормону человека, который включает: культивирование указанного трансформанта и выделение из полученной культуры химерного или очеловеченного антитела против белка, родственного паращитовидному гормону человека.
Настоящее изобретение далее относится к фармацевтической композиции или средству, предназначенному для подавления гиперкальциемии или улучшения при гипофосфатемии, которые содержат указанное антитело в качестве активного ингредиента. Кальциемия возникает вследствие злокачественного заболевания и гипофосфатемия часто наблюдается у субъектов, страдающих гиперкальциемией, обусловленной злокачественной опухолью. Таким образом, антитело по настоящему изобретению можно использовать для лечения злокачественной опухоли или ослабления симптомов гиперкальциемии или гипофосфатемии. Злокачественная ткань может включать, но не ограничиваться, по крайней мере одной, выбранной из группы рака поджелудочной железы, легкого, глотки, гортани, языка, десны, пищевода, желудка, желчных протоков, молочной железы, почек, мочевого пузыря, матки и предстательной железы, а также злокачественной лимфомы. Средство по настоящему изобретению, предназначенное для подавления гиперкальциемии, можно использовать в случае любого злокачественного заболевания, вызывающего гиперкальциемию.
Подробно настоящее изобретение будет описано ниже.
1. Получение моноклональных антител мыши против PTHrP человека
Моноклональные антитела мыши против PTHrP человека можно получить путем создания гибридом в результате слияния миеломных клеток и антителообразующих клеток, выделенных у животных, иммунизированных антигеном, и выбора из полученных гибридом клонов, продуцирующих антитела, которые специфически ингибируют активность PTHrP.
(1) Получение антигенов
PTHrP, используемый для иммунизации животных, включает пептиды, содержащие всю или часть аминокислотной последовательности PTHrP, полученного с помощью технологии получения рекомбинантных ДНК или химического синтеза, и PTHrP, выделенного из супернатантов раковых клеток, вызывающих гиперкальциемию. Например, в качестве антигена можно использовать пептид [PTHrP(1-34)], содержащий аминокислоты 1-34 известного PTHrP (Kemp, B.E. et al., Science (1987) 238, 1568-1570). PTHrP (1-34) человека имеет аминокислотную последовательность, выраженную последовательностью с идентификационным №75.
Полученный PTHrP присоединяют к белку-носителю, такому как тироглобулин, с последующим добавлением адъюванта. Можно смешивать любой адъювант, включая полные и неполные адъюванты Фрейнда.
(2) Иммунизация и выделение антителообразующих клеток
Полученный выше антиген вводят млекопитающему, такому как мышь, крыса, лошадь, обезьяна, кролик, коза или овца. Иммунизацию можно осуществлять любыми известными методами, включая внутривенные, подкожные и внутрибрюшинные инъекции. Временные интервалы между инъекциями с целью иммунизации не имеют каких-либо конкретных ограничений и могут составлять от нескольких дней до нескольких недель, предпочтительно от 4 дней до 21 дня.
Через два или три дня после последней иммунизации выделяют антителообразующие клетки. Антителообразующими клетками являются клетки селезенки, лимфатического узла и периферической крови; причем обычно используют клетки селезенки. Однократная доза антигена, предназначенного для иммунизации, составляет 100 мкг/мышь.
(3) Определение титров антител
Чтобы определить уровни иммунной реакции иммунизированных животных и выбрать представляющие интерес гибридомы из клеток, подвергнутых слиянию, измеряют титр антител в крови иммунизированного животного или титр антител в супернатанте антителообразующих клеток.
Методы детектирования антител хорошо известны и включают иммуноферментный анализ (EIA), радиоиммунный анализ (RIA) и твердофазный иммуноферментный анализ (ELISA).
(4) Слияние клеток
Миеломные клетки, используемые для слияния с антителообразующими клетками, включают линии клеток, которые получают у разных животных, таких как мыши, крысы и человек, и, как правило, могут быть легко получены специалистами в этой области. Приемлемые линии клеток характеризуются лекарственной устойчивостью, неспособностью выживать в избирательной среде, такой как НАТ-среда, в несвязанном состоянии, и способностью выживать в указанной среде только в связанном состоянии. Обычно используют линии клеток, устойчивые к 8-азагуанину, у которых отсутствует гипоксантин-гуанин-фосфорибозилтрансфераза и которые не могут расти в гипоксантин-аминоптерин-тимидиновой (HAT) среде.
Пригодными для использования миеломными клетками являются разные известные линии клеток, такие как Р3 (P3x63Ag8.653) (J.Immunl. (1979) 123:1548-1550); P3x63Ag8U.l (Current Topics in Microbiology and Immunology (1978) 81:1-7); NS-1 (Kohler, G and Milstein, C., Eur. J.Immunol. (1976) 6:511-519); MPC-11 (Margulies, D.H. et al., Cell (1976) 8:405-415); SP2/0 (Shulman, M. et al., Nature (1978) 276:269-170); FO (de St. Groth, S.F. et al., J.Iinmunol. Methods (1980) 35:1-21); S194 (Trowbridge, I.S, J.Exp.Med. (1978) 148:313-323) и R210 (Galfre, G. et al., Nature (1979) 277:131-133).
Антителообразующие клетки можно получить из клеток селезенки, лимфатического узла или подобных клеток. С этой целью у любого из вышеуказанных животных удаляют селезенку, лимфатический узел или другой орган и ткань измельчают. Полученный измельченный материал суспендируют в среде или буфере, таком как забуференный фосфатом физиологический раствор (PBS), модифицированная по способу Дульбекко среда Игла (DMEM) или RPMI1640, фильтруют через фильтр из нержавеющий стали или тому подобный и центрифугируют с получением требуемых антителообразующих клеток.
Затем указанные миеломные клетки и антителообразующие клетки подвергают слиянию.
Слияние клеток можно осуществлять путем соединения миеломных и антителообразующих клеток в отношении от 1:1 до 1:10 в среде для культивирования животных клеток, такой как минимальная поддерживающая среда (MEM), DMEM или RPME-1640, в присутствии акселератора слияния при температуре 30-37°С в течение 1-15 минут. Для ускорения слияния клеток можно использовать любой акселератор слияния или вирус, такой как полиэтиленгликоль со средней молекулярной массой 1000-6000, поливиниловый спирт или вирус Сендай. Слияние антителообразующих и миеломных клеток можно также осуществлять в промышленно доступном аппарате для слияния клеток с использованием электрической стимуляции, такой как электропорация.
(5) Отбор и клонирование гибридом
Представляющие интерес гибридомы отбирают из клеток после слияния клеток, например, по методу селективного выращивание клеток в селективных средах.
С этой целью суспензию клеток разводят в приемлемой среде и инокулируют на титрационном микропланшете. В каждую лунку добавляют селективную среду, такую как НАТ-среда, и инкубируют, периодически заменяя указанную селективную среду свежей средой.
Выращенные клетки собирают и используют в качестве гибридом.
Эти гибридомы затем исследуют посредством ограниченного разведения, клеточного сортера, активируемого флуоресценцией, или другим способом. И, наконец, получают гибридомы, продуцирующие моноклональное антитело.
(6) Выделение моноклональных антител
Для получения моноклональных антител из полученных гибридом обычно используют способы культивирования клеток и образования асцита.
В соответствии со способом культивирования клеток, гибридомы культивируют в среде для выращивания животных клеток, такой как RPMI-1640, содержащая 10-20% сыворотки плода коровы, минимальная поддерживающая среда или бессывороточная среда, в приемлемых условиях (например, 37°С, 5% СО2) в течение 2-14 дней, после чего антитела выделяют из супернатанта.
В соответствии со способом образования асцита, гибридомы внутрибрюшинно инокулируют млекопитающему того же вида, который используют в качестве источника миеломных клеток, для достижения обильного роста гибридом. Через 1-4 недели получают асцит или сыворотку.
Для получения очищенных антител используют отдельно или в сочетании такие известные способы, как осаждение сульфатом аммония, ионообменную хроматографию и аффинную хроматографию.
2. Конструирование химерных антител
(1) Клонирование ДНК, содержащей последовательность оснований, кодирующую V-область моноклоналъного антитела мыши против PTHrP человека.
(i) Получение мРНК
Чтобы клонировать ДНК, содержащую последовательность оснований, кодирующую V-область моноклонального антитела мыши против PTHrP человека, полученные гибридомы обрабатывают известным способом, например, гуанидин-ультрацентрифугированием (Chirgwin, J.M. et al., Biochemistry (1979) 18, 5294-5299) или методом AGPC (Chomczynski, P. et al., Analytical Biochemistry (1987) 162, 156-159), с получением полной РНК, из которой выделяют мРНК, например, в разделительной колонке с олиго(тимидин)целлюлозным наполнителем, которая входят в набор для очистки мРНК (Pharmacia). Для получения мРНК можно также использовать набор для очистки мРНК Quick Prep (Pharmacia AB), при этом не нужно выделять полную РНК.
(ii) Получение и амплификация кДНК
Из полученной выше (i) мРНК синтезируют кДНК в V-областях L- и Н-цепей с использованием обратной транскриптазы. В процессе синтеза кДНК можно использовать затравку, такую как олиготимидин, или любую другую приемлемую затравку, которая гибридизирует с С-областью L- или Н-цепи, например, затравку МНС2, имеющую последовательность оснований, выраженную последовательностью с идентификационным №1.
Для синтеза кДНК указанную мРНК и затравку смешивают и подвергают взаимодействию в присутствии обратной транскриптазы, например, при температуре 52°С в течение 30 минут.
Амплификацию кДНК как L-цепи, так и Н-цепи можно осуществлять путем полимеразной реакции синтеза цепи (PCR) по методу 5'-RACE (Frohman, M.A. et al., Proc. Natl. Acad. Sci. USA, 85, 8998-9002, 1988; Belyavsky, A. et al., Nu-cleic Acids Res., 17, 2919-2932, 1989) с использованием набора 5'-Ampli FINDER RACE (CLONTECH Inc.). Таким образом, связывающий фрагмент Ampli FINDER (последовательность с идентификационным №42) присоединяют к 5' концу синтезированной выше кДНК и осуществляют полимеразную реакцию синтеза цепи в отношении ДНК, содержащей последовательности оснований, кодирующие V-области L- и Н-цепей. (ДНК, содержащая последовательность оснований, кодирующую V-область L-цепи, далее иногда определяется как "ДНК для V-области L-цепи" или "ДНК, кодирующая V-область L-цепи". То же самое относится к V-области Н-цепи, С-области и т.д.).
Приемлемой затравкой для амплификации ДНК, кодирующей V-область L-цепи, может быть, например, связывающая затравка (последовательность с идентификационным №2) и затравки, полученные из консервативных последовательностей в константной области Lλ-цепи (Сλ-область) антител мыши, такие как затравка MLC, имеющая последовательность оснований, выраженную последовательностью с идентификационным №4. Приемлемой затравкой для амплификации ДНК, кодирующей V-область Н-цепи, может быть, например, связывающая затравка (последовательность с идентификационным №2) и затравка MHC-G1 (последовательность с идентификационным №3) (S.Т.Jones, et al., Biotechnology, 9, 88, 1991).
(iii) Очистка ДНК и определение последовательности оснований
Продукты полимеразной реакции синтеза цепи (PCR) подвергают электрофорезу в агарозном геле известными способами с целью вырезания представляющих интерес фрагментов ДНК, которые затем выделяют, очищают и лигируют с векторной ДНК.
Очистку ДНК можно осуществлять с помощью промышленно доступных наборов, таких как GENECLEAN II; BIО101. Векторная ДНК, несущая фрагменты ДНК, известна; с этой целью можно, например, использовать pUC19 или Bluescript.
Указанную ДНК и векторную ДНК лигируют с помощью известного набора для лигирования (Takara Shuzo) с получением рекомбинантного вектора.
Полученный рекомбинантный вектор вводят в Escherichia coli JM109 и в устойчивые к ампициллину колонии; таким образом, векторную ДНК получают известным способом (J.Sambrook, et al., "Molecular Cloning", Cold Spring Harbor Laboratory Press, 1989). После расщепления векторной ДНК одним или несколькими рестрикционными ферментами, последовательность оснований требуемой ДНК определяют известным способом, таким как дидезокси способ (J. Sambrook, et al., "Molecular Cloning", Cold Spring Harbor Laboratory Press, 1989). При осуществлении настоящего изобретения можно использовать автоматическое устройство для определения последовательности оснований (секвенатор ДНК 373А; ABI Inc.).
(iv) Гипервариабельный участок
V-области Н- и L-цепи образуют антигенсвязывающий сайт, и их полные структуры обладают некоторым сходством. То есть, четыре участка каркасной области (FR) связаны тремя гипервариабельными участками (CDR). Аминокислотная последовательность в каркасной области является достаточно консервативной, в то время как аминокислотная последовательность гипервариабельного участка отличается высокой вариабельностью (Kabat, E.A. et al., "Sequence of Proteins of Immunological Interest", US Dept. Health and Human Services, 1983).
Многие участки указанных четырех каркасных областей имеют β-складчатую структуру, вследствие чего три гипервариабельных участка образуют петлю. Гипервариабельный участок может иногда составлять часть β-складчатой структуры. Поэтому три гиперварибельных участка в пространственном отношении расположены очень близко друг к другу из-за указанной структуры каркасных областей, которые образуют антигенсвязывающий сайт вместе с тремя гипервариабельными участками в спаренных областях.
С учетом этих факторов гипервариабельные участки можно обнаружить путем сравнения аминокислотной последовательности в вариабельной области моноклонального антитела мыши против PTHrP человека с базой данных по структуре аминокислотных последовательностей для антител, полученных по методу Кабата и др. ("Sequence of Proteins of Immunological Interest", US Dept. Health and Human Services, 1983), с целью исследования их гомологии.
(2) Конструирование экспрессирующего вектора химерного антитела
После клонирования фрагментов ДНК, кодирующей V-области L- и Н-цепи моноклонального антитела мыши (далее L- или Н-цепь антитела иногда определяется как "L-цепь мыши" и т.д. для антител мыши и "Н-цепь человека" и т.д. для антител человека), ДНК, кодирующие V-области мыши, и ДНК, кодирующие константные области антитела человека, лигируют и экспрессируют с получением химерных антител против PTHrP человека.
Стандартным способом получения химерных антител является лигирование лидерной последовательности мыши и последовательности V-области, присутствующей в клонированной кДНК, с последовательностью, кодирующей С-область антитела человека, которая уже имеется в экспрессирующем векторе клетки млекопитающего. Альтернативно, лидерную последовательность мыши и последовательность V-области, присутствующую в клонированной кДНК, лигируют с последовательностью, кодирующей С-область антитела человека, и затем лигируют с экспрессирующим вектором клетки млекопитающего.
Полипептид, содержащий С-область антитела человека, может представлять собой любые С-области Н- или L-цепи, включая, например, Сγ1, Сγ2, Сγ3 или Сγ4 для Н-цепей человека или Cλ или Сk для L-цепей.
Чтобы получить химерное антитело, сначала конструируют два экспрессирующих вектора; то есть, экспрессирующий вектор, содержащий ДНК, кодирующие V-область L-цепи мыши и С-область L-цепи человека, под контролем регулирующей экспрессию области, такой как система энхансер/промотор, и экспрессирующий вектор, содержащий ДНК, кодирующие V-область Н-цепи мыши и С-область Н-цепи человека, под контролем регулирующей экспрессию области, такой как система энхансер/промотор. Затем клетки-хозяева, такие как клетки млекопитающих, котрансформируют с помощью этих экспрессирующих векторов, после чего трансформированные клетки культивируют in vitro или in vivo с целью получения химерного антитела (см., например, WO 91/16928).
Альтернативно лидерную последовательность мыши, имеющуюся в клонированной кДНК и ДНК, кодирующих V-область L-цепи мыши и С-область L-цепи человека, а также лидерную последовательность мыши и ДНК, кодирующие V-область Н-цепи мыши и С-область Н-цепи человека, вводят в один экспрессирующий вектор (см., например, WO 94/11523) и используют указанный вектор для трансформации клетки-хозяина; после чего трансформированную клетку-хозяина культивируют in vivo или in vitro с целью получения требуемого химерного антитела.
(i) Получение Н-цепи химерного антитела
Вектор экспрессии Н-цепи химерного антитела можно получить путем введения кДНК, содержащей последовательность оснований, кодирующую V-область Н-цепи мыши (далее определяется так же как "кДНК для V-области Н-цепи"), в приемлемый экспрессирующий вектор, содержащий геномную ДНК с последовательностью оснований, кодирующей С-область Н-цепи антитела человека (далее определяется так же как "геномная ДНК для С-области Н-цепи"), или кДНК, кодирующую указанную область (далее определяется так же как "кДНК для С-области Н-цепи"). С-область Н-цепи включает, например, Сγ1, Сγ2, Сγ3 или Сγ4 области.
(i-a) Конструирование экспрессирующего вектора химерной Н-цепи, содержащего геномную ДНК, кодирующую С-область Н-цепи
Экспрессирующие векторы, содержащие геномную ДНК, кодирующую С-область Н-цепи, в частности, кодирующие Сγ1-область, включают, например, HEF-PMh-gγ1 (WO 91/19759) и DHFR-ΔE-RVh-PMl-f (WO 92/19759).
После введения в эти экспрессирующие векторы кДНК, кодирующей V-область Н-цепи мыши, в указанную кДНК можно ввести соответствующую последовательность оснований способом полимеразной реакции синтеза цепи (PCR). Например, чтобы ввести в экспрессирующий вектор соответствующие последовательности оснований, полимеразную реакцию синтеза цепи можно осуществлять с помощью затравки для PCR, которая предназначена для получения кДНК, содержащей узнающую последовательность для приемлемого рестрикционного фермента у 5'-конца и согласованную последовательность Козака, расположенную непосредственно перед инициирующим кодоном, с целью повышения эффективности транскрипции, и затравки для PCR, которая предназначена для получения кДНК, содержащей узнающую последовательность для приемлемого рестрикционного фермента у 3'-конца и донорскую область, что необходимо для правильного сплайсинга первичных продуктов транскрипции геномной ДНК с целью получения мРНК, для введения указанных последовательностей оснований в экпрессирующий вектор.
После обработки сконструированной таким образом кДНК, кодирующей V-область Н-цепи мыши, одним или несколькими приемлемыми рестрикционными ферментами ее вставляют в указанный экспрессирующий вектор с целью создания экспрессирующего вектора химерной Н-цепи, содержащего геномную ДНК, кодирующую С-область Н-цепи (Cγ1-область).
(i-b) Конструирование экспрессирующего вектора химерной Н-цепи, содержащего кДНК с последовательностью оснований, кодирующей Н-цепь
Экспрессирующие векторы, содержащие кДНК, кодирующую С-область Н-цепи, такую как Cγ1-область, можно сконструировать следующим образом: мРНК получают из клеток яичника китайского хомячка, в которые вводят экспрессирующий вектор DHFR-ΔE-RVh-PMI-f (см. WO 91/19759), содержащий ДНК, кодирующую V-область Н-цепи очеловеченного антитела РМ1, и геномную ДНК С-области Н-цепи (Сγ1) антитела человека (N. Takahashi, et al., Cell, 29, 671-679 (1982)), и экспрессирующий вектор RVl-PM1a (см. WO91/19759), содержащий геномную ДНК, кодирующую V-область L-цепи очеловеченного антитела РМ1, и геномную ДНК С-области Lκ-цепи антитела человека; по методу RT-PCR клонируют кДНК, кодирующую V-область Н-цепи очеловеченного антитела РМ1, и кДНК, кодирующую С-область Н-цепи (Сγ1) антитела человека, и лигируют с экспрессирующим вектором животной клетки, который обрабатывают приемлемым рестрикционным ферментом, для конструирования желаемого экспрессирующего вектора.
Когда кДНК, кодирующая V-область Н-цепи мыши, лигирована непосредственно с кДНК, кодирующей С-область Н-цепи (Сγ1) антитела человека, во фрагмент, содержащий кДНК, кодирующую V-область Н-цепи, можно ввести соответствующие последовательности оснований по методу PCR. Например, полимеразную реакцию синтеза цепи можно осуществить с помощью специальной затравки для PCR, которая предназначена для получения кДНК, содержащей узнающую последовательность для приемлемого рестрикционного фермента у 5'-конца и согласованную последовательность Козака, расположенную непосредственно перед инициирующим кодоном, с целью повышения эффективности транскрипции, и затравки для PCR, которая предназначена для получения кДНК, содержащей узнающую последовательность для приемлемого рестрикционного фермента у 3'-конца, что необходимо для прямого лигирования с С-областью Н-цепи (Сγ1) с целью введения указанных последовательностей оснований в указанную кДНК.
Сконструированную таким образом кДНК, кодирующую V-область Н-цепи мыши, обрабатывают одним или несколькими приемлемыми рестрикцинными ферментами, лигируют с кДНК, кодирующей С-область Н-цепи (Сγ1), и вставляют в экспрессирующий вектор, такой как pCOS1 или pCHO1, с целью создания экспрессирующего вектора, содержащего кДНК, кодирующую химерную Н-цепь.
(ii) Получение L-цепи химерного антитела
Вектор экспрессии L-цепи химерного антитела можно получить путем лигирования кДНК, кодирующей V-область L-цепи мыши, с геномной ДНК или кДНК, кодирующей С-область L-цепи антитела человека, и введения в приемлемый экспрессирующий вектор. С-область L-цепи включает, например, κ-цепь и λ-цепь.
(ii-a) Конструирование экспрессирующего вектора, содержащего кДНК, кодирующую химерную Lλ-цепь
Сконструировав экспрессирующий вектор, содержащий кДНК, кодирующую V-область L-цепи мыши, в указанный экспрессирующий вектор можно ввести соответствующие последовательности оснований по методу PCR. Например, полимеразную реакцию синтеза цепи можно осуществить с помощью специальной затравки для PCR, которая предназначена для получения кДНК, содержащей узнающую последовательность для приемлемого рестрикционного фермента у 5'-конца и согласованную последовательность Козака, с целью повышения эффективности транскрипции, и затравки для PCR, которая предназначена для получения кДНК, содержащей узнающую последовательность для приемлемого рестрикционного фермента у 3'-конца, что необходимо для введения указанных последовательностей оснований в указанную кДНК.
Всю последовательность оснований кДНК, кодирующей С-область Lλ-цепи человека, можно синтезировать с помощью синтезатора ДНК и сконструировать по способу PCR. Известно, что С-область Lλ-цепи человека, имеет по крайней мере 4 разных изотипа, и каждый изотип можно использовать для создания экспрессирующего вектора. Например, на основании данных о гомологии с С-областями Lλ-цепи клонированных моноклональных антител мыши можно выбрать изотип Mcg+Ke+Oz-фрагмента С-области Lλ-цепи человека (№ Х57819) (P.Dariavach et al., Proc. Nati. Acad. Sci. USA, 84, 9074-9078, 1987) и использовать его для создания экспрессирующего вектора. Чтобы сконструировать кДНК для известной С-области Lλ-цепи человека, такой как Mcg+Ke+Oz-, можно использовать четыре нижеследующие затравки, выраженные последовательностями с идентификационными №№11-14: затравки MBC1HGP1 (последовательность с идентификационным №11) и MBC1HGP3 (последовательность с идентификационным №13) содержат смысловые последовательности ДНК, а затравки MBC1HGP2 (последовательность с идентификационным №12) и MBC1HGP4 (последовательность с идентификационным №14) содержат антисмысловые последовательности ДНК, причем каждая затравка имеет комплементарную последовательность длиной от 20 до 23 пар оснований у каждого конца.
MBC1HGPS (последовательность с идентификационным №15) и MBC1HGPR (последовательность с идентификационным №16) являются внешними затравками, имеют последовательности, гомологичные соответственно MBC1HGP1 и MBC1HGP4, и узнающую последовательность для приемлемого рестрикционного фермента. Произведя сборку четырех затравкок по методу PCR, синтезируют полную цепь кДНК и добавляют внешние затравки для амплификации кДНК.
Сборку по способу PCR производят следующим образом: у MBC1HGP1 и MBC1HGP2 или MBC1HGP3 и MBC1HGP4 гибридизируют комплементарные последовательности, синтезируя фрагмент MBC1HGP1-MBC1HGP2 и фрагмент MBC1HGP3-MBC1HGP4, после чего у каждого фрагмента снова гибридизируют комплементарные последовательности, синтезируя кДНК, кодирующую непроцессированную С-область Lλ-цепи человека.
Сконструированную таким образом кДНК, кодирующую С-область Lλ-цепи человека, и сконструированную выше кДНК, кодирующую V-область L-цепи мыши, можно лигировать между приемлемыми сайтами рестрикционных ферментов и вставить в экспрессирующий вектор, такой как pCOS1 или pCHO1, с целью создания экспрессирующего вектора, содержащего кДНК, кодирующую Lλ-цепь химерного антитела.
(ii-b) Конструирование экспрессирующего вектора, содержащего кДНК, кодирующую химерную Lκ-цепь
Сконструировав экспрессирующий вектор, содержащий кДНК, кодирующую V-область L-цепи, в указанную кДНК можно ввести соответствующие последовательности оснований по способу PCR. Например, полимеразную реакцию синтеза цепи можно осуществить с помощью специальной затравки для PCR, которая предназначена для получения кДНК, содержащей узнающую последовательность для приемлемого рестрикционного фермента у 5'-конца и согласованную последовательность Козака, с целью повышения эффективности транскрипции, и затравки для PCR, которая предназначена для получения кДНК, содержащей узнающую последовательность для приемлемого рестрикционного фермента у 3'-конца, что необходимо для введения указанных последовательностей оснований в указанную кДНК.
ДНК, кодирующую С-область Lκ-цепи человека, которая предназначена для лигирования с ДНК, кодирующей V-область L-цепи мыши, можно сконструировать, например, из HEF-PM1k-gk, содержащей геномную ДНК (см. WO 92/19759).
Узнающие последовательности для приемлемых рестрикционных ферментов можно ввести по способу PCR в 5'- и 3'-концы ДНК, кодирующей С-область Lκ-цепи, и ДНК, кодирующую V-область L-цепи мыши, и ДНК, кодирующую С-область Lκ-цепи, можно лигировать друг с другом и вставить в экспрессирующий вектор, такой как pCOS1 или pCHO1, с целью создания экспрессирующего вектора, содержащего кДНК, кодирующую Lκ-цепь химерного антитела.
3. Получение очеловеченных антител
(1) Выявление гомологии с антителами человека
Чтобы получить очеловеченное антитело, в котором гипервариабельный участок моноклонального антитела мыши трансплантирован в антитело человека, желательно, чтобы между каркасными областями многоклонального антитела мыши и антитела человека существовала значительная гомология. Поэтому необходимо произвести сравнение V-областей Н- и L-цепей моноклонального антитела мыши против PTHrP человека с V-областями всех известных антител, структуру которых определяют на основании банка данных по структуре белка. Кроме того, одновременно производят сравнение с подгруппами антител человека (HSG: человеческая подгруппа), классифицированными Кабатом и др., с учетом длины каркасной области антитела, гомологии аминокислот и тому подобного (Kabat, E.A. et al., US Dep.Health and Human Services, US Government Printing Offices, 1991).
V-области Н-цепи человека можно отнести к одной из подгрупп HSG I-III на основании классификации Кабата и др., при этом V-области Н-цепи моноклонального антитела мыши против PTHrP человека характеризуются 82,7% гомологией с согласованной последовательностью подгруппы HSG III. С другой стороны, V-области Lλ-цепи человека можно отнести к одной из подгрупп HSG I-VI на основании классификации Кабата и др., при этом V-области Lλ-цепи моноклонального антитела мыши против PTHrP человека не обладают достаточно высокой гомологией с согласованными последовательностями V-областей Lλ-цепи человека, входящими в эти подгруппы.
Если необходимо очеловечить моноклональное антитело мыши против PTHrP человека, то желательно использовать V-область Н-цепи человека, которая относится к подгруппе HSG III и обладает самой высокой гомологией, или V-область Н-цепи человека, в которой каркасная область имеет соответствующую стандартную структуру (Chothia С, et al., J. Mol. Biol., 196, 901-917, 1987). Кроме того, поскольку не существует согласованной последовательности с высокой гомологией в подгруппах V-областей Lλ-цепи человека, для конструирования очеловеченного антитела желательно использовать V-область Lλ-цепи антитела человека с самой высокой гомологией, зарегистрированной в банке данных по структуре белка.
(2) Конструирование ДНК, кодирующей V-область очеловеченного антитела
На первой стадии конструирования ДНК, кодирующей V-область очеловеченного антитела, необходимо выбрать V-область антитела человека в качестве основы для указанной конструкции.
При осуществлении настоящего изобретения в очеловеченном антителе можно использовать каркасную область V-области антитела человека, которая гомологична каркасной области V-области антитела мыши более чем на 80%. Каркасная область V-области Н-цепи, используемая в качестве фрагмента по существу идентичной каркасной области, может включать каркасную область, относящуюся к подгруппе III, такую как S31679 (NBRF-PDB, Cuisinier A.M. et al., Eur.J. Immunol, 23, 110-118, 1993). Кроме того, каркасная область V-области L-цепи, используемая в качестве фрагмента по существу идентичной каркасной области, может включать, например, FR1, FR2 и FR3, выделенные из антитела человека HSU03868 (GEN-BANK, Deftos M. et al., Scand. J. Immunol, 39, 95-103, 1994), и FR4, выделенную из антитела человека S25755 (NBRF-PDB).
Антитело человека S311679 клонировано из библиотеки кДНК печени плода человека, и антитело человека HSU03868 клонировано в качестве нового гена для V-области Lλ-цепи человека.
(3) Получение полипептидов, содержащих V-область очеловеченного антитела
В очеловеченном антителе по настоящему изобретению С-область и каркасные области (FR) V-области указанного антитела взяты у человека, и гипервариабельные участки V-области взяты у мыши. Полипептид, содержащий V-область очеловеченного антитела по настоящему изобретению, можно получить путем трансплантации гипервариабельных участков по методу PCR с использованием в качестве матрицы фрагмента ДНК антитела человека. Способ трансплантации гипервариабельных участков заключается в том, что получают фрагмент ДНК, кодирующей гипервариабельный участок мыши, и заменяют его антителом человека, используемым в качестве матрицы.
Если фрагмент ДНК антитела человека, предназначенного для использования в качестве матрицы, недоступен, последовательность оснований, зарегистрированную в базе данных, можно синтезировать в синтезаторе ДНК, и ДНК для V-области очеловеченного антитела можно получить по способу полимеразной реакции синтеза цепи (PCR). Кроме того, если в базе данных зарегистрирована только аминокислотная последовательность, всю последовательность оснований можно вывести из указанной аминокислотной последовательности с учетом данных об использовании кодонов в антителах по способу Кабата и др. (Kabat, E.A. et al., in US Dep.Health and Human Services, US Government Printing Offices, 1991). Эту последовательность оснований синтезируют в синтезаторе ДНК, затем по методу PCR получают ДНК V-области очеловеченного антитела и вводят в приемлемого хозяина с последующей экспрессией, необходимой для получения требуемого полипептида.
Ниже описываются общие процедуры трансплантации гипервариабельных участков по методу PCR, выполняемые при наличии фрагмента ДНК антитела человека, используемого в качестве матрицы.
(i) Трансплантация гипервариабельных участков
Предположим, что ДНК, кодирующая V-область, представляет собой ДНК, кодирующие FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4, которые связаны друг с другом в указанном порядке.
Сначала синтезируют фрагменты ДНК мыши, соответствующие требуемым гипервариабельным участкам. Гипервариабельные участки 1-3 синтезируют на основе последовательностей оснований ранее клонированных V-областей Н- и L-цепи мыши. Трансплантирующие затравки В и Е синтезируют с таким расчетом, чтобы затравка В имела последовательность, гибридизирующую с CDR1 мыши и FR2 антитела человека в направлении смысловой последовательности, и затравка Е имела последовательность, гибридизирующую с CDR1 и FR1 антитела человека в направлении антисмысловой последовательности. Аналогичным образом синтезируют трансплантирующие затравки С и F и затравки D и G. Помимо этого, синтезируют так называемые "внешние затравки", которые могут соответственно гибридизировать с верхними областями от FR1 и нижними областями от FR4. Трансплантирующие затравки можно выделить и экстрагировать известными методами (Sambrook, et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, 1989).
Затем выполняют первую полимеразную реакцию синтеза цепи, используя трансплантирующую затравку Е и внешнюю затравку А, трансплантирующие затравки В и F, трансплантирующие затравки С и G, а также трансплантирующую затравку D и внешнюю затравку Н, в результате чего соответственно образуются фрагменты А-Е, B-F, C-G и D-H.
Поскольку верхняя область трансплантирующей затравки В и часть нижней области трансплантирующей затравки Е были сконструированы, чтобы перекрывать друг друга (то же самое верно для трансплантирующих затравок С и F, а также D и С), эти фрагменты могут быть гибридизированы с соответствующими комплементарными последовательностями при осуществлении реакции в приемлемых температурных условиях и собраны в результате выполнения полимеразной реакции синтеза цепи с образованием ДНК длиной от А до Н. Получив фрагмент ДНК, кодирующей V-область, можно добавить внешние затравки А и Н и выполнить вторую полимеразную реакцию синтеза цепи, что дает ДНК, кодирующую V-область очеловеченного антитела, в котором каркасные области 1-4 выделены у человека и гипервариабельные участки 1-3 выделены у мыши. Затем эту ДНК можно ввести в приемлемый хозяин для экспрессии с получением требуемого полипептида.
(ii) Конструирование ДНК и экспрессирующего вектора, кодирующего очеловеченную V-область Н-цепи
При осуществлении настоящего изобретения всю последовательность оснований ДНК, кодирующей V-область Н-цепи антитела человека, которая предназначена для использования в качестве матрицы очеловеченного антитела, можно синтезировать в синтезаторе ДНК и сконструировать по способу PCR, хотя указанную ДНК нельзя получить из естественных источников.
V-область Н-цепи моноклонального антитела мыши против PTHrP человека характеризуется высокой гомологичностью с S31679, входящим в человеческую подгруппу III. Для использования этого антитела человека в качестве матрицы для конструирования ДНК, кодирующей очеловеченную V-область Н-цепи, необходимы четыре затравки, выраженные, например, последовательностями с идентификационными №№23-26. Затравки MBC1HGP1 (последовательность с идентификационным №23) и MBC1HGP3 (последовательность с идентификационным №24) содержат смысловые последовательности ДНК, а затравки MBC1HGP2 (последовательность с идентификационным №25) и MBC1HGP4 (последовательность с идентификационным №26) содержат антисмысловые последовательности ДНК. Каждая из них должна иметь с любого конца комплементарную последовательность длиной от 15 до 21 пары оснований.
Внешние затравки MBC1HVS1 (последовательность с идентификационным №27) и MBC1HVR1 (последовательность с идентификационным №28) имеют последовательность, гомологичную соответственно с MBC1HGP1 и MBC1HGP4, и каждая из них содержит узнающую последовательность для соответствующего приемлемого рестрикционного фермента. Четыре затравки собирают по способу PCR и синтезируют непроцессированную кДНК, после чего добавляют внешние затравки для амплификации ДНК. "Сборка по методу PCR" означает гибридизацию MBC1HGP1 и MBC1HGP2 или MBC1HGP3 и MBC1HGP4 по их комплементарным последовательностям с получением фрагмента MBC1HGP1-MBC1HGP3 и фрагмента MBC1HGP2-MBC1HGP4 с последующей гибридизацией этих фрагментов по их комплементарным последовательностям с получением непроцессированной ДНК для очеловеченной V-области Н-цепи.
С-область Н-цепи антитела человека может быть любой С-областью Н-цепи человека, например, Cγ1, Cγ2, Сγ3 или Сγ4 областью Н-цепи человека.
ДНК для V-области Н-цепи очеловеченного антитела, которая получена в соответствии с приведенным выше описанием, можно лигировать с ДНК для любой С-области Н-цепи антитела человека, например. Cγ1-области Н-цепи человека. Как указывалось в разделе "Получение Н-цепи химерного антитела", ДНК для V-области Н-цепи можно обработать приемлемым рестрикционным ферментом и лигировать с ДНК, кодирующей С-область Н-цепи человека, под контролем регулирующей экспрессию области, такой как система энхансер/промотор, с получением экспрессирующего вектора, содержащего ДНК для очеловеченной V-области Н-цепи и С-области Н-цепи человека.
(iii) Конструирование ДНК и экспрессирующего вектора, кодирующего очеловеченную V-область L-цепи
При осуществлении настоящего изобретения всю последовательность оснований ДНК, кодирующей V-область L-цепи антитела человека, используемого в качестве матрицы, можно синтезировать в синтезаторе ДНК и сконструировать по способу PCR, хотя ДНК для V-области L-цепи не доступна так же, как ДНК, кодирующую V-область H-цепи.
Чтобы сконструировать ДНК для очеловеченной V-области L-цепи, используя в качестве матрицы антитело человека SU03868, характеризующееся наибольшей гомологией с V-областью L-цепи моноклонального антитела мыши против PTHrP человека, необходимы четыре затравки, выраженные, например, последовательностями с идентификационными №№29-32. Затравки MBC1LGP1 (последовательность с идентификационным №29) и MBC1LGP3 (последовательность с идентификационным №30) содержат смысловые последовательности ДНК, а затравки MBC1LGP2 (последовательность с идентификационным №31) и MBC1LGP4 (последовательность с идентификационным №32) содержат антисмысловые последовательности ДНК. Все они были сконструированы для того, чтобы иметь комплементарную последовательность длиной от 15 до 21 пары оснований у любого конца.
Внешние затравки MBC1LVS1 (последовательность с идентификационным №33) и MBC1LVR1 (последовательность с идентификационным №34) имеют последовательность, гомологичную соответственно с MBC1LGP1 и MBC1LGP4, и содержат узнающую последовательность для соответствующего приемлемого рестрикционного фермента. Четыре затравки собирают по методу PCR с получением непроцессированной ДНК и добавляют внешние затравки для амплификации ДНК. "Сборка по методу PCR" означает гибридизацию затравок MBC1LGP1 и MBC1LGP3 или затравок MBC1LGP2 и MBC1LGP4 по их комплементарным последовательностям с получением фрагмента MBC1LGP1-MBC1LGP3 и фрагмента MBC1LGP2-MBC1LGP4 с последующей гибридизацией этих фрагментов по их комплементарным последовательностям с получением непроцессированной ДНК, кодирующей очеловеченную V-область Н-цепи.
С-область L-цепи антитела человека может быть любой С-областью L-цепи человека, например, Сλ- или Сκ-областью L-цепи человека.
ДНК для V-области L-цепи очеловеченного антитела, которая получена в соответствии с приведенным выше описанием, можно лигировать с ДНК для любой С-области L-цепи антитела человека, например, Сλ-области L-цепи человека. ДНК для V-области L-цепи можно обработать приемлемым рестрикционным ферментом и лигировать с ДНК, кодирующей С-область Lλ-цепи человека, под контролем регулирующей экспрессию области, такой как система энхансер/промотор, с получением экспрессирующего вектора, содержащего ДНК, кодирующие очеловеченную V-область L-цепи и С-область Lλ-цепи человека.
Факт получения полипептида способом, описанным выше, содержащего V-область очеловеченного антитела, вовсе не означает, что указанный полипептид будет обладать активностью в качестве антитела, например, обладать связывающей или нейтрализующей активностью против своего антигена. Это, в частности, относится к L-цепи, так как V-область L-цепи моноклонального антитела мыши против PTHrP человека выделена из очень редкого Vλx-гена, поэтому необходимо исследовать указанный полипептид в отношении наличия или отсутствия у него данной активности путем соединения его с очеловеченной Н-цепыо и экспрессии в животной клетке, такой как COS-7.
Эффективным способом выявления каркасной области в V-области очеловеченного антитела, обладающей связывающей и нейтрализующей активностью очеловеченного антитела, может быть конструирование гибридной V-области (Ohtomo, T.et al., Molecular Immunology, 32, 407-416, 1995) и подтверждение полученных результатов. Чтобы выявить аминокислоту в V-области L-цепи очеловеченного антитела по настоящему изобретению, которую необходимо мутировать с получением аминокислоты, обладающей требуемой активностью, конструируют ДНК, в которой фрагмент каркасной области очеловеченного антитела рекомбинирован фрагментом каркасной области, выделенным у мыши, после чего каждую область анализируют в отношении очеловечивания.
Получают антитело с полипептидом, содержащим рекомбинантную V-область, в которой FR1 и FR2 выделены из антитела человека и FR3 и FR4 выделены из антитела мыши (такое антитело, имеющее рекомбинантный фрагмент, определяется как "гибридное антитело"), гибридное антитело, в котором только FR1 выделена у человека, и гибридное антитело, в котором только FR2 выделена у человека. Каждую ДНК, кодирующую эти гибридные антитела, вводят в экспрессирующий вектор и временно экспрессируют очеловеченные антитела для исследования на наличие требуемой активности.
С помощью этого способа автор настоящего изобретения исследовал полипептиды, содержащие V-области L-цепи, в отношении антигенсвязывающей и нейтрализующей активности и обнаружил, что определенные заменяемые аминокислоты находятся в каркасных областях FR2 и FR3.
Обнаружив, что аминокислоты, определяющие данную активность, находятся в областях FR2 и FR3, автор настоящего изобретения установил, что указанной активностью обладают 36-я, 45-я и 49-я аминокислоты в области FR2 и 87-я аминокислота в области FR3 (нумерация аминокислот в антителах определена Кабатом (Kabat, E.A. et al., US Dep. Health and Human Services, US Government Printing Offices, 1991).
Таким образом, при осуществлении настоящего изобретения получают полипептид, содержащий V-область, в которой мутирована одна или несколько таких аминокислот (например, заменена).
В соответствии с рассмотренным выше способом трансплантации гипервариабельных участков сначала получают полипептид, содержащий V-область с аминокислотной последовательностью в качестве основы для мутации аминокислоты. Этот исходный полипептид содержит аминокислотную последовательность, выраженную последовательностью с идентификационным №47, и определяется как "вариант а" ("а" в таблице 1).
Затем, используя в качестве основы "вариант а", получают разные вариантные фрагменты, в которых мутирована одна или несколько аминокислот каркасной области.
Мутацию можно осуществить путем конструирования олигонуклеотидной затравки (мутагенная затравка), кодирующей аминокислоту, вводимую в качестве требуемой мутации, которую используют для выполнения полимеразной реакции синтеза цепи с использованием указанной затравки.
Так получают полипептиды, содержащие V-области (варианты b-t), в которых мутированы конкретные аминокислоты в областях FR2 и FR3 (b-t в таблице 1).
Полученную выше ДНК, кодирующую каждый вариант V-области L-цепи очеловеченного антитела, можно лигировать с ДНК любой С-области L-цепи антитела человека, такой как Сλ-область L-цепи человека. С этой целью ее обрабатывают приемлемым рестрикционным ферментом и лигируют с ДНК, кодирующей С-область Lλ-цепи человека, под контролем регулирующей экспрессию области, такой как система энхансер/промотор с получением экспрессирующего вектора, содержащего ДНК, кодирующую каждый вариант очеловеченной V-области L-цепи, и ДНК, кодирующую очеловеченную С-область Lλ-цепи.
Сконструированную выше ДНК, кодирующую V-область Н-цепи очеловеченного антитела и С-область Н-цепи человека, и ДНК, кодирующую очеловеченную V-область L-цепи и С-область L-цепи человека, можно также ввести в один экспрессирующий вектор, описанный в патенте WO 94/11523, причем указанный вектор можно использовать для трансформации клетки-хозяина и трансформированный хозяин можно культивировать in vivo или in vitro с получением требуемого очеловеченного антитела.
4. Получение химерного антитела и очеловеченного антитела
Чтобы получить химерное или очеловеченное антитело, необходимо приготовить два вышеуказанных экспрессирующих вектора. Так, в случае химерного антитела конструируют экспрессирующий вектор, содержащий ДНК, кодирующую V-область Н-цепи мыши и С-область Н-цепи человека, под контролем регулирующей экспрессию области, такой как система энхансер/промотор, и экспрессирующий вектор, содержащий ДНК, кодирующую V-область L-цепи мыши и С-область L-цепи человека, под контролем регулирующей экспрессию области, такой как система энхансер/промотор. В случае очеловеченного антитела конструируют экспрессирующий вектор, содержащий ДНК, кодирующую очеловеченную V-область Н-цепи и С-область Н-цепи человека, под контролем регулирующей экспрессию области, такой как система знхансер/промотор и экспрессирующий вектор, содержащий ДНК, кодирующую очеловеченную V-область L-цепи и С-область L-цепи человека, под контролем регулирующей экспрессию области, такой как система усилителя энхансер/промотор.
Затем клетку-хозяина, такую как клетка млекопитающего, котрансформируют этими экспрессирующими векторами и полученную трансформированную клетку культивируют in vitro или in vivo с получением химерного или очеловеченного антитела (см., например, WO91/16928).
Альтернативно ДНК, кодирующую V- и С-области Н-цепи, и ДНК, кодирующую V- и С-области L-цепи, можно лигировать с единичным вектором и трансформировать в приемлемую клетку-хозяин с получением антитела. Так, для экспрессии химерного антитела ДНК, кодирующую лидерную последовательность мыши, имеющуюся в клонированной кДНК, V-область Н-цепи мыши и С-область Н-цепи человека, а также ДНК, кодирующую лидерную последовательность мыши, V-область L-цепи мыши и С-область L-цепи человека, вводят в один экспрессирующий вектор, описанный, например, в WO 94/11523. Для экспрессии очеловеченного антитела, ДНК, кодирующую очеловеченную V-область Н-цепи и С-область Н-цепи человека, и ДНК, кодирующую очеловеченную V-область L-цепи и С-область L-цепи человека, вводят в единичный экспрессирующий вектор, описанный, например, в WO 94/11523. Такой вектор используют для трансформации клетки-хозяина, после чего трансформированного хозяина культивируют in vivo или in vitro с получением представляющего интерес химерного или очеловеченного антитела.
Представляющее интерес химерное или очеловеченное антитело, полученное путем культивирования трансформанта, преобразованного посредством ДНК, кодирующей указанное химерное или очеловеченное антитело, можно выделить из внутренней или наружной части клетки и очистить до однородного состояния.
Представляющее интерес химерное или очеловеченное антитело по настоящему изобретению можно выделить и очистить в колонке, заполненной белком А и агарозой. Для этой цели можно также использовать любые другие способы, применяемые для выделения и очистки обычных белков, причем их выбор ничем не ограничен. Например, для выделения и очистки химерного или очеловеченного антитела можно использовать по отдельности или в сочетании разные виды хроматографии, ультрафильтрации, высаливания и диализа.
Для получения химерного или очеловеченного антитела против PTHrP человека по настоящему изобретению можно использовать любую экспрессирующую систему. Например, эукариютические клетки включают животные клетки, в частности, выделенные линии клеток млекопитающих, клетки плесени, грибов и дрожжей; прокариотические клетки включают бактериальные клетки, такие как клетки Escherichia coli. Химерное или очеловеченное антитело по настоящему изобретению предпочтительно экспрессируют в клетке млекопитающего, такой как клетки COS или СНО.
Можно использовать любые известные промоторы, предназначенные для экспрессии в клетках млекопитающих. Например, предпочтительно используют быстродействующий протомор цитомегаловируса человека (HCMV). Примерами экспрессирующих векторов, содержащих промотор HCMV, являются HCMV-VH-HCγ1 и HCMV-VL-HCK, выделенные из pSV2neo (WO92/19759).
Кроме того, при осуществлении настоящего изобретения в качестве промоторов для экспрессии гена в клетках млекопитающих можно использовать вирусные промоторы, такие как ретровирус, вирус полиомы, аденовирус и вирус обезьяны (SV) 40, и промоторы, выделенные из клеток млекопитающих, например, из фактора-1α элонгации цепи полипептида человека (HEF-lα). Например, промотор SV40 можно легко использовать по способу Муллигана и др. (Mulligan et al., Nature, 277, 108, 1979) и промотор HEF-lα можно эффективно использовать по способу Мизушима и др. (Mizushima, S. et al., Nucleic Acids Research, 18, 5322, 1990).
Исходным материалом для репликации, используемым при осуществлении настоящего изобретения, получают из вируса SV40, вируса полиомы, аденовируса или вируса папилломы крупного рогатого скота (BPV). Кроме того, экспрессирующий вектор может содержать ген для фосфотрансферазы АРН(3') II или I (neo), тимидин-киназы (ТК), ксантин-гуанин-фосфорибозил-трансферазы (Ecogpt) E.coli или дигидрофолат-редуктазы (DHFR) в качестве селективного маркера для увеличения количества копий гена в системе клетки-хозяина.
5. Оценка антигенсвязывающей и нейтрализующей активности химерного и очеловеченного антитела.
(1) Определение концентрации антитела
Концентрацию полученного очищенного антитела можно определить по способу твердофазного иммуноферментного анализа (ELISA).
Планшеты для определения концентрации антител по способу ELISA получают следующим образом: в каждой лунке 96-луночного планшета для анализа ELISA (например, Maxisorp, NUNC) иммобилизируют 100 мкл антитела козы против иммуноглобулина G (IgG) человека с концентрацией, равной, например, 1 мкг/мл. Содержимое лунок блокируют 200 мкл разбавляющего буфера (например, 50 мМ трис-HCl, 1 мМ MgCl2, 0,1 М NaCl, 0,05% твина-20, 0,02% NaN3, 1% бычьего сывороточного альбумина (BSA), рН 7,2), в каждую лунку добавляют постепенно разбавленный супернатант клеток COS-7 или СНО, в котором экспрессировано химерное, гибридное или очеловеченное антитело либо очищенное химерное, гибридное или очеловеченное антитело; 100 мкл конъюгированного со щелочной фосфатазой антитела козы против IgG человека и 1 мг/мл раствора субстрата (Sigma 104, паранитрофенилфосфорная кислота, SIGMA), после чего с помощью аппарата для прочтения микропланшетов (Bio Rad) измеряют оптическую плотность при длине волны 405 нм. В качестве эталона для определения концентраций можно использовать очищенный IgGl λ человека (сайт связывания).
(2) Определение антигенсвязывающей способности
Планшеты для определения антигенсвязывающей способности по способу ELISA получают следующим образом: в каждой лунке 96-луночного планшета для анализа ELISA (например, Maxisorp, NUNC) иммобилизируют 100 мкл PRHrP человека (1-34) с концентрацией 1 мкг/мл. Содержимое лунок блокируют 200 мкл разбавляющего буфера, в каждую лунку добавляют постепенно разбавленный супернатант клеток COS-7 или СНО, в котором экспрессировано химерное, гибридное или очеловеченное антитело либо очищенное химерное, гибридное или очеловеченное антитело, 100 мкл конъюгированного со щелочной фосфатазой антитела козы против IgG человека и 1 мг/мл раствора субстрата (Sigma 104, паранитрофенилфосфорная кислота, SIGMA), после чего с помощью аппарата для прочтения микропланшетов (Bio Rad) измеряют оптическую плотность при длине волны 405 нм.
(3) Определение нейтрализующей.активности
Нейтрализующую активность антитела мыши, химерного антитела и очеловеченного антитела можно определить, используя, например, линию клеток остеосаркомы крыс ROS17/2,8-5 (Sato, K.et al., Acta Endocrinology, 116, 113-120, 1987). Клетки ROS 17/2,8-5 стимулируют, используя 4 мМ гидрокортизона, чтобы индуцировать рецептор РТН/PTHrP. Вырожденный фермент для циклического аденозинмонофосфата (сАМР) ингибируют 1 мМ изобутил-1-метилксантина (IBMX, SIGMA). Антитело мыши, или химерное или очеловеченное антитело, предназначенное для определения нейтрализирующей активности, смешивают с равным количеством PTHrP (1-34) и в каждую лунку добавляют полученную смесь антитела и PTHrP (1-34). Нейтрализующую активность антитела мыши, химерного или очеловеченного антитела можно определить путем измерения количества сАМР, продуцированного линиями клеток остеосаркомы крыс ROS17/2,8-5 в результате стимуляции PTHrP.
(4) Кинетический анализ взаимодействия между PTHrP и антителом против PTHrP
При осуществлении настоящего изобретения, кинетику взаимодействия между PTHrP и анти-PTHrP можно определить разными средствами и способами. В частности, константы диссоциации, константы скорости диссоциации и константы скорости ассоциации можно измерить по методу Скатчарда (Scatchard) и с помощью резонансного сенсора поверхностного плазмона BIACORE (разработан и продается фирмой Pharmacia Biotech). Анализ с помощью резонансного сенсора поверхностного плазмона BIOCORE будет описан ниже в одном из примеров.
BIACORE состоит из оптического источника, призмы, детектора и микроканала. В процессе практического применения лиганд иммобилизируют на конце сенсора кассетного типа и инъецируют в него анализируемое вещество. При наличии между ними сродства оптически определяют степень связывания.
Принцип детектирования этого метода определяется как резонанс поверхностного плазмона. Падающий свет направляют на поверхность раздела между стеклом и металлической пленкой так, чтобы происходило полное отражение, при этом свет, падающий под определенным углом, вызывает возбуждение поверхностного плазмона. Угол падения света изменяется в зависимости от изменения концентрации растворителя, соприкасающегося с металлической пленкой (сенсор). BIACORE определяет это изменение.
В BIACORE это изменение называется резонансным сигналом (SPR-сигнал), и изменение на 0,1 градус составляет 1000 резонансных единиц (RU). 1000 резонансных единиц соответствует изменению связывания, равному примерно 1 нг белка на тонком золотом сенсоре с площадью поверхности 1 мм2. Для белка можно полностью определить изменение, равное примерно 50 резонансным единицам (50 пг).
Обнаруженные сигналы преобразуются в присоединенном к BIACORE компьютере в кривую связывания, именуемую сенсограммой, которая строится на мониторе компьютера в реальном времени (Natsume, T, et al., (1995) Experimental Medicine, 13, 563-569; Karlsson, R., et al.(1991) J.Inimunol. Methods 145, 229-240).
С помощью вышеописанного прибора BIACORE можно измерить кинетические параметры, то есть константу диссоциации (KD), константу скорости диссоциации (Kdiss) и константу скорости ассоциации (Kass) антител против PTHrP по настоящему изобретению.
Антитела против PTHrP по настоящему изобретению предпочтительно имеют как можно меньшую константу диссоциации (значение KD) с точки зрения нейтрализующей активности. Против PTHrP антитела по настоящему изобретению предпочтительно имеют значение KD, равное 1,86×10-7 или меньше, более предпочтительно 1,86×10-8 или меньше и наиболее предпочтительно 3,58×10-10 или меньше.
Значения KD определяют на основании двух параметров:
констант скорости диссоциации (Kdiss) и констант скорости ассоциации (Kass) (KD=Kdiss/Kass). Поэтому совершенно очевидно, что значения KD должны быть меньше при меньших значениях Kdiss и больших значениях Kass.
В частности, значения Kdiss антител против PTHrP по настоящему изобретения могут быть равны 1,22×10-1 [1/сек] или меньше. Значения Kdiss предпочтительно равны 1,22×10-2 или меньше, более предпочтительно 3,16×10-4 или меньше и наиболее предпочтительно 2,32×10-4 [1/сек] или меньше.
С другой стороны, значения Kass могут быть равны 6,55×104 [1/М.сек] или больше. Значения Kass предпочтительно равны 6,55×105 или больше, более предпочтительно 0,883×106 или больше и наиболее предпочтительно 1,03×106 [1/М.сек] или больше.
Кроме того, предпочтительны антитела против PTHrP, имеющие значение Kdiss, равное 1,22×10-1 [1/сек], и значение Kass, равное 6,55×104 [1/М.сек] или больше.
В частности, антитела против PTHrP по настоящему изобретению имеют значение KD в диапазоне от 1,02×10-11 до 1,86×10-7 [М], предпочтительно от 1,01×10-10 до 1,86×10-8 [М], более предпочтительно от 1,34×10-10 до 3,58×10-10 [М], наиболее предпочтительно от 2,25×10-10 до 3,58×10-10 [М].
Значения Kdiss находятся в диапазоне от 7,38×10-6 до 1,22×10-1 [1/сек], предпочтительно от 7,38×10-5 до 1,22×10-2 [1/сек], более предпочтительно от 1,66×10-4 до 3,16×10-4 [1/сек], наиболее предпочтительно от 1,66×10-4 до 2,32×10-4 [1/сек].
Значения Kass находятся в диапазоне от 6,55×104 до 1,24×107 [1/М.сек], предпочтительно от 6,55×105 до 1,24×106 [1/М.сек], более предпочтительно от 7,23×105 до 1,03×106 [1/М.сек], наиболее предпочтительноот 0,883×106 до 1,03×106 [1/М.сек].
Эти значения KD, Kdiss и Kass можно получить с помощью анализа Скэтчарда или резонансного сенсора поверхностного плазмона, такого как BIACORE, и предпочтительно BIACORE. ом.
6. Фармацевтическая композиция и лекарственное средство для подавления гиперкальциемии, содержащие антитело против PTHrP или очеловеченное антитело в качестве активного ингредиента.
Терапевтический эффект очеловеченного антитела на PTHrP можно проверить путем введения антитела против PTHrP или очеловеченного антитела животному, страдающему гиперкальциемией, и измерения индекса гиперкальциемии. У животных с гиперкальциемией и у субъектов, страдающих гиперкальциемией, часто наблюдается гипофосфатемия; антитела по настоящему изобретению можно также использовать для улучшения гипофосфатемии.
При осуществлении настоящего изобретения используют антитело против PTHrP, включая антитело человека, химерное антитело, приматированное антитело или очеловеченное антитело против PTHrP, которые имеют значения константы диссоциации, константы скорости диссоциации и константы скорости ассоциации. Антитело, которое будет нейтрализовать активность PTHrP, связываясь с ним, предпочтительно включает очеловеченное антитело №23-57-137-1. Способ получения очеловеченного антитела №23-57-137-1 описывается в примерах 1-3.
Антитело по настоящему изобретению можно очистить с достижением высокой степени очистки с помощью любой комбинации известных способов очистки, таких как высаливание, гель-фильтрация с использованием жидкостной хроматографии высокого разрешения и т.д., а также аффинной хроматографии с использованием колонки, заполненной белком А, и т.д. Точность узнавания PTHrP очищенным антителом можно проверить известными иммунологическими средствами, такими как радиоиммунный анализ (RIA), иммуноферментный анализ (EIA, ELISA) и иммунофлуоресцентный анализ.
В качестве испытуемого животного с симптомами гиперкальциемии можно использовать животную модель, полученную путем трансплантации PTHrP-продуцирующих раковых клеток экспериментальному животному с пониженной или отсутствующей иммунологической функцией. Трансплантированные раковые клетки, которые предпочтительно берут у человека, включают, например, раковые клетки поджелудочной железы человека PAN-7. Животное с пониженной или отсутствующей иммунологической функцией, которому трансплантируют раковые клетки, является "голой" мышью и мышью линии SCID.
Степень подавления гиперкальциемии можно определить путем измерения концентрации кальция в крови, массы тела или восстановления двигательной активности по истечении определенного периода времени с последующей оценкой изменения состояния субъекта на основании полученных данных.
Фармацевтическую композицию и средство для подавления гиперкальциемии, содержащие антитело или очеловеченное антитело против PTHrP по настоящему изобретению в качестве активного ингредиента, можно вводить парентеральным способом системно или местно. Например, можно производить внутривенные инъекции, включая капельные, внутримышечные инъекции, внутрибрюшинные инъекции или подкожные инъекции. Способ введения выбирают в зависимости от возраста субъекта и тяжести заболевания. Эффективная однократная доза может составлять от 0,01 до 1000 мг/кг массы тела. Альтернативно, указанная доза может составлять от 5 до 10000 мг/массу тела, предпочтительно от 50 до 1000 мг/массу тела.
Фармацевтическая композиция и средство для подавления гиперкальциемии, содержащие антитело или очеловеченное антитело против PTHrP по настоящему изобретению в качестве активного ингредиента, могут далее включать фармацевтически приемлемый носитель и/или добавку или добавки в зависимости от способа введения. Примерами таких носителей и добавок являются вода, фармацевтически приемлемые органические растворители, коллаген, поливиниловый спирт, поливинилпирролидон, карбоксивинил полимер, натрий-карбоксиметилцеллюлоза, поли(акрилат натрия), аргинат натрия, водорастворимый декстран, натрий-карбоксиметиловый крахмал, пектин, метилцеллюлоза, этилцеллюлоза, ксантановая смола, аравийская камедь, казеин, желатин, агар, диглицерин, глицерин, пропиленгликоль, полиэтиленгликоль, вазелин, парафин, стеариловый спирт, стеариновая кислота, сывороточный альбумин человека (HSA), маннитол, сорбитол, лактоза и сурорантанты, пригодные для использования в качестве фармацевтических добавок. Добавки можно использовать по отдельности или в сочетании, не ограничиваясь вышеуказанными веществами.
Антитело по настоящему изобретению можно использовать для лечения гиперкальциемии, возникающей вследствие различных видов рака (злокачественных опухолей). Эти виды рака не имеют каких-либо конкретных ограничений и включают не только какой-либо один вид рака, но и комбинацию разных видов рака. Виды рака могут, например, включать рак поджелудочной железы, легкого, глотки, гортани, языка, десны, пищевода, желудка, желчных протоков, молочной железы, почек, мочевого пузыря, матки и предстательной железы, а также злокачественную лимфому.
Примеры
Далее приведено более подробное описание настоящего изобретения со ссылкой на нижеследующие примеры, которые не должны ограничивать объем настоящего изобретения.
Способ получения гибридомы, продуцирующей моноклональное антитело мыши против PTHrP (1-34)
Гибридомы, способные продуцировать моноклональное антитело против PTHrP человека (1-34), №23-57-154 и №23-57-137-1, получают в соответствии со способом, описанным Каньи Сато и др. (Sato, К. et al., J. Bone Miner. Res. 8, 849-860, 1993).
В качестве иммуногена используют PTHrP (1-34) (Peninsula, с которым конъюгируют белок-носитель и тироглобулин, используя карбодиимид (Dojinn). Конъюгированный с тироглобулином PTHrP (1-34) диализируют, для получения раствора с концентрацией белка 2 мкг/мл. Полученный раствор смешивают с адъювантом Фрейнда (Difco) в отношении 1:1 с получением эмульсии. Эту эмульсию вводят в виде дорсально-подкожной или внутрибрюшинной инъекции 16 самкам мышей BALB/C в дозе 100 мкг/мышь с целью иммунизации указанных мышей. Эту инъекцию выполняют 11 раз. Для первой иммунизаций используют полный адъювант Фрейнда и для последующих иммунизаций используют неполный адъювант Фрейнда.
У иммунизированных мышей определяют титры антител в сыворотках следующим образом:
У всех мышей берут кровь из хвостовой вены и центрифугируют ее с получением сыворотки. Эту сыворотку разбавляют буфером для радиоиммунного анализа (RIA), смешивают с 125-I меченым PTHrP (1-34) и определяют ее связывающую активность. Мышам, обладающим достаточно высоким титром антител, внутрибрюшинно вводят PTHrP (1-34) без белка-носителя в количестве 50 мкг/мышь для окончательной иммунизации.
Через три дня после окончательной иммунизации мышей умерщвляют и удаляют у них селезенку. Затем производят слияние клеток селезенки с линией миеломных клеток мыши P3x63Ag8U. 1 в соответствии с известным методом на основе использования 50% полиэтиленгликоля 4000. Полученные связанные клетки инокулируют в лунки 96-луночных планшетов (всего 85 планшетов) в количестве 2×104/лунку. Скрининг представляющих интерес гибридом производят с использованием гипоксантин-аминоптерин-тимидиновой (HAT) среды следующим образом.
Гибридомы исследуют на наличие PTHrP-узнающих антител в культуральном супернатанте, тех лунок, где наблюдался рост клеток в НАТ-среде, с помощью твердофазного радиоиммунного анализа. Гибридомы собирают из лунок, в которых достоверно установлена способность культуры связываться с PTHrP-узнающим антителом. Полученные таким образом гибридомы суспендируют в среде RPMI-1640, содержащей 15% фетальной телячьей сыворотки (FCS) и OPI-добавку (Sigma), унифицируют по методу ограниченного разбавления, что дает два типа гибридомных клонов, №23-57-154 и №23-57-137-1, каждый из которых обладает сильной способностью связывания с PTHrP (1-34).
Гибридомный клон №23-57-137-1, получивший название "гибридома типа мышь-мышь №23-57-137-1", был включен в коллекцию Национального института Бионауки Человеческих технологий, агентство промышленной науки и технологии, Япония (1-3, Higashi 1-chome, Tsukuba-shi, Ibaragi-ken, Япония) под номером FERM ВР-5631 на основании Будапештского договора от 15 августа 1996 г.
Пример 1
Клонирование ДНК, кодирующей V-область моноклонального антитела мыши против PTHrP человека (1-34)
Клонирование ДНК, кодирующей V-область полученного выше моноклонального антителя мыши против PTHrP человека (1-34) №23-57-137-1, выполняют следующим образом.
(1) Получение мРНК
мРНК получают из гибридомы №23-57-137-1 с использованием набора ддя очистки мРНК Quick Prep (Pharmacia Biotech) аналогично описанной ниже процедуре.
Клетки полученной выше гибридомы №23-57-137-1 полностью гомогенизируют экстракционным буфером, после чего мРНК экстрагируют из этого буфера в колонке с олиго(тимидин)целлюлозным наполнителем в соответствии с инструкцией производителя этого набора. мРНК осаждают этанолом из экстракционного раствора и растворяют полученный осадок мРНК в буфере для элюирования.
(2) Получение и амплификация кДНК гена, кодирующего V-область Н-цепи антигена мыши
(i) Клонирование кДНК для V-области Н-цепи антитела №23-57-137-1 ДНК, кодирующую V-область Н-цепи моноклонального антитела мыши против PTHrP человека, клонируют по методу 5'-RACE (Frohman, M.A. et al.,Prov. Natl. Acad. Sci. USA, 85, 8998-9002, 1988; Belyavsky, A. et al., Nucieic Acids Res. 17, 2919-2932, 1989). Этот метод выполняют с использованием набора 5'-Ampli FINDER RACE (CLONETECH) в соответствии с инструкциями производителя. При осуществлении этого метода используют затравку для синтеза кДНК, например, затравку МНС2 (последовательность с идентификационным №1), которая гибридизирует с С-областью Н-цепи антитела мыши. Примерно 2 мкг полученной выше мРНК, которая является матрицей для синтеза кДНК, смешивают с 10 пмолями затравки МНС2. Полученную смесь подвергают взаимодействию с обратной транскриптазой при температуре 52°С в течение 30 минут, для приготовления кДНК, комплементарной мРНК.
Полученное вещество смешивают с 6 н NaOH для гидролиза мРНК (при температуре 65°С в течение 30 минут) и осаждают кДНК этанолом. Выделенную таким образом кДНК лигируют с Ampli FINDER (последовательность с идентификационным №42) у 5'-конца в результате взаимодействия с РНК-лигазой Т4 при температуре 37°С в течение 6 часов и затем при комнатной температуре в течение 16 часов. В качестве затравок для амплификации кДНК по методу PCR используют затравку Anchor (последовательность с идентификационным №2) и затравку MHC-G1 (последовательность с идентификационным №3) (S.T.Jones, et al., Biotechnology, 9, 88, 1991).
Раствор для полимеразной реакции синтеза цепи (50 мкл), используемый при осуществлении этого метода, состоит из 10 мМ трис-HCl (рН 8,3), 50 мМ KCl, 0,25 мМ dNTP (dATP, dGTP, dCTP, dTTP), 1,5 мМ MgCl2, 2,5 единицы TaKaRa Taq (Takara Shuzo), 10 пмолей затравки Anchor и 1 мкл реакционной смеси кДНК, с которой лигируют затравку MHC-G1 и затравку Ampli FINDER Anchor, помещая сверху 50 мкл минерального масла. В термоциклизаторе модели 480J (Perkin Elmer) выполняют тридцать циклов полимеразной реакции синтеза цепи в соответствии с программой циклического изменения температуры в следующей последовательности: 94°С в течение 45 секунд; 60°С в течение 45 секунд и 72°С в течение 2 минут.
(ii) Клонирование кДНК для V-области L-цепи антитела №23-57-137-1 ДНК, кодирующую V-область L-цепи моноклонального антитела мыши против PTHrP человека, клонируют по методу 5'-RACE (Frohman, M.A. et al., Proc. Natl. Acad. Sci. USA, 85, 8998-9002, 1988; Belyavsky, A. et al., Nucleic Acids Res. 17, 2919-2932, 1989). Этот метод выполняют с использованием набора 5'-Ampli Finder RACE (CloneTech) в соответствии с инструкциями производителя. При осуществлении этого метода, в качестве затравки для синтеза кДНК используют олиго(тимидиновую) затравку. Примерно 2 мкг полученной выше мРНК, которая является матрицей для синтеза кДНК, смешивают с олиготимидиновой затравкой. Полученную смесь подвергают взаимодействию с обратной транскриптазой при температуре 52°С в течение 30 минут с получением кДНК. Полученное вещество смешивают с 6 н NaOH для гидролиза РНК (при температуре 65°С в течение 30 минут). Полученную смесь осаждают этанолом для выделения кДНК в виде осадка. Выделенную таким образом кДНК лигируют со связывающим фрагментом Ampli FINDER Anchor у 5'-конца в результате взаимодействия с РНК-лигазой Т4 при температуре 37°С в течение 6 часов и затем при комнатной температуре в течение 16 часов.
Затравку MLC (последовательность с идентификационным №4) для полимеразной реакции синтеза цепи конструируют на основе консервативной последовательности С-области λ-цепи L-цепи мыши и синтезируют в синтезаторе 394 ДНК/РНК (ABI). Раствор для полимеразной реакции синтеза цепи (100 мкл), используемый в процессе получения затравки, состоит из 10 мМ трис-HCl (рН 8,3), 50 мМ KCl, 0,25 мМ dNTP (dATP, dGTP, dCTP, dTTP), 1,5 мМ MgCl2, 2,5 единицы AmpliTaq (PERKIN ELMER), 50 пмолей затравки Anchor (последовательность с идентификационным №2) и 1 мкл реакционной смеси кДНК, с которой лигируют затравку MLC (последовательность с идентификационным №4) и затравку Ampli FINDER Anchor лигировали, помещая сверху 50 мкл минерального масла. В термоциклизаторной модели 480J (Perkin Elmer) выполняют тридцать пять циклов полимеразной реакции синтеза цепи в соответствии с программой циклического изменения температуры в следующей последовательности: 94°С в течение 45 секунд, 60°С в течение 45 секунд и 72°С в течение 2 минут.
(3) Очистка и фрагментация продукта полимеразной реакции синтеза цепи
Все фрагменты ДНК, амплифицированные описанными выше методами PCR, разделяют с помощью электрофореза в агарозном геле с использованием 3% агарозы Nu Sieve GTG (FMC Bio. Products). Для каждой V-области Н-цепи и V-области L-цепи из геля вырезают соответственно фракцию агарозного геля, содержащую фрагмент ДНК длиной около 550 пар оснований. Изо всех полученных гель-фракций выделяют ДНК, используя набор GENECLEAN II (BIO 101) в соответствии с инструкциями производителя. Очищенную ДНК осаждают из раствора этанолом и растворяют в 20 мкл раствора, содержащего 10 мМ трис-HCl (рН 7,4) и 1 мМ EDTA. Один мкл полученного таким образом раствора ДНК расщепляют рестрикционным ферментом XmaI (New England Biolabs) при температуре 37°С в течение 1 часа и рестрикционным ферментом EcoRI (Takara Shuzo) при температуре 37°С в течение еще 1 часа. Гидролизованную смесь экстрагируют фенолом и хлороформом и осаждают ДНК этанолом.
Аналогичным образом получают ДНК, кодирующую V-область Н-цепи мыши, и ДНК, кодирующую V-область L-цепи мыши, которые имеют EcoRI-узнающую последовательность у 5'-конца и XmaI-узнающую последовательность у 3'-конца.
Все фрагменты ДНК EcoRI-XmaI, содержащие соответственно ДНК, кодирующую V-область Н-цепи мыши, и ДНК, кодирующую V-область L-цепи мыши, подвергают взаимодействию с вектором pUC19, который предварительно расщепляют EcoRI и Xmal, при температуре 16°С в течение 1 часа с использованием набора для лигирования ДНК, вариант 2 (Takara Shuzo) в соответствии с инструкциями производителя. Полученную таким образом лигированнную смесь (10 мкл) добавляют к 100 мкл раствора, содержащего компетентные клетки Е. coli, JM 109 (Nippon Gene). Смесь клеток оставляют выстаиваться на льду в течение 15 минут, затем при температуре 42°С в течение 1 минуты и снова на льду в течение еще 1 минуты. Полученный продукт смешивают с 300 мкл культуральной среды SOC (Molecular Cloning: A Laboratory Manual, Sambrook, et al., Cold Spring Harbor Laboratory Press, 1989) и инкубируют при температуре 37°С в течение 30 минут. Полученный раствор клеток помещают на агаровую среду LB или 2xYT (Molecular Cloning: A Laboratory Manual, Sambrook, et al., Cold Spring Harbor Laboratory Press, 1989), содержащую 100 или 50 мкг/мл ампициллина, 0,1 мМ IPTG и 20 мкг/мл X-gal, и инкубируют при температуре 37°С в течение ночи. Аналогичным образом получают трансформанты Е. coli.
Трансформанты культивируют в течение ночи в 2 мл среды LB или 2xYT, содержащей 100 или 50 мкг/мл ампициллина, при температуре 37°С, после чего из клеточной фракции получают плазмидную ДНК с помощью плазмидного экстрактора PI-100Σ (Kurabou) или набора для выделения плазмид QIAprep (QIAGEN). У полученных таким образом плазмидных ДНК определяют последовательности ДНК.
(4) Секвенирование кДНК, кодирующей V-область антитела мыши
Последовательность кДНК, кодирующей область плазмиды, определяют с помощью секвенатора ДНК 373А (ABI; Perkin-Elmer), используя набор для циклического секвенирования с окрашиванием терминатора (Perkin-Elmer). Для определения этой последовательности ДНК исследуют последовательности оснований в обеих ориентациях с помощью таких затравок, как затравка М13 Primer M4 (Takara Shuzo) (последовательность с идентификационным №5) и затравка М13 Primer RV (Takara Shuzo) (последовательность с идентификационным №6).
Полученные таким образом плазмиды, содержащие кДНК, кодирующую V-область Н-цепи мыши, и кДНК, кодирующую V-область L-цепи мыши, выделенные из гибридомы №23-57-137-1, названы соответственно "МВС1Н04" и "MBC1L24". Последовательности (включая соответствующие аминокислотные последовательности) ДНК, кодирующей V-область Н-цепи, и ДНК, кодирующей V-область L-цепи антитела мыши №23-57-137-1 (относящиеся соответственно к плазмидам МВС1Н04 и МВС1Н24), представлены соответственно последовательностями с идентификационными №№57 и 65. Оба полипептида для фрагмента V-области Н-цепи и фрагмента V-области L-цепи транслированы, начиная с 58-го основания (которое кодирует глутамин) в последовательностях ДНК, выраженных последовательностями с идентификационными №№57 и 65. Аминокислотные последовательности для V-области Н-цепи и V-области L-цепи выражены соответственно последовательностями с идентификационными №№46 и 45.
Штамм Е. coli, имеющий плазмиду МВС1Н04, и штамм Е. coli, имеющий плазмиду MBC1L24, соответственно названы "Escherichia coli JM109 (МВС1Н04)" и "Escherichia coli JM109 (MBC1L24)". Эти штаммы Е. coli включены в коллекцию Национального института бионауки человеческой технологии, агентство промышленной науки и технологии, Япония (1-3, Higashi 1-chome, Tsukuba-shi, Ibaragi-ken, Япония), под номерами FERM ВР-5628 для Escherichia coli JM109 (МВС1Н04) и FERM ВР-5627 для Escherichia coli JM109 (MBC1L24) на основании Будапештского договора от 15 августа 1996 г.
(5) Определение гипервариабельного участка моноклонального антитела мыши №23-57-137-1 против PTHrP человека
Общие структуры V-области Н-цепи и V-области L-цепи обладают значительным сходством. То есть обе структуры имеют четыре каркасные области, дотированные с помощью трех гипервариабельных участков [то есть, CDR]. Аминокислотные последовательности каркасных областей являются достаточно консервативными, в то время как аминокислотные последовательности гипервариабельных участков характеризуются сильной мутагенностью (Kabat, E.A. et al., "Sequence of Proteins of Immunological Interest", US Dept. Health and Human Services, 1983).
На основании вышеуказанных факторов, гипервариабельные участки (CDR) определяют путем поиска гомологии аминокислотных последовательностей V-области моноклонального антитела мыши в результате обращения к базе данных по структуре аминокислотных последовательностей для антител, созданной Кабатом и др.
Аминокислотные последовательности гипервариабельных участков 1-3 V-области L-цепи выражены соответственно последовательностями с идентификационными №№59-61, и аминокислотные последовательности гипервариабельных участков 1-3 V-области Н-цепи выражены соответственно последовательностями с идентификационными №№62-64. (см.табл.2).
Пример 2
Конструирование химерного антитела
(1) Конструирование Н-цепи химерного антитела
(i) Конструирование V-области Н-цепи
Клонированную кДНК, кодирующую V-область Н-цепи мыши, модифицируют по методу PCR и лигируют с экспрессирующим вектором, содержащим геномную ДНК для Сγ1 С-области Н-цепи человека. Нижнюю затравку MBC1-S1 (последовательность с идентификационным №7) конструируют таким образом, чтобы она гибридизировала с ДНК, кодирующей 5'-концевую область лидерной последовательности V-области, и имела согласованную последовательность Козака (Kozak, M. et al., J. Mol. Biol, 196, 947-950, 1987) и HindIII-узнающую последовательность. Верхнюю затравку МВС1-а (последовательность с идентификационным №8) конструируют таким образом, чтобы она гибридизировала с ДНК, кодирующей 3'-концевую область J-области и имела донорскую последовательность сплайсированного фрагмента и BamHI-узнающую последовательность. Полимеразную реакцию синтеза цепи осуществляют с использованием TaKaRa Ex Taq (Takara Shuzo) и соответствующего буфера. Раствор для полимеразной реакции синтеза цепи (50 мкл) содержит 0,07 мкг плазмиды MBC1Н04 в качестве матричной ДНК, 50 пмолей МВС1-а и 50 пмолей MBC1-S1 в качестве затравок, 2,5 единицы TaKaRa Ex Taq и 0,25 мМ dNTP в буфере, поверх которого помещают 50 мкл минерального масла. Выполняют тридцать циклов полимеразной реакции синтеза цепи в соответствии с программой циклического изменения температуры в следующей последовательности: 94°С в течение 1 минуты/ 55°С в течение 1 минуты, 72°С в течение 2 минут. Фрагменты ДНК, амплифицированные в результате выполнения полимеразной реакции синтеза цепи, разделяют посредством электрофореза в агарозном геле с использованием 3% агароэы Nu Sieve GTG (FMC Bio. Products).
Затем вырезают участок агарозного геля, содержащий фрагмент ДНК длиной 437 пар оснований, и очищают указанный фрагмент ДНК с помощью набора GENECLEAN II (BIO 101) в соответствии с прилагаемыми к нему инструкциями. Очищенную ДНК осаждают этанолом и растворяют в 20 мкл раствора, содержащего 10 мМ трис-HCl (рН 7,4) и 1 мМ этилендиаминтетрауксусной кислоты (EDTA). Один мкл полученного раствора ДНК расщепляют рестрикционными ферментами BamHI и HindIII (Takara Shuzo) при температуре 37°С в течение 1 часа. Гидролизованную смесь экстрагируют фенолом и хлороформом и осаждают ДНК этанолом.
Полученный фрагмент ДНК HindIII-BamHI, который содержит ДНК, кодирующую V-область Н-цепи мыши, субклонируют в векторе pUC19, который предварительно расщепляют ферментами HindIII и BamHI. Полученную плазмиду секвенируют секвенатором ДНК 373А (Perkin-Elmer), используя затравки М13 Primer М4 и М13 Primer RV и набор для циклического секвенирования с окрашиванием терминатора (Perkin-Elmer). Указанная плазмида, которая содержит ДНК с требуемой последовательностью оснований, кодирующей V-область Н-цепи мыши, выделенную из гибридомы №23-57-137-1, и имеет HindIII-узнающую последовательность, последовательность Козака в 5'-концевой области и BamHI-узнающую последовательность в 3'-концевой области, названа "MBC1H/pUC19".
(ii) Конструирование V-области Н-цепи, используемой для получения кДНК химерной Н-цепи типа "мышь - человек"
Полученную на предыдущей стадии ДНК, кодирующую V-область Н-цепи мыши, модифицируют по методу PCR и лигируют с кДНК для Сγ1 С-области Н-цепи человека. Обратную затравку MBC1PVS2 (последовательность с идентификационным №9), используемую для модификации V-области Н-цепи, конструируют таким образом, чтобы заменить глицином вторую аминокислоту (то есть аспарагин) последовательности, кодирующей переднюю часть лидерной последовательности V-области, и получить согласованную последовательность Козака (Kozak, N. et al., J. Mol. Biol., 196, 947-950, 1987} и HindIII- и EcoRI-узнающие последовательности. Прямую затравку MBC1PVR2 (последовательность с идентификационным №10), используемую для модификации V-области Н-цепи, конструируют таким образом, чтобы она гибридизировала с последовательностью ДНК, кодирующей 3'-концевую область J-области, и с последовательностью ДНК, кодирующей 5'-концевую область С-области, и имела Apal- и Smal-узнающие последовательности.
Полимеразную реакцию синтеза цепи осуществляют с использованием TaKaRa Ex Taq (Takara Shuzo) и соответствующего буфера. Раствор для полимеразной реакции синтеза цепи (50 мкл) содержит 0,6 мкг плазмиды MBClH/pUC19 в качестве матричной ДНК, 50 пмолей MBC1HVS2 и 50 пмолей MBC1HVR2 в качестве затравок, 2,5 единицы TaKaRa Ex Taq и 0,25 мМ dNTP в буфере, поверх которого помещают 50 мкл минерального масла. Выполняют тридцать циклов полимеразной реакции синтеза цепи в соответствии с программой циклического изменения температуры в следующей последовательности: 94°С в течение 1 минуты; 55°С в течение 1 минуты; 72°С в течение 1 минуты. Фрагменты ДНК, амплифицированные в результате выполнения полимеразной реакции синтеза, разделяют посредством электрофореза в агарозном геле с использованием 1% агарозы Sea Kem GTG (FMC Bio. Products). Затем вырезают участок агарозного геля, содержащий фрагмент ДНК длиной 456 пар оснований, и очищают указанный фрагмент ДНК с помощью набора GENECLEAN II (BIO 101) в соответствии с инструкциями производителя. Очищенные фрагменты ДНК осаждают этанолом и растворяют в 20 мкл раствора, содержащего 10 мМ трис-HCl (рН 7,4) и 1 мМ EDTA.
Один мкл полученного раствора ДНК расщепляют рестрикционными ферментами EcoRI и SmaI (Takara Shuzo) при температуре 37°С в течение 1 часа. Гидролизованную смесь экстрагируют фенолом и хлороформом и осаждают этанолом ДНК. Полученные фрагменты ДНК EcoRI-SmaI, которые содержат ДНК, кодирующую V-область Н-цепи мыши, субклонируют в векторе pUC19, плазмиду предварительно расщепляют ферментами EcoRI и SmaI. Полученную плазмиду секвенируют секвенатором ДНК 373А (Perkin-Elmer), используя затравки М13 Primer M4 и М13 Primer RV и набор для циклического секвенирования с окрашиванием терминатора (Perkin-Elmer). Указанная плазмида, которая содержит ДНК с требуемой последовательностью оснований, кодирующей V-область Н-цепи мыши, выделенную из гибридомы №23-57-137-1, и имеет HindIII-узнающую последовательность, последовательность Козака в 5'-концевой области и ApaI- и Smal-узнающие последовательности в 3'-концевой области, названа "MBC1Hv/pUC19".
(iii) Конструирование экспрессирующего вектора для Н-цепи химерного антитела
кДНК, содержащую Сγ1 С-области Н-цепи антитела человека, получают следующим образом.
Из клетки яичника китайского хомячка, в которую предварительно вводят экспрессирующий вектор DHFR-ΔE-RVh-PM-lf (см. WO 92/19759), кодирующий геномные ДНК V-области Н-цепи очеловеченного антитела РМ1 и IgGl С-области Н-цепи антитела человека, и экспрессирующий вектор RVl-PMla (см. WO 92/19759), кодирующий геномные ДНК V-области L-цепи очеловеченного антитела РМ1 и С-области κ-цепи L-цепи антитела человека, получают мРНК. Полученную мРНК используют для клонирования по методу RT-PCR кДНК, содержащую V-область Н-цепи очеловеченного антитела РМ1 и Сγ1 С-области антитела человека, которую затем субклонируют в сайте HindIII-BamHI плазмиды pUC19. У субклонированной плазмиды определяют последовательность ДНК. Плазмида с требуемой последовательностью оснований названа "pRVh-PM1f-кДНК".
Чтобы сконструировать экспрессирующий вектор для кДНК, содержащей V-область Н-цепи очеловеченного антитела РМ1 и Сγ1 С-области антитела человека, получают экспрессирующий вектор DHFR-ΔE-RVh-PM-1-f с делециями в сайте HindIII между промотором SV40 и геном DHFR и в сайте EcoRI между промотором EF-1α и V-областью Н-цепи очеловеченного антитела РМ1.
Полученную плазмиду pRVh-PMlf-кДНК расщепляют BamHI, дефосфолируют фрагментом Кленова и еще раз расщепляют HindIII с получением дефосфолированного фрагмента HindIII-BamHI. Этот дефосфолированный фрагмент HindIII-BamHI лигируют с экспрессирующим вектором DHFR-ΔE-RVh-PM-1-f, имеющим делеции в сайтах HindIII и EcoRI, который предварительно расщепляют HindIII и BamHI, с целью конструирования экспрессирующего вектора RVh-PM1f-кДНК, содержащего кДНК, кодирующие соответственно V-область Н-цепи очеловеченного антитела РМ1 и Сγ1 С-области антитела человека.
Экспрессирующий вектор RVh-PM1f-кДНК, содержащий кДНК, кодирующие V-область Н-цепи очеловеченного антитела РМ1 и Cγ1 С-области антитела человека, расщепляют ApaI и BamHI, после чего получают фрагмент ДНК, содержащий С-область Н-цепи. Полученный фрагмент ДНК вводят в вышеуказанную плазмиду MBC1Hv/pUC19, которую предварительно расщепляют Aral и BamHI. Полученная таким образом плазмида названа "МВС1НкДНК/рUС19". Эта плазмида содержит кДНК, которые кодируют соответственно V-область Н-цепи антитела мыши и Cγ1 С-области антитела человека и имеют EcoRI- и HindIII-узнающие последовательности у 5'-конца и BamHI-узнающую последовательность у 3'-конца.
Плазмида МВС1НсДНК/рUС19 была расщеплена EcoRI и BamHI для получения ДНК, кодирующей Н-цепь химерного антитела. Полученный фрагмент ДНК вводят в экспрессирующий вектор pCOSI, который предварительно расщепляют EcoRI и BamHI. Полученный таким образом экспрессирующий вектор для химерного антитела назван "МВС1НкДНК/рСOS1". Экспрессирующий вектор pCOSI конструируют с использованием HEF-PMh-gγ1 (см. WO92/19759), удаляя ген антитела путем расщепления с помощью EcoRI и SmaI и лигируя его с адаптером EcoRI-NotI-BamHI (Takara Shuzo).
Чтобы получить плазмиду для экспрессии в клетке яичника китайского хомячка, плазмиду МВС1НкДНК/рUС19 расщепляют EcoRI и BamHI с получением ДНК, кодирующей Н-цепь химерного антитела, которую затем вводят в экспрессирующую плазмиду pCHO1, которую предварительно расщепляют EcoRI и BamHI. Полученная таким образом экспрессирующая плазмида для химерного антитела названа "MBClНкДНК/рСНО1". Экспрессирующий вектор рСНО1 конструируют с использованием DHFR-ΔE-rvH-PM1-f (см. WO92/19759), удаляя ген антитела путем расщепления с помощью EcoRI и SmaI и лигируя его с адаптером EcoRI-NotI-BamHI (Takara Shuzo).
(2) Конструирование С-области L-цепи человека
(i) Получение клонирующего вектора
Чтобы сконструировать вектор pUC19, содержащий С-область L-цепи человека, получают вектор pUC19 с делецией сайта HindIII. Два мкг вектора pUC19 расщепляют в 20 мкл реакционного раствора, содержащего 20 мМ трис-HCl (рН 8,5), 10 мМ MgCl2,1 мМ дитиотреитола (DTT), 100 мМ KCl, 8 единиц HindIII (Takara Shuzo), при температуре 37°С в течение 1 часа. Полученную гидролизованную смесь экстрагируют фенолом и хлороформом и осаждают требуемую ДНК этанолом.
Полученную ДНК подвергают взаимодействию в 50 мкл реакционного раствора, содержащего 50 мМ трис-HCl (рН 7,5), 10 мМ MgCl2, 1 мМ дитиотреитола (DTT), 100 мМ NaCl, 0,5 мМ dNTP и 6 единиц фрагмента Кленова (GIBCO BRL), при комнатной температуре в течение 20 минут, в результате чего происходит дефосфолирование ДНК. Полученную реакционную смесь экстрагируют фенолом и хлороформом и осаждают этанолом векторной ДНК.
Полученную векторную ДНК подвергают взаимодействию в 10 мкл реакционного раствора, содержащего 50 мМ трис-HCl (рН 7,6), 10 мМ MgCl2, 1 мМ аденозин-5'-трифосфата (АТР), 1 мМ дитиотреитола (DTT), 5% (в объемном отношении) полиэтиленгликоля-8000 и 0,5 единицы ДНК-лигазы Т4 (GIBCO BRL), при температуре 16°С в течение 2 часов, в результате чего происходит аутолигирование векторной ДНК. Реакционную смесь (5 мкл) добавляют к 100 мкл раствора, содержащего компетентные клетки штамма JM109 Е.coli (Nippon Gene), и полученный раствор оставляют выстаиваться на льду в течение 30 минут, затем при температуре 42°С в течение 1 минуты и снова на льду в течение 1 минуты. К реакционному раствору добавляют 500 мл культуральной среды SOC и инкубируют при температуре 37°С в течение 1 часа. Полученный раствор помещают на агаровую среду 2xYT (содержащую 50 мкг/мл ампициллина), на поверхность которой предварительно нанесены Х-gal и IPTG (Molecular Cloning: A Laboratory Manual, Sambrook, et al., Cold Spring Harbor Laboratory Press, 1989), и культивируют при температуре 37°С в течение ночи, получая таким образом трансформант.
Этот трансформант культивируют на среде 2xYT, содержащей 50 мкг/мл ампициллина, при температуре 37°С в течение ночи. Из клеточной фракции культуральной среды выделяют плазмидную ДНК, используя для этой цепи мининабор для очистки плазмид (QIAGEN) в соответствии с прилагаемыми к нему инструкциями. Очищенную плазмиду расщепляют HindIII. Эта плазмида с делецией сайта HindIII названа "pUC19 ΔHindIII".
(ii) Конструирование ДНК, кодирующей С-область λ-цепи L-цепи человека
Известно, что С-область λ-цепи L-цепи антитела человека имеет по крайней мере четыре изотипа, включающие Mcg+Ke+Oz-, Mcg-Ke-Oz-, Mcg-Ke-Oz+и Mcg-Ke+Oz- (P.Dariavach, et al., Proc. Natl. Acad. Sci. USA, 84, 9074-9078, 1987). На основании базы данных EMBL произведен поиск С-области λ-цепи L-цепи антитела человека, которая гомологична С-области λ-цепи L-цепи мыши №23-57-137-1. В результате этого установлено, что изотип Mcg+Ke+Oz- (№ доступа 1Х57819) P.Dariavach, et al., Proc. Natl. Acad. Sci. USA, 84, 9074-9078, 1987) λ-цепи L-цепи антитела человека в наибольшей степени гомологичен С-области λ-цепи L-цепи мыши №23-57-137-1, характеризуясь 64,4% гомологией в отношении аминокислотной последовательности и 73,4% гомологией в отношении последовательности ДНК.
Затем по методу PCR конструируют ДНК, кодирующую С-область λ-цепи L-цепи антитела человека. Все нижеследующие затравки синтезируют с помощью синтезатора ДНК/РНК 394 (ABI). Синтезируют затравки HLAMB1 (последовательность с идентификационным №11) и HLAMB3 (последовательность с идентификационным №13), которые содержат смысловую последовательность ДНК, и затравки HLAMB2 (последовательность с идентификационным №12) и HLAMB4 (последовательность с идентификационным №14), которые содержат антисмысловую последовательность ДНК, при этом все затравки имеют с обоих концов комплементарную последовательность длиной 20-23 пары оснований.
Внешние затравки HLAMBS (последовательность с идентификационным №15) и HLAMBR (последовательность с идентификационным №16) имеют последовательность, комплементарную затравкам HLAMB1 и HLAMB4, соответственно, а также содержат соответственно EcoRI-, HindIII- и Blnl-узнающие последовательности и EcoRI-узнающую последовательность. Во время первой полимеразной реакции синтеза цепи происходит взаимодействие HLAMB1-HLAMB2 и HLAMB3-HLAMB4. После завершения указанных реакций оба полученных продукта смешивают друг с другом в эквивалентных количествах и производят их сборку во время второй полимеразной реакции синтеза цепи. К полученному продукту добавляют внешние затравки HLAMBS и HLAMBR. Эту реакционную смесь подвергают третьей полимеразной реакции синтеза цепи с целью амплификации непроцессированной ДНК.
Полимеразные реакции синтеза цепи выполняют с помощью TaKaRa Ex Taq (Takara Shuzo) в соответствии с инструкциями производителя. Во время осуществления первой полимеразной реакции синтеза цепи используют 100 мкл реакционного раствора, содержащего 5 пмолей HLAMB1, 0,5 пмолей HLAMB2 и 5 единиц TaKaRa Ex Taq (Takara Shuzo), или реакционный раствор, содержащий 0,5 пмолей HLAMB3, 5 пмолей HLAMB4 и 5 единиц TaKaRa Ex Taq (Takara Shuzo), поверх которого помещают 50 мкл минерального масла, и выполняют пять циклов полимеразной реакции синтеза цепи в соответствии с программой циклического изменения температуры в следующей последовательности: 94°С в течение 1 минуты, 60°С в течение 1 минуты и 72°С в течение 1 минуты. Во время осуществления второй полимеразной реакции синтеза цепи используют смесь, содержащую по 50 мкл каждого реакционного раствора, поверх которой помещают 50 мкл минерального масла, и выполняют три цикла полимеразной реакции синтеза цепи в соответствии с программой циклического изменения температуры в следующей последовательности: 94°С в течение 1 минуты, 60°С в течение 1 минуты и 72°С в течение 1 минуты. Во время осуществления третьей полимеразной реакции синтеза цепи используют реакционный раствор, к которому добавляют по 50 пмолей внешних затравок HLAMBS и HLAMBR, и выполняют тридцать циклов полимеразной реакции' синтеза цепи в соответствии с программой циклического изменения температуры в следующей последовательности: 94°С в течение 1 минуты, 60°С в течение 1 минуты и 72°С в течение 1 минуты.
Фрагмент ДНК, полученный в результате третьей полимеразной реакции синтеза цепи, подвергают электрофорезу в 3% низкоплавком агарозном геле (NuSieve GTG Agarose, FMC), после чего его выделяют и очищают от геля с помощью набора GENECLEAN II (BIO 101) в соответствии с прилагаемыми к нему инструкциями.
Полученный таким образом фрагмент ДНК расщепляют в 20 мкл реакционного раствора, содержащего 50 мМ трис-HCl (рН 7,5), 10 мМ MgCl2, 1 мМ дитиотреитола (DTT), 100 мМ NaCl и 8 единиц EcoRI (Takara Shuzo), при температуре 37°С в течение 1 часа. Гидролизованный раствор экстрагируют фенолом и хлороформом и осаждают ДНК этанолом. Полученную ДНК собирают и растворяют в 8 мкл раствора, содержащего 10 мМ трис-HCl (рН 7,4) и 1 мМ этилендиаминтетрауксусной кислоты (EDTA).
Плазмиду pUC19 ΔHindIII (0,8 мкг) расщепляют EcoRI аналогично вышеописанной процедуре. Гидролизованный раствор экстрагируют фенолом и хлороформом и осаждают этанолом, что дает расщепленную плазмиду pUC19 ΔHindIII. Расщепленную плазмиду подвергают взаимодействию в реакционном растворе (50 мкл), содержащем 50 мМ трис-HCl (рН 9,0), 1 мМ MgCl2 и щелочную фосфатазу (E.coli C75; Takara Shuzo), при температуре 37°С в течение 30 минут, в результате чего происходит дефосфолирование указанной плазмиды (то есть обрабатывают щелочной фосфатазой бактерий). Реакционный раствор экстрагируют фенолом и хлороформом и осаждают ДНК этанолом. Полученную таким образом ДНК растворяют в 10 мкл раствора, содержащего 10 мМ трис-HCl (рН 7,4) и 1 мМ EDTA.
Один мкл обработанной фосфатазой бактерий плазмиды pUC19 ΔHindIII смешивают с 4 мкл ДНК, полученной в результате вышеуказанной полимеразной реакции синтеза цепи, чтобы лигировать их друг с другом при помощи набора для лигирования ДНК, вариант 2 (Takara Shuzo). Полученную плазмиду вводят в компетентную клетку E.coli, JM109, для образования трансформанта. Трансформант культивируют в течение ночи в 2 мл среды 2xYT, содержащей 5 мкг/мл ампициллина. Полученную из этой клетки плазмиду очищают с помощью набора для очистки плазмид QIAprep (QIAGEN).
В вышеописанной плазмиде подтверждают последовательность клонированной ДНК. Для определения последовательности ДНК используют секвенатор ДНК 373А (ABI) и затравки "М13 Primer M4" и "М13 Primer RV" (Takara Shuzo). Это позволяет установить, что клонированная ДНК имеет делецию длиной 12 пар оснований. Указанная плазмида, содержащая эту ДНК, названа "сλΔ/рUС19". Затем для получения рекомбинантной части вновь синтезируют затравки HCLMS (последовательность с идентификационным №17) и HCLMR (последовательность с идентификационным №18) и по методу полимеразной реакции синтеза цепи (PCR) реконструируют требуемую ДНК.
Первую полимеразную реакцию синтеза цепи осуществляют, используя плазмиду сλΔ/рUС19, содержащую удаленную ДНК в качестве матрицы, и затравки HLAMBS и HCLMS или затравки HCLMS и HLAMB4. Все продукты полимеразной реакции синтеза цепи последовательно очищают. При осуществлении второй полимеразной реакции синтеза цепи производят сборку продуктов PCR. К полученному продукту добавляют внешние затравки HLAMBS и HLAMB4, после чего выполняют третью полимеразную реакцию синтеза цепи для амплификации непроцессированной ДНК.
Во время осуществления первой полимеразной реакции синтеза цепи используют 100 мкл реакционного раствора, содержащего 0,1 мкг cλΔ/pUC19 в качестве матрицы, по 50 пмолей затравок HLAMBS и HCLMR или по 50 пмолей затравок HCLMS и HLAMB4 и 5 единиц TaKaRa Ex Taq (Takara Shuzo), поверх которого помещают 50 мкл минерального масла, и выполняют тридцать циклов полимеразной реакции синтеза цепи в соответствии с программой циклического изменения температуры в следующей последовательности: 94°С в течение 1 минуты, 60°С в течение 1 минуты и 72°С в течение 1 минуты.
Продукты полимеразной реакции синтеза цепи, HLAMBS-HCLMR (236 пар оснований) и HCLMS-HLAMB4 (147 пар оснований) подвергают электрофорезу в 3% низкоплавком агарозном геле, чтобы выделить фрагмент ДНК. Фрагмент ДНК собирают и очищают от геля с помощью набора GENECLEAN II (BIO 101). Во время осуществления второй полимеразной реакции синтеза цепи используют 20 мкл реакционного раствора, содержащего 40 нг очищенных фрагментов ДНК и 1 единицу TaKaRa Ex Taq (Takara Shuzo), поверх которого помещают 25 мкл минерального масла, и выполняют пять циклов полимеразной реакции синтеза цепи в соответствии с программой циклического изменения температуры в следующей последовательности: 94°С в течение 1 минуты, 60°С в течение 1 минуты и 72°С в течение 1 минуты.
Во время осуществления третьей полимеразной реакции синтеза цепи используют 100 мкл реакционного раствора, содержащего 2 мкл реакционного раствора, полученного при выполнении второй полимеразной реакции синтеза цепи, по 50 пмолей затравок HLAMBS и HLAMB4 и 5 единиц TaKaRa Ex Taq (Takara Shuzo), поверх которого помещают 50 мкл минерального масла, и выполняют тридцать циклов полимеразной реакции синтеза цепи в соответствии с программой циклического изменения температуры в следующей последовательности: 94°С в течение 1 минуты, 60°С в течение 1 минуты и 72°С в течение 1 минуты, что дает фрагмент ДНК длиной 357 пар оснований (продукт третьей полимеразной реакции синтеза цепи). Фрагмент ДНК подвергают электрофорезу в 3% низкоплавком агарозном геле. Полученный фрагмент ДНК удаляют и очищают с помощью набора GENECLEAN (BIO 101).
Полученный таким образом фрагмент ДНК (0,1 мкг) расщепляют EcoRI и субклонируют в плазмиде pUC19 ΔHindIII, которую предварительно обрабатывают щелочной фосфатазой бактерий (ВАР). Полученную плазмиду вводят в компетентную клетку Е. coli, JM109, для образования трансформанта. Полученный таким образом трансформант культивируют в течение ночи в 2 мл среды 2хYТ, содержащей 50 мкг/мл ампициллина. Выделенную из клеточной фракции плазмиду очищают с помощью набора для очистки плазмид QIAprep (QIAGEN).
Последовательность ДНК полученной плазмиды подтверждают с помощью затравок М13 Primer M4 и М13 Primer RV (Takara Shuzo) и определяют на секвенаторе ДНК 373А (ABI). Плазмида, с подтвержденной правильной последовательностью ДНК без какой-либо делеции, названа "Cλ/pUC19".
(iii) Конструирование ДНК, кодирующей С-область κ-цепи L-цепи человека
Фрагмент ДНК, кодирующий С-область κ-цепи L-цепи, клонируют из плазмиды HEF-PMIk-gk (WO 92/19759) по методу PCR. Прямую затравку HKAPS (последовательность с идентификационным №19) конструируют таким образом, чтобы она содержала EcoRI-, HindIII- и Blnl-узнающие последовательности, и обратную затравку НКАРА (последовательность с идентификационным №20) конструируют таким образом, чтобы она содержала EcoRI-узнающую последовательность, используя для их синтеза синтезатор ДНК/РНК 394 (ABI).
Полимеразную реакцию синтеза цепи осуществляют, используя 100 мкл реакционного раствора, содержащего 0,1 мкг плазмиды HEF-PMIk-gk в качестве матрицы, по 50 пмолей затравок HKAPS и НКАРА и 5 единиц TaKaRa Ex Taq (Takara Shuzo), поверх которого помещают 50 мкл минерального масла. Выполняют тридцать циклов полимеразной реакции синтеза цепи в соответствии с программой циклического изменения температуры в следующей последовательности: 94°С в течение 1 минуты, 60°С в течение 1 минуты и 72°С в течение 1 минуты, в результате чего получают фрагмент ДНК длиной 360 пар оснований. Полученный фрагмент ДНК выделяют электрофорезом в 3% низкоплавком агарозном геле, удаляют и очищают с помощью набора GENECLEAN II (BIO 101).
Полученный таким образом фрагмент ДНК расщепляют EcoRI и клонируют в плазмиде pUC19 ΔHindIII, которую предварительно обрабатывают щелочной фосфатазой бактерий (ВАР). Полученную плазмиду вводят в компетентную клетку E.coli, JM109, для образования трансформанта. Полученный таким образом трансформант культивируют в течение ночи в 2 мл среды 2xYT, содержащей 50 мкг/мл ампициллина. Выделенную из клеточной фракции плазмиду очищают с помощью набора для очистки плазмид QIAprep (QIAGEN).
Очищенную плазмидную ДНК секвенируют, используя затравки М13 Primer М4 и М13 Primer RV (Takara Shuzo), с помощью секвенатора ДНК 373А (ABI). Плазмида, с подтвержденной правильной последовательностью оснований, названа "Сκ/pUC 19".
(3) Конструирование экспрессирующего вектор L-цепи химерного антитела
Конструируют экспрессирующий вектор L-цепи химерного антитела №23-57-137-1. ДНК, кодирующую V-область L-цепи №23-57-137-1, лигируют с сайтами HindIII и Binl, расположенными непосредственно перед С-областью антитела человека, обеих плазмид Cλ/pUC19 и Cκ/pUC19, в результате чего получают векторы pUC19, содержащие ДНК, кодирующую V-область L-цепи химерного антитела № 23-57-137-1 и С-область λ- или κ-цепи L-цепи. Оба вектора затем расщепляют EcoRI, чтобы вырезать ДНК, кодирующую L-цепь химерного антитела, которую затем субклонируют в экспрессирующем векторе HEF.
ДНК, кодирующую V-область L-цепи антитела №23-57-137-1, клонируют из плазмиды MBC1L24 по методу PCR. Отдельные затравки синтезируют с помощью синтезатора ДНК/РНК 394 (ABI). Обратную затравку MBCCHL1 (последовательность с идентификационным №21) конструируют таким образом, чтобы она содержала HindIII-узнающую последовательность и последовательность Козака (Kozak, M. et al., J. Mol. Biol. 196, 947-950, 1987), и прямую затравку MBCCHL3 (последовательность с идентификационным №22) конструируют таким образом, чтобы она содержала BgII- и RcoRI-узнающие последовательности.
Полимеразную реакцию синтеза цепи осуществляют, используя 100 мкл реакционного раствора, содержащего 10 мМ трис-HCl (рН 8,3), 50 мМ KCl, 1,5 мМ MgCl2, 0,2 мМ dNTP, 0,1 мкг MBC1L24, по 50 пмолей затравок MBCCHL1 и MBCCHL3 и 1 мкл AmpliTaq (Perkin Elmer), поверх которого помещают 50 мкл минерального масла. Выполняют тридцать циклов полимеразной реакции синтеза цепи в соответствии с программой циклического изменения температуры в следующей последовательности: 94°С в течение 45 секунд, 60°С в течение 45 секунд и 72°С в течение 2 минут.
Фрагмент ДНК длиной 444 пары оснований подвергают электрофорезу в 3% низкоплавком агарозном геле, собирают и очищают с помощью набора GENECLEAN (BIO 101). Очищенный фрагмент ДНК растворяют в 20 мкл раствора, содержащего 10 мМ трис-HCl (рН 7,4) и 1 мМ EDTA. Один мкл продукта полимеразной реакции синтеза цепи расщепляют в 20 мкл реакционного раствора, содержащего 10 мМ трис-HCl (рН 7,5), 10 мМ MgCl2, 1 мМ дитиотреитола, 50 мМ NaCl, 8 единиц HindIII (Takara Shuzo) и 8 единиц EcoRI (Takara Shuzo), при температуре 37°С в течение 1 часа. Гидролизованный раствор экстрагируют фенолом и хлороформом и осаждают ДНК этанолом. Полученную таким образом ДНК растворяют в 8 мкл раствора, содержащего 10 мМ трис-HCl (рН 7,4) и 1 мМ EDTA.
Один мкг плазмиды pUC19 расщепляют HindIII и EcoRI аналогично вышеописанной процедуре, экстрагируют фенолом и хлороформом, после чего расщепленную плазмиду осаждают этанолом. Полученный продукт обрабатывают щелочной фосфатазой бактерий [то есть щелочной фосфатазой (E.coli C75; Takara Shuzo)], экстрагируют фенолом и хлороформом и осаждают ДНК этанолом. Полученную ДНК растворяют в 10 мкл раствора, содержащего 10 мМ трис-НС! (рН 7,4) и 1 мМ EDTA.
Один мкл обработанной щелочной фосфатазой плазмиды pUC19 смешивают с 4 мкл вышеуказанного продукта полимеразной реакции синтеза цепи, чтобы лигировать их друг с другом при помощи набора для лигирования ДНК, вариант 2 (Takara Shuzo). Полученную плазмиду вводят в компетентную клетку Е. coli, JM109 (Nippon Gene) аналогично процедуре, описанной выше для образования трансформанта. Полученный трансформант инокулируют в течение ночи на агаровой среде 2хYТ, содержащей 50 мкг/мл ампициллина, при температуре 37°С. Затем полученный трансформант культивируют в течение ночи в 2 мл среды 2xYT, содержащей 50 мкг/мл ампициллина, при температуре 37°С. Выделенную из клеточной фракции плазмиду очищают с помощью набора для очистки плазмид QIAprep (QIAGEN). После определения последовательности ДНК, плазмида, с подтвержденной правительной последовательностью ДНК, названа "CHL/pUC19".
По одному мкг плазмид Cλ/pUC19 и Cκ/pUC19 расщепляют в 20 мкл реакционного раствора, содержащего 20 мМ трис-HCl (рН 8,5), 10 мМ MgCl2, 1 мМ дитиотреитола, 100 мМ KCl, 8 единиц HindIII (Takara Shuzo) и 2 единицы BInI (Takara Shuzo), при температуре 37°С в течение 1 часа. Гидролизованный раствор экстрагируют фенолом и хлороформом и осаждают ДНК этанолом. Полученную ДНК обрабатывают щелочной фосфатазой бактерий при температуре 37°С в течение 30 минут, экстрагируют фенолом и хлороформом и осаждают этанолом. Полученный продукт растворяют в 10 мкл раствора, содержащего 10 мМ трис-HCl (рН 7,4) и 1 мМ EDTA.
Восемь мкг плазмиды CHL/pUC19, которая содержит ДНК, кодирующую V-область L-цепи №23-57-137-1, расщепляют HindIII и В1nI так, как это описано выше. Полученный таким образом фрагмент ДНК длиной 409 пар оснований подвергают электрофорезу в 3% низкоплавком агарозном геле, собирают и очищают от геля с помощью набора GENECLEAN (BIO 101). Этот фрагмент ДНК растворяют в 10 мкл раствора, содержащего 10 мМ трис-HCl (рН 7,4) и 1 мМ EDTA.
Четыре мкл ДНК V-области L-цепи субклонируют в 1 мкл обработанных щелочной фосфатазой плазмид Cλ/pUC19 или Cκ/pUC19 и вводят в компетентную клетку E.coli, JM109, с целью получения трансформанта. Полученный трансформант культивируют в течение ночи в 3 мл среды 2xYT, содержащей 50 мкг/мл ампициллина. Выделенную из клеточной фракции плазмиду очищают с помощью набора для очистки плазмид QIAprep (QIAGEN). Полученные таким образом плазмиды соответственно названы "MBC1L(λ)/pUC19" и "MBC1L(κ)/pUC19".
Плазмиды MBC1L(λ)/pUC19 и MBC1L(κ)/pUC19 расщепляют EcoRI и подвергают электрофорезу в 3% низкоплавком агарозном геле. Выделяют фрагмент ДНК длиной 743 пары оснований, очищают его от геля с помощью набора GENECLEANII (BIO 101) и растворяют в 10 мкл раствора, содержащего 10 мМ трис-HCl (рН 7,4) и 1 мМ EDTA.
Экспрессирующий вектор плазмиды HEF-PMlk-gk (2,7 мкг) расщепляют EcoRI, экстрагируют фенолом и хлороформом и осаждают фрагмент ДНК этанолом. Полученный фрагмент ДНК обрабатывают щелочной фосфатазой бактерий и подвергают электрофорезу в 1% низкоплавком агарозном геле. Фрагмент ДНК длиной 6561 пар оснований выделяют и очищают от геля с помощью набора GENECLEANII (BIO 101). Фрагмент ДНК растворяют в 10 мкл раствора, содержащего 10 мМ трис-HCl (рН 7,4) и 1 мМ EDTA.
Полученный таким образом вектор HEF обрабатывают щелочной фосфатазой бактерий и 2 мкл обработанного щелочной фосфатазой вектора HEF смешивают с 3 мкл EcoRI-фрагментов плазмид MBC1L(λ)/pUC19 или MBC1L(κ)/pUC19, чтобы лигировать их друг с другом. Продукт лигирования вводят в компетентную клетку Е. coli, JM109, для образования трансформанта. Полученный трансформант культивируют в 2 мл среды 2xYT, содержащей 50 мкг/мл ампициллина. Выделенную из клеточной фракции плазмиду очищают с помощью набора для очистки плазмид QIPprep (QIAGEN).
Очищенную таким образом плазмидную ДНК расщепляют в 20 мкл реакционного раствора, содержащего 20 мМ трис-HCl (рН 8,5), 10 мМ MgCl2, 1 мМ дитиотреитола, 100 мМ КС1, 8 единиц HindIII (Takara Shuzo) и 2 единицы Pvul (Takara Shuzo), при температуре 37°С в течение 1 часа. Предполагается, что, если вышеуказанный фрагмент ДНК введен в вектор с правильной ориентацией, то в результате гидролиза будет получен расщепленный фрагмент длиной 5104/2195 пар оснований, и если вышеуказанный фрагмент ДНК введен в вектор с обратной ориентацией, то будет получен расщепленный фрагмент длиной 4387/2926 пар оснований. Исходя из этого предположения плазмиды, в которых данный фрагмент ориентирован правильно, названы соответственно "MBC1L(λ)/neo" и "МВС1L(κ)/neo".
(4) Трансфекция клеток COS-7
Полученные выше экспрессирующие плазмиды временно экспрессируют в клетках COS-7, чтобы определить связывающую и нейтрализующую активность химерного антитела против антигена.
Временную экспрессию химерного антитела осуществляют, используя комбинацию плазмид МВС1НкДНК/рСOS1 и MBClL(λ)/neo или плазмид МВС1НкДНК/рСOS1 и MBC1L(κ)/neo, по методу электропорации с помощью электроимпульсного устройства Gene Pulser (Bio Rad) для котрансфекции этих комбинаций плазмидных ДНК в клетки COS-7. То есть к 0,8 мл суспензии клеток COS-7 в забуференном фосфатом физиологическом растворе (PBS(-)) с концентрацией 1×107 клеток/мл добавляют 10 мкг каждой плазмидной ДНК. Полученный раствор подвергают воздействию импульсов при электростатической емкости 1500 В и силе тока 2 мкФ, чтобы вызвать электропорацию. Раствор выдерживают в течение 10 минут при комнатной температуре, после чего клетки суспендируют в модифицированной по способу Дульбекко среде Игла, содержащей 2% фетальной телячьей сыворотки с ультранизким содержанием IgG (GIBCO), и культивируют в 10 см чашке в инкубаторе с CO2. Клетки культивируют в течение 72 часов, после чего культуральный супернатант собирают, центрифугируют для удаления клеточного дебриса и используют в качестве образца для твердофазного иммуноферментного анализа (ELISA).
При выполнении этой процедуры очистку химерных антител от культурального супернатанта клеток COS-7 производят с помощью набора AffiGel Protein A MAPSII (Bio Rad) в соответствии с прилагаемыми к нему инструкциями.
(5) Твердофаэный иммуноферментный анализ (ELISA)
(i) Определение концентрации антител
Планшет для твердофазного иммуноферментного анализа (ELISA), предназначенный для определения концентрации антител, готовят следующим образом. Во все лунки 96-луночного планшета для ELISA (Maxisorp, NUNC) вводят 100 мкл раствора, содержащего антитело козы против IgG человека (TAGO), в буфере для сенсибилизации поверхностей (0,1М раствор NaHCO3, 0,02% NaN3), с концентрацией 1 мкг/мл и блокируют 200 мкл буфера для разведения [50 мМ трис-HCl, 1 мМ MgCl2, 0,1 М NaCl, 0,05% твина-20, 0,02% NaN3, 1% бычьего сывороточного альбумина (BSA); рН 7,2]. Во все лунки добавляют культуральный супернатант клеток COS-7, в которых были экспрессированы химерные антитела или очищенные химерные антитела, полученные в результате последовательного разведения. Содержимое лунок инкубируют при комнатной температуре в течение 1 часа и промывают смесью забуференного фосфатом физиологического раствора и твина-20, после чего в каждую лунку добавляют 100 мкл раствора конъюгированных со щелочной фосфатазой антител козы против IgG человека (TAGO). Полученную смесь инкубируют при комнатной температуре в течение 1 часа, промывают смесью забуференного фосфатом физиологического раствора и твина-20 и добавляют в каждую лунку 1 мг/мл раствора субстрата ("Sigma 104", паранитрофенилфосфорная кислота, SIGMA). У полученного раствора измеряют оптическую плотность при длине волны 405 нм, используя аппарат для прочтения микропланшетов (Bio Rad). В качестве эталона при выполнении этого измерения используют очищенный иммуноглобулин IgG1λ человека (сайт связывания).
(ii) Определение антигенсвязывающей способности
Планшет для твердофазного иммуноферментного анализа (ELISA), предназначенный для определения антигенсвязывающей способности, готовят следующим образом. Во все лунки 96-луночного планшета вводят 100 мкл раствора, содержащего PTHrP человека (1-34) (Peptide Research Institute), в буфере для сенсибилизации поверхностей с концентрацией 1 мкг/мл, и блокируют 200 мкл буфера для разведения. Во все лунки добавляют культуральный супернатант клеток COS-7, в которых были экспрессированы химерные антитела или очищенные химерные антитела, полученные в результате последовательного разведения. Содержимое лунок инкубируют при комнатной температуре и промывают смесью забуференного фосфатом физиологического раствора и твина-20, после чего в каждую лунку добавляют 100 мкл раствора конъюгированных со щелочной фосфатазой антител козы против IgG человека (TAGO). Полученную смесь инкубируют при комнатной температуре, промывают смесью забуференного фосфатом физиологического раствора и твина-20 и добавляют в каждую лунку 1 мг/мл раствор субстрата ("Sigma 104", паранитрофенилфосфорная кислота, SIGMA). У полученного раствора измеряют оптическую плотность при длине волны 405 нм, используя аппарат для прочтения микропланшетов (Bio Rad).
Результаты этого анализа показывают, что химерное антитело обладает связывающей способностью против PTHrP человека (1-34) и имеет правильную структуру V-области клонированного антитела мыши. Кроме того, установлено, что не существует различия между связывающей способностью против PTHrP (1-34) химерного антитела, в котором С-область L-цепи имеет λ-цепь, и химерного антитела, в котором С-область L-цепи имеет κ-цепь. Поэтому С-область L-цепи очеловеченного антитела конструируют с использованием λ-цепи L-цепи очеловеченного антитела.
(6) Создание стабильно трансформированной линии клеток яичника китайского хомячка (СНО)
Чтобы создать стабильный трансформант для химерного антитела, вышеуказанную экспрессирующую плазмиду вводят в клетку СНО (DXB11).
Стабильный трансформант для химерного антитела создают, используя комбинации экспрессирующих плазмид для клетки СНО, МВС1НкДНК/рСНO1 и MBC1L(λ)/neo, или экспрессирующих плазмид для клетки СНО, МВС1НкДНК/рСНO1 и MBC1L(κ)/neo. Эти комбинации плазмид по отдельности котрансфецируют в клетки СНО по методу электропорации с помощью устройства Gene Pulser (Bio Rad). Все экспрессирующие векторы расщепляют рестрикционным ферментом Pvul с получением линейной ДНК. Полученную ДНК экстрагируют фенолом и хлороформом и осаждают этанолом. Полученные таким образом плазмидные ДНК подвергают электропорации. К 0,8 мл суспензии клеток СНО в PBS(-) с концентрацией 1×107 клеток/мл добавляют 10 мкг каждой плазмидной ДНК. Полученную смесь подвергают воздействию импульсов при электростатической емкости 1500 В и силе тока 2 мкФ. Электропорированные клетки выдерживают при комнатной температуре в течение 10 минут и суспендируют в среде МЕМ-α(GIBCO), содержащей 10% фетальной телячьей сыворотки (GIBCO). Полученную суспензию культивируют на трех 96-луночных планшетах (Falcon) в инкубаторе с CO2. На следующий день после начала культивирования эту среду заменяют селективной средой [среда МЕМ-α, содержащей 10% фетальной телячьей сыворотки (GIBCO) и 500 мг/мл GENETICIN (G418Sulfate; GIBCO) без рибонуклеозида или дезоксирибонуклеозида]. Из культуральной среды отбирают клетки, в которые введен ген антитела. Селективную среду заменяют свежей средой до культивирования и через две недели культивирования, после чего клетки исследуют под микроскопом. В клетках, характеризующихся удовлетворительным ростом, определяют количество антител, полученных в результате выполнения вышеуказанного твердофазного иммуноферментного анализа. Избирательно собирают клетки, которые продуцировали наибольшее количество антител.
Повышение уровня культуры стабильного трансформанта для полученных антител производят во вращающемся флаконе с использованием минимальной поддерживающей среды (MEM), дополненной 2% фетальной телячьей сыворотки с ультранизким содержанием IgG без рибонуклеозида или дезоксирибонуклеозида. На 3-й и 4-й день культивирования культуральный супернатант собирают и фильтруют через фильтр с размером пор 0,2 мкм (Millipore), чтобы удалить клеточный дебрис.
Затем химерные антитела очищают от культурального супернатанта клеток СНО в колонке POROS, заполненной белком А (PerSeptive Biosystems), на ConSep LC100 (Millipore) в соответствии с прилагаемыми инструкциями. Очищенные химерные антитела используют в качестве образцов для определения нейтрализующей активности и для исследования эффективности на животных моделях гиперкальциемии. Концентрацию и связывающую активность очищенных химерных антител против антигена определяют с помощью аналогичной системы для твердофазного иммуноферментного анализа ELISA.
Пример 3
Конструирование очеловеченного антитела
(1) Конструирование Н-цепи очеловеченного антитела
(i) Конструирование очеловеченной V-области Н-цепи
Н-цепь очеловеченного антитела №23-57-137-1 получают путем трансплантации гипервариабельного участка по методу PCR. Чтобы получить Н-цепь очеловеченного антитела №23-57-137-1 (вариант "а"), имеющую каркасную область, выделенную из антитела человека S31679 (NMRF-PDB; Cuisinier, A.M. et al., Eur. J.Iinmunol., 23, 110-118, 1993), используют следующие шесть типов затравок для полимеразной реакции синтеза цепи: затравки для трансплантации гипервариабельных участков MBC1PGP1 (последовательность с идентификационным №23) и MBC1HGP3 (последовательность с идентификационным №24) (обе содержат смысловую последовательность ДНК) и MBC1HGP2 (последовательность с идентификационным №25) и MBC1HGP4 (последовательность с идентификационным №26) (обе содержат антисмысловую последовательность ДНК), которые с обоих концов имеют комплементарную последовательность длиной 15-21 пар оснований; внешние затравки MBC1HVS1 (последовательность с идентификационным №27) и MBC1HVR1 (последовательность с идентификационным №28), которые соответственно гомологичны затравкам для трансплантации гипервариабельных участков MBC1HGP1 и MBC1HGP4.
Затравки для трансплантации гипервариабельных участков MBC1HGP1, MBC1HGP2, MBC1HGP3 и MBC1HGP4 выделяют с помощью денатурированного мочевиной полиакриламидного геля (Molecular Cloning: A Laboratory Manual, Sambrook, et al., Cold Spring Harbor Laboratory Press, 1989) и экстрагируют из гель-фракции методом измельчения и вымачивания (Molecular Cloning: A Laboratory Manual, Sambrook, et al., Cold Spring Harbor Laboratory Press, 1989), выполняя эту процедуру следующим образом.
С помощью 6% денатурированного полиакриламидного геля выделяют по одному нмолю всех затравок для трансплантации гипервариабельного участка с получением фрагментов ДНК. Полученные фрагменты ДНК требуемой длины идентифицируют на тонкой пластинке силикагеля, облучаемой ультрафиолетом, и удаляют их методом измельчения и вымачивания. Полученный продукт растворяют в 20 мкл раствора, содержащего 10 мМ трис-HCl (рН 7,4) и 1 мМ EDTA. Полимеразную реакцию синтеза цепи осуществляют с использованием TaKaRa Ex Taq (Takara Shuzo). Реакционный раствор (100 мкл), используемый для осуществления полимеразной реакции синтеза цепи, содержит по 1 мкл вышеуказанных затравок для трансплантации гипервариабельных участков MBC1HGP1, MBC1HGP2, MBC1HGP3 и MBC1HGP4, 0,25 мМ dNTP и 2,5 единицы TaKaRa Ex Taq в буфере. Выполняют пять циклов полимеразной реакции синтеза цепи в соответствии с программой циклического изменения температуры в следующей последовательности: 94°С в течение 1 минуты, 55°С в течение 1 минуты и 72°С в течение 1 минуты. К полученной реакционной смеси добавляют обе внешние затравки MBC1HVS1 и MBC1HVR1 в количестве 50 пмолей. Используя эту реакционную смесь, выполняют еще 30 циклов полимеразной реакции синтеза цепи в соответствии с той же программой циклического изменения температуры. Амплифицированный таким образом фрагмент ДНК выделяют путем электрофореза в агарозном геле с использованием 4% агарозы Nu Sieve GTG (FMC Bio. Products).
Затем вырезают участок агарозы, содержащий фрагмент ДНК длиной 421 пар оснований, и очищают указанный фрагмент ДНК при помощи набора GENECLEANII (BIO 101) в соответствии с прилагаемыми к нему инструкциями. Очищенный фрагмент ДНК осаждают этанолом и растворяют в 20 мкл раствора, содержащего 10 мМ трис-HCl (рН 7,4) и 1 мМ EDTA. Реакционную смесь для полимеразной реакции синтеза цепи используют для субклонирования этого фрагмента ДНК в плазмиде pUC19, которую предварительно расщепляют BamHI и HindIII, после чего определяют последовательность оснований полученной плазмиды. Плазмида, имеющая правильную последовательность, названа "hMBCHv/pUC19".
(ii) Конструирование V-области Н-цепи для кДНК очеловеченной Н-цепи
ДНК очеловеченной V-области Н-цепи, полученную на предыдущей стадии, модифицируют по методу PCR, чтобы лигировать ее с кДНК очеловеченной Сγ1 С-области Н-цепи. Для этого конструируют обратную затравку MVC1HVS1 так, чтобы она гибридизировала с последовательностью, кодирующей 5'-концевую область лидерной последовательности V-области, имела согласованную последовательность Козака (Kozak et al., J. Mol.Biol. 196, 947-950, 1987) и HindIII- и EcoRI-узнающие последовательности. Прямую затравку MBC1HVR2, используемую для модификации ДНК для V-области Н-цепи, конструируют таким образом, чтобы она гибридизировала с последовательностью ДНК, кодирующей 3'-концевую область J-области, и с последовательностью ДНК, кодирующей 5'-концевую область С-области, и имела AlaI- и SamI-узнающие последовательности.
Полимеразную реакцию синтеза цепи выполняют с использованием TaKaRa Ex Taq (Takara Shuzo) и соответствующего буфера. Реакционный раствор, используемый для полимеразной реакции синтеза цепи, содержит 0,4 мкг hMBCH/pUC19 в качестве матрицы ДНК, по 50 пмолей затравок MBC1HVS2 и MBC1HVR2, 2,5 единицы TaKaRaExTaq и 0,25 мМ dNTP в буфере. Выполняют тридцать циклов полимеразной реакции синтеза цепи в соответствии с программой циклического изменения температуры в следующей последовательности: 94°С в течение 1 минуты, 55°С в течение 1 минуты и 72°С в течение 1 минуты. Амплифицированный таким образом фрагмент ДНК выделяют посредством электрофореза в агарозном геле с использованием 3% агарозы Nu Sieve GTG (FMC Bio. Products).
Фрагмент ДНК длиной 456 пар оснований вырезают и очищают с помощью набора GENECLEANII (BIO 101) в соответствии с прилагаемыми к нему инструкциями. Очищенный фрагмент ДНК осаждают этанолом и растворяют в 20 мкл раствора, содержащего 10 мМ трис-HCl (рН 7,4) и 1 мМ EDTA. Полученную таким образом реакционную смесь используют для субклонирования этого фрагмента ДНК в плазмиде pUC19, которую предварительно расщепляли EcoRI и SmaI, после чего определяют последовательность ДНК полученной плазмиды. Плазмидная ДНК, которая содержит ДНК, кодирующую V-область Н-цепи мыши, выделенную из гибридомы №23-57-137-1, и имеет EcoRI- и HindIII-узнающие последовательности, последовательность Козака у 5'-конца и ApaI- и SmaI-узнающие последовательности у 3'-конца, названа "hMBClHv/pUC19".
(2) Конструирование экспрессирующего вектора для Н-цепи очеловеченного антитела
Плазмиду RVh-PM1f-кДНК, содержащую последовательность кДНК Н-цепи антитела hPM1, расщепляют ApaI и BamHI с получением фрагмента ДНК, содержащего последовательность оснований С-области Н-цепи. Полученный фрагмент ДНК вводят в плазмиду hMBClHv/pUC19, которую предварительно расщепляют ApaI и BamHI. Полученная таким образом плазмида названа "hМВС1НкДНК/рUС19". Эта плазмида содержит ДНК, кодирующую V-область Н-цепи очеловеченного антитела №23-57-137-1, и ДНК, кодирующую Сγ1 С-области Н-цепи человека, имеет EcoRI- и Hindi II-узнающие последовательности в 5'-концевой области и BamHI-узнающую последовательность в 3'-концевой области. Эта последовательность оснований и соответствующая аминокислотная последовательность очеловеченной Н-цепи варианта "а", имеющиеся в плазмиде hМВС1НкДНК/рUС19, выражены соответственно последовательностями с идентификационными №№58 и 56.
Плазмиду hМВС1НкДНК/рUС19 расщепляют EcoRI и BamHI с получением фрагмента ДНК, содержащего последовательность оснований, кодирующую Н-цепь. Полученный фрагмент ДНК вводят в экспрессирующую плазмиду pCOS1, которую предварительно расщепляют EcoRI и BamHI. Полученная таким образом экспрессирующая плазмида для очеловеченного антитела названа "hМВС1НкДНК/рCOS1".
Чтобы получить плазмиду для экспрессии в клетке СНО, плазмиду hМВС1НкДНК/рUС19 расщепляют EcoRI и BamHI с получением фрагмента ДНК, кодирующего Н-цепь. Полученный фрагмент ДНК вводят в экспрессирующий вектор pCHO1, который получают путем расщепления плазмиды EcoRI и BamHI. Полученная таким образом экспрессирующая плазмида для очеловеченного антитела названа "hВС1НкДНК/рСНО1".
(3) Конструирование L-цепи для вариабельной области гибридного антитела
(i) Получение гибридного антитела FR1,2/FR3,4
Конструируют ДНК, кодирующую L-цепь, в которой каркасные области рекомбинированы областями очеловеченного антитела и (химерного) антитела мыши, и оценивают указанные области в отношении их пригодности для очеловечивания. На этом этапе, используя сайт рестрикции AflII, имеющийся в CDR2, получают гибридное антитело, содержащее FR1 и FR2, выделенные из антитела человека, и FR3 и FR4, выделенные из антитела мыши.
В 100 мкл реакционного раствора, содержащего 10 мМ трис-HCl (рН 7,5), 10 мМ MgCl2, 1 мМ дитиотреитола, 50 мМ NaCl, 0,01% (в отношении веса к объему) бычьего сывороточного альбумина и 10 единиц AflII (Takara Shuzo), расщепляют по десять мкг плазмид MBClL(λ)/neo и hMBCIL(λ)/neo при температуре 37°С в течение 1 часа. Реакционный раствор подвергают электрофорезу в 2% низкоплавком агарозном геле, удаляют фрагменты ДНК длиной 6282 пары оснований (определяются как "cl") и длиной 1022 пары оснований (определяются как "h1") и очищают их от геля с помощью набора GENECLEANII (BIO 101).
Один мкг полученных фрагментов с1 и h1 обрабатывают щелочной фосфатазой бактерий (ВАР). Полученный фрагмент ДНК экстрагируют фенолом и этанолом, осаждают этанолом и растворяют в 10 мкл раствора, содержащего 10 мМ трис-HCl (рН 7,4) и 1 мМ EDTA.
Один мкл фрагментов с1 и h1, обработанных щелочной фосфатазой, смешивают соответственно с 4 мкл фрагментов ДНК h2 и с2, чтобы лигировать их друг с другом (при температуре 4°С в течение ночи). Продукт лигирования вводят в компетентную клетку E.coli, JM109, с целью получения трансформанта. Полученный трансформант культивируют в 2 мл среды 2хYТ, содержащей 50 мкг/мл ампициллина. Выделенную из клеточной фракции плазмиду очищают с помощью набора для очистки плазмид QIAprep (QIAGEN).
Очищенную плазмидную ДНК расщепляют в 20 мкл реакционного раствора, содержащего 10 мМ трис-НС! (рН 7,5), 10 мМ MgCl2, 1 мМ дитиотреитола, 2 единицы ApaLI (Takara Shuzo) и 8 единиц BamHI (Takara Shuzo) или HindIII (Takara Shuzo), при температуре 37°С в течение 1 часа. На этой стадии производят идентификацию плазмиды, полагая, что, если фрагмент c1-h2 правильно лигирован в плазмиде, это лигирование должно давать ApaLI-расщепленный фрагмент, содержащий 5560/1246/498 пар оснований, или BamHI/HindIII-расщепленный фрагмент, содержащий 7134/269 пар оснований.
Экспрессирующий вектор, кодирующий L-цепь гибридного антитела мыши, содержащего FR1,2 человека и FR3,4 мыши, назван "h/mMBC1L(λ)/neo". С другой стороны, нельзя получить клон для h1-c1. Поэтому производят рекомбинацию на векторе pUC с последующим клонированием в векторе HEF. В качестве матриц используют плазмиду hMBC1Laλ/pUC19, которая содержит ДНК, кодирующую V-область L-цепи очеловеченного антитела без аминокислотных замен, и плазмиду hMBClLdλ/pUC19, которая содержит ДНК, кодирующую V-область L-цепи очеловеченного антитела с заменой аминокислоты в 91-положении каркасной области FR3 (аминокислота №87 в соответствии с определением Кабата), то есть тирозина, изолейцином.
В 30 мкл реакционного раствора, содержащего 10 мМ трис-HCl (рН 7,5), 10 мМ MgCl2, 1 мМ дитиотреитола, 50 мМ NaCl, 0,01% (в отношении веса к объему) бычьего сывороточного альбумина, 16 единиц HindIII и 4 единицы AfIII, расщепляют по десять мкл плазмид MBC1L(λ)/pUC19, hMBC1Laλ/pUC19 и hMBC1Ldλ/pUC19 при температуре 37°С в течение 1 часа. Реакционный раствор обрабатывают электрофорезом в 2% низкоплавком агарозном геле, после чего собирают и очищают с помощью набора GENECLEANII (BIO 101) следующие фрагменты ДНК: фрагмент ДНК длиной 215 пар оснований из плазмиды MBC1L(λ)/pUC19 (определяется как "с2'") или фрагмент ДНК длиной 3218 пар оснований из плазмид hMBC1Laλ/pUC19 и hMBClLdλ/pUC19 (определяются соответственно как "hal'" и "hdl'").
Фрагменты hal' и hdl' по отдельности лигируют с фрагментом с2' и вводят в компетентную клетку E.coli с целью получения трансформанта. Полученный трансформант культивируют в 2 мл среды 2xYT, содержащей 50 мкг/мл ампициллина. Выделенную из клеточной фракции плазмиду очищают с помощью набора для очистки плазмид QIAprep (QIAGEN). Полученные плазмидные ДНК, содержащие фрагмент hal' и фрагмент hdl', названы соответственно "m/hMBClLaλ/pUC19" и "m/hMBClLdλ/pUC19".
Плазмиды m/hMBClLaλ/pUC19 и m/hMBClLdλ/pUC19 расщепляют EcoRI. Фрагмент ДНК длиной 743 пары оснований обрабатывают электрофорезом в 2% низкоплавком агарозном геле, удаляют и очищают от геля с помощью набора GENECLEANII (BIО101). Полученный продукт растворяют в 20 мкл раствора, содержащего 10 мМ трис-HCl (рН 7,4) и 1 мМ EDTA.
Четыре мкл полученного фрагмента ДНК смешивают с 1 мкл вышеуказанного вектора HEF, обработанного щелочной фосфатазой бактерий, чтобы лигировать их друг с другом. Продукт лигирования вводят в компетентную клетку E.coli, JM109, с целью получения трансформанта. Полученный трансформант культивируют в 2 мл среды 2xYT, дополненной 50 мкг/мл ампициллина. Выделенную из клеточной фракции плазмидную ДНК очищают с помощью набора для очистки плазмид QIAprep (QIAGEN).
Очищенную плазмидную ДНК расщепляют в 20 мкл реакционного раствора, содержащего 20 мМ трис-HCl (рН 8,5), 10 мМ MgCl2, 1 мМ дитиотреитола, 100 мМ KCl, 8 единиц HindIII (Takara Shuzo) и 2 единицы Pvul (Takara Shuzo), при температуре 37°С в течение 1 часа. На этой стадии плазмидную ДНК идентифицируют, исходя из предположения о том, что, если фрагмент ДНК введен в плазмиду с правильной ориентацией, то в результате гидролиза будет получен расщепленный фрагмент длиной 5104/2195 пар оснований, и если указанный фрагмент ДНК введен в плазмиду с обратной ориентацией, то будет получен расщепленный фрагмент длиной 4387/2926 пар оснований. Полученные таким образом плазмиды являются экспрепрессирующими векторами, кодирующими L-цепь гибридного антитела, содержащего FR1,2 мыши и FR3,4 человека, которые названы соответственно "m/hMBClLaλ/neo" и "m/hMBClLdλ/neo".
(ii) Получение гибридного антитела FR1/FR2
Гибридное антитело FR1/FR2 получают так же, как описано выше, используя сайт рестрикции SnaBI, имеющийся в гипервариабельном участке CDR1.
В 20 мкл реакционного раствора, содержащего 10 мМ трис-HCl (рН 7,9), 10 мМ MgCl2, 1 мМ дитиотреитола, 50 мМ NaCl, 0,01% (в отношении веса к объему) бычьего сывороточного альбумина и 6 единиц SnaBI (Takara Shuzo), расщепляют по десять мкг плазмид MBC1Lλ/neo и mMBC1Lλ/neo при температуре 37°С в течение 1 часа. Полученный реакционный раствор далее гидролизуют в 50 мкл реакционного раствора, содержащего 20 мМ трис-HCl (рН 8,5), 10 мМ MgCl2, 1 мМ дитиотреитола, 100 мМ KCl, 0,01% (в отношении веса к объему) бычьего сывороточного альбумина и 6 единиц Pvul, при температуре 37°С в течение 1 часа.
Полученный реакционный раствор обрабатывают электрофорезом в 1,5% низкоплавком агарозном геле, после чего фрагменты ДНК длиной 4955 и 2349 пар оснований удаляют и очищают от геля с помощью набора GENECLEANII (ВIO101). Фрагменты ДНК, полученные из плазмиды MBC1L(λ)/neo, названы "m1" (4955 пар оснований) и "m2" (2349 пар оснований), и фрагменты ДНК, полученные из плазмиды h/mMBClL(λ) /пео, названы "hm1" (4955 пар оснований) и "hm2" (2349 пар оснований). Все полученные фрагменты ДНК растворяют в 40 мкл раствора, содержащего 10 мМ трис-HCl (рН 7,4) и 1 мМ EDTA.
По одному мкл фрагментов m1 и hm1 лигируют соответственно с 4 мкл фрагментов hm2 и m2, а затем вводят в компетентную клетку E.coli, JM109, с целью получения трансформанта. Полученный трансформант культивируют в 2 мл среды 2xYT, содержащей 50 мкг/мл ампициллина. Выделенную из клеточной фракции плазмидную ДНК очищают с помощью набора для очистки плазмид QIAprep (QIAGEN).
Очищенную плазмидную ДНК расщепляют в 20 мкл реакционного раствора, содержащего 10 мМ трис-HCl (рН 7,5), 10 мМ MgCl2, 1 мМ дитиотреитола и 8 единиц Apal (Takara Shuzo) или 2 единицы AlaII (Takara Shuzo), при температуре 37°С в течение 1 часа.
Полученные таким образом плазмиды (m1-hm2 и hm1-m2) идентифицируют, исходя из предположения о том, что, если фрагменты ДНК лигированы в плазмиде с правильной ориентацией, то в результате гидролиза плазмиды (ml-hm2) Apal и AlaLI будут соответственно получены расщепленный фрагмент длиной 7304 пары оснований и фрагменты длиной 5560/1246/498 пар оснований, и в результате гидролиза плазмиды (hml-m2) Apal и ApLI будут соответственно получены фрагменты длиной 6538/766 пар оснований и фрагмент длиной 3535/2025/1246/498 пар оснований.
Экспрессирующий вектор, кодирующий L-цепь гибридного антитела, содержащего FR1 человека и FR2,3,4 мыши, назван "hmmMBCIL(λ)/neo", и экспрессирующий вектор, кодирующий L-цепь гибридного антитела FR1 мыши, FR2 человека и FR3,4 мыши, назван "mhmMBC1L(λ)/neo".
(4) Конструирование L-цепи очеловеченного антитела
L-цепь очеловеченного антитела №23-57-137-1 получают путем трансплантации гипервариабельного участка по методу PCR. То есть получают L-цепь очеловеченного антитела №23-57-137-1 (вариант "а"), которая содержит области FR1, FR2 и FR3, выделенные из антитела человека HSU03868 (GEN-BANK, Deftos, M. et al., Scand. J.Immunol, 39, 95-103, 1994), и область FR4, выделенную из антитела человека S25755 (NBRF-PDB), используя шесть типов затравок для полимеразной реакции синтеза цепи: затравки для трансплантации гипервариабельных участков MBC1LGP1 (последовательность с идентификационным №29) и MBC1LGP3 (последовательность с идентификационным №30), которые содержат смысловую последовательность ДНК, затравки для трансплантации гипервариабельных участков, MBC1LGP2 (последовательность с идентификационным №31) и MBC1LGP4 (последовательность с идентификационным №32), которые содержат антисмысловую последовательность ДНК, при этом все указанные затравки для трансплантации гипервариабельных участков имеют с обоих концов комплементарную последовательность длиной 15-21 пар оснований; и внешние затравки MBC1LVS1 (последовательность с идентификационным №33) и MBC1LVR1 (последовательность с идентификационным №34), которые гомологичны соответственно затравкам для трансплантации гипервариабельных участков MBC1LGP1 и MBC1LGP4.
Затравки для трансплантации гипервариабельных участков MBC1LGP1, MBC1LGP2, MBC1LGP3 и MBC1LGP4 выделяют с помощью денатурированного мочевиной полиакриламидного геля (Molecular Cloning: A Laboratory Manual, Sambrook et al. Cold Spring Harbor Laboratory Press, 1989) и экстрагируют из гель-фракции методом измельчения и вымачивания (Molecular Cloning: A Laboratory Manual, Sambrook et al., Cold Spring Harbor Laboratory Press, 1989).
С помощью 6% денатурированного полиакриламидного геля выделяют по одному нмолю всех затравок для трансплантации гипервариабельных участков. Фрагменты полученной ДНК требуемой длины идентифицируют на тонкой пластинке силикагеля, облучаемой ультрафиолетом, и удаляют методом измельчения и вымачивания. Полученный продукт растворяют в 20 мкл раствора, содержащего 10 мМ трис-HCl (рН 7,4) и 1 мМ EDTA.
Полимеразную реакцию синтеза цепи осуществляют, используя TaKaRa Ex Taq (Takara Shuzo) с буфером. Реакционный раствор (100 мкл), предназначенный для полимеразной реакции синтеза цепи, содержит по 1 мкл затравок для трансплантации гипервариабельных участков MBC1LGP1, MBC1LGP2, MBC1LGP3 и MBC1LGP4, 0,25 мМ dNTP и 2,5 единицы TaKaRa Ex Taq в буфере. Выполняют пять циклов полимеразной реакции синтеза цепи в соответствии с программой циклического изменения температуры в следующей последовательности: 94°С в течение 1 минуты, 55°С в течение 1 минут и 72°С в течение 1 минуты. В полученную реакционную смесь добавляют по 50 пмолей внешних затравок MBC1LVS1 и MBC1LVR1. Используя эту реакционную смесь, выполняют еще 30 циклов полимеразной реакции синтеза цепи в соответствии с той же программой циклического изменения температуры. Амплифицированный фрагмент ДНК выделяют путем электрофореза в агарозном геле с использованием 3% агарозы Nu Sieve GTG (FMC Bio. Products).
Вырезают участок агарозы, содержащий фрагмент ДНК длиной 421 пара оснований, и очищают от геля указанный фрагмент ДНК при помощи набора GENECLEANII (ВIО101) в соответствии с прилагаемыми к нему инструкциями. Полученную таким образом реакционную смесь для полимеразной реакции синтеза цепи используют для субклонирования этого фрагмента ДНК в плазмиде pUC19, которую предварительно расщепляют BamHI и HindIII. Затем определяют последовательность ДНК полученной плазмиды. Указанная плазмида названа "hMBCL/pUC19". Однако установлено, что в этой плазмиде аминокислота в 104-положении (аминокислота №96 в соответствии с определением Кабата) гипервариабельного участка CDR4 этой плазмиды заменена аргинином. Чтобы заменить эту аминокислоту тирозином, конструируют и синтезируют затравку MBC1LGP10R (последовательность с идентификационным №35). Затем осуществляют полимеразную реакцию синтеза цепи, используя TaKaRa Ex Taq (Takara Shuzo) с буфером. Реакционный раствор (100 мкл), используемый для выполнения полимеразной реакции синтеза цепи, содержит 0,6 мкг плазмиды hMBCL/pUC19 в качестве матричной ДНК, 50 пмолей затравок MBC1LVS1 и MBC1LGP10R, 2,5 единицы TaKaRa Ex Taq (Takara Shuzo) и 0,25 мМ dNTP в буфере, поверх которого помещают слой минерального масла. Выполняют тридцать циклов полимеразной реакции синтеза цепи в соответствии с программой циклического изменения температуры в следующей последовательности: 94°С в течение 1 минуты, 55°С в течение 1 минуты и 72°С в течение 1 минуты. Амплифицированный фрагмент ДНК выделяют посредством электрофореза в агарозном геле, используя 3% агарозу Nu Sieve GTG (FMC Bio. Products).
Фрагмент ДНК длиной 421 пара оснований вырезают и очищают от геля с помощью набора GENECLEANII (BIO 101) в соответствии с прилагаемыми к нему инструкциями. Полученную реакционную смесь для полимеразной реакции синтеза цепи используют для субклонирования фрагмента ДНК в плазмиду pUC19, которая была приготовлена путем расщепления плазмиды BamHI и HindIII.
В полученной плазмиде определяют последовательность ДНК, используя затравки М 13 Primer M4 и М13 Primer RV. Полученные результаты подтверждают, что плазмида имеет правильную последовательность. Эту плазмиду расщепляют HindIII и B1nI и посредством электрофореза в 1% агарозном геле выделяют из нее фрагмент ДНК длиной 416 пар оснований. Полученный фрагмент ДНК очищают с помощью набора GENECLEANII (BIO 101) в соответствии с прилагаемыми к нему инструкциями и вводят в плазмиду Cλ/pUC, которая была приготовлена путем расщепления плазмиды HindIII и B1nI. Полученная плазмида названа "hMBClLaλ/pUC19". Эту плазмиду расщепляют EcoRI с получением фрагмента ДНК, кодирующего очеловеченную L-цепь. Полученный фрагмент ДНК вводят в плазмиду pCOS1 так, чтобы инициирующий кодон очеловеченной L-цепи располагался внизу от промотора EF1α. Полученная таким образом плазмида названа "hMBC1Laλ/pCOS1". Последовательность ДНК (включая соответствующую аминокислотную последовательность) очеловеченной L-цепи (вариант "а") выражена последовательностью с идентификационным №66. Аминокислотная последовательность варианта "а" выражена последовательностью с идентификационным №47.
Вариант "b" получают путем введения мутагена по методу PCR. Вариант "b" конструируют таким образом, чтобы заменить аминокислоту в 43-положении, то есть глицин (аминокислота №43 в соответствии с определением Кабата), пролином и аминокислоту в 49-положении, то есть лизин (аминокислота №49 в соответствии с определением Кабата), аспарагиновой кислотой. Полимеразную реакцию синтеза цепи осуществляют с использованием плазмиды hMBC1Laλ/pUC19 в качестве матрицы, мутагенной затравки MBV1LGP5R (последовательность с идентификационным №36) и затравки MBC1LVS1. Полученный фрагмент ДНК расщепляют BamHI и HindIII и расщепленный фрагмент субклонируют в сайте BamHI-HindIII плазмиды рUC19. Полученную плазмидную ДНК секвенируют и расщепляют HindIII и AfIII, поеле чего полученный расщепленный фрагмент лигируют с плазмидой hMBC1Laλ/pUC19, которую предварительно расщепляют HindIII и AflII.
Полученная плазмида названа "hMBC1Lbλ/pUC19". Эту плазмидную ДНК расщепляют EcoRI с получением фрагмента ДНК, содержащего ДНК, кодирующую очеловеченную L-цепь. Указанный фрагмент ДНК вводят в плазмиду pCOSi так, чтобы инициирующий кодон очеловеченной L-цепи находился внизу от промотора EF1α. Полученная таким образом плазмида названа "hMBClLbλ/pCOSi".
Вариант "с" получают путем введения мутагена по методу PCR. Вариант "с" конструируют таким образом, чтобы заменить аминокислоту в 84-положении, то есть серии (аминокислота №80 в соответствии с определением Кабата), пролином. Полимеразную реакцию синтеза цепи осуществляют с использованием плазмиды hMBClLaλ/pUC19 в качестве матрицы, мутагенной затравки MBC1LGP6S (последовательность с идентификационным №37) и затравки М13 Primer RV. Полученный фрагмент ДНК расщепляют BamHI и HindIII и субклонируют в плазмиде pUC19, которую предварительно расщепляют BamHI и HindIII. Плазмидную ДНК секвенируют и расщепляют BstPI и Аоr51НI, после чего полученный фрагмент ДНК лигируют с плазмидой hMBClLaλ/pUC19, которую предварительно расщепляют BstPI и Aor51HI. Полученная плазмида названа "hMBC1Lcλ/pUC19". Эту плазмидную ДНК расщепляют EcoRI с получением последовательности, кодирующей очеловеченную L-цепь. Эту последовательность вводят в сайт EcoRI плазмиды pCOS1 так, чтобы инициирующий кодон очеловеченной L-цепи находился в прямом направлении от промотора EF1α. Полученная таким образом плазмида названа "hMBC1Lcλ/pCOS1".
Варианты "d", "e" и "f" также получают путем введения мутагена по методу PCR. Варианты "d", "e" и "f" конструируют с заменой в вариантах "а", "b" и "с" аминокислоты в 91-положении, то есть тирозина (аминокислота №87 в соответствии с определением Кабата), изолейцином. Для получения вариантов "d", "e" и "f" полимеразную реакцию синтеза цепи осуществляют с использованием плазмид hMBC1Laλ/pCOS1 (для варианта "d"), hMBClLbλ/pCOS1 (для варианта "e") и hMBC1Lcλ/pCOS1 (для варианта "f") в качестве матрицы, мутагенной затравки MBC1LGP11R (последовательность с идентификационным №38) и затравки M-S1 (последовательность с идентификационным №44). Полученный фрагмент ДНК расщепляют BamHI и HindIII и субклонируют в pUC19, которую приготавливают путем расщепления pUC19 BamHI и HindIII. После проведения секвенирования, плазмиду расщепляют HindIII и BinI и полученный расщепленный фрагмент лигируют с плазмидой Cλ/pUC19, которую приготавливают путем расщепления плазмиды HindIII и BlnI.
Полученные плазмиды соответственно названы 'hMBC1Ldλ/pUC1", "hMBC1Leλ/pUC19" и "hMBC1Lfλ/pUC19". Все эти плазмиды расщепляют EcoRI с получением фрагмента ДНК, содержащего ДНК, кодирующую очеловеченную L-цепь. Этот фрагмент ДНК вводят в сайт EcoRI плазмиды pCOS1 так, чтобы инициирующий кодон очеловеченной L-цепи находился внизу от протомора EF1α данной плазмиды. Полученные таким образом плазмиды названы "hMBClLdλ/pCOS1", "hMBC1Leλ/pCOS1" и "hMBC1Lfλ/pCOS1".
Варианты "g" и "h" также получают путем введения мутагена по методу PCR. Варианты "g" и "h" конструируют с заменой в вариантах "а" и "d" аминокислоты в 36-положении, то есть гистидина (аминокислота №36 в соответствии с определением Кабата), тирозином. Полимеразную реакцию синтеза цепи осуществляют с использованием мутагенной затравки MBC1LGP9R (последовательность с идентификационным №39), затравки М13 Primer PV с использованием плазмиды hMBC1Laλ/pUC19 в качестве матрицы. Продукт полимеразной реакции синтеза цепи еще раз подвергают полимеразной реакции синтеза цепи с использованием затравки М 13 Primer M4 и плазмиды hMBC1Laλ/pUC19 в качестве матрицы. Полученный фрагмент ДНК расщепляют HindIII и BinI и субклонируют в плазмиде Cλ/pUC19, которую приготавливают путем расщепления плазмиды HindIII и B1nI. Используя эту плазмиду в качестве матрицы, осуществляют полимеразную реакцию синтеза цепи с затравками MBC1LGP13R (последовательность с идентификационным №40) и MBC1LVS1. Полученный продукт PCR расщепляют AlaI и HindIII и вводят в плазмиды hMBC1Laλ/pUC19 и hMBC1Ldλ/pUC19, которые приготавливают путем расщепления обоих плазмид AlaI и HindIII. В полученных плазмидах определяют последовательности ДНК. Плазмиды, в которых было подтверждено наличие правильных последовательностей, названы соответственно "hMBC1Lgλ/pUC19" и "hMBC1Lhλ/pUC19". Эти плазмиды расщепляют EcoRI с получением последовательности, кодирующей очеловеченную L-цепь. Эту последовательность вводят в сайт EcoRI плазмиды pCOS1 так, чтобы инициирующий кодон очеловеченной L-цепи находился внизу от промотора EF1α. Полученные плазмиды названы соответственно "hMBClLgλ/pCOS1" и "hMBC1Lhλ/pCOS1".
Варианты "i", "j", "k", "l", "m", "n" и "о" также получают путем введения мутагена по методу PCR. Полимеразную реакцию синтеза цепи осуществляют с использованием мутагенной затравки MBC1LGP14S (последовательность с идентификационным №41), затравки V1RV (λ) (последовательность с идентификационным №43) и плазмиды hMBC1Laλ/pUC19 в качестве матрицы. Полученный фрагмент ДНК расщепляют ApaI и BlnI и субклонируют в плазмиде hMBC1Lgλ/pUC19, которую приготавливают путем расщепления плазмиды ApaI и BInI. В полученной плазмиде определяют последовательность оснований и выбирают клон с мутацией, соответствующей каждому из указанных вариантов. Полученная таким образом плазмида названа "hMBC1Lxλ/pUC19 (х=i, j, k, l, m, n или о)". Эту плазмиду расщепляют EcoRI с получением последовательности, кодирующей очеловеченную L-цепь. Полученную последовательность вводят в сайт EcoRI плазмиды pCOS1 так, чтобы инициирующий кодон очеловеченной L-цепи находился внизу от промотора EF1α. Полученная плазмида названа "hMBClLxλ/pCOS1" (x=i, j, k, l, m, n или о). Последовательности ДНК (включая соответствующие аминокислотные последовательности) вариантов "j", "l", "m" и "о" выражены соответственно последовательностями с идентификационными №№67, 68, 69 и 70. Аминокислотные последовательности этих вариантов выражены соответственно последовательностями с идентификационными №№48, 49, 50 и 51.
Варианты "р", "q", "r", "s" и "t" являются модифицированными формами вариантов "i", "j", "m", "l" и "о", в которых аминокислота в 87-положении, то есть тирозин, заменена изолейцином. Эти варианты получают, используя сайт рестрикции Аоr51МI области FR3 для замены варианта "h" вариантом "i", "j", "m", "l" или "о" следующим образом. Из экспрессирующей плазмиды hMBC1Lxλ/pCOS1 (x=i, j, m, l или о) удаляют рестрикционный фрагмент Аоr51НI (514 пар оснований), содержащий гипервариабельный участок CDR3, часть области FR3 и всю область FR4. Рестрикционный фрагмент Аоr51НI (514 пар оснований), содержащий гипервариабельный участок CDR3, часть области FR3 и всю область FR4, лигируют с удаленной частью экспрессирующей плазмиды, заменяя аминокислоту в 91-положении, то есть тирозин (аминокислота №87 в соответствии с определением Кабата), изолейцином. В полученных плазмидах определяют последовательность ДНК и выбирают клон вариантов "i", "j", "m", "l" и "о", в котором аминокислота в 91-положении, то есть тирозин (аминокислота №87 в соответствии с определением Кабата), заменена изолейцином. Варианты, соответствующие вариантам "i", "j", "m", "l" и "о", названы соответственно вариантами "р", "q", "s", "r" и "t", и плазмиды для этих вариантов названы "hMBC1Lxλ/pCOS1" (x=р, q, s, r или t). Последовательности ДНК (включая соответствующие аминокислоты) вариантов "q", "r", "s" и "t" выражены соответственно последовательностями с идентификационными №№71, 72, 73 и 74. Аминокислотные последовательности этих вариантов выражены соответственно последовательностями с идентификационными №№52, 53, 54 и 55.
Плазмиду hMBC1Lqλ/pCOS1 расщепляют HindIII и EcoRI и субклонируют в плазмиде pUC19, которую приготавливают путем расщепления плаэмиды HindIII и EcoRI. Полученная таким образом плазмида названа "hMBC1Lqλ/pUC19".
Положение замененных аминокислот в каждом варианте очеловеченной L-цепи показано в таблице 3.
В таблице 3 заглавными буквами обозначены следующие аминокислоты:
Y - тирозин; Р - пролин; К - лизин; V - валин; D - аспарагиновая кислота и I - изолейцин.
Штамм E.coli, содержащий плазмиду hМВС1НкДНК/рUС19, и штамм E.coli, содержащий плазмиду hMBC1Lqλ/pUC19, названы соответственно "Escherichia coli JM109 (hМВС1НкДНК/рUС19" и "Escherichia coli JM109 (hMBC1Lqλ/pUC19)" и включены на основании Будапештского договора от 15 августа 1996 г.в коллекцию Национального института бионауки человеческой технологии, агентство промышленной науки и технологии, Япония (1-3, Higashi 1-chome, Tsukuba-shi, Ibaragi-ken, Япония) под номером FERM ВР-5629 для Escherichia coli JM109 (hМВС1НкДНК/рUС19) и под номером FERM BP-5630 для Escherichia coli JM109 (hMBClLqλ/pUC19.
(5) Трансфекция в клетке COS-7
Вышеуказанные экспрессирующие плазмиды временно экспрессируют в клетках COS-7, чтобы определить антигенсвязывающую и нейтрализующую активность гибридного антитела и очеловеченного антитела №23-57-137-1. Для временной экспрессии L-цепи гибридного антитела нижеследующие комбинации плазмид котрансфецируют клетки COS-7 по методу электропорации с помощью электроимпульсного устройства Gene Pulser (Bio Rad): hМВС1НкДНК/рСOS1 и h/mMBC1L(λ)/neo; hМВС1НкДНК/рСOS1 и m/hMBC1Laλ/neo; hВС1НкДНК/рСOS1 и m/hMBC1Ldλ/neo; hМВС1НкДНК/рСOS1 и hmmMBClL(λ)/neo; и hМВС1НкДНК/рСOS1 и mhmMBCIL(λ)/пео. К 0,8 мл суспензии клеток COS-7 в забуференном фосфатом физиологическом растворе (PBS(-)) с концентрацией 1×107 клеток/мл добавляют по 10 мкг всех плазмидных ДНК. Полученный раствор подвергают воздействию импульсов при электростатической емкости 1500 В и силе тока 25 мкФ.
Раствор выдерживают в течение 10 минут при комнатной температуре, после чего электропорированные клетки суспендируют в модифицированной по способу Дульбекко среде Игла, содержащей 2% фетальную телячью сыворотку с ультранизким содержанием IgG (GIBCO), и культивируют в 10 см чашке в инкубаторе с атмосферой СО2. Клетки культивируют в течение 72 часов, после чего культуральный супернатант собирают и центрифугируют для удаления плеточного дебриса. Полученный продукт используют в качестве образца для твердофазного иммуноферментного анализа (ELISA).
Для временной экспрессии очеловеченного антитела. №23-57-137-1 плазмидную комбинацию hМВС1кДНК/рСOS1 или hMBC1Lxλ/pCOS1 (х=а-t) трансфецируют в клетки COS-7 с помощью электроимульсного устройства Gene Pulse (Bio Rad) аналогично процедуре, описанной выше для гибридного анитела. Культуральный супернатант используют в качестве образца для твердофазного иммуноферментного анализа (ELISA).
Гибридное антитело или очеловеченное антитело очищают от культурального супернатанта клеток COS-7 с помощью набора AffiGal Protein A MAPSII (Bio Rad) в соответствии с прилагаемыми к нему инструкциями.
(6) Твердофазный иммуноферментный анализ (ELISA)
(i) Определение концентрации антител
Планшет для твердофазного иммуноферментного анализа (ELISA), предназначенный для определения концентрации антител, готовят следующим образом. Во все лунки 96-луночного планшета для ELISA (Maxisorp, NUNC) вводят 100 мкл буфера для сенсибилизации поверхностей (0,1 М раствор NaHCO3, 0,02% NaN3), дополненного 1 мкг/мл антитела козы против IgG человека (TAGO), и блокируют 200 мкл буфера для разведения [50 мМ трис-HCl, 1 мМ MgCl2, 0,1 М NaCl, 0,05% твина-20, 0,02% NaN3, 1% бычьего сывороточного альбумина (BSA); рН 7,2]. Во все лунки добавляют культуральный супернатант клеток COS, в которых было экспрессировано гибридное антитело или очеловеченное антитело, полученное в результате последовательного разведения. Содержимое лунок инкубируют при комнатной температуре в течение 1 часа и промывают смесью забуференного фосфатом физиологического раствора и твина-20, после чего в каждую лунку добавляют 100 мкл раствора конъюгированного со щелочной фосфатазой антитела козы против IgG человека (TAGO). Полученную' смесь инкубируют при комнатной температуре в течение 1 часа промывают смесью забуференного фосфатом физиологического раствора и твина-20 и добавляют в каждую лунку 1 мг/мл раствора субстрата ("Sigma104", паранитрофенилфосфорная кислота, SIGMA). У полученного раствора измеряют оптическую плотность при длине волны 405 нм, используя аппарат для прочтения микропланшетов (Bio Rad). В качестве эталона при определении концентрации антител используют очищенный иммуноглобулин IgGlλ человека (сайт связывания).
(ii) Определение антигенсвязывающей способности
Планшет для твердофазного иммуноферментного анализа (ELISA), предназначенный для определения антигеневязывающей способности, готовят следующим образом. Во все лунки 96-луночного планшета для ELISA (Maxisorp, NUNC) вводят 100 мкл буфера для сенсибилизации поверхностей, дополненного 1 мкг/мл PTHrP человека (1-34), и блокируют 200 мкл буфера для разведения. Во все лунки добавляют культуральный супернатант клеток COS-7, в которых было экспрессировано гибридное антитело или очеловеченное антитело, либо растворы очищенного гибридного антитела или очищенного очеловеченного антитела, полученные в результате последовательного разведения. Содержимое лунок инкубируют при комнатной температуре и промывают смесью эабуференного фосфатом физиологического раствора и твина-20, после чего в каждую лунку добавляют 100 мкл раствора конъюгированного со щелочной фосфатазой антитела козы против IgG человека (TAGO). Полученную смесь инкубируют при комнатной температуре, промывают смесью забуференного фосфатом физиологического раствора и твина-20 и добавляют в каждую лунку 1 мг/мл раствора субстрата ("Sigma104", паранитрофенилфосфорная кислота, SIGMA). У полученного раствора измеряют оптическую плотность при длине волны 405 нм, используя аппарат для прочтения микропланшетов (Bio Rad).
(7) Подтверждение активностей
(i) Оценка очеловеченной Н-цепи
Установлено, что антитело, содержащее очеловеченную Н-цепь варианта "а" и химерную L-цепь, характеризуются таким же уровнем PTHrP-связывающей активности, что и химерное антитело. Этот результат позволяет предположить, что в варианте "а" достигнуто удовлетворительное очеловечивание V-области Н-цепи. Поэтому очеловеченная Н-цепь варианта "а" использована в качестве Н-цепи очеловеченного антитела в следующих экспериментах.
(ii) Активность гибридного антитела
(ii-a) Гибридное антитело FR1,2/FR3,4
Когда L-цепь имеет структуру h/mMBC1Ld(λ), антитело не обладает антигенсвязывающей активностью. Однако, когда L-цепь гибридного антитела имеет структуру m/hMBC1Laλ или m/hMBClLdλ, данное антитело характеризуется таким же уровнем антигенсвязывающей активности, что и химерное антитело №23-57-137-1. Эти результаты позволяют предположить, что области FR3 и FR4 пригодны для очеловеченного антитела, а в областях FR1 и FR2 имеется один или несколько аминокислотных остатков, которые необходимо заменить.
(ii-b) Гибридное антитело FR1/FR2
Когда L-цепь гибридного антитела имеет структуру mhmMBC1L(λ), антитело не обладает антигенсвязывающей активностью. Однако, когда L-цепь гибридного антитела имеет структуру hmmMBC1L(λ), данное антитело характеризуется таким же уровнем антигенсвязывающей активности, что и химерное антитело №23-57-137-1. Эти результаты позволяют предположить, что область FR1 пригодна для очеловеченного антитела, а в области FR2 имеется один или несколько аминокислотных остатков, которые необходимо заменить.
(iii) Активность очеловеченного антитела
Определяют антигенсвязывающую активность очеловеченного антитела, в котором в качестве L-цепи использованы все варианты от "а" до "t". Полученные результаты показывают, что очеловеченные антитела, имеющие L-цепь в соответствии с вариантами "j", "l", "m", "о", "q", "r", "s" и "t", характеризуются таким же уровнем PTHrP-связывающей активности, что и химерное антитело.
(8) Создание стабильно продуцируемой линии клеток яичника китайского хомячка
Чтобы создать стабильный трансформант для очеловеченного антитела, вышеуказанные экспрессирующие плазмиды вводят в клетку СНО (DXB11).
Стабильный трансформант очеловеченного антитела создают с использованием нижеследующих комбинаций плазмид в качестве экспрессирующего вектора для клеток СНО, а именно hМВС1НкДНК/рСНO1 и hМВС1Lmλ/рСOS1; hМВС1НкДНК/рСНO1 и hMBC1Lqλ/pCOS1; hМВС1НкДНК/рСНO1 и hMBC1Lrλ/pCOS1. Эти плазмиды котрансфецируют в клетки СНО по методу электропорации с помощью электроимпульсного устройства Gene Pulser (Bio Rad). Все экспрессирующие векторы расщепляют рестрикционным ферментом Pvul с получением линейной ДНК. Указанную ДНК экстрагируют фенолом и хлороформом и осаждают этанолом.
Полученные таким образом ДНК подвергают электропорации. К 0,8 мл суспензии клеток СНО в PBS(-) с концентрацией 1×107 клеток/мл добавляют по десять мкг всех плазмидных ДНК. Полученную смесь подвергают воздействию импульсов при электростатической емкости 1500 В и силе тока 2 мкФ. Электропорированные клетки выдерживают при комнатной температуре в течение 10 минут и суспендируют в среде МЕМ-α (GIBCO), дополненной 10% фетальной телячьей сыворотки (GIBCO), и культивируют на 96-луночных планшетах (Falcon) в инкубаторе с CO2. На следующий день после начала культивирования среду заменяют селективной средой МЕМ-α, дополненной 10% фетальной телячьей сыворотки (GIBCO) и 500 мг/мл GENETICIN (G418Sulfate; GIBCO) без рибонуклеозида или дезоксирибонуклеозида. Из культуральной среды отбирают клетки, в которые введен ген антитела. Селективную среду заменяют свежей средой до культивирования и через две недели культивирования, после чего клетки исследуют под микроскопом. В клетках, характеризующихся удовлетворительным ростом, определяют количество антител, полученных в результате выполнения твердофазного иммуноферментного анализа (ELISA), который обычно используют для измерения концентрации антител в соответствии с описанной выше процедурой. Избирательно собирают клетки, продуцирующие наибольшее количество антител.
Повышение уровня культуры стабильного трансформанта для полученных антител производят во вращающемся флаконе с использованием минимальной поддерживающей среды МЕМ-α, дополненной 2% фетальной телячьей сыворотки с ультранизким содержанием IgG без рибонуклеозида или дезоксирибонуклеозида. На 3-й и 4-й день культивирования культуральный супернатант собирают и фильтруют через фильтр с размером пор 0,2 мкм (Millipore) для удаления клеточного дебриса. Затем очеловеченные антитела очищают от культурального супернатанта клеток СНО в колонке POROS, заполненной белком А (PerSeptive Biosystems), на ConSep LC100 (Millipore) в соответствии с прилагаемыми инструкциями. Очищенные очеловеченные антитела используют в качестве образцов для определения нейтрализующей активности и для исследования фармакологической эффективности на животных моделях гиперкальциемии. Концентрацию и антигенсвязывающую активность очищенных очеловеченных антител определяют с помощью аналогичной системы для твердофазного иммуноферментного анализа ELISA.
Пример 4
Определение нейтрализующей активности
Нейтрализующую активность антитела мыши, химерного антитела и очеловеченного антитела определяют с использованием линии миеломных клеток крыс ROS17/2,8-5. Клетки ROS17/2,8-5 культивируют в среде F-12 Хэма (GIBCO), дополненной 10% фетальной телячьей сывороткой (GIBCO), в инкубаторе с CO2. Клетки ROS 17/2,8-5 инокулируют во все лунки 96-луночного планшета с концентрацией 104 клеток/100 мкл/лунку и культивируют в течение 1 дня. Культуральную среду заменяют средой F-12 Хэма (GIBCO), дополненной 4 мМ гидрокортизона и 10% фетальной телячьей сыворотки. Клетки культивируют в течение трех-четырех дней, промывают 260 мкл среды F-12 Хэма (GIBCO) и добавляют 80 мкл среды F-12 Хэма, дополненной 1 мМ изобутил-1-метилксантина (IBMX, SIGMA), 10% фетальной телячьей сыворотки и 10 мМ HEPES. Полученную смесь инкубируют при температуре 37°С в течение 30 минут.
Антитело мыши, химерное антитело и очеловеченное антитело, предназначенные для испытания нейтрализующей активности, предварительно поэтапно разводят следующим образом: [10 мкг/мл, 3,3 мкг/мл, 1,1 мкг/мл и 0,37 мкг/мл], [10 мкг/мл, 2 мкг/мл, 0,5 мкг/мл и 0,01 мкг/мл] и [10 мкг/мл, 5 мкг/мл, 1,25 мкг/мл, 0,63 мкг/мл и 0,31 мкг/мл]. Каждый раствор образца разведенного антитела смешивают с эквивалентным количеством 4 нг/мл PTHrP (1-34). В каждую лунку вводят 80 мкл раствора полученной смеси. Конечная концентрация каждого антитела равна четвертой части исходной концентрации вышеуказанного антитела, поэтому концентрация PTHrP (1-34) составляет 1 нг/мл. Культуру выдерживают в течение десяти минут при комнатной температуре, после чего культуральный супернатант удаляют и остаток трижды промывают физиологическим раствором с фосфатным буфером. Из полученного продукта экстрагируют циклический аденозинмонофосфат (сАМР) в клетках, используя 10 мкл смеси 0,3% HCl и 95% этанола, и упаривают с помощью впрыскивающего аспиратора для удаления HCl этанола. Остаток растворяют в 120 мкл буфера для иммуноферментного анализа (EIA), прилагаемого к набору для анализа сАМР методом EIA (CAYMAN CHEMICAL'S). Уровень сАМР определяют с помощью набора (CAYMAN CHEMICAL'S) в соответствии с прилагаемыми к нему инструкциями. Полученные результаты показывают, что очеловеченные антитела, содержащие разные варианты L-цепи, характеризуются таким же уровнем антигенсвязывающей активности, что и химерное антитело, при этом очеловеченные антитела с L-цепью вариантов "q", "r", "s" и "t", в которых тирозин в 91-положении заменен изолейцином, обладают нейтрализующей активностью, которая ближе всего соответствует аналогичной активности химерного антитела, особенно те, которые имеют L-цепь варианта "q", обладают наиболее сильной нейтрализующей активностью.
Пример 5
Исследование фармакологического действия на животной модели гиперкалыциемии (1)
Терапевтическое действие химерного очеловеченного антитела против PTHrP, имеющих L-цепь вариантов "m", "r" и "q", исследовали на животной модели гиперкальциемии (опухоль человека, трансплантированная "голым" мышам).
В качестве животной модели гиперкальциемии использовали "голых" мышей, которым трансплантировали злокачественную опухоль поджелудочной железы человека PAN-7 [мыши были приобретены в Центральном институте экспериментальных животных]. Известно, что у "голых" мышей, которым трансплантирована злокачественная опухоль поджелудочной железы человека PAN-7, повышается концентрация кальция в крови по мере увеличения объема опухоли и развивается гиперкальциемия, вызывающая уменьшение массы тела и сокращение двигательной активности. В соответствии с этим примером терапевтическое действие химерного антитела и очеловеченного антитела по настоящему изобретению на гиперкальциемию, обусловленную злокачественной опухолью поджелудочной железы человека PAN-7, исследовали путем измерения массы тела и концентрации кальция в крови испытуемого животного.
Злокачественную опухоль поджелудочной железы человека PAN-7 прививали "голым" мышам BALB/c-nu/nu (Nippon Charles River) in vivo. Для оценки фармакологического действия антител по настоящему изобретению были приобретены самцы "голых" мышей BALB/c-nu-nu (Nippon Charles River) в возрасте 5 недель, которых акклиматизировали в течение 1 недели и использовали для выполнения указанного эксперимента в 6-недельном возрасте. Испытуемых мышей с симптомами гиперкальциемии готовили и распределяли по группам следующим образом. Пассированную злокачественную опухоль поджелудочной железы человека PAN-7 иссекали и вырезали из нее 3 мм кубик срезов. Каждой мыши трансплантировали подкожно по одному срезу опухоли. Через две или три недели после трансплантации, когда раковая опухоль у мышей достигала достаточно большого объема, мышей распределяли по группам с учетом среднего объема опухоли, концентрации кальция в крови и массы тела, после чего их использовали в качестве животных моделей гиперкальциемии.
Терапевтическое действие на гиперкальциемию исследовали следующим образом. Однократную дозу химерного или очеловеченного антител против PTHrP, имеющих L-цепь варианта "m" или "r", вводили в хвостовую вену испытуемым мышам в количестве 10 или 30 мкг/мышь. Однократную дозу очеловеченного антитела, имеющего L-цепь варианта "q", вводили в хвостовую вену испытуемым мышам с симптомами гиперакальциемии, в количестве 20 или 60 мкг/мышь. Для оценки фармакологического действия антител у всех мышей измеряли концентрацию кальция в крови и массу тела на 1-й, 4-й, 7-й и 11-й день после введения. Объем опухоли определяли путем измерения наибольшего диаметра (а мм) и наименьшего диаметр (b мм) опухоли и выполнения вычислений с использованием обоих полученных значений по уравнению Галанта [ab2/2]. Концентрацию кальция в крови определяли на основании концентрации ионизированного кальция в цельной крови, которую брали у всех мышей через глазницу с помощью гематокритной трубки и анализировали в автоматическом анализаторе 643Ca++/pH (CIBA-CORNING).
Было установлено, что введение химерного антитела и очеловеченных антител, имеющих L-цепь вариантов "m", "r" и "q", вызывает быстрое улучшение по отношению к изменению массы тела и концентрации кальция в крови и улучшение сохраняется в течение длительного периода времени. Полученные результаты показывают, что химерное антитело и очеловеченные антитела по настоящему изобретению являются полезными для лечения гиперкальциемии, обусловленной злокачественной опухолью.
Пример 6
Исследование фармакологического действия на животной модели гиперкалыциемии (2)
Терапевтическое действие химерного очеловеченного антитела против PTHrP, имеющего L-цепь варианта "q", исследовали на животной модели гиперкальциемии (опухоль человека, трансплантированная "голым" мышам).
Терапевтическое действие на гиперкальциемию исследовали следующим образом. Однократную дозу химерного или очеловеченного антитела против PTHrP, имеющего L-цепь варианта "q", вводили в хвостовую вену испытуемым мышам с симптомами гиперкальциемии в количестве 10 или 30 мкг/мышь. Для оценки фармакологического действия антител у всех мышей измеряли концентрацию кальция в крови и массу тела на 1-й, 3-й, 7-й и 11-й день после введения. Концентрацию кальция в крови определяли на основании концентрации ионизированного кальция в цельной крови, которую брали у всех мышей через глазницу с помощью гематокритной трубки и анализировали в автоматическом анализаторе 643Ca++/pH (CIBA-CORNING).
Было установлено, что введение химерного и очеловеченного антитела, имеющего L-цепь варианта "q", вызывает быстрое улучшение по отношению к изменению массы тела и концентрации кальция в крови, улучшение сохраняется в течение длительного периода времени. Полученные результаты показывают, что химерное антитело и очеловеченное антитело по настоящему изобретению являются полезными средствами для лечения гиперкальциемии, обусловленной злокачественной опухолью.
Пример 7
Исследование фармакологического действия животной модели гиперкальциемии (3)
Терапевтическое действие химерного и очеловеченного антитела против PTHrP, имеющего L-цепь варианта "q", исследовали на животной модели гиперкальциемии (злокачественная опухоль легкого человека LC-6, трансплантированная "голым" мышам).
В качестве животной модели гиперкальциемии использовали "голых" мышей, которым трансплантировали злокачественную опухоль легкого человека LC-6 [мыши были приобретены в Центральном институте экспериментальных животных]. Известно, что у "голых" мышей, которым трансплантирована злокачественная опухоль легкого человека LC-6, повышается концентрация кальция в крови по мере увеличения объема опухоли и развивается гиперкальциемия, вызывающая уменьшение массы тела и сокращение двигательной активности.
В соответствии с этим примером терапевтическое действие химерного антитела и очеловеченного антитела по настоящему изобретению на гиперкальциемию, обусловленную злокачественной опухолью легкого человека LC-6, исследовали путем измерения массы тела и концентрации кальция в крови испытуемых животных.
Злокачественную опухоль легкого человека LC-6 прививали "голым" мышам BALB/c-nu/nu (Nippon Charles River) in vivo. Для оценки фармакологического действия антител по настоящему изобретению были приобретены самцы "голых" мышей BALB/c-nu-nu (Nippon Charles River) в возрасте 5 недель, которых акклиматизировали в течение 1 недели и использовали для выполнения указанного эксперимента в 6-недельном возрасте.
Испытуемых мышей с симптомами гиперкальциемии готовили и распределяли по группам следующим образом. Пассированную злокачественную опухоль легкого человека LC-6 иссекали и вырезали из нее 3 мм кубик срезов. Каждой мыши трансплантировали подкожно по одному срезу опухоли. Через две или три недели после трансплантации, когда раковая опухоль у мышей достигала достаточно большого объема, мышей распределяли по группам с учетом среднего объема опухоли, концентрации кальция в крови и массы тела, после чего их использовали в качестве животных моделей гиперкальциемии.
Терапевтическое действие на гиперкальциемию исследовали следующим образом. Однократную дозу химерного или очеловеченного антитела против PTHrP, имеющего L-цепь варианта "q", вводили в хвостовую вену испытуемым мышам с симптомами гиперкальциемии в количестве 10 или 30 мкг/мышь. Для оценки фармакологического действия антител у всех мышей измеряли концентрацию кальция в крови и массу тела на 1-й, 3-й, 6-й и 10-й день после введения. Концентрацию кальция в крови определяли на основании концентрации ионизированного кальция в цельной крови, которую брали у всех мышей через глазницу с помощью гематокритной трубки и анализировали в автоматическом анализаторе 643Ca++/pH (CIBA-CORNING).
Было установлено, что введение химерного антитела и очеловеченного антитела, имеющего L-цепь варианта "q", вызывает быстрое улучшение по отношению к изменению массы тела и концентрации кальция в крови у испытуемых мышей, имеющих злокачественную опухоль легкого человека LC-6, и улучшение сохраняется в течение длительного периода времени. Полученные результаты показывают, что химерное антитело и очеловеченное антитело по настоящему изобретению являются полезными средствами для лечения гиперкальциемии, обусловленной злокачественной опухолью.
Пример 8
Кинетический анализ взаимодействия между PTHrP и антителом против PTHrP с использованием BIACORE
В этом эксперименте выполняли кинетический анализ взаимодействия антиген-антитело с использованием BIACORE. В качестве антитела использовали PTHrP (1-34+Cys), который адсорбировали на конце сенсора, особенно на С-конце. В качестве аналита использовали очищенные антитела с разными концентрациями. На основании полученной сенсорграммы высчитывали кинетические параметры (константа скорости связывания "kass" и константа скорости диссоциации "kdiss"). Кинетический анализ выполняли по методике, описанной в статье "Kinetic analysis of monoclonal antibody-antigen interactions with a new biosensor based analytical system", Karlsson, R. et al., (1991), J.Immunol. Methods 145, p.229-240.
(1) Иммобилизация PTHrP (1-34+С) на конце сенсора
PTHrP (1-34+С) адсорбировали на конце сенсора СМ5 (Pharmacia). В качестве испытательного буфера использовали HBS (10 мМ HEPES, рН 7,4, 0,15 М NaCl, 3,4 мМ EDTA, 0,005% сурфантанта Р20) со скоростью потока 5 мкл/мин. Карбоксильные группы карбоксиметилдекстрана на конце сенсора СМ5 активировали путем введения 100 мкл 0,05 М гидроксисукцинимида (NHS)/0,2M гидроксихлорида N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) и 100 мкл 80 мМ 2-(2-пиридинилдитио)-этанамина (PDEA)/0,1 М боратного буфера (рН 8,5) и дополнительного введения 10 мкл 5 мкг/мл PTHrP (1-34+С)/10 мМ натрий-ацетатного буфера (рН 5,0), в результате чего на С-концах PTHrP (1-34+С) происходила адсорбция, особенно Cys-остатков. Затем вводили 100 мкл 50 мМ (L)-цистеина/1M NaCl/0,1 М натрий-формиатного буфера (рН 4,3), чтобы блокировать чрезмерно активированные группы. Вслед за этим вводили 10 мкл 0,1 М глицин-HCl буфера (рН 2,5) и 10 мкл 10 мМ HCl для промывки веществ с нековалентным связыванием.
Количество иммунизированного PTHrP (1-34+C) составило 226,4 резонансной единицы (RU).
(2) Взаимодействие между иммунизированным PTHrP (1-34+C) и очищенным антителом мыши против PTHrP
В качестве буфера для перегонки использовали HBS со скоростью потока 20 мкл/мин. Антителообразующие гибридомы инъецировали в брюшную полость мышам Balb/c. Через несколько недель собирали асцит и вводили его в колонку, заполненную белком А, для очистки антител. Очищенное антитело № 23-57-137-1 было названо "МВС" и очищенное антитело 3F5 было названо "3F5". Эти антитела разбавляли HBS с получением нескольких растворов с концентрациями 1,25, 2,5, 5, 10 и 20 мкг/мл.
При выполнении этого анализа в течение 2 минут вводили 40 мкл раствора антитела для достижения фазы связывания, затем в течение 2 минут вводили НВ5 для достижения фазы диссоциации. После окончания диссоциации вводили 10 мкл 10 мм HCl для восстановления конца сенсора. Анализ выполняли в соответствии с процедурой связывания - диссоциации - восстановления в виде одного цикла и введения разных растворов антител с целью получения сенсорграммы.
(3) Взаимодействие между иммобилизированным PTHrP (1-34+С) и очищенным очеловеченным антителом против PTHrP
В качестве буфера для перегонки использовали HBS со скоростью потока 20 мкл/мин. Антитело получали из клеток яичника китайского хомячка и очищали в колонке, заполненной белком А. Очищенное химерное антитело было названо "chMBC" и очищенные очеловеченные антитела вариантов m и q были названы "hMBCm" и "hMBCq". Эти антитела разбавляли HBS с получением нескольких растворов с концентрациями 1,25, 2,5, 5, 10 и 20 мкг/мл.
При выполнении этого анализа в течение 2 минут вводили 40 мкл раствора антитела для достижений фазы связывания, затем в течение 2 минут вводили HBS для достижения фазы диссоциации. После окончания диссоциации вводили 10 мкл 10 мМ HCl для восстановления конца сенсора. Анализ выполняли в соответствии с процедурой связывания - диссоциации - восстановления в виде одного цикла и введения разных растворов антител с целью получения сенсорграммы.
(4) Кинетический анализ взаимодействия
Считывали файл с интересующими данными и сравнивали реакционные модели путем наложения друг на друга представляющих интерес областей реакции. Затем выполняли кинетический анализ взаимодействия с использованием программы анализа, специально предназначенной для сенсора BIACORE "BIAevaluation 2/1" (Pharmacia), которая позволяет высчитывать кинетические параметры (константу скорости связывания "kass" и константу скорости диссоциации "kdiss") путем обработки полученных графиков (таблицы 4 и 5).
В этом эксперименте для определения константы скорости связывания использовали модель анализа типа 4 (BIAevaluation 2/1 Software Handbook, A1-A5).
Пример 9
Подавление экскреции фосфора в модели гиперкальциемии, обусловленной злокачественной опухолью
Гиперкальциемия, обусловленная злокачественной опухолью (ННМ), является болезнью, вызываемой PTHrP, известно, что PTHrP ускоряет резорбцию костной ткани и резорбцию кальция в почках и почечных канальцах, что ведет к развитию гиперкальциемии. С другой стороны, если рассматривать фосфор, то PTHrP подавляет резорбцию фосфора в почках и почечных канальцах, что ведет к выведению фосфора, поэтому у субъектов, страдающих гиперкальциемией, часто наблюдается гипофосфатемия. Влияние очеловеченного антитела против PTHrP на экскрецию фосфора в почках исследовали на крысах, которые служили животной моделью гиперкальциемии, обусловленной злокачественной опухолью.
В качестве животной модели использовали "голых" крыс, которым трансплантировали злокачественную опухоль легкого человека LC-6 (крысы были приобретены в Центральном институте экспериментальных животных). Известно, что у "голых" крыс, которым подкожно трансплантирована злокачественная опухоль легкого человека LC-6, повышается концентрация кальция в крови по мере увеличения объема опухоли и развивается гиперкальциемия, вызывающая уменьшение массы тела и сокращение двигательной активности. Используя эту животную модель, исследовали воздействие очеловеченного антитела против PTHrP по настоящему изобретению на экскрецию фосфата в почках по методу почечного клиренса на основании описанной ниже фракциональной экскреции фосфата.
Злокачественную опухоль легкого человека LC-6 прививали "голым" крысам BALB/c-nu/nu (Nippon Kurea) in vivo. Для оценки фармакологического действия антител по настоящему изобретению были приобретены самцы "голых" крыс F344N/Jcl-rnu (Nippon Kurea) в возрасте 5 недель, которых акклиматизировали в течение 1 недели и использовали для выполнения указанного эксперимента в 6-недельном возрасте.
Испытуемых крыс с симптомами гиперкальциемии, обусловленной злокачественной опухолью, готовили следующим образом. Пассированную злокачественную опухоль легкого человека LC-6 иссекали и вырезали из нее 3 мм кубик срезов. Крысам подкожно трансплантировали по одному срезу опухоли. Через тридцать дней после трансплантации, когда раковая опухоль у крыс достигала достаточно большого объема (3000 мм3), крыс распределяли по группам с учетом концентрации кальция в крови и массы тела, после чего их использовали в качестве животных моделей гиперкальциемии.
Экскрецию фосфата по методу почечного клиренса исследовали следующим образом.
(1) Метод почечного клиренса
Испытуемого животного с симптомами гиперкальциемии, обусловленной злокачественной опухолью, анестезировали пентобарбиталом (Nembutal, Dainippon Pharmaceutical Co., Ltd.), неподвижно фиксировали на спине на инкубационном мате при температуре 37°С и вводили в мочевой пузырь канюлю (полиэтиленовая трубка, РЕ50, Nippon Beckton Dickenson) для сбора мочи. Затем этому животному вводили канюлю (полиэтиленовая трубка, РЕ50, Nippon Beckton Dickinson) в бедренную вену и через эту канюлю с помощью инфузионного насоса вводили раствор для вливания (0,7% инулина, 5% маннита, 0,2% пентобарбитала и 0,9% хлорида натрия) со скоростью потока 2 мл/час. После достижения физиологического баланса, то есть спустя 50 минут, через канюлю в течение 5 минут через 20-минутные интервалы собирали мочу (начиная с периода 1 и кончая периодом 5), в результате чего были получены пробы мочи. В середине процедуры по сбору мочи у подопытного животного брали примерно 0,25 мл крови из правой шейной вены с помощью обработанного гепарином шприца для инъекций.
(2) Введение антитела
Во время описанного выше клиренс-теста в момент начала сбора мочи периода 2, животному внутривенно вводили очеловеченное антитело против PTHrP в количестве 1 мг/мл/кг.
(3) Определение концентрации инулина и фосфора в моче и крови
Измеряли объем проб мочи, полученных с периода 1 по период 5, и определяли содержание в них инулина и фосфора. Полученные выше пробы крови центрифугировали в условиях охлаждения с получением образца плазмы, который использовали для определения концентрации инулина и фосфора. Содержание инулина определяли по антронсульфатному методу (Roe, L. et al., J. Biol. Chem. 178, 839-845, 1949) и содержание фосфора определяли при помощи автоматического анализатора модели 7170 фирмы Hitachi с использованием реагента для определения неорганического фосфора, Autosera IP (Daiichi Pure Chemicals) в соответствии с прилагаемым руководством (метод Physke-Sabaroh).
(4) Вычисление клиренса инулина, клиренса фосфора и фракциональной экскреции фосфора
Клиренс инулина (Cin), клиренс фосфора (Ср) и фракциональную экскрецию фосфора (FEp) высчитывали по следующим уравнениям.
Вычисление клиренса инулина (Cin):
Cin=Uin V/Pin,
где Cin означает клиренс инулина (мл/кг/мин); Uin означает концентрацию инулина в моче (мг/мл); V означает количество мочи в единицу времени (мл/кг/мин) и Pin означает концентрацию инулина в крови (мг/мл).
Вычисление клиренса фосфора (Ср):
Ср=Up V/Pp,
где Ср означает клиренс фосфора (мл/кг/мин); Up означает концентрацию фосфора в моче (мг/мл); V означает количество мочи в единицу времени (мл/кг/мин) и Рр означает концентрацию фосфора в крови (мг/мл).
Вычисление фракциональной экскреции фосфора (FEp):
FEp=Cp/Cin,
где FEp означает фракциональную экскрецию фосфора; Cin означает клиренс инулина и Ср означает клиренс фосфора. Для этого исследования использовали четырех животных. Результаты определяли в виде среднего значения ± стандартная ошибка.
Очеловеченное антитело против PTHrP (1 мг/кг) вводили (внутривенно) в начале периода 2.
Результаты показывают, что фракциональная экскреция фосфора после введения антитела (то есть с периода 2 по период 5) существенно ниже по сравнению с показателем, полученным до введения антитела (то есть период 1). Другими словами, установлено, что введение нейтрализующего антитела субъекту, страдающему гипофосфатемией вследствие повышенной экскреции фосфора (FEp>0,2), восстанавливает резорбцию фосфора у субъекта почти до нормального уровня (фракциональная резорбция фосфата=1-FEp>0,8%), при этом наблюдается тенденции нормализации концентрации фосфора в крови обследуемого субъекта. Эти результаты свидетельствуют об эффективности антител по настоящему изобретению в качестве средств для лечения повышенной экскреции фосфора и гипофосфатемии, вызываемой наличием PTHrP.
Поскольку PTHrP является субстратом, вызывающим гиперкальциемию, обусловленную злокачественной опухолью, с высокой степенью вероятности можно прогнозировать увеличение экскреции фосфора и сокращение высокоэнергетического органического фосфора в тканях под воздействием PTHrP. Считается, что многие болезни, обусловленные гипофосфатемией, такие как гипофосфатемический рахит и гипофосфатемический рахит, устойчивый к витамину D, возникают вследствие увеличения экскреции фосфора в моче, поэтому антитела по настоящему изобретению должны быть также полезны для лечения указанных болезней.
Пример 10
Положительная динамика различных клинических симптомов гиперкальциемии, обусловленной злокачественной опухолью
Известно, что гиперкальциемия, обусловленная злокачественной опухолью, возникает под воздействией PTHrP, вырабатываемого опухолью, и что PTHrP ускоряет резорбцию костной ткани и резорбцию кальция в почках и почечных канальцах, что ведет к гиперкальциемии. Кроме того, у субъекта, страдающего гиперкальциемией, наблюдается ухудшение клинических симптомов, а именно плохое физическое состояние, потеря сознания, постоянное недомогание, гидродипсия, тошнота и рвота (анорексия). Воздействие антитела против PTHrP на такие клинические симптомы исследовали с помощью системы трансплантации злокачественной опухоли человека "голым" мышам и "голым" крысам, испольуемым в качестве животных моделей гиперкальциемии.
В качестве животной модели гиперкальциемии использовали "голых" мышей и "голых" крыс (мыши и крысы были приобретены в Центральном институте экспериментальных животных), которым трансплантировали злокачественную опухоль легкого человека LC-6. Известно, что у "голых" мышей и "голых" крыс, которым трансплантирована злокачественная опухоль легкого человека LC-6, повышается концентрация кальция в крови по мере увеличения объема опухоли и развивается гиперкальциемия, вызывающая понижение температуры тела и уменьшение массы тела.
Положительное воздействие антитела мыши против PTHrP на общие клинические симптомы гиперкальциемии, обусловленной злокачественной опухолью, исследовали с использованием системы трансплантации "голым" мышам злокачественной опухоли легкого человека LC-6. Полученные результаты представлены на фотографиях. Воздействие указанного антитела на улучшение по отношению к сниженной двигательной активности, температуры тела и анорексии исследовали с использованием системы трансплантации "голым" мышам злокачественной опухоли легкого человека LC-6.
1. Положительная динамика выраженных клинических симптомов, обусловленных гиперкальциемией
Злокачественную опухоль легкого человека LC-6 прививали "голым" мышам BALB/c-nu/nu (Nippon Kurea) in vivo. Для оценки фармакологического действия антител были приобретены самцы "голых" мышей BALB/c-nu-nu (Nippon Kurea) в возрасте 5 недель, которых акклиматизировали в течение 1 недели и использовали для выполнения указанного эксперимента в 6-недельном возрасте.
Испытуемых мышей с симптомами гиперкальциемии готовили и распределяли по группам следующим образом. Пассированную злокачественную опухоль легкого человека LC-6 иссекали и вырезали из нее 3 мм кубик срезов. Каждой мыши трансплантировали подкожно по одному срезу опухоли. Через двадцать семь дней после трансплантации, когда раковая опухоль у мышей достигала достаточно большого объема, мышей распределяли по группам с учетом среднего объема опухоли, концентрации кальция в крови и массы тела, после чего их использовали в качестве животных моделей гиперкальциемии.
Объем опухоли определяли путем измерения наибольшего диаметра (а мм) и наименьшего диаметр (b мм) опухоли и выполнения вычислений по уравнению Галанта [ab2/2].
Концентрацию кальция в крови определяли на основании концентрации ионизированного кальция в цельной крови, которую брали у всех мышей через глазницу с помощью гематокритной трубки и анализировали в автоматическом анализаторе 643 Са++/рН (CIBA-CORNING).
Терапевтическое действие данного антитела на гиперкальциемию исследовали следующим образом. Антитело мыши против PTHrP вводили в количестве 100 мкг/мышь в хвостовую вену всем испытуемым животным с симптомами гиперкальциемии на 27-й, 30-й, 34-й и 37-й день после трансплантации злокачественной опухоли. Контрольным животным вместо антитела аналогичным образом вводили забуференный фосфатом физиологический раствор. На 41-й день после трансплантации опухоли, из каждой группы животных, которым вводили указанное антитело, и из контрольной группы выбирали по одной типичной мыши и фотографировали их рядом с нормальной мышью.
В результате была получена модель с трансплантированной злокачественной опухолью легкого человека LC-6, хотя масса опухоли у мышей, которым вводили антитело, соответствовала массе контрольных мышей, лишь мыши, которым вводили антитело, выглядели так же, как нормальные мыши. Полученные результаты позволяют предположить, что введение антитела против PTHrP вызывает положительную динамику выраженных клинических симптомов.
2. Восстановление двигательной активности, пониженной вследствие гиперкальциемии
Злокачественную опухоль легкого человека LC-6 прививали "голым" мышам BALB/c-nu/nu (Nippon Kurea) in vivo. Для оценки фармакологического действия антител по настоящему изобретению были приобретены самцы "голых" крыс F344/N Jclrun (Nippon Kurea) в возрасте 5 недель, которых акклиматизировали в течение 1 недели и использовали для выполнения указанного эксперимента в 6-недельном возрасте.
Испытуемых животных с симптомами гиперкальциемии готовили следующим образом. Пассированную злокачественную опухоль легкого человека LC-6 иссекали и вырезали из нее 3 мм кубик срезов. Каждой мыши трансплантировали подкожно по одному срезу опухоли. Через тридцать дней после трансплантации, когда раковая опухоль у мышей достигала достаточно большого объема, мышей распределяли по группам с учетом среднего объема опухоли, концентрации кальция в крови и массы тела, после чего их использовали в качестве животных моделей гиперкальциемии.
Концентрацию кальция в крови определяли на основании концентрации ионизированного кальция в цельной крови, которую брали у всех мышей через глазницу с помощью гематокритной трубки и анализировали в автоматическом анализаторе 643Ca++/pH (CIBA-CORNING).
(1) Метод определения двигательной активности
Двигательную активность определяли с помощью измерителя активности ANIMEX типа SE (FARAD, Electronics, Швеция), который помещали в определенном положении в полиэтиленовую клетку с испытуемым животным, получавшим воду и пищу. Это устройство предназначено для измерения подвижности крысы. С помощью этого устройства подвижность регистрируется в виде количества движений, совершаемых за определенный период времени. Измерение производили в течение 13 часов (с 19.00 часов вечера одного дня до 8.00 часов утра следующего дня). Результаты приведены в виде количества движений за один час.
(2) Введение антитела
Очеловеченное антитело против PTHrP вводили в количестве 5 мг/0,5 мл/кг в хвостовую вену всем вышеуказанным крысам, страдающим гиперкальциемией. Контрольной группе крыс аналогичным образом вводили физиологический раствор. Измерение производили поочередно у испытуемых крыс, которым вводили антитело, и у контрольных крыс.
Крыс, которым вводили антитело, обследовали на 0-й день (то есть день, предшествующий введению), 2-й, 4-й, 7-й и 14-й день и контрольных крыс обследовали на 1-й, 3-й, 5-й, 8-й и 15-й день.
Полученные результаты показывают, что у контрольных крыс не наблюдалось изменения или снижения двигательной активности во время испытательного периода, в то время как у крыс, которым вводили антитело, двигательная активность повысилась на 4-й день введения антитела и в последующие дни.
3. Повышение температуры тела, пониженной вследствие гиперкальциемии
Испытуемым животным прививали злокачественную опухоль легкого человека LC-6, вызывали у них гиперкальциемию, обусловленную злокачественной опухолью, и готовили к эксперименту в соответствии с процедурой, описанной на стадии 2.
(1) Метод измерения температуры тела
Температуру тела испытуемых животных измеряли с помощью цифрового термометра. Для этого животных анестезировали пентобарбиталом (Nembutal, Dainippon Pharmaceutical Co., Ltd.) и вводили в прямую кишку датчик температуры.
(2) Введение антитела
Очеловеченное антитело против PTHrP вводили в количестве 1 мг/мл/кг в хвостовую вену всем испытуемым крысам, страдающим гиперкальциемией. Контрольной крысе аналогичным образом вводили физиологический раствор. Кроме того, температуру тела измеряли также у нормальной крысы, которой не вводили указанное антитело. Температуру тела у всех крыс, которым вводили антитело, у контрольной крысы и нормальной крысы измеряли на 0-й день (то есть день, предшествующий введению), 1-й, 2-й и 3-й день после введения.
В результате этого эксперимента у нормальной крысы не было обнаружено изменения температуры тела (34,2-34,4°С) на протяжении всего периода испытания, в то время как у крыс, страдающих гиперкальциемией, обусловленной злокачественной опухолью, наблюдалось снижение температуры тела примерно на 2°С по сравнению с нормальными крысами. Через три дня после начала введения испытуемым крысам очеловеченного антитела против PTHrP температура тела у них повышалась до уровня, характерного для нормальных крыс. Эти результаты позволяют предположить, что очеловеченное антитело против PTHrP по настоящему изобретению эффективно для повышения сниженной температуры тела у животных, страдающих гиперкальциемией, обусловленной злокачественной опухолью.
4. Улучшение аппетита у испытуемых животных, сниженного вследствие гиперкальциемии
Испытуемым животным прививали злокачественную опухоль легкого человека LC-6, вызывали у них гиперкальциемию и готовили к эксперименту в соответствии с процедурой, описанной в разделе 2. Крыс распределяли по группам с учетом средней концентрации кальция в крови и массы тела, после чего их использовали в описываемых ниже экспериментах.
(1) Измерение количества потребляемой пищи
Во время испытания каждую крысу помещали в отдельную метаболическую клетку, где она получала воду и пищу. Количество корма, съеденного каждой крысой, определяли в виде количества (г), съеденного за 24 часа (с 9.00 часов утра одного дня до 9.00 часов утра следующего дня). Для этого измеряли общую массу кормушки с кормом в 9.00 часов утра одного дня (то есть вместе с массой тары) и в 9.00 часов утра следующего дня, после чего высчитывали разность между ними.
(2) Введение антитела
Очеловеченное антитело против PTHrP вводили в количестве 5 мг/0,5 мл/кг в хвостовую вену всем испытуемым крысам, страдающим гиперкальциемией (крысы ННМ). Контрольной группе крыс аналогичным образом вводили физиологический раствор. Кроме того, физиологический раствор вводили в хвостовую вену нормальным крысам. Количество корма, съеденного крысами, которым вводили антитело, контрольными крысами и нормальными крысами, определяли на 0-й день (то есть день, предшествующий введению антитела), 1-й день (то есть в период со дня введения до следующего дня), 3-й день (то есть в период через три дня после введения до следующего дня) и 5-й день (то есть в период через пять дней после введения до следующего дня).
В результате этого эксперимента было установлено, что до введения антитела количество корма, съеденного крысами с симптомами гиперкальциемии (5-9 крыс), составляло в среднем 8,11 г, в то время как нормальные крысы съедали в среднем 12,06 г, что свидетельствует о явном сокращении количества потребляемого корма испытуемыми крысами, страдающими гиперкальциемией. Когда испытуемым крысам вводили очеловеченное антитело против PTHrP, то в день введения антитела и в последующие дни у них повышалось потребление корма до уровня, характерного для нормальных крыс, в то время как у контрольных крыс практически не наблюдалось изменения в потреблении количества корма. Эти результаты позволяют предположить, что очеловеченное антитело против PTHrP по настоящему изобретению эффективно для улучшения сниженного аппетита у животных с симптомами гиперкальциемии, обусловленной злокачественной опухолью (таблица 6).
Приведенные выше результаты показывают, что химерные антитела и очеловеченные антитела по настоящему изобретению являются полезными средствами воздействия на положительную динамику различных клинических симптомов гиперкальциемии, обусловленной злокачественной опухолью.
5. Улучшение показателя рН крови, сниженного вследствие гиперкальциемии
Испытуемым животным прививали злокачественную опухоль легкого человека LC-6, вызывали у них гиперкальциемию, обусловленную злокачественной опухолью, и готовили к эксперименту в соответствии с процедурой, описанной на стадии 2. Крыс распределяли по группам с учетом средней концентрации кальция в крови и массы тела.
(1) Определение показателя рН крови
У всех испытуемых животных брали кровь с помощью обработанного гепарином шприца для инъекций по методу взятия проб крови из сердца и анализировали полученные пробы крови в автоматическом анализаторе 643 Са++/рН (CIBA-CORNING) с целью определения показателя рН.
(2) Введение антитела
Очеловеченное антитело против PTHrP вводили в количестве 5 мг/0,5 мл/кг в хвостовую вену всем испытуемым крысам, страдающим гиперкальциемией (крысы ННМ) (n=3). Контрольным крысам в хвостовую вену аналогичным образом вводили физиологический раствор (n=2). Показатель рН крови у крыс, которым вводили антитело, и у контрольных крыс определяли на 0-й день (то есть день введения), 1-й и 7-й день. Результаты приведены в виде среднего значения показателей рН.
Полученные результаты показывают, что до введения антитела показатель рН крови у испытуемых крыс с симптомами гиперкальциемии был равен примерно 7,49 (в то время как у нормальных крыс указанный показатель был равен 7,40±0,02); это, по-видимому, свидетельствует о том, что у испытуемых крыс имел место метаболический алкалоз. Когда испытуемым крысам вводили очеловеченное антитело против PTHrP по настоящему изобретению, у них происходило восстановление рН почти до значения, характерного для нормальных крыс, через семь дней после введения антитела, в то время как у контрольных крыс практически не наблюдалось какого-либо изменения рН крови. Известно, что алкалоз является одним из клинических симптомов гиперкальциемии, обусловленной злокачественной опухолью, и возникает в результате ингибирования экскреции бикарбонат-иона (НСО3 -) в почках. Поскольку введение очеловеченного антитела против PTHrP по настоящему изобретению нормализуют рН крови у испытуемых животных с симптомами гиперкальциемии, можно предположить, что данное антитело способно восстанавливать метаболический алкалоз, возникающий вследствие гиперкальциемии, обусловленной злокачественной опухолью.
Приведенные выше результаты показывают, что химерные антитела и очеловеченные антитела по настоящему изобретению являются полезными средствами воздействия на положительную динамику различных клинических симптомов гиперкальциемии, обусловленной злокачественной опухолью.
Промышленная применимость
Настоящее изобретение относится к получению химерного антитела и очеловеченного антитела против PTHrP. Эти антитела характеризуются низкой антигенностью в отношении человека и поэтому являются полезными средствами для лечения гиперкальциемии, гипофосфатемии и подобных заболеваний.

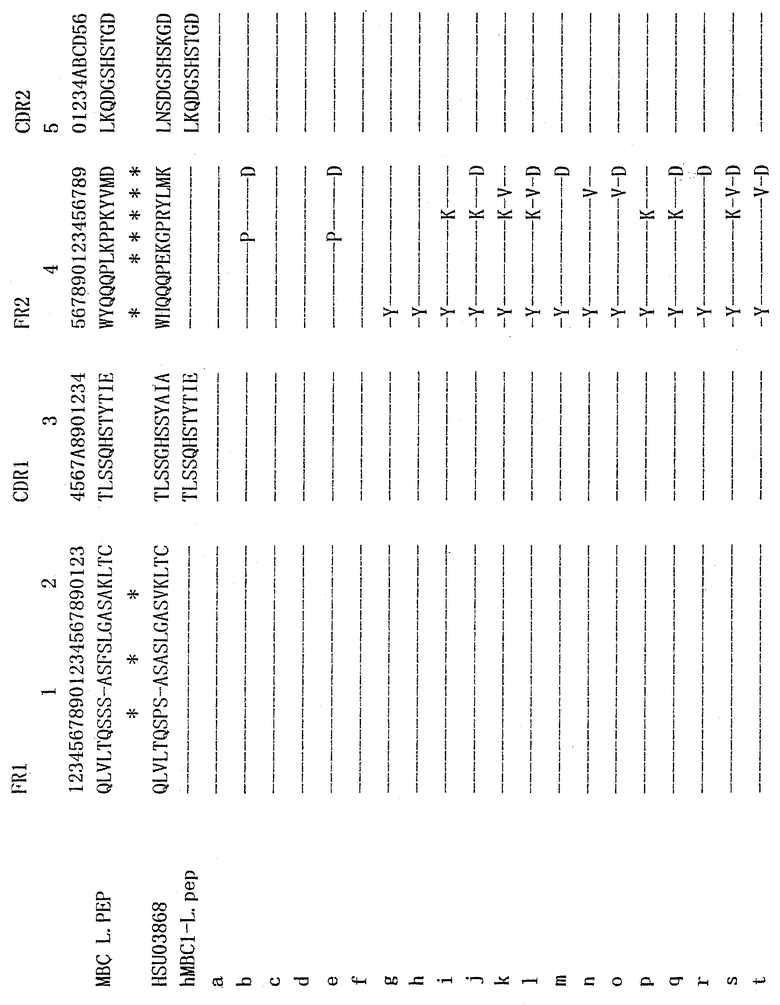























































Настоящее изобретение относится к средству для профилактики или улучшения симптомов или состояний организма, в частности, анорексии, содержащему антитело против белка, родственного паратиреоидному гормону человека (PTHrP), в качестве активного ингредиента. Средство может содержать антитело против PTHrP человека, при этом антитело может быть человеческим, гуманизированным или химерным, при этом антитело характеризуется низкой антигенностью. Использование указанного средства позволит улучшить состояние пациента со злокачественной опухолью. 5 з.п. ф-лы, 6 табл.
| JP 4228089 А, 18.08.1992 | |||
| WO 9217602 A1, 15.10.1992 | |||
| WO 9200753 A1, 23.01.1992 | |||
| WO 9603437 A, 08.02.1996 | |||
| RU 2060245 С1, 20.05.1996. |
Авторы
Даты
2008-04-20—Публикация
2002-09-18—Подача