Изобретение относится к медицине и может быть использовано для диагностики острых вирусных и бактериальных инфекций.
В лабораторной практике с целью диагностики инфекций для регистрации активности антигенов до и после контакта с эритроцитами обычно используются коммерческие тест-системы - РТПГА для антигенов бактерий и риккетсий, РГА для вирусных антигенов (Биргер М.О. Справочник по микробиологическим и вирусологическим методам исследования. - М.: Медицина, 1982). Применяемые серологические методы, несмотря на простоту и относительную доступность, не лишены определенных недостатков.
Во-первых, они достаточно трудоемки и длительны (необходимость выполнения ручных манипуляций раститровки рабочей сыворотки и антигена, внесения эритроцитарного диагностикума или эритроцитов, проведения 30-минутной (минимум) инкубации раствора иммунной сыворотки с определяемым антигеном перед раститровкой в РТПГА).
Во-вторых, указанные серологические методы, основанные на феноменах прямой или пассивной гемагглютинации, являются полуколичественными. Кроме того, сам учет реакций по общепринятой системе 4-х крестов носит субъективный характер и с трудом поддается объективизации.
В-третьих, применяемые методы не являются экспрессными: от окончания постановки реакции до их учета проходит от 1-1,5 часов (вирусная ГА) до 2 - 2,5 или 12-14 часов (РТПГА в микро- или макроварианте).
Наконец, постановка используемых реакций требует постоянного наличия ингредиентов для РТПГА - дорогостоящих специфических гипериммунных сывороток и стабильных антигенных эритроцитарных диагностикумов и для РГА - свежих куриных (для исследования гриппозного гемагглютинина) и гусиных (для исследования гемагглютинина вируса клещевого энцефалита) эритроцитов. Даже при наиболее точной постановке реакции микрометодом с наконечниками однократного применения объемами на 0,5 или 0,25 мл наблюдается большой расход ингредиентов, затрудняющий рентабельное проведение большого числа исследований в короткие сроки. При работе микрометодом с применением микродозатора Такачи из-за большого разброса воспроизводимости уменьшаются точность и достоверность исследования. Поэтому особый интерес представляют аппаратные методы определения степени связывания антигенов.
Изобретение направлено на решение задачи: ускорение, упрощение способа при высокой чувствительности и специфичности.
Сущность изобретения: указанная задача достигается тем, что диагностическое исследование производят с кровью больного, определяя косвенным образом полярографическим методом количество антигена микробов, связанного клетками крови в сравнении с контрольными исследованиями по степени уменьшения величины волны ионов меди, связанных этим антигеном.
Исследование не плазмы, а чувствительности клеток крови к различным антигенам микробов обеспечивает диагностику инфекционных заболеваний даже в самые ранние сроки от момента заражения.
Известно, что полярографически неактивные вещества можно обнаружить, если ввести в испытуемое соединение активную группу либо определять косвенно по уменьшению волны восстанавливающего вещества, дающего с испытуемым соединением осадок или комплекс.
Полярографическое исследование позволяет количественно (после составления калибровочной кривой) определить степень связывания антигена клетками крови по убыли микроколичества количества ионов меди. В свою очередь, сравнение полярограмм здоровых контрольных доноров и больных лиц позволяет поставить диагноз.
В качестве фонового раствора используют 30%-ный CaCl2 в объеме 4,0 мл. В электролизер добавляют 10 гамма двухвалентной меди (0,1 мл стандартного раствора с концентрацией 100 гамма меди в 1 мл) и после перемешивания производят трехкратную запись полярограммы.
После этого непосредственно в электролизер добавляют 0,1 мл исследуемого раствора; перемешивают и производят запись полярограммы, измеряя величину полуволны в мм. На основании заранее произведенной калибровки рассчитывают количество антигена, оставшегося в растворе после взаимодействия с эритроцитами, и диагностируют заболевание.
Способ поясняется рисунками полярограмм, где на фиг. 1а показана полярограмма фонового раствора 30% CaCl2;
- фиг. 1б - совмещенная полярограмма фонового раствора и раствора 10 гамма Cu++;
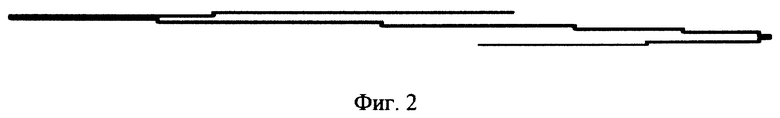
- фиг. 2 - полярограмма фонового раствора и раствора 10 гамма Cu++;
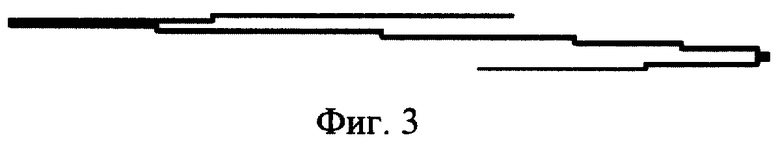
- фиг. 3 - полярограмма после внесения в электролизер 0,1 мл исследуемого антигена;
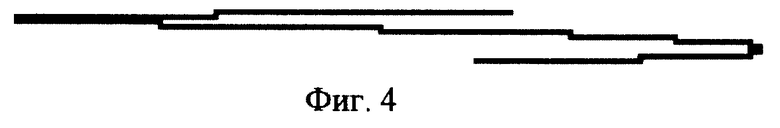
- фиг. 4 полярограмма после внесения в электролизер 0,1 мл исследуемого антигена после контакта с кровью здоровых лиц;
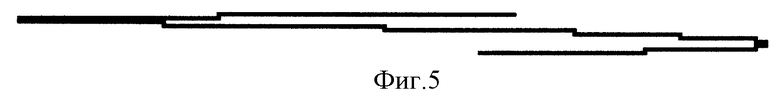
- фиг. 5 - полярограмма после внесения в электролизер 0,1 мл исследуемого антигена после контакта с кровью больных лиц.
Способ осуществляют следующим образом.
Для исследования берут 0,1 мл крови донора, смешивают с консервантом (0,1 мл "Глюгицира"), центрифугируют в течение 5-10 мин при 500 об/мин, удаляют плазму с антикоагулянтом, трижды отмывают клетки крови от остатков плазмы 0,9% раствором хлористого натрия, разбавляют клетки крови в 0,9% растворе хлористого натрия до 5-10%, смешивают 0,1 мл этой взвеси с 0,01 мл исследуемого антигена (гриппа, энтеровируса Коксаки В, шигелл Флекснер, Зонне, Ньюкестл или др.), инкубируют полученную смесь 3-5 мин в термостате при температуре 37-37,5oC, центрифугируют, после чего снимают полярограмму 10 гамма Cu++ в фоновом растворе 30% CaCl2, добавив 0,1 мл надосадочной жидкости, вновь снимают полярограмму, и разницу в величине этих полярограмм принимают за эталон. У здоровых лиц связывание антигена клетками крови не превышает 5-20%.
Первоначально составляют калибровочную кривую-эталон при всегда одинаковых параметрах. Ячейка электролизера полярографа предварительно заполнена фоновым раствором 30% CaCl2. При подаче напряжения на электроды электролизера в фоновом растворе ячейки полярографа появляется электрический ток, который регистрируется самописцем полярографа в виде стандартной кривой (фиг. 1а), а при внесении в электролизер 10 гамма Cu++ наблюдается отклонение в виде полуволны (фиг. 1б).
Величина тока зависит от количества электропроводящих ионов в растворе ячейки электролизера полярографа, каковыми в нашем исследовании являются ионы CaCl2 фонового раствора и добавляемое микроколичество двухвалентных ионов меди - 10 гамма Cu++ (фиг. 2). Самописец полярографа графически отображает величину тока между электродами ячейки полярографа на бумажной ленте. Определяют зависимость между величиной электрического тока между электродами ячейки по степени отклонения пера самописца на бумаге и количеством добавленных в ячейку ионов меди. На этом основании составляют калибровочную кривую, измеряя величину отклонения пера самописца полярографа после внесения в электролизер 0,1 мл исследуемого антигена, который, связывая ионы меди, уменьшает величину волны (фиг. 3). Величина, на которую уменьшилась длина волны, принимается за 100% расчетной величины степени связывания антигена - нулевая отметка.
После составления калибровочной кривой исследуют способность клеток крови здоровых лиц связывать на своей поверхности исследуемый антиген. Для этого клетки крови разводят в 0,9% растворе хлористого натрия, добавляют исследуемый антиген и после инкубации в термостате клеток крови с антигеном эту смесь центрифугируют. Надосадочную жидкость отсасывают микропипеткой и вносят в ячейку электролизера ртутно-капельного полярографа, в которую заранее внесен фоновый раствор 30% CaCl2 с 10 гамма Cu++. При подаче напряжения на электроды электролизера в растворе появляется электрический ток, который вызывает отклонение пера самописца от стандартной кривой фонового раствора. Параметры исследования всегда являются постоянными. В этом случае величина тока зависит от количества электропроводящих ионов в растворе ячейки электролизера полярографа, какими в нашем исследовании являются ионы Cu++. Самописец полярографа графически отображает на бумажной ленте величину тока между электродами ячейки электролизера, показывая зависимость между величиной электрического тока между электродами ячейки электролизера и количество ионов меди, оставшейся после взаимодействия с антигеном, контактировавшим с клетками крови здоровых людей (фоновый раствор и микроколичество ионов меди всегда постоянны). Для определения степени связывания исследуемого антигена клетками крови здоровых лиц величину электрического тока по степени отклонения пера самописца на бумаге в миллиметрах делят на величину в мм, полученную при определении эталона, и определяют процент связывания количества антигена в данном исследовании. У здоровых лиц степень связывания эритроцитами антигена не превышает 20% добавленного антигена, а оставшийся антиген связывает ионы меди, уменьшая величину волны, например, со 165 до 110 мм (фиг. 4).
При добавлении к микроколичеству меди надосадочной жидкости, содержащей антиген после контакта с кровью больного человека, величина волны составила 140 мм (фиг. 5).
Пример расчета:
а) величина волны полярограммы 10 гамма меди в 30% CaCl2=165 мм;
б) эта величина сократилась после добавления антигена до 100 мм, таким образом, при добавлении 0,1 мл исследуемого антигена волна уменьшилась на 65 мм что принимается за 100% переменной величины при добавлении антигена;
в) при записи полярограммы здорового человека величина волны составила 110 мм, соответственно 110 - 100 = 10 мм : 65 мм = 15,3% (здоровый донор);
г) при записи полярограммы больного человека величина волны составила 140 мм, соответственно 140 - 100 = 40 мм : 65 мм = 61,5% (больной человек).
Примеры конкретного выполнения
Пример 1.
Б-ной И-нов (43 года) поступил в инфекционное отделение ОКБ с жалобами на высокую температуру, головную боль, боли в животе. Болен 3-й день. Предварительный диагноз: Энтеровирусная инфекция. Берут 0,1 мл крови больного, смешивают с консервантом (0,1 мл "Глюгицира"), центрифугируют в течение 5-10 мин при 500 об/мин, удаляют плазму с антикоагулянтом, трижды отмывают клетки крови от остатков плазмы 0,9% раствором хлористого натрия, разбавляют клетки крови в 0,9% растворе хлористого натрия до 5-10%, смешивают 0,1 мл этой взвеси с 0,01 мл исследуемого антигена (энтеровируса Коксаки В), инкубируют полученную смесь 3-5 мин в термостате при температуре 37-37,5oC, повторно центрифугируют, после чего снимают полярограмму 10 гамма Cu++ в фоновом растворе 30% CaCl2 (величина волны 165 мм) и, добавив 0,1 мл надосадочной жидкости, вновь снимают полярограмму (величина волны 135 мм). Величина волны с 0,01 мл исследуемого антигена (энтеровируса Коксаки В) 105 мм, таким образом, эритроцитами больного связано 135-105 = 30 мм : 65 мм • 100% = 46,1%.
Заключение: у больного энтеровирусная инфекция (диагноз позднее был подтвержден серологически и клинически).
Пример 2.
Донор С-кин (52 года). Берут 0,1 мл крови больного, смешивают с консервантом (0,1 мл "Глюгицира"), центрифугируют в течение 5-10 мин при 500 об/мин, удаляют плазму с антикоагулянтом, трижды отмывают клетки крови от остатков плазмы 0,9% раствором хлористого натрия, разбавляют клетки крови в 0,9% растворе хлористого натрия до 5-10%, смешивают 0,1 мл этой взвеси с 0,01 мл исследуемого антигена (энтеровируса Коксаки В), инкубируют полученную смесь 3-5 мин в термостате при температуре 37-37,5oC, повторно центрифугируют, после чего снимают полярограмму 10 гамма Cu++ в фоновом растворе 30% CaCl2 (величина волны 168 мм) и, добавив 0,1 мл надосадочной жидкости, вновь снимают полярограмму (величина волны 103 мм). Величина волны с 0,01 мл исследуемого антигена (энтеровируса Коксаки В) 115 мм, таким образом, эритроцитами больного связано 115-103=12 мм: 65 мм • 100% = 18,5%.
Заключение: у обследуемого энтеровирусной инфекции нет.
Пример 3.
Б-ной И-нов (43 года) поступил в инфекционное отделение ОКБ с жалобами на высокую температуру, головную боль, боли в животе. Болен 3-й день. Предварительный диагноз: Энтеровирусная инфекция. Берут 0,1 мл крови больного, смешивают с консервантом (0,1 мл "Глюгицира"), центрифугируют в течение 5-10 мин при 500 об/мин, удаляют плазму с антикоагулянтом, трижды отмывают клетки крови от остатков плазмы 0,9% раствором хлористого натрия, разбавляют клетки крови в 0,9% растворе хлористого натрия до 5-10%, смешивают 0,1 мл этой взвеси с 0,016 мл исследуемого антигена (дизентерийный антигенный диагностикум шигелл Флекснер), инкубируют полученную смесь 3-5 мин в термостате при температуре 37-37,5oC, повторно центрифугируют, после чего снимают полярограмму 10 гамма Cu++ в фоновом растворе 30% CaCl2 (величина волны 165 мм) и, добавив 0,1 мл надосадочной жидкости, вновь снимают полярограмму (величина волны 110 мм). Величина волны с 0,01 мл исследуемого антигена (антигенный диагностикум шигелл Флекснер) 100 мм, таким образом, эритроцитами больного связано 110 - 100 = 10 мм : 65 мм • 100% = 15,4%.
Заключение: у больного дизентерии Флекснер нет.
Заключение: учитывая, что основными методами диагностики инфекций являются клинические и серологические методы, результаты которых имеет лишь ретроспективное значение (определение степени нарастания титров антител в "парных" сыворотках производится через 10-15 дней от начала заболевания), либо выделение и идентификация возбудителя в материале от больного человека (что весьма трудоемко и занимает большой промежуток времени), а заявляемый способ позволяет поставить диагноз заболевания в течение 25-30 мин от начала обследования больного и может быть использован для дифференциальной диагностики от сходных с ним по клиническим признакам заболеваний.
Предлагаемый способ точен, т.к. при повторных полярографических исследованиях результаты были практически одинаковыми.
Предлагаемый способ объективен, т.к. заключение о наличии заболевания делается на основании величины полярографической волны антигена надосадочной жидкости, что осуществляется простым замером с помощью миллиметровой линейки, исключая всякий субъективизм в оценке результатов.
Предлагаемый способ значительно уменьшает трудоемкость и повышает производительность труда по сравнению с аналогами.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИММУНОДИАГНОСТИКИ ИНФЕКЦИЙ | 2000 |
|
RU2176794C2 |
| СПОСОБ ДИАГНОСТИКИ КЛЕЩЕВОГО ЭНЦЕФАЛИТА | 1994 |
|
RU2095814C1 |
| СПОСОБ ДИАГНОСТИКИ МИАСТЕНИИ | 1997 |
|
RU2128340C1 |
| СПОСОБ ДИАГНОСТИКИ МИАСТЕНИИ | 1998 |
|
RU2138811C1 |
| СПОСОБ ИММУНОДИАГНОСТИКИ ИНФЕКЦИЙ | 1996 |
|
RU2136000C1 |
| СПОСОБ ДИАГНОСТИКИ РАССЕЯННОГО СКЛЕРОЗА | 1994 |
|
RU2081412C1 |
| СПОСОБ ИММУНОДИАГНОСТИКИ РАССЕЯННОГО СКЛЕРОЗА | 1996 |
|
RU2125728C1 |
| СПОСОБ ДИАГНОСТИКИ МИАСТЕНИИ | 1996 |
|
RU2098827C1 |
| СПОСОБ ДИАГНОСТИКИ РАССЕЯННОГО СКЛЕРОЗА | 1997 |
|
RU2128840C1 |
| СПОСОБ ДИАГНОСТИКИ РАССЕЯННОГО СКЛЕРОЗА | 1996 |
|
RU2104543C1 |
Изобретение относится к медицине, в частности, к инфекционным болезням. Способ обеспечивает ускорение и упрощение исследования при высокой чувствительности и специфичности. Исследование проводят с кровью больного, определяя косвенным образом полярографическим методом количество антигена микробов, связанного клетками крови, в сравнении с контрольными исследованиями по степени уменьшения величины волны ионов меди, связанных этим антигеном. При этом к смеси форменных элементов крови и хлорида натрия добавляют раствор исследуемого антигена при их объемном соотношении 1:1, полученную смесь инкубируют в течение 3-5 мин при 37-37,5oС с последующим центрифугированием. После этого снимают полярограмму микроконцентрации ионов Си++ в 30% растворе СаСl2 после добавления надосадочной жидкости и сравнивают с эталонной полярограммой. Способ позволяет диагностировать острые вирусные и бактериальные инфекции в течение 25-30 мин от начала обследования больного. 5 ил.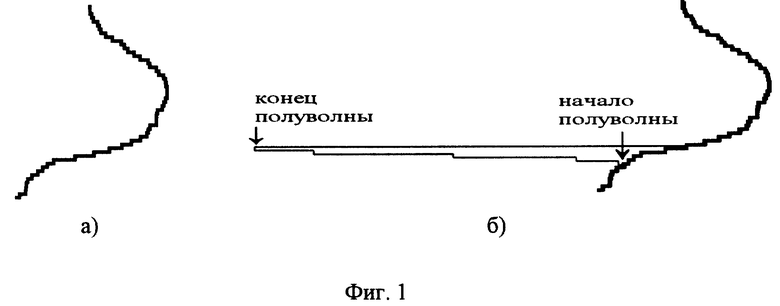
Способ диагностики инфекций, включающий забор пробы крови, получение форменных элементов крови с последующим добавлением к ним 0,9% раствора хлорида натрия, а затем раствора исследуемого антигена, инкубирование полученной смеси и определение диагностически значимого показателя, отличающийся тем, что к смеси форменных элементов крови и хлорида натрия добавляют раствор исследуемого антигена при их объемном соотношении 1:1, полученную смесь инкубируют в течение 3-5 мин при 37-37,5°С с последующим центрифугированием, после чего снимают полярограмму микроконцентрации ионов Cu++ в 30%-ном растворе СаCl2 после добавления надосадочной жидкости, сравнивают с эталонной полярограммой, которую снимают после добавления в ячейки электролизера с микроконцентрацией ионов Cu++ в фоновом растворе 30%-ного СаCl2 стандартного количества исследуемого антигена, и при увеличении отклонения пера самописца от нулевой отметки более чем на 20% по сравнению с величиной отклонения пера самописца от нулевой отметки на эталонной полярограмме диагностируют заболевание.
| БИРГЕР М.О | |||
| Справочник по микробиологическим и вирусологическим методам исследования | |||
| - М.: Медицина, 1982, с | |||
| Способ добывания бензина и иных продуктов из нефти, нефтяных остатков и пр. | 0 |
|
SU211A1 |
| RU 93029220 А, 20.04.1996 | |||
| RU 93050831 A, 27.01.1997 | |||
| RU 92009198 A, 20.04.1995. | |||
Авторы
Даты
2001-05-27—Публикация
2000-02-01—Подача