Изобретение относится к гонадотропинам, фармацевтическим композициям, включающим указанные гонадотропины, и ДНК, кодирующим указанные гонадотропины.
Гонадотропины образуют семейство структурно родственных гликопротеиновых гормонов. Типичные члены включают хорионический гонадотропин (ХГ), фолликулостимулирующий гормон (ФСГ), лютеинизирующий гормон (ЛГ) и тироидостимулирующий гормон (ТСГ). ФСГ, ЛГ и ТСГ присутствуют у большинства видов позвоночных и синтезируются и секретируются гипофизом. ХГ до настоящего времени был обнаружен только у приматов, включая людей, и у лошадей и синтезируется плацентарной тканью.
Гонадотропины являются гетеродимерами, состоящими из двух различных субъединиц, называемыми α и β, которые связаны нековалентными связями. Внутри вида α-субъединицы по существу идентичны для каждого члена семейства гонадотропинов; он также высоко консервативен от вида к виду. β-субъединицы различны у каждого члена, т.е. ХГ, ФСГ, ТСГ и ЛГ, но проявляют существенную гомологию структуры. Более того, β-субъединицы также высокого консервативны от вида к виду. У людей α-субъединица состоит из 92 аминокислотных остатков, тогда как β-субъединица меняется в размере у каждого члена: 111 остатков у ФСГ человека, 121 остаток у ЛГ человека, 118 остатков у ТСГ человека и 145 остатков у ХГ человека (Combarnous, Y., Endocrine Reviews, 1992, vol. 13, pp. 670 - 691, Lustbader, J.W., et al., Endocrine Reviews, 1993, Vol. 14, pp. 291-311). β-субъединица ХГ человека является в значительной степени более крупной, чем другие β-субъединицы, так как она содержит приблизительно 34 дополнительных аминокислот у C-конца, называемого здесь карбокситерминальным белком (СТР).
Обе субъединицы гетеродимера имеют много консервативных внутрисубъединичных дисульфидных связей: пять дисульфидных мостиков в α-субъединице и шесть дисульфидных мостиков в β-субъединице. Соответствующие цистеиновые остатки полностью консервативны среди всех членов семейства гонадотропинов. Недавно полученная рентгеновская структура ХГ человека показывает, что эти дисульфидные связи вовлечены в типичные трехмерные структуры, называемые дисульфидными узлами. Гонодотропины обладают тремя или четырьмя аспарагиновыми остатками, которые могут быть N-гликолизированными. Кроме того, C-концевой пептид (СТР) ХГ человека может быть О-гликолизированным в четырех положениях серина.
Гонадоторопины выполняют важные функции в различных функциях организма, включая метаболизм, регуляцию температуры и процесс репродукции. Например, гипофизарный гонадотропин ФСГ играет главную роль в стимуляции развития и созревания фолликулитов, тогда как ЛГ вызывает овуляцию (Sharp, R.M., Clin. Endocrinol. , 1990, Vol. 33, pp. 787-807; Dorrington & Armstrohg, Recent Prog. Horm. Res., 1979, Vol. 35, pp. 301-342). В настоящее время ФСГ применяется в клинической практике либо изолированно, или в сочетании с активностью ЛГ для стимуляции яичников, т.е. гиперстимуляции яичников для оплодотворения in vitro (IVF) и индукции in vivo овуляции у женщин, страдающих ановуляторным бесплодием (Insler, V., Int. J. Fertility., 1988, Vol. 33, pp. 85 - 97, Navol & Rosenwaks, J. Vitro Fert. Embryo Transfer, 1988, Vol. 5, pp. 3 - 13), а также по поводу гипогонадизма у мужчин.
В настоящее время гонадотропины, предназначенные для лечебных целей, выделены из мочи человека и имеют низкую степень чистоты (Morse et al., Amer. J. Reproduct. Immunol. and Microbiology. 1988, Vol. 17, p.143). В отличие от этих гонадотропинов мочи, рекомбинантные гонадотропины дают большие преимущества в том, что они имеют устойчивое качество, т.е. имеют воспроизводимые биохимические и биологические свойства. Для всех субъединиц были приготовлены клоны геномной и кДНК, и была установлена их первичная структура. Кроме того, клетки яичников китайских хомячков (CHO) были трансфецированы генами субъединиц гонадотропина человека, и, как показано, эти клетки способы секретировать интактные димеры (например, Keen et al., J. Biol. Chem. , 1989, Vol. 264, pp. 4769-4775; Van Wezenbeek et al., в кн. "From clone to Cliniс" (издатели Crommelin D.J.A. и Schellekens H., pp. 245-251).
С тех пор было показано, что биохимические и биологические характеристики, например, рекомбинатного ФСГ почти идентичны характеристикам естественного ФСГ (Mannаerts et al., Endokrinology, 1991, Vol. 129, pp. 2623-2630). Кроме того, после контрольной суперовуляции яичников с использованием рекомбинантного ФСГ было достигнуто развитие беременностей (Germond et al., Lancet, 1992, Vol. 339, p. 1170; Devroey et al., Lancet, 1992, Vol. 339, pp. 1170-1171).
Успешная сборка двух субъединиц в димер является абсолютным предварительным условием для биологической активности димера. Диссоциация гетеродимера на соответствующие субъединицы считается главным процессом в утрате биологической активности in vivo. Кроме того, процессы, как, например, диссоциация и дезамидирование, приводит к резкому уменьшению сроков хранения. Поэтому термодинамическая стабильность гетеродимера считается важным фактором, который влияет на период полураспада гонадотропинов как в условиях in vivo, так и in vitro. Следовательно, для клинического применения требуются дальнейшие улучшения устойчивости гонадотропинов.
Настоящее изобретение дает такие гонадотропины. К удивлению было обнаружено, что один или более ненативных дисульфидных мостиков могут быть введены в гонадотропины, что приводит к увеличению стабильности указанных гонадотропинов. Как описано в настоящем изобретении, ненативные дисульфидные мостики являются дисульфидными мостиками, которые не встречаются в нативных гонадотропинах, следовательно ненативные дисульфидные мостики не включают ни пять дисульфидных мостиков в α-субъединице, ни шесть дисульфидных мостиков в β-субъединице, которые присутствуют в нативных гонадотропинах. "Нативными" гонадотропинами являются те гонадотропины, которые имеют такую же аминокислотную последовательность, как и гонадотропины, выделенные из соответствующей ткани.
Настоящее изобретение дает гонадотропины, состоящие из α-субъединицы и β-субъединицы, которые включают один или более ненативных дисульфидных мостиков.
Ненативные дисульфидные мостики могут быть введены сайт-направленным мутагенезом: точечной мутации нативного аминокислотного остатка в соответствующем положении в цистеин. Точечная мутация условно изображена как X αy Cys или X βy Cys, в которых является аминокислотным остатком в соответствующем положении "y" α- или β-субъединицы, соответственно мутированных в цистеин (трехбуквенный код используется для аминокислот). Условные обозначения Cys αy Cys или Cys βy Cys относятся к положениям у цистеинов в нативной субъединице. Точечные мутации в соответствии с изобретением ведут к незначительным изменениям конформации гонадотропинов.
Диапазон изобретения также включает гонадотропины, в которых была введена только одна мутация. Такая мутация может быть введена в ДНК, кодирующую α- или β-субъединицы, что приводит к появлению нового цистеинового остатка, способного образовывать дисульфидный мостик с уже существующим цистеиновым остатком. Такие мутации предпочтительно вводятся в α-субъединицу, более предпочтительно в аминокислотные положения 88 - 92.
Ненативные дисульфидные мостики, в соответствии с изобретением, могут присутствовать между парами аминокислотных остатков, посредством чего аминокислотные остатки помещаются на различные субъединицы (межсубъединичные). Кроме того, ненативные дисульфидные мостики могут также присутствовать между парами аминокислотных остатков, в которых оба аминокислотных остатка располагаются на одной и той же субъединице (внутрисубъединичные). В соответствии с изобретением, необязательно, в результате присутствия одного или более ненативных дисульфидных мостиков может происходить делеция одного или более из одиннадцати нативных дисульфидных мостиков.
В соответствии с изобретением ненативные дисульфидные мостики предотвращают диссоциацию димеров, приводящую в результате к более высокой биологической стабильности in vitro и in vivo и к возможности более длительного хранения по сравнению с нативными гликопротеинами. Кроме того, они уменьшают гибкость полипептидного скелета гонадотропинов, делая таким образом эти гонадотропины менее восприимчивыми к дезамидированию. Дезамидирование является спонтанным процессом, который происходит в физиологических условиях и который отрицательным образом влияет на чистоту и устойчивость белка.
Гонадотропины, в которых присутствует комбинация ненативных интер- и интрасубъединичных дисульфидных мостиков, также находится в диапазоне изобретения.
В соответствии с изобретением соответствующие гонадотропины, в которых α-субъединица имеет человеческое происхождение, содержат ненативный интрасубъединичный дисульфидный мостик между одной или более аминокислотными парами (Phe α18 Cys - Ile α25 Cys), Gln α20 Cys - Ala α23 Cys), (Ser α34 Cys - Ser α57 Cys), (Thr α39 Cys - Thr α54 Cys), (Ala α62 Cys - His α79 Cys) и (Lys α63 Cys - Ala α81 Cys), (Tyr α65 Cys - His α79 Cys) и (Asn α66 Cys - Asn α78 Cys).
В соответствии с изобретением соответствующие гонадотропины, в которых β-субъединицы являются β-субъединицей
ХГ человека, могут содержать интерсубъединичный дисульфидный мостик между одной или более аминокислотными парами (Gln α5 Cys - Arg β8 Cys), (Pro α24 Cys - Gly β71 Cys), (Met α29 Cys - Met β41 Cys), (Arg α35 Cys - Ala β35 Cys), (Tyr α37 Cys - Ile β33 Cys), (Lys α51 Cys - Asp β99 Cys) и (His α90 Cys - Cys βy Cys) и/или интрасубъединичный дисульфидный мостик между одной или более аминокислотными парами (Pro β4 Cys - Pro β7 Cys), (Pto β11 Cys - Thr β32 Cys), (Pro β11 Cys - Ala β85 Cys), (Thr β32 Cys - Ala β85 Cys), (Arg β60 Cys - Ser β87 Cys), (Arg β60 Cys - Gln β89 Cys), (Asp β61 Cys - Leu β86 Cys), (Asp β61 Cys - Ser β87 Cys), (Ser β66 Cys - Ser β81 Cys) и (Leu β69 Cys - Pro β78 Cys). В соответствии с изобретением ХГ человека предпочтительно содержит ненативный интерсубъединичный дисульфидный мостик между аминокислотными парами (Met α29 Cys - Met β41 Cys), (Tyr α37 Cys - Ile β33 Cys) или (Lys α51 Cys - Asp β99 Cys), или (His α90 Cys - Cys βy Cys).
В соответствии с изобретением соответствующие гонадотропины, в которых β-субъединица является β-субъединицей ЛГ человека, могут содержать интерсубъединичный дисульфидный мостик между одной или более аминокислотными парами (Gln α5 Cys - Trp β8 Cys), (Pro α24 Cys - Gly β71 Cys), (Met α29 Cys - Met β41 Cys), (Arg α35 Cys - Ala β35 Cys), (Tyr α37 Cys- Ile β33 Cys), (Lys α51 Cys - Asp β99 Cys) и (His α90 Cys - Cys βy Cys) и/или интрасубъединичный дисульфидный мостик между одной или более аминокислотными парами (Pro β4 Cys - Pro β7 Cys), (Pro β11 Cys - Thr β32 Cys),
(Pro β11 Cys - Ala β85 Cys), (Thr β32 Cys - Ala β85 Cys), (Arg β60 Cys - Ser β87 Cys), (Arg β60 Cys - Arg β89 Cys), (Asp β61 Cys - Leu β86 Cys), (Asp β61 Cys - Ser β87 Cys), (Ser β66 Cys - Ser β81 Cys) и (Leu β69 Cys - Pro β78 Cys). В соответствии с изобретением предпочтительным гонадотропином является ЛГ человека, содержащий дисульфидный мостик между аминокислотными парами (Met α24 Cys - Met β41 Cys), (Tyr α37 Cys - Ile β33 Cys), (Lys α51 Cys - Asp β99 Cys) или (His α90 Cys - Cys βy Cys).
В соответствии с изобретением соответствующие гонадотропины, в которых β-субъединица является β-субъединицей ФСГ человека, могут содержать интерсубъединичный дисульфидный мостик между одной или более аминокислотными парами (Gln α5 Cys - Ser β2 Cys), (Pro α24 Cys - Gly β65 Cys), (Met α29 Cys - Arg β35 Cys), (Arg α35 Cys - Ala β29 Cys), (Tyr α37 Cys - Trp β27 Cys), (Lys α51 Cys - Asp β93 Cys) и (His α90 Cys - Cys βy Cys) и/или интрасубъединичный дисульфидный мостик между одной или более аминокислотными парами (Leu β5 Cys - Thr β26 Cys), (Leu β5 Cys - Ala β79 Cys), (Thr β26 Cys - Ala β79 Cys), (Lys β54 Cys - Gln β81 Cys), (Lys β54 Cys - His β83 Cys), (Glu β55 Cys - Thr β80 Cys), (Glu β55 Cys - Gln β81 Cys), (Thr β60 Cys - Thr β75 Cys) и (Val β63 Cys - Ser β72 Cys). В соответствии с изобретением предпочтительным гонадотропином является ФСГ человека, в котором β-субъединица содержит интерсубъединичный дисульфидный мостик между аминокислотной парой (Tyr α37 Cys - Trp β27 Cys) или (His α90 Cys - Cys βy Cys).
В соответствии с изобретением соответствующие гонадотропины, в которых β-субъединица является β-субъединицей ТСГ человека, содержат интерсубъединичный дисульфидный мостик между одной или более аминокислотными парами (Gln α5 Cys - Phe β1 Cys), (Pro α24 Cys - Gly β66 Cys), (Met α29 Cys - Arg β34 Cys), (Arg α35 Cys - Ala β28 Cys), (Tyr α37 Cys - Ile β26 Cys), (Lys α51 Cys - Asp β94 Cys) и (His α90 Cys - Cys βy Cys) и/или имнтрасубъединичный дисульфидный мостик между одной или более аминокислотными парами (Pro β4 Cys - Thr β25 Cys), (Pro β4 Cys - Ala β80 Cys), (Thr β25 Cys - Ala β80 Cys), (Arg β55 Cys - Ser β82 Cys), (Arg β55 Cys - Lys β84 Cys), (Asp β56 Cys - Leu β81 Cys), (Asp β56 Cys - Ser β82 Cys), (Thr β61 Cys - Ser β76 Cys) и (Ile β64 Cys - Pro β73 Cys).
Будет ясно, что комбинации интер- и интра-ненативных дисульфидных мостиков также включены в настоящее изобретение.
Представленные выше мутационные положения относятся к аминокислотной последовательности гонадотропинов человека. Сравнимые ненативные дисульфидные мостики внутри субъединиц гонадотропинов от других видов также входят в диапазон изобретения. Точное положение аминокислотных остатков, подлежащих мутации в цистеин, может быть получено при выравнивании последовательностей указанных субъединиц гонадотропина с субъединицами гонадотропина человека.
Ввиду того, что дисульфидное связывание играет главную роль во время укладки и сборки субъединиц, вызывает большое удивление, что введение ненативных дисульфидных мостиков, в соответствии с изобретением, не вмешивается в образование правильно уложенных гонадотропинов. Соответствующее образование дисульфидных связей является главным процессом в укладке и созревании функциональных гонадотропинов. Особенно принципиально образование дисульфидных связей в β-субъединице: все дисульфидные связи требуются для эффективного комбинирования и укладки. Детальные исследования укладки ХГ человека показали, что укладка молекулы не происходит простым последовательным путем, а происходит независимо в различных доменах молекулы. Поэтому предполагалось, что введение дополнительных цистеиновых остатков в α- и/или β-субъединицы нарушит процесс укладки, что приведет к потере конформации молекулы, и, как следствие этого, к утрате функциональности и биологической активности молекулы. Особенно поскольку так много цистеинов уже присутствуют в этих молекулах.
В соответствии с изобретением точечные мутации в цистеины лишь маргинально изменяют общий аминокислотный состав и характеристики белка, поэтому гонадотропины в соответствии с изобретением имеют дополнительное преимущество в том, что их потенциальная иммуногенность не будет существенно отличаться от иммуногенности гонадотропинов дикого типа. Особенно, когда ненативные дисульфидные мостики помещаются на внутренней поверхности димеров гонадотропинов, влиянием на иммуногенность можно будет пренебречь.
В соответствии с изобретением в зависимости от участка мутации гонадотропины могут быть агонистами или антагонистами. Как уже упоминалось выше, сайт мутации может привести к незначительным изменениям в конформации молекулы. Если сайт мутации выбран в частях белка, которые связаны с рецепторным связыванием и/или передачей сигнала, в соответствии с изобретением ненативные дисульфидные мостики могут привести к частичной или полной утрате активности передачи сигнала в сочетании с повышенной стабильностью гликопротеина. Таким образом, настоящее изобретение дает антагонисты с повышенной стабильностью. Если сайт мутации выбран на внутренней поверхности димеров внутреннего юора гликопротеина, полученные в результате ненативные дисульфидные мостики не будут влиять на рецепторное связывание и/или активность передачи сигнала, но приведут к повышенной стабильности относительно нативных гонадопротеинов. В результате таких мутаций будут получены агонисты гонадотропина с повышенной стабильностью.
В соответствии с изобретением гонадотропины могут содержать другие модификации, в целом известные в этой области.
В соответствии с изобретением в одной такой предпочтительной модификации гонадотропинов С-концевая аминокислотная последовательность одной субъединицы связана, необязательно, через линкер с N-концом аминокислотной последовательности другой субъединицы. Предпочтительно, чтобы линкер являлся полной или частичной единицей СТР или его вариантом.
Другой модификацией гонадотропинов, в соответствии с изобретением, может быть удлинение α- и/или β -субъединицы соответственно на их N- и C-концах с помощью полной или частичной единицы СТР или его варианта. Удлинение может включать соответствующие единицы СТР в единичной или множественной формах. В альтернативном варианте в N- и C-концевые сегменты указанных субъединиц могут быть вставлены полная единица СТР, частичная единица СТР или их множественные формы.
Кроме того, в соответствии с изобретением гонадотропины могут быть либо гликолизированными или негликолизированными. Частично или негликолизированные гонадотропины в соответствии с изобретением могут быть получены либо посредством химической модификации, ферментативной модификации, либо с помощью сайт-направленного мутагенеза, посредством которого удаляются один или более участков распознавания гликолизирования в гонадотропинах. В альтернативном варианте тип гликолизирования гонадотропинов в соответствии с изобретением может модифицироваться введением дополнительных участков распознавания гликолизирования и, как вариант, удаления одного или более участков распознавания гликолизирования, что в результате приводит к модифицированному гликолизированию указанных гонадотропинов. Участок распознавания гликолизирования, используемый здесь, состоит из аминокислотной последовательности Asn-X-Ser/Thr, где X может быть любой аминокислотой.
α- и β-субъединицы ХГ, ФСГ, ЛГ и ТСГ, а также гетеродимерные формы, используемые здесь, имеют в целом свои обычные определения и относятся к белкам, имеющим аминокислотные последовательности, как таковые, известные в этой области, или их аллельным вариантам, независимо от проявленного типа гликолизирования.
"Нативными" формами этих белков являются те белки, которые имеют аминокислотные последовательности, как и выделенные из соответствующей ткани позвоночных, и, как таковые, имеют эти известные последовательности или их аллельные варианты.
Этими "вариантами" являются те белки, которые имеют запланированные изменения аминокислотных последовательностей относительно нативных белков. Изменения могут включать одиночные или множественные делеции, вставки, замещения и их комбинации и могут быть вызваны, например, сайт-специфическим мутагенезом или с помощью других рекомбинантных манипуляций или могут быть приготовлены синтетическим способом. Эти изменения предпочтительно состоят из замещений консервативных аминокислот, при которых замещенный остаток относится к той же общей аминокислотной категории, как и тот, на который было произведено замещение. Такая классификация аминокислот в целом известна в этой области и описана, например, Dayhoff, M. et al., Atlas of Protein Sequeces and Structure, 1972, Vol. 5, pp. 89-99.
Используемый здесь термин "единица СТР" относится к аминокислотной последовательности, найденной на карбокси-конце β-субъединицы ХГ человека, которая простирается от аминокислоты 112-118 до остатка 145 на C-конце или его части. "Полная" единица СТР содержит 28-34 аминокислоты в зависимости от N-конца СТР. "Частичная" единица СТР является аминокислотной последовательностью, которая встречается между положениями от 112-118 до 145 включительно, но с делецией по крайней мере одной аминокислоты из насколько возможно самой короткой полной единицы СТР (аминокислоты 118-145). Под "множественными" единицами СТР подразумевают и тандемные матрицы полной единицы СТР, или частичную единицу СТР, или комбинации обеих.
ДНК, кодирующие любой их гонадотропинов, в соответствии с изобретением также находятся в диапазоне изобретения. Указанные ДНК в соответствии с изобретением включает один или боле кодирующих цистеин кодонов, которые были замещены на кодоны, которые кодируют аминокислоту, подлежащую замещению, ДНК в соответствии с изобретением может быть получена из ДНК, кодирующей нативные гоналотропины или их варианты, путем замещения в указанной ДНК одного или более кодонов, кодирующих аминокислотный остаток, подлежащий замещению кодоном, кодирующим цистеин. Эти замещения могут выполняться путем сайт-направленного мутагенеза.
Способы конструирования гонадотропинов в соответствии с изобретением хорошо известны в этой области (Sambrook et al., Molecular Cloning: a Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, последнее издание). Наиболее практичным подходом является производство этих гонадотропинов путем экспрессии ДНК, кодирующей желаемый белок. Методики сайт-направленного мутагенеза, лигирования дополнительных последовательностей, ПЦР и создания подходящих систем экспрессии - все они в настоящее время хорошо известны в этой области. Части или все ДНК, кодирующие желаемый белок, могут быть получены синтетическим способом с использованием стандартных твердофазных методик, предпочтительно для включения сайтов рестрикции для облегчения лигирования. Соответствующие контрольные элементы для транскрипции и трансляции включений кодирующей последовательности могут быть введены в последовательности, кодирующие ДНК. Как хорошо известно, в настоящее время доступны системы экспрессии, которые совместимы с широким разнообразием хозяев, включая прокариотических хозяев, как например, бактерии, и эукариотические хозяева, как например, дрожжи, растительные клетки, клетки насекомых, клетки млекопитающих, клетки птиц и им подобные. Выбор хозяина особенно зависит от посттрансляционных процессов, больше всего от гликолизирования. Локализация гликолизирования преимущественно контролируется природой участка гликолизирования внутри молекулы. Однако природа сахаров, занимающих этот участок, в значительной степени контролируется природой хозяина.
В соответствии с изобретением гонадотропины могут использоваться для тех же клинических целей, что и нативные гонадотропины, с тем преимуществом, что они проявляют повышенную стабильность. Мутированные гонадотропины могут использоваться в качестве агонистов или антагонистов в зависимости от типа мутации. В соответствии с изобретением соответствующие фармацевтические композиции включают один или более гонадотропинов в соответствии с изобретением и фармацевтически приемлемый носитель.
Фармацевтически приемлемые носителя хорошо известны специалистам в этой области и включают, например, стерильный солевой раствор, лактозу, сахарозу, фосфат кальция, желатин, декстрин, агар, пектин, арахисовое масло, оливковое масло, кунжутное масло и воду.
Кроме того, фармацевтическая композиция в соответствии с изобретением может включать один или более стабилизаторов, такие как, например, углеводы, включая сорбитол, маннитол, крахмал, сахарозодекстрин и глюкозу, белки, такие как альбумин или казеин, и буферы, подобные щелочным фосфатам.
Соответствующими путями введения являются внутримышечные инъекции, подкожные инъекции, внутривенные инъекции или внутрибрюшинные инъекции, оральное или интраназальное введение.
Следующие примеры иллюстрируют изобретение и ни в коей мере не должны расцениваться как ограничивающие объем притязаний изобретения.
Подписи к фигурам
Фигура 1: Структурная организация плазмиды pPKS.hCGαcβc экспрессии hCGαcβc.SV40 - ранний промотор SV40. E = M-MuLV усилитель. MT-11A - промотор металлотионена-11A человека. hCGαg = геномный hCGα мини ген, кодирующий субъединицу hCGα. hCGβc = кДНК, кодирующий субъединицу hCGβ. β-глобин = последовательность полиаденилирования и сигналы сплайсинга кроличьего β-глобина. S = последовательность терминации транскрипции SV40. pBR327 = часть плазмиды pBR327, содержащая происходящий из E. coli ген, кодирующий репликцию и устойчивость к ампициллину.
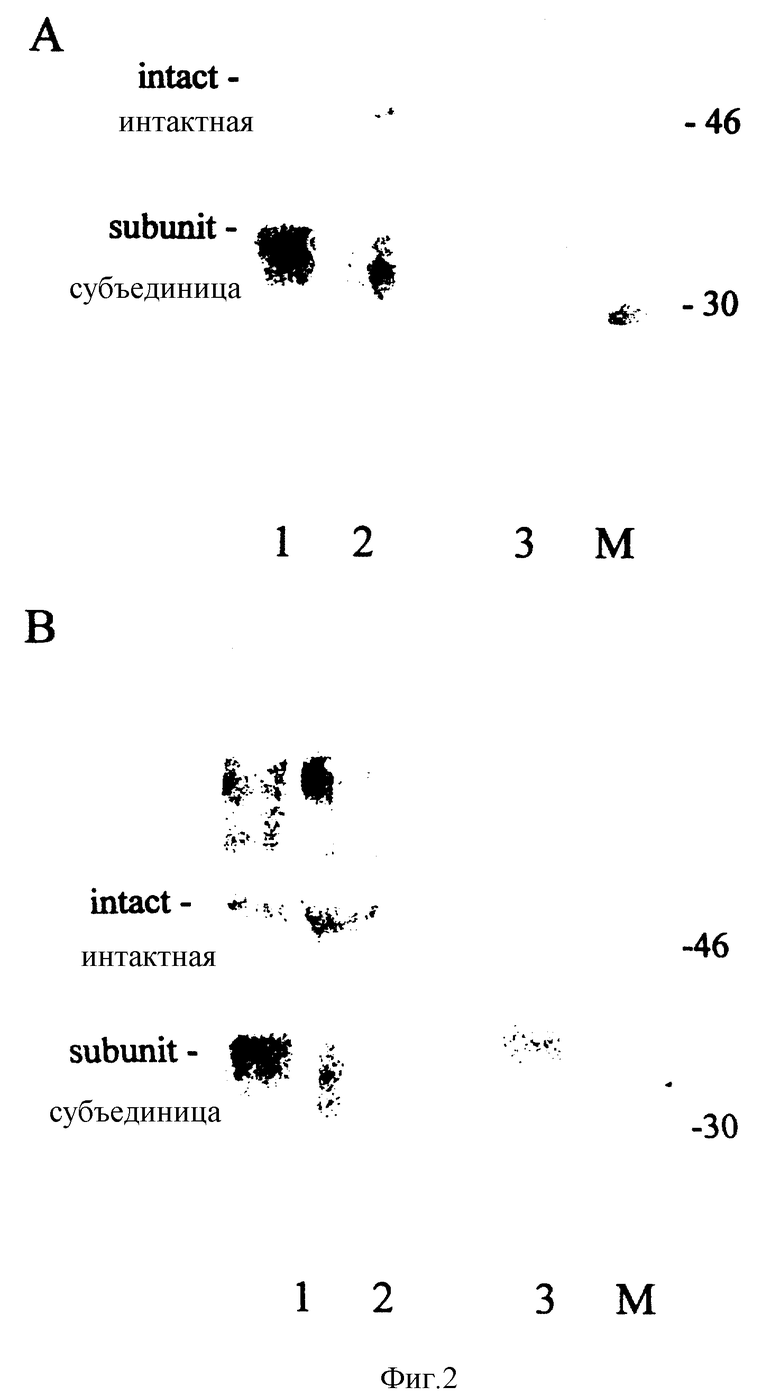
Фигура 2: Анализ методом "Western botl" супернатантов клеточной культуры при получении человеческого ХГ (ХГч)-межцепочечная связь 1, ХГч-межцепочечная связь 2 и ХГч дикого типа для экспрессии ХГч (мутеинов) и образования межсубъединичных дисульфидных мостиков. Супернатанты клеточных культур из G418-резистентных трансфекционных пулов ХГч-межцепочечная связь 1, ХГч-межцепочечная связь 2 и из рекомбинантного ХГч дикого типа, содержащие приблизительно 0,2 ME ХГч, были солюбилизированы при комнатной температуре (Панель A) или 100oC (Панель B и C) в содержащем додецилсульфат натрия буфере образца при отсутствии (Панели A и B) или в присутствии β-меркаптоэтанола (Панель C). После электрофореза и переноса на мембраны из поливинилидинфторида ХГч был визуализирован инкубацией с β-ХГч специфичным моноклональным антителом с последующей инкубацией со вторым конъюгатом антитело-HRP и окрашиванием ТМВ. Как видно, солюбилизиация как при комнатной температуре (Панель A, полосы 1 и 2), так и при 100oC (Панель B, полосы 1 и 2) в результате приводит к выявлению интактного гормона, тогда как в контроле (ХГч дикого типа) кипение вызывает диссоциацию гормона на его субъединицы (Панель B, полоса 3). Добавление восстанавливающего вещества приводит к диссоциации на субъединицы во всех трех образцах (Панель C). Таким образом, комбинированные данные приводят к заключению, что как ХГч-межцепочечная связь 1, так и межцепочечная связь 2, стабилизируются с помощью межмолекулярного дисульфидного мостика.
Фигура 3: Анализ смещения ХГч межсубъединичных мутеинов ХГч. B/B0 = % общего связывания... -+- = ХГч дикого типа (WT)- Δ = ХГч-межцепочечная связь 1. -о- = ХГч-межцепочечная связь 2.
Фигура 4: Биологическая активность in vitro межсубъединичных мутеинов. -+- = I.S 75/537. - Δ - = ХГч-межцепочечная связь 1. -о- = ХГч-межцепочечная связь 2.
Фигура 5: Уровни ХГч в плазме после внутримышечной инъекции препаратов рекомбинантного ХГч самкам гончих собак.
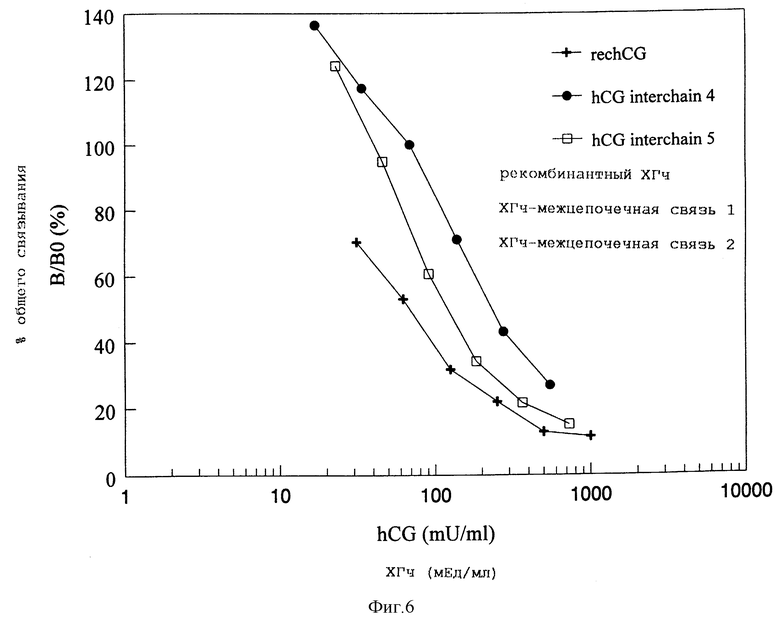
Фигура 6: Активность связывания ХГч дикого типа и мутантов ХГч с межцепочечными связями с мембранами клеток CHO, стабильно экспрессирующих рецептор ЛГ/ХГ человека. Мембраны инкубировались с меченным I125 ХГч в отсутствии и в присутствии варьирующих концентраций немеченого ХГч дикого типа или межцепочечных ХГч. Кривые смещения представлены как процент максимального связывания при каждой дозе немеченого гормона.
Фигура 7: Биологическая активность in vitro молекул ХГч дикого типа и межцепочечного ХГч. Содержание внеклеточной цАМФ измерялось с помощью радииммунного анализа после стимуляции клеток CHO, стабильно экспрессирующих рецептор ЛГ/ХГ человека.
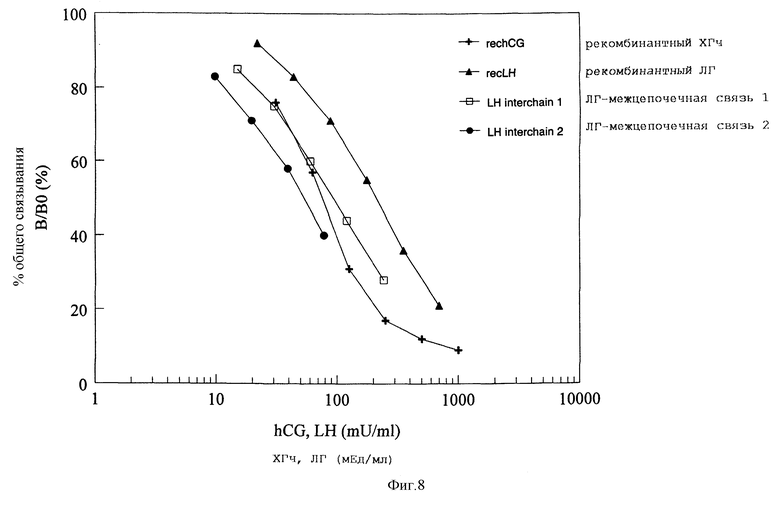
Фигура 8: Активность связывания ХГч дикого типа, ЛГ дикого типа и межцепочечных мутантов ЛГ с мембранами клеток CHO, стабильно экспрессирующими рецептор ЛГ/ХГ человека. Мембраны инкубировались с меченным I125 ХГч в отсутствии или присутствии варьирующих концентраций немеченого ХГч дикого типа, ЛГ дикого типа или межцепочечных ХГч. Кривые смещения представлены как процент максимального связывания при каждой дозе немеченного гормона.
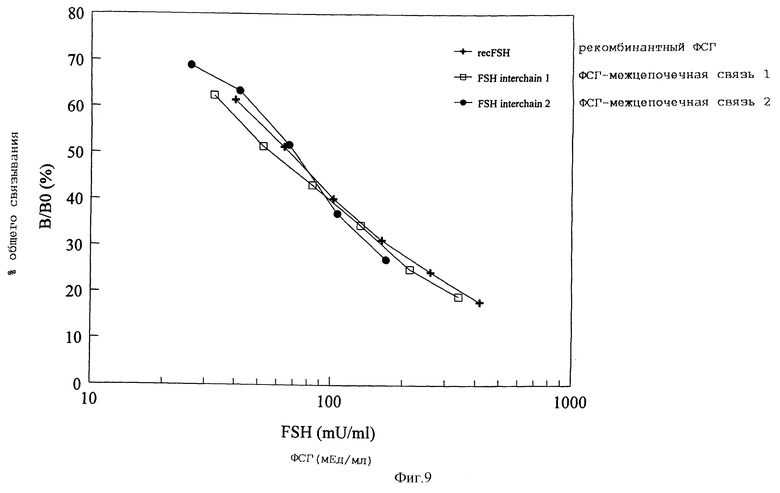
Фигура 9. Активность связывания ФСГ дикого типа и межцепочечных мутантов ФСГ с мембранами клеток CHO, стабильно экспрессирующих рецептор ЛГ/ХГ человека. Мембраны инкубировались с меченным I125 ФСГ в отсутствии или присутствии варьирующих концентраций немеченого ФСГ дикого типа или межцепочечных ФСГ. Кривые смещения представлены как процент максимального связывания при каждой дозе немеченого гормона.
Примеры
Пример 1.
Конструкция межцепочечных мутеинов
Конструирование вектора
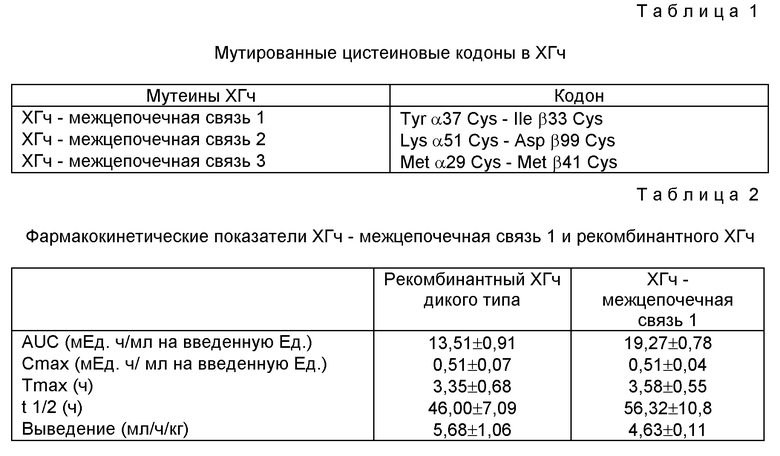
Для экспрессии мутеинов ХГч, содержащих дополнительную межцепочечную дисульфидную связь, были генерированы три конструкции. Их структура и общая организация в целом идентична таковой pKMS hCGαgβc, вектора, использованного для экспрессии рекомбинантного ХГч дикого типа в клетках CHO (фигура 1). Соответствующие гены α (Fiddes, J.C. & Goodman, H.M., J. Mol. Appl. Genet., 1981, Vol. 1. pp. 3-18) и β-субъединиц ХГч (Fiddes, J.C. & Goiodman, H.M., Nature, 1980, Vol. 286, pp. 648-687) были вставлены в pKMS. Путем комбинирования клона кДНК с геномным клоном был получен полный "гибридный" ген ХГч α (Van Wesenbeek et al., 1990), способный после трансфекции в клетку-хозяина экспрессировать субъединицу α дикого типа, кДНК для ХГчβ был выделен, как описано, и заменен ФСГβ в векторе pKMS.FSH. Транскрипция гена α направлена от раннего промотора SV40, тогда как ген β транскрибирован с промотора IIa металлотионеина человека, индуцируемого тяжелыми металлами. Были созданы три межцепочечных конструкции ХГч (таблица 1).
Для конструирования мутации субъединицы α в ХГч-межцепочечная связь 1, специфические замещения оснований были введены в "гибридный" ген ХГчα таким образом, что кодон, кодирующий тирозин α37, был замещен на кодон, кодирующий цистеин. Это было выполнено путем сайт-специфичного мунтагенеза и комбинирования ПЦР-фрагментов, которые перекрывают друг друга в последовательностях, как описано в работе (Erich, H.A. "PCR Technology, Principles and Applications for DNA Amplification". Atockton Press, New-York, 1980, pp. 63-66), с использованием стандартных условий ПЦР. ПЦР-фрагменты были отделены, субклонированы в pGEM3Z и проверены с использованием "Автоматического секвенатора" (Pharmacia). Праймеры были выбраны таким образом, чтобы субклонированный ПЦР-фрагмент содержал соответствующие участки рестрикции как 3', так и 5' мутации (мутаций) таким образом, что его можно было заменить последовательностью нативной α цепи в pKSM.ХГчαgβc. Это выполнялось с использованием стандартных методик. Для конструирования субъединицы β мутация ХГч-межцепочечная связь 1, специфические замещения оснований были введены в ген ХГчβ таким образом, что кодон, кодирующий изолейцин β33, был заменен клодоном, кодирующим цистеин. Мутагенные ПЦР-реакции, субклонирование и секвенирование были выполнены с использованием способов, сравнимых с таковыми, используемыми для конструирования мутации субъединицы α. Для конструирования конечной плазмиды экспрессии ХГч-межцепочечная связь 1, ген дикого типа ХГчβc был заменен мутированным β-фрагментом ХГч в конструкции
pKSM.ХГчαgβc , которая уже содержала мутацию субъединицы α.
Для конструирования векторов, кодирующих ХГч-межцепочечная связь 2 (в которой кодоны, кодирующие лизин α51 и аспарагин β99, были замещены кодонами, кодирующими цистеин) и ХГч-межцепочечная связь 3 (в которой кодоны, кодирующие метионин α29 и метионин β41, были замещены кодонами, кодирующими цистеин), следовали сравнимой стратегии.
Трансфекция и селекция клеток CHO
Клетки CHO K1 (ATCC CCL61) устойчиво транфецируют 10 мкг pKMS.hCG межцепочечные конструкции с использованием реактива Transfectam reagent (Promega). Отобранную плазмиду, содержащую неомициновый селективный ген, трансфецируют в молярном соотношении 10:1 (избыток межцепочечной конструкции pKMS.hCG), обеспечивая возможность селекции клеток в культурной среде, содержащей G-418 (0,8 мг/мл).
Производят селекцию CHO на секрецию иммунореактивного белка. Культурные супернатанты положительно реагировали в сэндвич-ELISA анализе с использованием α и β специфических моноклональный антител. Анализ культуральных супернатантов методом "Western blot" показал, что межцепочечные мутеины ХГч имеют величину молекулярного веса, сравнимую с таковой рекомбинантного ХГч дикого типа.
Пример 2.
Анализ межсубъединичного дисульфидного образования
Для определения того, окислились ли вновь введенные цистеины в межсубъединичную дисульфидную связь, образцы супернатантов из клеточной культуры G418-резистеинтных трансфекционных пулов растворяют кипячением в буфере образцы, содержащем SDS, подвергают электрофорезу в SDS-полиакриламидном геле и переносят на мембрану PVDF. ХГч визуализируют с помощью иммуноокрашивания моноклональным антителом, направленным против β-субъединицы с последующей инкубацией со вторым антителом, конъюгированным с пероксидазой хрена (HRP) и окрашиванием тетраметилбензидином (ТМБ) /Co++/H2O2. Когда образуется межсубъединичная дисульфидная связь, кипячение образцов в буфере образца, содержащем SDS, будет удерживать две субъединицы вместе, тогда как эти условия солюбилизации вызовут диссоциацию на субъединицы в случае отсутствия образования дисульфидного мостика. В контрольных экспериментах образцы солюбилизируют без восстанавливающего вещества при комнатной температуре (интактный ХГч) и путем добавления β-меркаптоэтанола (βME). В последнем случае происходит денатурация в субъединицы независимо от присутствия межцепочечной дисульфидной связи. Как видно из фигуры 2, панель A, солюбилизация при комнатной температуре в отсутствии βME приводит к выявлению интактного ХГч дикого типа (полоса 3, молекулярная масса приблизительно 50 кД), а также некоторой свободной β-субъединицы (молекулярная масса приблизительно 32 кД). Образцы из ХГч-межцепочечная связь 1 и ХГч-межцепочечная связь 2 также содержат иммунореактивный материал приблизительно в том же количестве, указывая на присутствие интактного мутеина ХГч. После нагревания ХГч дикого типа диссоциирует на субъединицы, о чем свидетельствует исчезновение полосы 50 кД (Панель B, линия 3). Напротив, это не происходит с мутантами ХГч (панель B, линии 1 и 2), указывая на присутствие межмолекулярной ковалентной связи. Добавление βME окончательно доказывает, что межмолекулярная связь между 2 субъединицами обеспечивается дисульфидом, поскольку добавление восстанавливающего вещества диссоциирует ХГч и мутанты в субъединицы (панель C).
Пример 3.
Связывание с рецептором ЛГ/ХГ
Связывание с рецептором ЛГ/ХГ является первым процессом в механизме действия ХГч. Используют рецепторный анализ in vitro для определения относительной прочности связывания с рецепторами межцепочечных мутеинов ХГч посредством перемещения иодилированного ХГч на мембраны семенников крысы (Rao, M.C. et al., Endocrinology, 1977, Vol. 101, pp. 512-523). Для этой цели фиксированное количество [I125] ХГч инкубируют с мембранами семенников крысы и возрастающим количеством пробы при комнатной температуре в течение 18 часов. Для оценки максимального связывания выполняют дополнительные инкубации без образца. Неспецифическое связывание определяют добавлением 1000-кратного избытка немеченого лиганда (Pregnyl, Organon, West Orange, NJ). Инкубацию заканчивают 2-кратным разведением образцов ледяным Трис-буфером с добавлением 0,1% бычьего сывороточного альбумина и центрифугированием при комнатной температуре в течение 5 мин при 150000•N кг-1. После отсасывания супернатанта определяют радиоактивность осадка с помощью гамма-счетчика.
ХГч-межцепочечная связь 1 дает кривую смещения иодированного ХГч, сравнимую с рекомбинантным ХГч дикого типа (см. фигуру 3). Это доказывает, что межсубъединичная дисульфидная связь ХГч-межцепочечная связь 1 не влияет на рецепторное связывание, указывая на то, что конформация этого мутеина, безусловно, сравнима с рекомбинантным ХГч дикого типа. Смещение иодированного ХГч ХГч-межцепочечная связь 2 несколько уменьшено. Вероятно, это связано с тем, что этот межцепочечный дисульфидный мостик расположен в зоне, которая важна для рецепторного связывания и сигнальных процессов.
Пример 4.
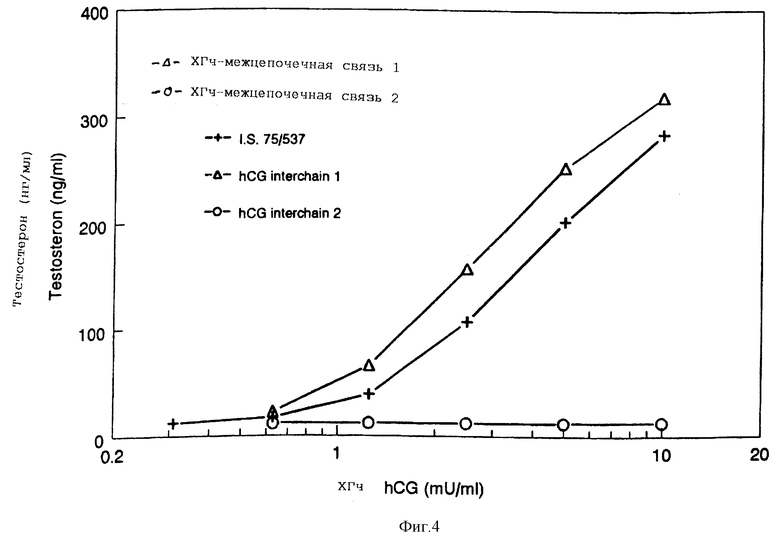
Продукция тестостерона, вызванная ХГч
ХГч индуцирует продукцию тестостерона в мышиных клетках Лейдига. Анализ in vitro (Van Damme et al., Acta Endocrinol., 1974, Vol. 77, pp. 655-671), модифицированный Mannaerts et al., Neuroendocrinology of reproduction, 1987, R. Rolland et al. (eds. ), Elsevier Science Publishers B.V., pp. 49-58), используют для определения биологической активности мутеинов ХГч, содержащих межцепочечные дисульфидные связи (фигура 4). Обработка клеток ХГч-межцепочечная связь 1 приводит к зависимому от дозы увеличению выработки тестостерона с той же активностью, как и под влиянием рекомбинантных ХГч дикого типа. Поэтому ХГч-межцепочечная связь 1 может расцениваться как полный агонист ХГч. Напротив, способность передачи сигнала ХГч-межцепочечная связь 2 была снижена до нуля, свидетельствуя о том, что ХГч-межцепочечная связь 2 может использоваться как полный антагонист ХГч дикого типа.
Пример 5.
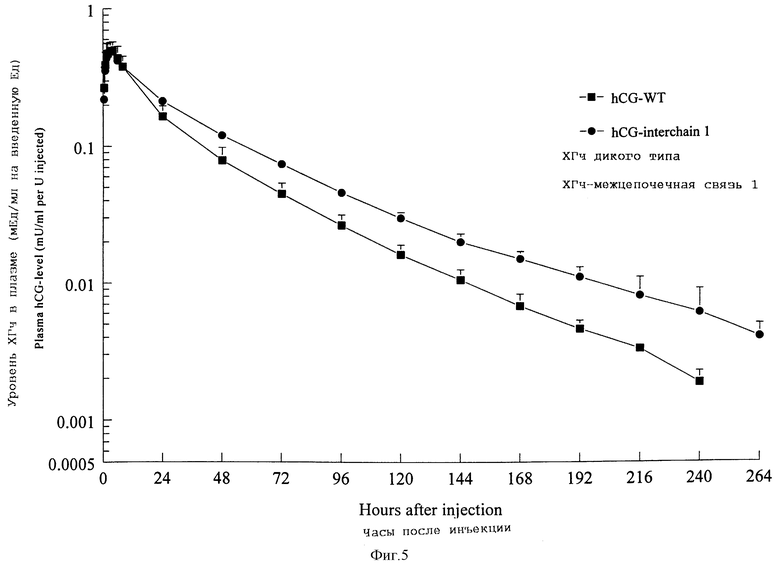
Фармакокинетическое поведение у самок гончих собак
Фармакокинетическое поведение ХГч-межцепочечная связь 1 оценивают после внутримышечного введения самкам гончих собак. Две собаки получали однократную внутримышечную инъекцию ХГч-межцепочечная связь 1 в дозе (иммуноферментный анализ ХГч) ЕД/кг. Пробы крови берут перед инъекцией и через 30 мин, 1, 1,5, 2, 3, 4, 6, 8, 24, 48, 72, 96, 120, 144, 168, 192, 216, 240 и 264 часа после инъекции. Уровни в плазме иммунореактивного ХГч-межцепочечная связь 1 измеряют с помощью ХГч-специфичного флюороиммуноанализа с разрешением во времени (hCG-DELFIA), адаптированного для плазмы собак. Кривые очистки ХГч-межцепочечная связь 1 показаны на фигуре 5. Для сравнения на фигуре 5 также показана кривая очистки ХГч (рекомбинантный ХГч, 25 (ХГч EIA ЕД/кг) после внутримышечного введения трем собакам. Фармакокинетические показатели AUC (площадь под кривой зависимости уровня в плазме от времени, tmax (время достижения максимальной концентрации), t 1/2 (период полувыделения из сыворотки и CL (скорость очистки), полученные по кривым выведения, показаны в таблице 2. Значения, измеренные между временными точками 144 и 240 час используют для определения t 1/2.
Сравнение внутримышечного введения ХГч-межцепочечная связь 1 с внутримышечным введением рекомбинантного ХГч показало более высокие значения AUC и t 1/2 для ХГч-межцепочечная связь 1 и более низкие величины CL, тогда как величины Cmax и tmax были сравнимы. На основании сравнения кинетики ХГч-межцепочечная связь 1 и рекомбинантного ХГч можно придти к заключению, что ХГч-межцепочечная связь 1 проявляет более низкую скорость выведения и более длительный период полувыведения.
Пример 6:
ХГч-межцепочечная связь 4 (Gln α5 Cys - Arg β8 Cys)
Конструкция и экспрессия вектора.
Генерируют конструкцию для экспрессии мутеина ХГч, содержащего другую дополнительную межцепочечную дисульфидную связь. Ее структура и общая организация в значительной степени идентичны таковой pKMS.hCGαgβc (фигура 1), за исключением того, что вводят новые мутации. Вводят специфические замещения оснований в "гибридный" ген ХГчα таким образом, что кодон, кодирующий глютамин α5, заменяют в кодоне, кодирующем цистенин, а в гене, ХГчβ таким образом, что кодон, кодирующий аргинин β8, заменяют в кодоне, кодирующем цистеин. Конструкцию и последующую трансфекцию и селекцию клеток CHO выполняют аналогично тому, как описано для других мутеинов. Анализ белков, как описано в примере 2, показал, что межмолекулярная связь между 2 субъединицами осуществляется дисульфидом.
Биологическая активность
Активность рецепторного связывания и биологическую активность in vitro определяют на рецепторе человека (Jia, X. et al., Molecular Endоcrinoljgy, 1991, Vol. 5. pp. 759-768) по их экспрессии в стабильно трансфецированной линии клеток CHO. Активность рецепторного связывания ХГч-межцепочечная связь 4 количественно определяют с помощью анализа смещения рецептора с использованием радилиганда на фракциях мембраны, выделенных из экспоненциально растущих клеток. В общем объеме 0,5 мл инкубируют приблизительно 100 мкг мембранного белка с фиксированным количеством I125 ХГч (20000 имп./мин, приблизительно 12 пкМ) и возрастающими количествами конкурирующего ХГч в течение 18 часов при температуре окружающей среды. Меченный I125 ХГч (NEX-106) приобретают у компании Du Pont de Nemours. Обычно специфическое связывание составляло 10-12% общего количества добавленного I125 ХГч. После инкубации связанный и свободный гормон сепарируют центрифугированием. В качестве стандарта используют высокоочищенный рекомбинантный ХГч.
ХГч-межцепочечная связь 4 ХГч проявляет смещение иодированного ХГч, которое несколько уменьшено по сравнению с ХГч дикого типа (фигура 6).
ХГч вызывает выработку цАМФ в клетках CHO, содержащих рецептор ЛГ/ХГ человека. Биологический анализ in vitro используют для определения биологической активности ХГч-межцепочечная связь 4 ХГч. Инкубация клеток в течение 4 часов с возрастающими концентрациями ХГч-межцепочечная связь 4 в присутствии 0,1 мМ 3-изобутил-1-метилксантина привела к зависимому от дозы увеличения выработки цАМФ (внеклеточную концентрацию цАМФ определяют с помощью радииммунного анализа (Immunotech), при активности, сравнимой с рекомбинантным ХГч дикого типа (фигура 7). Поэтому ХГч-межцепочечная связь 4 можно рассматривать как полный агонист ХГч.
Пример 7.
ХГч-межцепочечная связь 5 (Arg α35 Cys - Ala β35 Cys)
ХГч-межцепочечная связь 5 получают путем замещений в положении 35 α-цепи и 35 β-цепи, замещая соответственно аргинин и аланин цистеиновыми остатками.
Для выделения иммунореактивного белка выбирают рекомбинантные клетки CHO, как описано для других межцепочечных связей ХГч. Культуральные супернатанты дают положительную реакцию при сэндвич-ELISA анализе ХГч с использованием α и β специфичных моноклональных антител. Межмолекулярная связь между 2 субъединицами обеспечивается дисульфидом, на что указывают данные белкового анализа, как описано в примере 2.
При анализе активности рецепторного связывания находят смещение иодированного ХГч, которое было несколько сниженным по сравнению с ХГч дикого типа (фигура 6). При биологическом анализе in vitro было установлено, что активность ХГч-межцепочечная связь 5 сравнима с таковой рекомбинантного ХГч дикого типа (фигура 7). Поэтому ХГч-межцепочечная связь 5 можно рассматривать как полный агонист ХГч.
Пример 8.
ХГч-межцепочечная связь 8 (His α90 Cys - Cys βy Cys)
ХГч-межцепочечная связь 6 получают замещением в положении 90 α цепи, замещающей гистидин, цистеиновым остатком. Для выделения иммунореактивного белка выбирают рекомбинантные клетки CHO, как описано для других межцепочечных связей ХГч. Культуральные супернатанты дают положительную реакцию при сэндвич-ELISA ХГч с использованием α и β специфичных моноклональных антител. Межмолекулярная связь между 2 субъединицами обеспечивается дисульфидом, на что указывают данные белкового анализа, как описано в примере 2.
При анализе активности рецепторного связывания находят смещение иодированного ХГч, которое было сравнимо с ХГч дикого типа. При биологическом анализе in vitro было установлено, что активностью ХГч-межцепочечная связь 6 можно пренебречь. Поэтому ХГч-межцепочечная связь 6 можно рассматривать как антагонист ХГч.
Пример 9.
ЛГ-межцепочечная связь 1 (Gln α5 Cys - Trp β8 Cys)
Генерируют конструкцию для экспрессии мутеина ЛГ, содержащего дополнительную межцепочечную дисульфидную связь. Выделение кДНК для ЛГ β проводят, как описано ранее (Talmage et al., Nature, 1984, Vol. 307, pp.37-49) и обменивают на ФСГβ в векторе pKMS.FSHαgβg (Van Wesenbeek et al., 1990).
Для конструкции мутации α-цепи в ЛГ-межцепочечную связь 1 вводят специфические замещения оснований в "гибридный" ген α таким образом, чтобы кодон, кодирующий гютамин α5, был заменен на кодон, кодирующий цистеин.
В ЛГβ специфические замещения оснований вводят таким образом, чтобы кодон, кодирующий триптофан β8, был заменен на кодон, колирующий цистеин. Выполняют мутагенные ПЦР, субклонирование и секвенирование с использованием способов, сравнимых со способами, описанными для ХГч. Мутированный белок экспрессируют в трансфецированных клетках CHO K1 (клетках ATCC CCL61). Для выделения иммунореактивного белка выбирают рекомбинантные клетки CHO. Культуральные супернатанты положительно реагировали при сэндвич-ELISA с использованием α и β специфических моноклональных антител. Анализ белка по методу, описанному в примере 2, показывал, что межмолекулярное связывание между 2 субъединицами осуществляется дисульфидом.
Активность рецепторного связывания и биологическую активность in vitro определяют на рецепторе человека по их экспрессии в стабильно трансфецированной линии клеток CHO (Jia, et al.). ЛГ-межцепочечная связь 2 показал смещение иодированного ХГч, которое сравнимо с ЛГ дикого типа (фигура 8).
Пример 10
ЛГ-межцепочечная связь 2 (Arg α35 Cys - Ala β35 Cys)
ЛГ-межцепочечная связь 2 получают путем замещений в положении 35 α-цепи и 35 β-цепи, замещая соответственно аргинин и аланин цистеиновыми остатками.
Для выделения иммунореактивного белка выбирают рекомбинантные клетки CHO, как описано для других межцепочечных связей ХГч. Культуральные супернатанты дают положительную реакцию при сэндвич-ELISA ХГч с использованием α и β специфичных моноклональных антител.
При анализе активности рецепторного связывания находят смещение иодированного ХГч, которое было сравнимо с ХГч дикого типа (фигура 8).
Пример 11.
ФСГ-межцепочечная связь 1 (Gln α5 Cys - Ser β2 Cys)
Генерируют конструкцию для экспрессии мутеина ФСГ, содержащего дополнительную межцепочечную дисульфидную связь. Ее структура и общая организация принципиально идентична таковой pKSM.FSHαgβg вектора, используемого для экспрессии рекомбинантного ФСГ дикого типа в клетках CHO. Вводят замещения оснований в соответствующих положениях аминокислот 5 (Gln) и 2 (Ser) генов субъединиц α и β ФСГ соответственно, что в результате дает кодоны цистеина (последовательность гена β дана в работе Keen et al., Biol. Chem., 1989, Vol. 264, pp. 4769-4775). Для выделения иммунореактивного белка выбирают рекомбинантные клетки CHO. Культуральные супернатанты положительно реагировали при сэндвич-ELISA ФСГ с использованием α и β специфических моноклональных антител.
Активность рецепторного связывания и биологическую активность in vitro определяют на рецепторе человека по их экспрессии в стабильно трансфецированной линии клеток CHO (Minegish et al., Biochem. Biphys. Res. Comm., 1991, Vol. 175, pp. 1125-1130). Активность рецепторного связывания ФСГ-межцепочечная связь 1 количественно определяют с помощью анализа смещения рецептора с использованием радиолиганда на фракциях мембраны, выделенных из экспотенциально растущих клеток. В общем объеме 0,5 мл инкубируют приблизительно 100 мкг мембранного белка с фиксированным количеством I125-ХГч (20000 имп./мин, приблизительно 12 пкМ) и возрастающими количествами конкурирующего ФСГ в течение 18 часов при температуре окружающей среды. Меченный I125 ФСГ (NEX-106) приобретают у компании Du Pont de Nemours. Обычно специфическое связывание составляло 10-12% общего количества добавленного I125 ФСГ. После инкубации связанный и свободный гормон сепарируют центрифугированием. В качестве стандарта используют высокоочищенный рекомбинантный ФСГ (фигура 9).
Пример 12.
ФСГ-межцепочечная связь 2 (Tyr α37 Cys - Trp β27 Cys)
ФСГ-межцепочечная связь 2 получают путем замещений в положении 37 α-цепи и 27 β-цепи, замещая соответственно тирозин и триптофан цистеиновыми остатками.
Для выделения иммунореактивного белка выбирают рекомбинантные клетки CHO, как описано для других межцепочечных связей ХГч. Культуральные супернатанты дают положительную реакцию при сэндвич-ELISA ФСГ с использованием α и β специфичных моноклональных антител.
При анализе активности рецепторного связывания находят смещение иодированного ФСГ, которое было сравнимо с ФСГ дикого типа (фигура 9).



Изобретение относится к гонадотропинам, состоящим из α- и β-субъединиц, причем указанные гонадотропины включают ненативные дисульфидные мостики, предпочтительно, ненативные межсубъединичные дисульфидные мостики. Кроме того, изобретение дает фармацевтические композиции, включающие указанные гонадотропины. Гонадотропины по изобретению имеют повышенную стабильность. 2 с. и 10 з.п.ф-лы, 2 табл., 9 ил.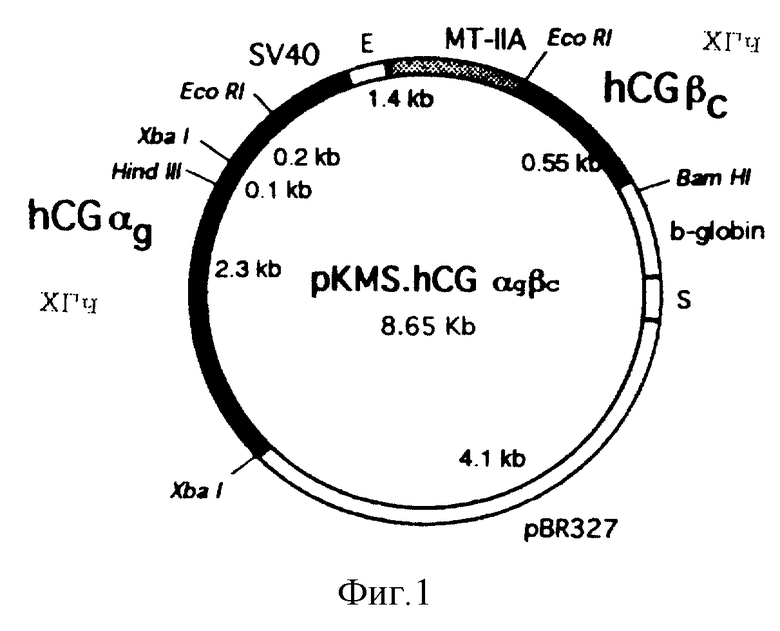
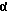 24 Cys - Glyβ66 Cys), (Metα29 Cys - Argβ34 Cys), (Argα35 Cys - Alaβ28 Cys), (Tyrα37 Cys - Ileβ26 Cys), (Lysα51 Cys - Aspβ94 Cys) и (Hisα90 Cys - Cysβy Cys).
24 Cys - Glyβ66 Cys), (Metα29 Cys - Argβ34 Cys), (Argα35 Cys - Alaβ28 Cys), (Tyrα37 Cys - Ileβ26 Cys), (Lysα51 Cys - Aspβ94 Cys) и (Hisα90 Cys - Cysβy Cys).
| Combarnous, Y., Endocrine Reviews, 1992, v | |||
| Насос | 1917 |
|
SU13A1 |
| Пневматический прибор для заправки нити в челнок | 1924 |
|
SU670A1 |
| Способ определения активности фолликулостимулирующего гормона | 1991 |
|
SU1787034A3 |
| Способ получения суспензии гонадотропинов | 1972 |
|
SU464087A3 |
Авторы
Даты
2001-10-10—Публикация
1996-10-23—Подача