Перекрестная ссылка на родственные заявки
В настоящей заявке испрашивается приоритет согласно предварительной заявке США 61/61/352,461, поданной в USPTO 8 июня 2010 года, полное содержание которой включено в данное описание посредством ссылки.
Область изобретения
Настоящее изобретение относится к мутеинам липокалина слезы человека, которые связываются с альфа-рецептором IL-4. Изобретение также относится к соответствующим молекулам нуклеиновой кислоты, кодирующим такой мутеин, и к способу их получения. Данное изобретение также относится к способу получения такого мутеина. И наконец, изобретение относится к фармацевтической композиции, которая содержит такой мутеин липокалина, а также к различным применениям этого мутеина.
Предшествующий уровень техники
Белки, которые селективно связываются с выбранными мишенями посредством нековалентного взаимодействия, играют ключевую роль в качестве реагентов в биотехнологии, медицине, биоаналитике, а также в биологических науках и науках о жизни в целом. Антитела, то есть иммуноглобулины, являются известным примером этого класса белков. Несмотря на разнообразные потребности в таких белках в сочетании с распознаванием, связыванием и/или разделением лигандов/мишеней, в настоящее время используются почти исключительно иммуноглобулины. Использование других белков с определенными лиганд-связывающими характеристиками, например пектинов, оставалось ограниченным специальными областями.
Дополнительными белок-подобными связывающими молекулами, которые обладают антитело-подобными функциями, являются члены семейства липокалинов, которые естественным образом развивались для связывания лигандов. Липокалины встречаются во многих организмах, включая позвоночных, насекомых, растения и бактерии. Члены семейства липокалиновых белков (Pervaiz, S., & Brew, К. (1987) FASEB J. 1, 209-214) обычно являются небольшими секретируемыми белками и имеют одну полипетидную цепь. Они характеризуются рядом различных свойств молекулярного распознавания: способностью связываться с различными, преимущественно гидрофобными молекулами (такими как ретиноиды, жирные кислоты, холестерины, простагландины, биливердины, феромоны, тастанты и одоранты), связыванием со специфическими рецепторами клеточной поверхности и образованием макромолекулярных комполексов. Хотя в прошлом они были классифицированы главным образом как транспортные белки, в настоящее время очевидно, что липокалины выполняют разнообразные физиологические функции. Они включают участие в транспорте ретинола, обоняние, передача сигналов феромонов и синтез простагландинов. Липокалины также вовлечены в регулирование иммунного ответа и опосредование клеточного гомеостаза (обзор смотри, например, в Flower, D.R. (1996) Biochem. J. 318, 1-14, и Flower, D.R. et al. (2000) Biochim. Biophys. Acta 1482, 9-24).
Липокалины демонстрируют необычно низкие уровни общей консервативности последовательностей, часто идентичности последовательностей составляют менее 20%. Напротив, их тип укладки является высококонсервативным. Центральная часть структуры липокалина состоит из одной восьминитевой анти-параллельной β-складки, замкнутой саму на себя с образованием непрерывного водород-связанного β-цилиндра. Этот β-цилиндр формирует центральную полость. Один конец цилиндра стерически блокирован N-концевым пептидным сегментом, который идет вдоль его дна, а также тремя пептидными петлями, соединяющими β-нити. Другой конец β-цилиндра открыт для растворителя и охватывает сайт связывания мишени, который образован четырьмя гибкими пептидными петлями. Именно это разнообразие петель в жестком в других отношениях скелете липокалина обеспечивает разнообразие разных типов связывания, каждый из которых способен вмещать мишени разного размера» формы или химического характера (смотри, например, обзор в Flower, D.R. (1996), выше; Flower, D.R. et al. (2000), выше, или Skerra, A. (2000) Biochim. Biophys. Acta 1482, 337-350).
В международной заявке на патент WO 99/16873 раскрыты полипептиды семейства липокалинов с мутированными аминокислотными положениями в области четырех пептидных петель, которые располагаются в конце цилиндрической структуры β-цилиндра, охватывающей связывающий карман, и которые соответствуют тем сегментам в линейной полипептидной последовательности, которые включают аминокислотный положения с 28 по 45, с 58 по 69, с 86 по 99 и со 114 по 129 билин-связывающего белка Pieris brassicae. Сообщали, что члены семейства липокалинов являются пост-трансляционно модифицированными, например, фосфорилирование и гликозилирование липокалина слезы (например, You, J., et al. (2010) Electrophoresis 31, 1853-1861). Тем не менее, никаких пост-трансляционных модификаций не требуется для их свойств молекулярного распознавания.
В международной заявке на патент WO 00/75308 описаны мутеины билин-связывающего белка, которые специфически связывают дигоксигенин, а международные заявки на патент WO 03/029463 и WO 03/029471 относятся к мутеинам человеческого нейтрофильного желатиназа-ассоциированного липокалина (hNGAL) и аполипопротеина D, соответственно. Для того, чтобы дополнительно улучшить и точно отрегулировать лигандную аффинность, специфичность, а также стабильность укладки варианта липокалина, были предложены различные подходы с использованием различных членов семейства липокалинов (Skerra, A. (2001) Rev. Mol. Biotechnol. 74, 257-275; Schlehuber, S., and Skerra, A. (2002) Biophys. Chem. 96, 213-228), такие как замена дополнительных аминокислотных остатков. В РСТ публикации WO 2006/56464 описаны мутеины человеческого нейтрофильного желатиназа-ассоциированного липокалина со связывающей аффинностью в отношении CTLA-4 в низком наномолярном диапазоне.
В международной заявке на патент WO 2005/19256 описаны мутеины липокалина слезы с по меньшей мере одним связывающим сайтом для разных или одного и того же лиганда-мишени и предложен способ получения таких мутеинов липокалина слезы человека. Согласно этой заявке РСТ, определенные аминокислотные участки в пределах первичной последовательности липокалина слезы, в частности петлевые области, которые включают аминокислоты 7-14, 24-36, 41-49, 53-66, 69-77, 79-84, 87-98 и 103-110 зрелого липокалина слезы человека, подвергают мутагенезу для того, чтобы получить мутеины со связывающими аффинностями. Полученные в результате мутеины имеют связывающие аффинности в отношении выбранного лиганда (Ко) в наномолярном диапазоне, в большинстве случаев более 100 нМ. В международной заявке на патент WO 2008/015239 описаны мутеины липокалина слезы, связывающиеся с данным лигандом неприродного происхождения, включая альфа-рецептор IL-4. Связывающие аффинности находятся в наномлярном диапазоне, составляя почти 1×10-10 М в экспериментах по поверхностному плазменному резонансу.
Липокалин слезы человека (TLPC или Tic), также называемый липокалин-1, пред-альбумин слезы или белок железы вон Эбнера (von Ebner), был первоначально описан как главный белок слезной жидкости человека (приблизительно одна треть общего содержания белка), но также был идентифицирован в некоторых других секреторных тканях, включая предстательную железу, надпочечную железу, тимус, молочную железу, яичко, слизистую оболочку носа и слизистую оболочку трахеи, а также кортикотропы гипофиза. Гомологичные белки были обнаружены у макак-резусов, шимпанзе, крысы, мыши, свиньи, хомяка, коровы, собаки и лошади. Липокалин слезы является необычным липокалиновым членом в том смысле, что он демонстрирует необычно широкую лигандную специфичность по сравнению с другими липокалинами и высокий промискуитет в отношении относительно нерастворимых липидов (смотри Redl, В. (2000) Biochim. Biophys. Acta 1482, 241-248). Этой особенностью липокалина слезы объяснялась функция белка в ингибировании роста бактерий и грибов в роговице. Значительное число липофильных соединений разных химических классов, таких как жирные кислоты, жирные спирты, фосфолипиды, гликолипиды и холестерин, являются эндогенными лигандами этого белка. Интересно, что в противоположность другим липокалинам, сила связывания лиганда (мишени) коррелирует с длиной углеводородного хвоста как для алкиламидов, так и для жирных кислот.Так, липокалин слезы связывает наиболее сильно наименее растворимые липиды (Glasgow, B.J. et al. (1995) Curr. Eye Res. 14, 363-372; Gasymov, O.K. et al. (1999) Biochim. Biophys. Acta 1433, 307-320). 1,8-Å кристаллическая структура липокалина слезы выявила необычно большую полость внутри его β-цилиндра (Breustedt, D.A. et al. (2005) J. Biol. Chem. 280, 1, 484-493).
Несмотря на этот прогресс, было бы желательно иметь мутеин липокалина слезы человека, который имеет улучшенные связывающие свойства в отношении альфа-рецептора IL-4, в частности более высокую связывающую аффинность, просто по причине дополнительного улучшения пригодности мутеинов липокалина слезы человека в диагностических и терапевтических приложениях.
Краткое изложение сущности изобретения
Соответственно, задача изобретения состояла в том, чтобы предложить дополнительный мутеин липокалина слезы человека с высокой аффинностью связывания в отношении альфа-рецептора IL4.
Эта задача решается мутеином липокалина слезы человека с признаками, указанными в формуле изобретения, в частности в п.1.
В первом аспекте настоящего изобретения предложен мутеин липокалина слезы человека. Этот мутеин связывается с альфа-рецептором IL4. Этот мутеин содержит мутированный аминокислотный остаток в любом одном или более чем одном из положений 27, 28, 30, 31, 33, 53, 57, 61, 64, 66, 80, 83, 104-106 и 108 последовательности линейной полипептидной последовательности зрелого липокалина слезы человека. Этот мутеин дополнительно содержит мутированный аминокислотный остаток в любых двух или более чем двух из положений 26, 32, 34, 55, 56, 58 и 63 последовательности линейной полипептидной последовательности зрелого липокалина слезы человека. Аминокислотная последовательность мутеина липокалина слезы человека содержит одну из следующих совокупностей аминокислотных комбинаций: (1) Ser 26, Glu 34, Leu 55, Lys 58, (2) Ser 26, Asn 34, Ala 55, Lys 58, (3) Ser 26, Val 34, (4) Pro 26, Ser 34 (5) Pro 26, Ala 55, (6) Leu 26, Trp 34, Ala 55, (7) Leu 26, Trp 34, lie 58, (8) Asn 26, Asp 34, (9) Asn 26, Ala 55, (10) Tyr 26, His 34, Ala 55, (11) Tyr 26, His 34, Ala 58, (12) Lys 26, Arg 34, Ala 55, (13) Lys 26, Arg 34, Asn 58, (14) Glu 26, Gly 34, Ala 55 или (15) Glu 26, Gly 34, Leu 58.
Термин "положение" при его использовании в соответствии с изобретением означает положение любой аминокислоты в пределах представленной здесь аминокислотной последовательности или положение нуклеотида в пределах представленной здесь нуклеиново-кислотной последовательности. Термин "соответствующее" при его использовании здесь также подразумевает, что положение не является определяемым только числом предшествующих нуклеотидов/аминокислот. Соответственно, положение данной аминокислоты в соответствии с изобретением, которая может быть заменена, может варьировать из-за делеции или вставки аминокислот где-либо в липокалине (мутантном или дикого типа). Аналогично, положение данного нуклеотида в соответствии с настоящим изобретением, который может быть заменен, может варьировать из-за делеций или дополнительных нуклеотидов в каком-либо участке в 5'-нетранслируемой области (UTR) в мутеине или липокалине дикого типа, включая промотор и/или любые другие регулятроные последовательности или ген (включая экзоны и интроны).
Таким образом, под "соответствующим положением" в соответствии с изобретением следует предпочтительно понимать, что нуклеотиды/аминокислоты могут отличаться в указанном номере, но могут все еще иметь сходные соседние нуклеотиды/аминокислоты. Указанные нуклеотиды/аминокислоты, которые могут быть заменены, делегированы или добавлены, также охватываются термином "соответствующее положение".
Конкретно, для того чтобы определить, соответствует ли нуклеотидный остаток или аминокислотный остаток аминокислотной последовательности липокалина, отличного от мутеина липокалина Tic по изобретению, определенному положению в нуклеотидной последовательности или аминокислотной последовательности мутеина липокалина Tic как описано, в частности любой из SEQ ID NO: 2-11, или тех последовательностях, которые имеют одну или более аминокислотных замен в положении 27, 28, 30, 31, 33, 53, 57, 61, 64, 66, 80, 83, 104-106 и 108 линейной полипептидной последовательности Tic (SEQ ID NO: 20), специалист в данной области может использовать средства и способы, хорошо известные в данной области, например выравнивания, либо вручную, либо посредством использования комьютерных программ, таких как BLAST2.0, которая принадлежит Basic Local Alignment Search Tool, или ClustalW, или любую другую приемлемую программу, которая подходит для генерирования выравниваний последовательностей. Соответственно, мутеин липокалина любой из SEQ ID No: 2-11 или имеющий одну или более аминокислотных замен в положении 27, 28, 30, 31, 33, 53, 57, 61, 64, 66, 80, 83, 104-106 и 108 линейной полипептидной последовательности Tic (SEQ ID NO: 20), может служить в качестве "предметной последовательности", тогда как аминокислотная последовательность липокалина, отличного от Tic, служит в качестве "уточняемой последовательности".
Во втором аспекте настоящего изобретения предложен способ получения мутеина липокалина слезы человека. Этот мутеин связывается с альфа-рецептором IL-4. При этом способе молекулу нуклеиновой кислоты,кодирующей липокалин слезы человека, подвергают мутагенезу по любому одному или более положений 27, 28, 30, 31, 33, 53, 57, 61, 64, 66, 80, 83, 104-106 и 108 аминокилотной последовательности линейной полипептидной последовательности зрелого липокалина слезы человека. Далее, при этом способе молекулу нуклеиновой кислоты, кодирующей липокалин слезы человека, подвергают мутагенезу по любым двум или более положениям 26, 32, 34, 55, 56, 58 и 63 аминокислотной последовательности линейной полипептидной последовательности зрелого липокалина слезы человека, по меньшей мере по одному из двух или более положений 26, 32, 34, 55, 56, 58 и 63 аминокислотной последовательности линейной полипептидной последовательности зрелого липокалина слезы человека. В результате получают одну или более нуклеиновых кислот, кодирующих мутеин липокалина слезы человека. Аминокислотная последовательность кодируемого мутеина включает одну из следующих совокупностей комбинаций аминокислот: (1) Ser 26, Glu 34, Leu 55, Lys 58, (2) Ser 26, Asn 34, Ala 55, Lys 58, (3) Ser 26, Val 34, (4) Pro 26, Ser 34, (5) Pro 26, Ala 55, (6) Leu 26, Trp 34, Ala 55, (7) Leu 26, Trp 34, lie 58, (8) Asn 26, Asp 34, (9) Asn 26, Ala 55, (10) Tyr 26, His 34, Ala 55, (11) Tyr 26, His 34, Ala 58, (12) Lys 26, Arg 34, Ala 55, (13) Lys 26, Arg 34, Asn 58, (14) Glu 26, Gly 34, Ala 55, и (15) Glu 26, Gly 34, Leu 58. Способ также включает экспрессирование полученной таким образом одной или более кодирующих мутеин молекул нуклеиновой кислоты в системе экспрессии. Тем самым способ включает получение одного или более мутеинов. Дополнительно этот способ включает обогащение полученных таким образом одного или более мутеинов, которые связываются с альфа-рецептором IL 4, посредством селекции и/или выделения.
В третьем аспекте настоящего изобретения предложена молекула нуклеиновой кислоты. Эта молекула нуклеиновой кислоты включает нуклеотидную последовательность, которая кодирует мутеин согласно первому аспекту.
В четвертом аспекте настоящего изобретения предложена клетка-хозяин. Эта клетка-хозяин содержит молекулу нуклеиновой кислоты согласно третьему аспекту.
В пятом аспекте настоящего изобретения предложена фармацевтическая композиция. Эта фармацевтическая композиция содержит мутеин липокалина слезы человека согласно первому аспекту. Эта фармацевтическая композиция дополнительно содержит фармацевтически приемлемый эксципиент.
Данное изобретение будет более понятным со ссылкой на подробное описание при рассмотрении в сочетании с неограничивающими примерами и сопровождающими их графическими материалами.
Описание графических материалов
На Фиг.1 показана полипептидная последовательность S191.4-B24 мутеина липокалина слезы человека, обладающего аффинностью связывания в отношении альфа-рецептора IL-4.
На Фиг.2 показаны полипептидные последовательности иллюстративных мутеинов с высокой афинностью в отношении альфа-рецептора IL-4 (SEQ ID NOs: 2-11).
На Фиг.3 показано ингибирование пролиферации клеток TF-1 возрастающими количествами мутеинов по изобретению в присутствии IL-4 (А) nlL-13 (B).
На Фиг.4 представлены величины IC50 для Фиг.3 и данные измерений с помощью Biacore связывания мутеинов липокалина слезы человека по изобретению с альфа-рецептором IL-4, таким как человеческий альфа-рецептор IL-4.
Подробное описание изобретения
В настоящем изобретении предложены мутеины липокалина слезы человека, которые обладают особенно высокой афинностью в отношении альфа-рецептора IL-4. Альфа-рецептор IL-4, представляющий собой мишень для мутеина по настоящему изобретению, как правило, является белком млекопитающего, таким как человеческий белок. In vivo альфа-рецептор IL-4 может связывать интерлейкин 4 и интерлейкин 13 с регулированием продукции IgE антител в В-клетках.
Было установлено, что аффинности связывания мутеинов согласно изобретению обычно имеют KD ниже 0,1 нМ и в ряде воплощений примерно 1 пикомоль (пМ) (см. Фиг.4). Мутеины липокалина по изобретению соответственно способны связывать альфа-рецептор IL-4 с обнаружимой аффинностью, то есть с константой диссоциации по меньшей мере 200 нМ. В ряде воплощений мутеин липокалина по изобретению связывает альфа-рецептор IL-4 с константой диссоциации в отношении альфа-рецептора IL-4 по меньшей мере приблизительно 10 нМ, приблизительно 1 нМ, приблизительно 0,1 нМ, приблизительно 10 пМ или даже менее. Аффинность связывания мутеина с выбранной мишенью, в данном случае альфа-рецептором IL-4, может быть измерена и посредством этого могут быть определены величины Ко комплекса мутеин-лиганд с помощью многочисленных способов, известных специалистам в данной области. Такие способы включают, без оганичения ими, флуоресцентное тирование, конкурентный El-ISA (твердофазный иммуноферментный анализ), калориметрические способы, такие как изотермальная титрационная калориметрия (ITC), и поверхностный плазменный резонанс (BIAcore). Примеры таких способов подробно описаны ниже (см., например, Пример 2).
Цепь человеческого альфа-рецептора интерлейкина-4 может иметь аминокислотную последовательность с номером доступа в банке данных SWISS PROT № Р24394 (SEQ ID NO: 18) или ее фрагменты. Иллюстративный пример фрагмента цепи человеческого альфа-рецептора интерлейкина-4 включает аминокислоты с 26 по 232 альфа-рецептора IL-4. Аминокислотная последовательность человеческого альфа-рецептора 1 к IL-13 показана в SEQ IDNO: 19.
В общем, термин "фрагмент", как он используется в данном описании в отношении белковых лигандов мутеинов липокалина слезы по изобретению, относится к N-терминально и/или С-терминально укороченным белковым или пептидным лигандам, которые сохраняют способность полноразмерного лиганда распознаваться и/или связываться мутеином согласно изобретению.
Мутеин липокалина слезы человека, связывающий альфа-рецептор IL-4, может действовать как антагонист IL-4 и/или антагонист IL-13, либо как обратный агонист IL-4 и/или обратный агонист IL-13. Обратный агонист связывается с тем же самым сайтом связывания, что и агонист для конкретного рецептора и уменьшают конститутивную активность соответствующего рецептора. Поскольку о рецепторах IL-4 не сообщалось как об обладающих собственной киназной активностью, постольку мутеин по изобретению может обычно действовать как антагонист IL-4 и/или антагонист IL-13. В одном воплощении мутеины липокалина слезы человека действуют как антагонисты человеческого IL-4 и/или человеческого IL-13. В ряде воплощений мутеин является перекрестно-реагирующим с альфа-рецептором IL-4 яванского макака (Cynomolgus) и как таковой действует как антагонист лигандов Cynomolgus, таких как IL-4 и/или IL-13. В ряде воплощений мутеин является перекрестно-реагирующим с альфа-рецептором IL-4 игрунки (Marmoset) и как таковой действует как антагонист лигандов игрунки, таких как IL-4 и/или IL-13.
Альфа-рецептор IL-4 может быть использован для определения лиганда липокалина слезы человека неприродного происхождения. Термин "лиганд неприродного происхождения" относится к соединению, которое не связывается с нативным зрелым липокалином слезы человека при физиологических условиях. Термин "липокалин слезы человека", как он используется в данном описании, относится к зрелому липокалину слезы человека, соответствующему белку из SWISS-PROT Data Bank с номером доступа Р31025. Зрелый липокалин слезы человека не включает N-терминальный сигнальный пептид, который включен в последовательность из SWISS-PROT с номером доступа Р31025 (смотри Фиг.2).
Аминокислотная последовательность мутеина по изобретению обладает высокой идентичностью последовательности со зрелым липокалином слезы человека при сравнении идентичностей последовательности с другими липокалинами (см. выше). В этом общем контексте аминокислотная последовательность мутеина по изобретению по меньшей мере по существу одинакова с аминокислотной последовательностью зрелого липокалина слезы человека. Соответствующая последовательность мутеина по изобретению, будучи по существу сходной с последовательностями зрелого липокалина слезы человека, имеет в ряде воплощений по меньшей мере 70%-ную, по меньшей мере 75%-ную, по меньшей мере 80%-ную, по меньшей мере 82%-ную, по меньшей мере 85%-ную, по меньшей мере 87%-ную, по меньшей мере 90%-ную идентичность, включая по меньшей мере 95%-ную идентичность, с последовательностью зрелого липокалина слезы человека, при условии, что сохраняется измененное положение или последовательность.
Под "идентичностью" понимают свойство последовательностей, которое измеряет их сходство или соотношение. Идентичность измеряют путем деления количества идентичных остатков на общее число остатков и умножая результат на 100. В качестве двух иллюстративных примеров, мутеин с последовательностью SEQ ID NO: 3 имеет идентичность последовательности 83,3% с аминокислотной последовательностью зрелого липокалина слезы человека, и мутеин с последовательностью SEQ ID NO: 7 имеет идентичность аминокислотной последовательности 82,0% со зрелым липокалином слезы человека.
"Бреши" представляют собой промежутки в выравнивании, которые являются результатом вставок или делеций аминокислот.Так, две копии точно одной и той же последовательности имеют 100%-ную идентичность, но последовательности, которые являются менее высококонсервативными или имеют делеций, вставки или замены, могут иметь более низкую степень идентичности. Специалисту в данной области известно, что для определния идентичности последовательностей доступно несколько компьютерных программ с использованием стандартных параметров, например Blast (Altschul, et al. (1997) Nucleic Acids Res. 25, 3389-3402), Blast2 (Altschul, et al. (1990) J. Mol. Biol. 215, 403-410) или Smith-Waterman (Smith, et al. (1981) J. Mol. Biol. 147, 195-197).
Термин "мутированный" или "мутант" при ссылке на нуклеиновую кислоту или полипептид относится к замене, делеций или вставке одного(ой) или более нуклеотидов или аминокислот, соответственно, по сравнению с существующими в природе нуклеиновой кислотой или полипептидом. Мутеин по настоящему изобретению содержит по меньшей мере три замены при сравнении с соответствующим нативным липокалином слезы человека.
В ряде воплощений мутеин согласно изобретению содержит по меньшей мере две аминокислотных замены, включая 2, 3, 4, 5 или более аминокислотных замен нативной аминокислоты остатком аргинина. Замененная аминокислота в ряде воплощений может быть локализована по любому из положений 27, 30, 57 и 83 касательно аминокислотной последовательности зрелого липокалина слезы человека.
В ряде воплощений мутеин согласно изобретение включает аминокислотную замену нативного остатка цистеина в положениях 61 и/или 153 остатком серина. В этом контексте следует отметить, что было обнаружено, что удаление структурной дисульфидной связи (на уровне библиотеки соответственных наивных нуклеиновых кислот) липокалина слезы дикого типа, которая образована остатками цистеина 61 и 153 (смотри Breustedt, et al., 2005, выше) обеспечивает мутеины липокалина слезы, которые не только стабильно уложены, но кроме этого также способны связывать данный лиганд неприродного происхождения с высокой аффинностью. Не желая ограничиваться теорией, также полагают, что элиминация структурной дисульфидной связи обепечивает дополнительное преимущество обеспечения возможности генерирования (спонтанного) или преднамеренного введения искусственных дисульфидных связей неприродного происхождения в мутеины по изобретению (смотри Примеры), тем самым повышая, например, стабильность этих мутеинов. В ряде воплощений мутеин согласно изобретению содержит аминокислотную замену нативного остатка цистеина в положении 101 остатком серина. Далее, в ряде воплощений мутеин согласно изобретению содержит аминокислотную замену нативного остатка аргинина в положениях 111 остатком пролина. В ряде воплощений мутеин согласно изобретению содержит аминокислотную замену нативного остатка лизина в положениях 114 остатком триптофана.
Мутеин липокалина слезы человека согласно изобретению обычно имеет одну из аминокислот аспарагин, глутаминовая кислота, пролин, лейцин, лизин, серин и тирозин в положении, которое соответствует аминокислотному положению 26 зрелого липокалина слезы человека. В ряде воплощений мутеин по изобретению имеет последовательность, в которой аминокислотное положение 34 является неизмененным относительно зрелого липокалина слезы человека, и где последовательность этого мутеина включает аминокислотные замены Arg 26→Ser, Met 55→Leu, Ser 58→Lys. В ряде воплощений мутеин по изобретению имеет последовательность, которая включает аминокислотные замены Arg 26→Pro и Glu 34→Ser. В ряде воплощений мутеин по изобретению имеет последовательность, которая включает аминокислотные замены Arg 26→Pro и Met 55→Ala. В ряде воплощений мутеин по изобретению имеет последовательность, которая включает аминокислотные замены Arg 26→Ser и Glu 34→Val. В ряде воплощений мутеин по изобретению имеет последовательность, которая включает аминокислотные замены Arg 26→Leu, Glu 34→Trp или Met 55→Ala. В ряде воплощений мутеин по изобретению имеет последовательность, которая включает аминокислотные замены Arg 26→Leu, Glu 34→Trp и Ser 58→IIe. В ряде воплощений мутеин по изобретению имеет последовательность, которая включает аминокислотные замены Arg 26→Ser, Glu 34→Asn, Met 55→Ala и Ser 58→Lys. В ряде воплощений мутеин по изобретению имеет последовательность, которая включает аминокислотные замены Arg 26→Asn и Glu 34→Asp. В ряде воплощений мутеин по изобретению имеет последовательность, которая включает аминокислотные замены Arg 26→Asn и Met 55→Ala. В ряде воплощений мутеин по изобретению имеет последовательность, которая включает аминокислотные замены Arg 26→Tyr, Glu 34→His и Met 55→Ala. В ряде воплощений мутеин по изобретению имеет последовательность, которая включает аминокислотные замены Arg 26→Tyr, Glu 34→His и Ser 58→Ala. В ряде воплощений мутеин по изобретению имеет последовательность, которая включает аминокислотные замены Arg 26→Lys, Glu 34→Arg и Met 55→Ala. В ряде воплощений мутеин по изобретению имеет последовательность, которая включает аминокислотные замены Arg 26→Lys, Glu 34→Arg и Ser 58→Asn. В ряде воплощений мутеин по изобретению имеет последовательность, которая включает аминокислотные замены Arg 26→Glu, Glu 34→Arg и Met 55→Ala. В ряде воплощений мутеин по изобретению имеет последовательность, которая включает аминокислотные замены Arg 26→Glu, Glu 34→Arg и Ser 58→Leu.
В ряде воплощений мутеин липокалина слезы человека по изобретению, который связывает альфа-рецептор IL-4, имеет, при сравнении с аминокислотной последовательностью зрелого липокалина слезы человека, мутированный аминокислотный остаток в положении последовательности 58 или в положении последовательности 63. В ряде воплощений последовательность мутеина по изобретению выбирают таким образом, что, при сравнении с аминокислотной последовательностью зрелого липокалина слезы человека, серин присутствует не в обоих аминокислотных положениях 26 и 34.
Мутеин липокалина может дополнительно содержать, относительно аминокислотной последовательности зрелого липокалина слезы человека, одну или более, включая по меньшей мере две, по меньшей мере три или по меньшей мере четыре аминокислотные замены нативных аминокислотных остатков остатками цистеина в любых из положений 26-28, 30-34, 53, 55-58, 61, 63, 64, 66, 80, 83, 104-106 и 108 нативного зрелого липокалина слезы человека. В ряде воплощений мутеин согласно изобретению содержит аминокислотную замену нативной аминокислоты остатком цистеина в положениях 28 или 105 относительно аминокислотной последовательности зрелого липокалина слезы человека. В ряде воплощений мутеин согласно изобретению содержит аминокислотную замену нативной аминокислоты остатком цистеина в положениях 28 или 105 относительно аминокислотной последовательности зрелого липокалина слезы человека.
В ряде воплощений мутеин согласно изобретение содержит мутированный аминокислотный остаток в любых трех или более, включая 3, 4, 5, 6 или 7, из положений 26, 32, 34, 55, 56, 58 или 63 последовательности линейной полипептидной последовательности зрелого липокалина слезы человека.
В ряде воплощений мутеин липокалина по изобретению имеет мутированный аминокислотный остаток в положении 26, который представляет собой один из следующих: аспарагин, глутамин, пролин, лейцин, лизин, серин и тирозин. В ряде воплощений мутеин липокалина по изобретению имеет мутированный аминокислотный остаток в положении 32, который представляет собой один из следующих: гистидин, лизин, тирозин и валин. В ряде воплощений мутеин липокалина по изобретению имеет мутированный аминокислотный остаток в положении 34, который представляет собой один из следующих: аргинин, аспарагиновая кислота, аспарагин, гистидин, серии, триптофан и валин. В ряде воплощений мутеин липокалина по изобретению имеет мутированный аминокислотный остаток в положении 55, который представляет собой один из следующих: аланин и лейцин. В ряде воплощений мутеин липокалина по изобретению имеет мутированный аминокислотный остаток в положении 56, который представляет собой один из следующих: аланин, глутамин, гистидин, метионин, лейцин и лизин. В ряде воплощений мутеин липокалина по изобретению имеет мутированный аминокислотный остаток в положении 58, который представляет собой один из следующих: аланин, аргинин, аспарагин, гистидин, изолейцин и лизин. В ряде воплощений мутеин липокалина по изобретению имеет мутированный аминокислотный остаток в положении 63, который представляет собой один из следующих: глутамин,лизин, пролин и серин.
В ряде воплощений мутеин согласно изобретению содержит по меньшей мере одну из замен Met 31→Ala, Leu 33→Tyr, Ser 61→Trp, Asp 80→Ser, Glu 104→Leu, His 106→Pro и Lys 108→Gin. В ряде воплощений мутеин согласно изобретению содержит две или более, например 3, 4, 5, 6 или все из следующих замен: Met 31→Ala, Leu 33→Tyr, Ser 61→Trp, Asp 80→Ser, Glu 104→Leu, His 106→Pro и Lys 108→Gin. В ряде воплощений мутеин согласно изобретение содержит замену Val 53→Phe или Val 53→Leu. Мутированный аминокислотный остаток может включать также замену Val 64→Tyr или Val 64→Met. Он может включать также замену Ala 66→Leu или Ala 66→Asp.
В ряде воплощений мутеин липокалина слезы человека согласно изобретению содержит аминокислоту по меньшей мере одного или обоих остатков цистеина, присутствующих в каждом из положений 61 или 153 последовательности, замененную другой аминокислотой, и мутацию по меньшей мере трех аминокислотных остатков по любым из положений 26-28, 30-34, 53, 55-58, 63, 64, 66, 80, 83, 104-106 и 108 последовательности линейной полипептидной последовательности зрелого липокалина слезы человека. Положения 26-28 и 30-34 включены в АВ петлю, положения 53 и 55 локализованы на самом конце бета-слоя, а следующие положения 56-58 включены в CD петлю. Удивительно, что положения 63, 64 и 66 включены в пределах бета-слоя ((3D), и положение 80 локализовано в области α-спирали. Положение 83 представляет собой одиночную определяющую петлю аминокислоту между этой α-спиральной областью и бета-слоем (βF). Положения 104-106 и 108 включены в петлю GH в сайте связывания по открытому концу β-цилиндрической структуры липокалина слезы. Определение этих районов используется в данном описании в соответствии с Flower (Flower, 1996, выше, Flower, et al., 2000, выше) и Breustedt et al. (2005, выше). Такой мутеин может содержать по меньшей мере 2, включая 3, 4, 5, 6, 8, 10, 12, 14, 15, 16, 17 или 18, мутированных аминокислотных остатков в положениях 26-34, 55-58, 63, 64, 80, 83, 104-106 и 108 последовательности линейной полипептидной последовательности зрелого липокалина слезы человека. В ряде воплощений мутеин содержит аминокислотные замены Cys 61→Ala, Phe, Lys, Arg, Thr, Asn, Tyr, Met, Ser, Pro или Trp и Cys 153→Ser или Ala. Такая замена, как показано, полезна для предотвращения образования существующего в природе дисульфидного мостика, связывающего Cys 61 и Cys 153, и, таким образом, для облегчения обработки мутеина. Однако, мутеины липокалина, которые связывают альфа-рецептор IL-4 или которые имеют дисульфидный мостик, образованный между Cys 61 и Cys 153, составляют часть настоящего изобретения.
В ряде воплощений мутеин содержит по меньшей мере одну аминокислотную замену, которая может представлять собой дополнительную аминокислотную замену, выбранную из Arg 111→Pro и Lys 114→Trp. Мутеин по изобретению может дополнительно содержать цистеин в положении 101 последовательности нативного зрелого липокалина слезы человека, замененный другой аминокислотой. Эта замена может, например, представлять собой мутацию Cys 101→Ser или Cys 101→Thr.
Как определено выше, мутеин по изобретению содержит по меньшей мере одну аминокислотную замену, которая локализована в положениях 27, 28, 30, 31, 33, 53, 57, 61, 64, 66, 80, 83, 104-106 и 108 последовательности линейной полипептидной последовательности зрелого липокалина слезы человека. В ряде воплощений мутеин по изобретению содержит две или более, например 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или 16, аминокислотных замен этих положений последовательности зрелого липокалина слезы человека. В одном воплощении мутеин имеет мутированный аминокислотный остаток в каждом из положений 27, 28, 30, 31, 33, 53, 57, 61, 64, 66, 80, 83, 104-106 и 108 последовательности линейной полипептидной последовательности зрелого липокалина слезы человека.
В ряде воплощений мутированный аминокислотный остаток по любому одному или более из положений 27, 28, 30, 31, 33, 53, 57, 61, 64, 66, 80, 83, 104-106 и 108 последовательности линейной полипептидной последовательности зрелого липокалина слезы человека относительно аминокислотной последовательности зрелого липокалина слезы человека содержит одну или более следующих замен: Met 31→Ala, Leu 33→Tyr, Ser 61→Trp, Asp 80→Ser, Glu 104Leu, His 106→Pro и Lys 108→Gin. В ряде воплощений мутеин по изобретению содержит две или более, например 3, 4, 5, 6 или 7 аминокислотных замен в этих положениях последовательности зрелого липокалина слезы человека.
В оставшейся области, то есть области, отличной от положений 26-28, 30-34, 53, 55-58, 63, 64, 66, 80, 83, 104-106 и 108 последовательности, мутеин липокалина по изобретению может содержать аминокислотную последовательность дикого типа (природного) вне положений мутированной аминокислотной последовательности. В ряде воплощений мутеин липокалина согласно изобретению может также нести одну или более аминокислотных мутаций в положении/положениях последовательности в той степени, в которой такая мутация не препятствует, по меньшей мере существенно, или не оказывает отрицательного воздействия на связывающую активность и укладку мутеина. Такие мутации могут быть осуществлены очень легко на уровне ДНК с помощью существующих стандартных способов. Иллюстративными примерами изменений аминокислотной последовательности являются вставки или делеции, а также аминокислотные замены. Такие замены могут быть консервативными, то есть аминокислотный остаток заменяют аминокислотным остатком со сходными химическими свойствами, в частности в отношении полярности, а также размера. Примерами консервативных замен являются замены среди членов следующих групп: 1) аланин, серин и треонин; 2) аспарагиновая кислота и глутаминовая кислота; 3) аспарагин и глутамин; 4) аргинин и лизин; 5) изолейцин, лейцин, метионин и валин; и 6) фенилаланин, тирозин и триптофан. С другой стороны, также возможно вводить неконсервативные изменения в аминокислотную последовательность. Кроме того, вместо замены одного аминокислотный остатка возможно либо вставить, либо удалить одну или более соседних аминокислот первичной структуры липокалина слезы так, чтобы эти делеции или вставки давали в результате стабильно уложенный/функциональный мутеин (смотри, например, экспериментальный раздел, в котором получают мутеины с усеченным N- или С-концом).
Такие модификации аминокислотной последовательности включают направленный мутагенез одиночных аминокислотных положений для того, чтобы просто субклонировать мутированный ген липокалина или его части путем включения сайтов расщепления для определенных рестрикционных ферментов. Кроме того, эти мутации могут также быть включены для дальнейшего улучшения аффинности мутеина липокалина в отношении данной мишени. Более того, мутации могут быть введены для того, чтобы модулировать определенные характеристики мутеина так, чтобы повышать стабильность укладки, стабильность в сыворотке, устойчивость к белкам или растворимость в воде, либо для того, чтобы снизить тенденцию к аггрегированию, если это необходимо. Например, имеющие место в природных условиях остатки цистеина могут быть мутированы в другие аминокислоты, чтобы предотвратить образование дисульфидного мостика. Также возможно сознательно мутировать другое положение аминокислотной последовательности в цистеин для того, чтобы ввести новые реакционноспособные группы, например для конъюгирования с другими соединениями, такими как полиэтиленгликоль (PEG), гидроксиэтилкрахмал (HES), биотин, пептиды или белки, либо для образования отсутствующих в природных условиях дисульфидных связей. Иллюстративные возможности такой мутации для введения остатка цистеина в аминокислотную последовательность мутеина липокалина слезы человека включают следующие замены: Thr 40→Cys, Glu 73→Cys, Arg 90→Cys, Asp 95→Cys и Glu 131→Cys. Полученная тиольная группировка с любой стороны любого из аминокислотных положений 40, 73, 90, 95 и/или 131 может быть использована для РЕСилирования или НЕбилирования мутеина, например, для того, чтобы увеличить период полувыведения из сыворотки соответствующего мутеина липокалина слезы.
Настоящее изобретение также охватывает мутеины, как определено выше, в которых первые четыре N-концевых аминокислотных остатка последовательности зрелого липокалина слезы человека (His-His-Leu-Leu; положения 1-4) и/или последние два С-концевых аминокислотных остатка (Ser-Asp; положения 157-158) последовательности зрелого липокалина слезы человека делегированы (смотри также Примеры и прилагаемые Перечни последовательностей). Другая возможная мутация последовательности дикого типа представляет собой замену аминокислотной последовательности в положениях от 5 до 7 (Ala Ser Asp) последовательности на Gly Gly Asp, как описано в публикации РСТ заявки WO 2005/019256.
В ряде воплощений мутеин липокалина слезы согласно изобретению имеет одну или более, включая 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12, из числа следующих аминокислотных замен в сравнении со зрелым липокалином слезы человека: Glu 27→Arg; Phe 28→Cys; Glu 30→Arg; Met 31→Ala; Leu 33→Tyr; lie 57→Arg; Ser 61→Trp; Asp 80→Ser; Lys 83→Arg; Glu 104→Leu; Leu 105→Cys; His 106→Pro; Lys 108→Gin. В ряде воплощений мутеин включает все эти аминокислотные замены. В ряде воплощений мутеин дополнительно включает совокупность аминокислотных замен Val 53→Phe, Val 64→Tyr, Ala 66→Leu. В других воплощениях мутеин дополнительно включает совокупность аминокислотных замен Val 53→Leu, Val 64→Met, Ala 66→Asp.
В ряде воплощений мутеин липокалина слезы согласно изобретению включает комбинацию аминокислотных замен Arg 26→Ser; Asn 32→Tyr; Met 55→Leu; Leu 56→Gin; Ser 58→Lys в сравнении со зрелым липокалином слезы человека. В ряде воплощений мутеин липокалина слезы согласно изобретению включает комбинацию аминокислотных замен Arg 26→Pro; Asn 32→Tyr; Glu 34→Ser; Met 55→Ala; Leu 56→Gin; Glu 63→Lys в сравнении со зрелым липокалином слезы человека. В ряде воплощений мутеин липокалина слезы согласно изобретению включает комбинацию аминокислотных замен Arg 26→Leu; Asn 32→Phe; Glu 34→Trp; Met 55→Ala; Ser 58→lie; Glu 63→Ser в сравнении со зрелым липокалином слезы человека. В ряде воплощений мутеин липокалина слезы согласно изобретению включает комбинацию аминокислотных замен Arg 26→Ser; Asn 32→Tyr; Glu 34→Val; Met 55→Ala; Leu 56→Ala; Ser 58→Ile; Glu 63→Ser в сравнении со зрелым липокалином слезы человека. В ряде воплощений мутеин липокалина слезы согласно изобретению включает комбинацию аминокислотных замен Arg 26→Ser; Asn 32→Val; Glu 34→Asn; Met 55→Ala; Leu 56→Gin; Ser 58→Lys; Glu 63→Lys в сравнении со зрелым липокалином слезы человека. В ряде воплощений мутеин липокалина слезы согласно изобретению включает комбинацию аминокислотных замен Arg 26→Tyr; Asn 32→Tyr; Glu 34→His; Met 55→Ala; Leu 56→His; Ser 58→Ala; Glu 63→Lys в сравнении со зрелым липокалином слезы человека. В ряде воплощений мутеин липокалина слезы согласно изобретению включает комбинацию аминокислотных замен Arg 26→Lys; Asn 32→Tyr; Glu 34→Arg; Met 55→Ala; Leu 56→Lys; Ser 58→Asn; Glu 63→Pro в сравнении со зрелым липокалином слезы человека. В ряде воплощений мутеин липокалина слезы согласно изобретению включает комбинацию аминокислотных замен Arg 26→Glu; Asn 32→His; Glu 34→Gly; Met 55→Ala; Leu 56→Met; Ser 58→Leu; Glu 63→Lys в сравнении со зрелым липокалином слезы человека.
В ряде воплощений мутеин по изобретению включает, относительно аминокислотной последовательности зрелого липокалина слезы человека, по меньшей мере 6, 8, 10, 12, 14 или 16 аминокислотных замен, выбранных их группы, состоящей из Arg 26→Ser, Pro; Glu 27→Arg; Phe 28→Cys; Glu 30→Arg; Met 31→Ala; Asn 32→Tyr, His; Leu 33→Tyr; Glu 34→Gly, Ser, Ala, Asp, Lys, Asn, Thr, Arg; Leu 56→Gin; lie 57→Arg; Ser 58→lie, Ala, Arg, Val, Thr, Asn, Lys, Tyr, Leu, Met; Asp 80→Ser; Lys 83→Arg; Glu 104→Leu; Leu 105→Cys; His 106→Pro и Lys 108→Gin.
Кроме того, такой мутеин может дополнительно включать по меньшей мере одну аминокислотную замену, выбранную из группы, состоящей из Met 39→Val; Thr 42→Met, Ala; Thr 43→Ile, Pro, Ala; Glu 45→ Lys, Gly; Asn 48→Asp, His, Ser, Thr; Val 53→Leu, Phe, lie, Ala, Gly, Ser; Thr 54→Ala, Leu; Met 55→Leu, Ala, lie, Val, Phe, Gly Thr, Tyr; Glu 63→Lys, Gin, Ala, Gly, Arg; Val 64→Gly, Tyr, Met, Ser, Ala, Lys, Arg, Leu, Asn, His, Thr, lie; Ala 66→lie, Leu, Val, Thr, Met; Glu 69→Lys, Gly; Lys 70→Arg, Gin, Glu; Thr 78→Ala; lie 89→Lei Val; Asp 95→Asn, Ala, Gly и Tyr 100→His.
В одном воплощении мутеин липокалина слезы человека, связывающий альфа-рецептор IL-4, включает следующие аминокислотные замены: Arg 26→Ser, Glu 27→Arg, Phe 28→Cys, Glu 30→Arg; Met 31→Ala, Leu 33→Tyr, Leu 56→Gin, lie 57→Arg, Asp 80→Ser, Lys 83→Arg, Glu 104→Leu, Leu 105→Cys, His 106→Pro и Lys 108→Gin.
В некоторых воплощениях мутеин липокалина слезы человека, связывающий альфа-рецептор IL-4, включает одну из следующих совокупностей аминокислотных замен:
(1) Arg 26→Ser; Glu 27→Arg; Phe 28→Cys; Glu 30→Arg; Met 31→Ala; Asn 32→Tyr; Leu 33→Tyr; Glu 34→Gly; Leu 56→Gin; lie 57→Arg; Ser 58→lie; Asp 80→Ser; Lys 83→Arg; Glu 104→Leu; Leu 105→Cys; His 106→Pro; Lys 108→Gin;
(2) Arg 26→Ser; Glu 27→Arg; Phe 28→Cys; Glu 30→Arg; Met 31→Ala; Asn 32→Tyr; Leu 33→Tyr; Glu 34→Lys; Leu 56→Gin; lie 57→Arg; Ser 58→Asn; Asp 80→Ser; Lys 83→Arg; Glu 104→Leu; Leu 105→Cys; His 106→Pro; Lys108→Gln;
(3) Arg 26→Ser; Glu 27→Arg; Phe 28→Cys, Glu 30→Arg; Met 31→Ala; Asn 32→Tyr; Leu 33→Tyr; Leu 56→Gin; lie 57→Arg; Ser 58→Arg; Asp 80→Ser; Lys 83→Arg; Glu 104→Leu; Leu 105→Cys; His 106→Pro; Lys 108→Gin;
(4) Arg 26→Ser; Glu 27→Arg; Phe 28→Cys; Glu 30→Arg; Met 31→Ala; Asn 32→Tyr; Leu 33→Tyr; Glu 34→Ser; Leu 56→Gin; lie 57→Arg; Asp 80→Ser; Lys 83→Arg; Glu 104→Leu; Leu 105→Cys; His 106→Pro; Lys 108→Gin;
(5) Arg 26→Ser; Glu 27→Arg; Phe 28→Cys; Glu 30→Arg; Met 31→Ala; Asn 32→His; Leu 33→Tyr; Glu 34→Ser; Leu 56→Gin; lie 57→Arg; Ser 58→Ala; Asp 80→Ser; Lys 83→Arg; Glu 104→Leu; Leu 105→Cys; His 106→Pro; Lys 108→Gln;
(6) Arg 26→Ser; Glu 27→Arg; Phe 28→Cys; Glu 30→Arg; Met 31→Ala; Asn 32→Tyr; Leu 33→Tyr; Glu 34→Asp; Leu 56→Gin; lie 57→Arg; Ser 58→Lys; Asp 80→Ser; Lys 83→Arg; Glu 104→Leu; Leu 105→Cys; His 106→Pro; Lys 108→Gln; и
(7) Arg 26→Ser;Glu 27→Arg; Phe 28→Cys; Glu 30→Arg; Met 31→Ala; Asn 32→Tyr; Leu 33→Tyr; Glu 34→Gly; Leu 56→Gin; Ile 57→Arg; Asp 80→Ser; Lys 83→Arg; Glu 104→Leu; Leu 105→Cys; His 106→Pro; Lys 108→Gin.
Мутеин липокалина слезы человека по изобретению может содержать, состоять по существу или состоять из любой аминокислотной последовательности, представленной в SEQ ID NOs: 3-11, или ее фрагмента или варианта. Термин "фрагмент", как он используется в данном описании в отношении мутеинов по изобретению, относится к белкам или пептидам, полученным из полноразмерного зрелого липокалина слезы человека, которые являются укороченными по N-концу и/или С-концу, то есть у которых отсутствует по меньшей мере одна N-концевая и/или С-концевая аминокислота. Такие фрагменты могут содержать по меньшей мере 10, например 20 или 30 либо более последовательных аминокислот первичной последовательности зрелого липокалина слезы человека и обычно являются обнаружимыми в иммуноанализе зрелого липокалина слезы человека.
Термин "вариант" как он используется в настоящем изобретении, относится к производным белка или пептида, которые включают модификации аминокислотной последовательности, например посредством замены, делеции, вставки или химической модификации. Такие модификации в ряде воплощений не снижают функциональность белка или пептида. Такие варианты включают белки, у которых одна или более аминокислот заменены их соответствующими D-стереоизомерами или аминокислотами, отличными от существующих в природе 20 аминокислот, такими как, например, орнитин, гидроксипролин, цитруллин, гомосерин, гидроксилизин, норвалин. Однако такие замены могут также быть консервативными, то есть когда аминокислотный остаток заменен химически сходным аминокислотным остатком. Примерами консервативных замен являются замены среди членов следующих групп: 1) аланин, серин и треонин; 2) аспарагиновая кислота и глутаминовая кислота; 3) аспарагин и глутамин; 4) аргинин и лизин; 5) изолейцин, лейцин, метионин и валин; и 6) фенилаланин, тирозин и триптофан.
Такой мутеин может содержать, относительно аминокислотной последовательности зрелого липокалина слезы человека, по меньшей мере 6, 8, 10, 12, 14 или 16 аминокислотных замен, выбранных из группы, состоящей из Arg 26→Ser; Glu 27→lie; Glu 30→Ser; Met 31→Gly; Asn 32→Arg; Leu 33→lie; Glu 34→Tyr; Leu 56→Lys, Glu, Ala, Met; lie 57→Phe; Ser 58→Arg; Asp 80→Ser, Pro; Lys 83→Glu, Gly; Glu 104→Leu; Leu 105→Ala; His 106→Val и Lys 108→Thr, и может дополнительно содержать по меньшей мере одну аминокислотную замену, выбранную из группы, состоящей из Leu 41→Phe; Glu 63→Lys; Val 64→Met; Asp 72→Gly; Lys 76→Arg, Glu; Ile 88→Val, Thr; lie 89→Thr; Arg 90→Lys; Asp 95→Gly; Phe 99→Leu и Gly 107→Arg, Lys, Glu.
В одном конкретном воплощении такой мутеин содержит следующие аминокислотные замены: Arg 26→Ser, Glu 27→Ile, Glu 30→Ser, Met 31→Gly, Asn 32→Arg, Leu 33→lie, Glu 34→Tyr, lie 57→Phe, Ser 58→Arg, Lys 83→Glu, Glu 104→Leu, Leu 105→Ala, His 106→Val и Lys 108→Thr.
Мутеин липокалина слезы по изобретению может существовать в виде мономерного белка. В ряде воплощений мутеин липокалина согласно изобретению может быть способен к спонтанной димеризации или олигомеризации. Применение мутеинов липокалина, которые образуют стабильные мономеры, может обеспечивать преимущества в ряде приложений, например, из-за более быстрой диффузии и лучшего проникновения в ткани. В других воплощениях применение мутеина липокалина, который спонтанно образует стабильные гомодимеры или мультимеры, может обеспечивать преимущество в силу того, что такие мультимеры могут обеспечивать (дополнительно) увеличенную аффинность и/или авидность в отношении заданной мишени. Кроме того, олигомерные формы мутеина липокалина могут обладать меньшими скоростями диссоциации или пролонгированным периодом полувыведения из сыворотки крови. Если желательна димеризация или мультимеризация мутеинов, которые образуют стабильные мономеры, это может быт достигнуто, например, посредством слияния соответствующих доменов олигомеризации, таких KaKjun-fos домены или лейциновые зипперы, с мутеинами по изобретению, либо посредством использования "Duocalins" (смотри также ниже).
Мутеин липокалина согласно настоящему изобретению может быть получен посредством мутагенеза существующей в природе формы липокалина слезы человека. Термин "мутагенез", как он используется в настоящем описании, означает, что выбраны такие экспериментальные условия, что аминокислоты, естественным образом присутствующие в данном положении последовательности липокалина слезы человека (Swiss-Prot банк данных, номер доступа Р31025) могут быть заменены по меньшей мере одной аминокислотой, которая не присутствует в этом конкретном положении в последовательности соответствующего природного полипептида. Термин "мутагенез" также включает (дополнительную) модификацию длины сегментов последовательности посредством делеции или вставки одной или более аминокислот.Так, в пределах объема изобретения находится ситуация, когда, например, одну аминокислоту в выбранном положении последовательность заменяют посредством совокупности трех случайных мутаций, что приводит к вставке двух аминокислотных остатков по сравнению с длиной соответствующего сегмента белка дикого типа. Такие вставка или делеция могут быть введены независимо друг от друга в любом сегменте пептида, который может быть подвергнут мутагенезу по изобретению. В одном иллюстративном воплощении изобретения вставка нескольких мутаций может быть введена в петлю АВ выбранного липокалинового скелета (см. международную заявку на патент WO 2005/019256, которая включена во всей ее полноте посредством ссылки). Термин "случайный мутагенез" означает, что никакая заранее определенная единичная аминокислота (мутации) не присутствует в определенном положении последовательности, но что по меньшей мере две аминокислоты могут быть включены с определенной вероятностью в заранее определенное положение последовательности в ходе мутагенеза.
Кодирующую последовательность липокалина слезы человека (Redl, В. et al. (1992) J. Biol. Chem. 267, 20282-20287) используют в качестве исходной точки для мутагенеза пептидных сегментов, выбранных в настоящем изобретении. Для мутагенеза перечисленных аминокислотных положений специалист в данной области имеет в своем распоряжении разнообразные разработанные стандартные способы для сайт-направленного мутагенеза. Традиционно применяемой техникой является введение мутаций посредством ПЦР (полимеразная цепная реакция) с помощью смесей синтетических олигонуклеотидов, которые несут вырожденную композицию оснований в желаемых положения последовательности. Например, использование кодона NNK или NNS (где N= аденин, гуанин или цитозин или тимин; К= гуанин или тимин; S= аденин или цитозин) обеспечивает возможность включения всех 20 аминокислот плюс амбер (amber) стоп-кодон в ходе мутагенеза, тогда как кодон WS ограничивает количество возможно включенных аминокислот до 12, поскольку он исключает аминокислоты Cys, lie, Leu, Met, Phe, Trp, Tyr, Val из числа включаемых в выбранное положение полипептидной последовательности; использование кодона NMS (где М= аденин или цитозин), например, ограничивает число возможных аминокислот в выбранном положении последовательности до 11, поскольку он исключает аминокислоты Arg, Cys, Gly, He, Leu, Met, Phe, Trp, Val из числа включаемых в выбранное положение последовательности. В этом отношении следует отметить, что кодоны для других аминокислот (иных, нежели обычные 20 существующих в природе аминокислот), таких как селеноцистеин или пирролизин, также могут быть введены в нуклеиновую кислоту мутеина. Также возможно, как описано by Wang, L, et al. (2001) Science 292, 498-500, или Wang, L, and Schultz, P.G. (2002) Chem. Comm. 1, 1-11, использовать "искусственные" кодоны, такие как UAG, которые обычно распознаются как стоп-кодоны, для того, чтобы вставить другие необычные аминокислоты, например о-метил-L-тирозин или п-аминофенилаланин.
Использование нуклеотидных строительных блоков с пониженной специфичностью спаривания, например инозина, 8-оксо-2'дезоксигуанозина или 6(2-дезокси-□-D-рибофуранозил)-3,4-дигидро-8Н-пиримидино-1,2-оксазин-7-она (Zaccolo et al. (1996) J. Mol. Biol. 255, 589-603), представляет собой другую возможность для введения мутаций в выбранный сегмент последовательности.
Другой возможностью является так называемый триплет-мутагенез. В этом методе используют смеси разных нуклеотидных триплетов, каждый из которых кодирует одну из аминокислот, для включения в кодирующую последовательность (Virnekas В, et al., 1994 Nucleic Acids Res 22, 5600-5607).
Одна возможная стратегия для введения мутаций в выбранные области соответствующих полипептидов основана на использовании четырех олигонуклеотидов, каждый из которых частично получен из одного из соответствующих сегментов последовательности, подлежащих мутированию. При синтезировании этих олигонуклеотидов специалист в данной области может использовать смеси нуклеиново-кислотных строительных блоков для синтеза тех нуклеотидных триплетов, которые соответствуют аминокислотным положениям, подлежащим мутированию, так что кодоны, кодирующие все встречающиеся в природе аминокислоты, возникают случайным образом, что имеет результатом по меньшей мере получение пептидной библиотеки липокалина. Например, первый олигонуклеотид соответствует по своей последовательности, за исключением мутированных положений, кодирующей нити для пептидного сегмента, подлежащего мутированию, не больше чем в N-концевом положении полипептида липокалина. Соответственно, второй олигонуклеотид соответствует некодирующей нити для второго сегмента последовательности, следующего в полипептидной последовательности. Третий олигонуклеотид соответствует, в свою очередь, кодирующей нити для соответствующего третьего сегмента последовательности. И наконец, четвертый олигонуклеотид соответствует некодирующей нити для четвертого сегмента последовательности. Полимеразная цепная реакция может быть осуществлена с соответствующим первым и вторым олигонуклеотидом и отдельно, если необходимо, с соответствующим третьим или четвертым олигонуклеотидом.
Продукты амплификации обеих этих реакций могут быть объединены различными известными способами в отдельную нуклеиновую кислоту, которая содержит последовательность от первого до четвертого сегмента последовательности, в которые были введены мутации в выбранных положениях. И наконец, оба продукта могут, например, быть подвергнуты новой полимеразной цепной реакции с использованием фланкирующих олигонуклеотидов, а также одной или более медиаторных молекул нуклеиновой кислоты, которые составляют последовательность между вторым и третьим сегментом последовательности. В выборе числа или выравнивания в пределах последовательности олигонуклеотидов, используемых для мутагенеза, специалист имеет в своем распоряжении многочисленные альтернативы.
Молекулы нуклеиновой кислоты, определенные выше, могут быть соединены посредством лигирования с недостающими 5'- или 3'-последовательностями нуклеиновой кислоты, кодирующей липокалиновый полипептид и/или вектор, и могут быть клонированы в известном организме-хозяине. Для лигирования и клонирования доступно множество разработанных процедур. Например, в последовательность синтетических олигоонуклеотидов могут быть встроены последовательности распознавания для эндонуклеаз рестрикции, также присутствующие в последовательности клонирующего вектора. Таким образом, после амплификации соотвестствующего PCR продукта и ферментативного расщепления полученный фрагмент может быть легко клонирован с помощью соответствующих последовательностей распознавания.
Более длинные сегменты последовательности в пределах гена, кодирующего белок, выбранный для мутагенеза, могут быть также подвергнуты случайному мутагенезу с помощью известных способов, например, путем использования полимеразной цепной реакции в условиях повышенной степени ошибок, посредством химического мутагенеза или посредством использования бактериальных штаммов-мутаторов. Такие способы могут также быть использованы для дополнительной оптимизации аффинности или специфичности мутеина липокалина в отношении мишени. Мутации, возможно происходящие вне сегментов экспериментального мутагенеза, часто являются допустимыми или даже могут оказаться благоприятными, например, если они вносят вклад в улучшение эффективности укладки или стабильность укладки мутеина липокалина.
В способе согласно изобретению молекулу нуклеиновой кислоты, кодирующую липокалин слезы человека, сначала подвергают мутагенезу по одному или более из положений 27, 28, 30, 31, 33, 53, 57, 61, 64, 66, 80, 83, 104-106 и 108 аминокислотной последовательности линейной полипептидной последовательности зрелого липокалина слезы человека. Затем молекулу нуклеиновой кислоты, кодирующую липокалин слезы человека, также подвергают мутагенезу по двум или более из положений 26, 32, 34, 55, 56, 58 и 63 аминокислотной последовательности линейной полипептидной последовательности зрелого липокалина слезы человека. Из числа этих последних положений аминокислотной последовательности по меньшей мере одно положение, подлежащее мутированию, выбирают из положения 58 аминокислотной последовательности и положения 63 аминокислотной последовательности.
В одном воплощении изобретения способ получения мутеина липокалина слезы человека включает мутирование по меньшей мере 2, 3, 4, 5, 6, 8, 10, 12, 14, 15, 16 или 17 кодонов любых из положений 26-28, 30-34, 53, 55-58, 63, 64, 66, 80, 83, 104-106 и 108 аминокислотной последовательности линейной полипептидной последовательности зрелого липокалина слезы человека. В одном воплощении мутированию подвергают все 22 кодона положений 26, 27, 28, 30, 31, 32, 33, 34, 53, 55, 56, 57, 58, 63, 64, 66, 80, 83, 104, 105, 106 и 108 аминокислотной последовательности линейной полипептидной последовательности зрелого липокалина слезы человека.
В одном вопощении вышеуказанного способа мутированию дополнительно подвергают по меньшей мере 2, 3, 4, 5, 6, 8, 10, 12, 14 или 15 кодонов любых из положений 26-28, 30-34, 53, 55-58, 63, 64, 66, 80, 83, 104-106 и 108 аминокислотной последовательности линейной полипептидной последовательности зрелого липокалина слезы человека.
В другом воплощении изобретения способы согласно изобретению включают мутирование обоих кодонов, кодирующих цистеин в положениях 61 и 153 в линейной полипептидной последовательности зрелого липокалина слезы человека. В одном воплощении положение 61 мутировано так, чтобы кодировать остаток аланина, фенилаланина, лизина, аргинина, треонина, аспарагина, тирозина, метионина, серина, пролина или триптофана, но это только несколько возможностей. В тех воплощениях, где положение 153 подвергнуто мутированию, в положение 153 может быть введена такая аминокислота, каксерин или аланин.
В другом воплощении изобретения как раскрыто в данном описании, кодоны, кодирующие положения 111 и/или 114 аминокислотной последовательности линейной полипептидной последовательности зрелого липокалина слезы человека, подвергнуты мутированию таким образом, чтобы они кодировали, например, аргинин в положении 111 и триптофан в положении 114.
Другое воплощение способов по изобретению включает такой мутагенез кодона, кодирующего цистеин в положении 101 линейной полипептидной последовательности зрелого липокалина слезы человека, чтобы этот кодон кодировал любую другую аминокислоту. В одном воплощении мутированный кодон, кодирующий положение 101, кодирует серин. Соответственно, в ряде воплощений два или все три цистеиновых кодона в положении 61, 101 и 153 заменены кодоном другой аминокислоты.
Согласно способу по изобретению мутеин получают, начиная с нуклеиновой кислоты, кодирующей липокалин слезы человека. Такую нуклеиновую кислоту подвергают мутагенезу и вводят в подходящий бактериальный или эукариотический организм-хозяин посредством технологии рекомбинантной ДНК. Получение библиотеки нуклеиновых кислот липокалина слезы может быть осуществлено с использованием любой подходящей методики, которая известна в данной области для генерирования мутеинов липокалина с антитело-подобными свойствами, то есть мутеинов, которые обладают аффинностью в отношении данной мишени. Примеры таких комбинаторных способов подробно описаны, например, в международных заявках на патенты WO 99/16873, WO 00/75308, WO 03/029471, WO 03/029462, WO 03/029463, WO 2005/019254, WO 2005/019255, WO 2005/019256 и WO 2006/56464. Срдержание каждой из этих заявок на патент включено в данное описание во всей их полноте посредством ссылки. После экспрессии последовательностей нуклеиновых кислот, которые были подвергнуты мутагенезу, в соответствующем хозяине, клоны, несущие генетическую информацию для ряда соответствующих мутеинов липокалина, которые связываются с данной мишенью, могут быть отобраны из полученной библиотеки. Для селекции этих клонов могут быть использованы хорошо известные методики, такие как фаговый дисплей (обзор представлен в Кау, В. К. et al. (1996) выше; Lowman, Н.В. (1997) выше, или Rodi, D.J., and Makowski, L. (1999) выше), скрининг колоний (обзор представлен в Pini, A. et al. (2002) Comb. Chem. High Throughput Screen. 5, 503-510), рибосомный дисплей (обзор представлен в Amstutz, P. et al. (2001) Curr. Opin. Biotechnol. 12, 400-405) или мРНК дисплей, как описано в Wilson, D.S. et al. (2001) Proc. Natl. Acad. Sci. USA 98, 3750-3755, либо способы, специально описанные в WO 99/16873, WO 00/75308, WO 03/029471, WO 03/029462, WO 03/029463, WO 2005/019254, WO 2005/019255, WO 2005/019256 или WO 2006/56464.
Молекулу нуклеиновой кислоты, кодирующую мутеин, экспрессируют, используя любую подходящую систему экспрессии. Полученный(ые) мутеин или мутеины обогащают посредством селекции и/или выделения. Селекция может быть осуществлена, например, в конкурентных условиях. Конкурентные условия, как они используются в данном описании, означают, что селекция мутеинов охватывает по меньшей мере одну стадию, на которой мутеины и данный лиганд липокалина слезы человека неприродного происхождения, то есть альфа-рецептор IL 4, приводят в контакт в присутствии дополнительного лиганда, который конкурирует со связывание мутеинов с альфа-рецептором IL 4. Этот дополнительный лиганд может представлять собой физиологический лиганд этой мишени, например IL 4, избыток самой мишени или любой другой нефизиологический лиганд этой мишени, который связывается по меньшей мере с перекрывающимся эпитопом с эпитопом, распознаваемым мутеинами по изобретению и таким образом мешает связыванию мишени с мутеинами. Альтернативно, дополнительный лиганд конкурирует со связыванием мутеинов посредством комплексообразования с эпитопом, отличным от связывающего сайта мутеинов, с мишенью посредством аллостерических эффектов.
Воплощение техники фагового дисплея (обзор представлен в Кау, В. К. et а1. (1996), выше; Lowman, Н. В. (1997) выше, или Rodi, D.J., & Makowski, L. (1999), выше) с использованием temperent-фага М13 приводится в качестве примера способа селекции, который может быть использован в настоящем изобретении. Другое воплощение технологии фагового дисплея, которое может быть использовано для селекции мутеинов по изобретению, представляет собой технология гиперфагового фага, как описано Broders et al. (Broders et al. (2003) "Hyperphage. Improving antibody presentation in phage display." Methods Mol. Biol. 205:295-302). Также может быть использован другой temperent-фаг, такой как f1, или литический фаг, такой как Т7. В качестве возможного способа селекции, получают фагмиды М13, которые обеспечивают возможность экспрессии последовательности нуклеиновой кислоты мутированного липокалина в виде слитого белка с сигнальной последовательностью на N-конце, такой как OmpA-сигнальная последовательность, и с капсидным белком pIII фага М13 или его фрагментами, способными к включению в фаговый капсид на С-конце. Для продуцирования слитых белков может быть использован С-концевой фрагмент ΔpIII фагового капсидного белка, который включает аминокислоты от 217 до 406 последовательности дикого типа. В одном воплощении используют С-концевой фрагмент pIII, в котором остаток цистеина в положении 201 отсутствует или заменен другой аминокислотой.
Соответственно, дополнительное воплощение способов по изобретению включает функциональное слияние нуклеиновой кислоты, кодирующей один или более мутеинов липокалина слезы человека и являющейся результатом мутагенеза по 3' концу, с геном, кодирующим оболочечный белок pIII нитчатого бактериофага М13-семейства или фрагмент этого оболочечного белка, для того, чтобы отобрать по меньшей мере один мутеин для связывания данного лиганда.
Этот слитый белок может содержать дополнительные компоненты, такие как метка (tag) аффинности, которая обеспечивает возможность иммобилизации, детектирования и/или очистки слитого белка или его частей. Кроме того, между областями последовательности, кодирующими липокалин или его мутеины, и геном фагового капсида или его фрагментами может быть локализован стоп-кодон, где этот стоп-кодон, такой как amber стоп-кодон, по меньшей мере частично транслируется в аминокислоту во время трансляции в подходящем супрессорном штамме.
Например, фагмидный вектор pTLPC27, называемый сейчас pTIc27, который раскрыт в данном описании, может быть использован для получения фагмидной библиотеки, кодирующей мутеины липокалина слезы человека. Молекулы нуклеиновой кислоты по изобретению, кодирующие мутеины липокалина слезы, встраивают в вектор с помощью двух BstXI сайтов рестрикции. После лигирования подходящий штамм-хозяин, такой как Е. coli XLI-Blue, трансформируют полученной смесью нуклеиновых кислот с получением большого числа независимых клонов. Для получения гиперфагмидной библиотеки может быть получен соответствующий вектор, если желательно.
Полученную библиотеку затем суперинфицируют в жидкой культуре соответствующим М13-хелперным фагом или гиперфагом для того, чтобы получить функциональные фагмиды. Рекомбинантная фагмида воспроизводит на своей поверхности мутеин липокалина в виде слияния с оболочечным белком pIII или его фрагментом, тогда как N-концевая сигнальная последовательность слитого белка нормально отщепляется. С другой стороны, она также несет одну или более копий нативного капсидного белка pIII, обеспеченных хелперным фагом, и поэтому способна инфицировать реципиента, обычно бактериальный штамм, несущий F- или F'-плазмиду В случае гиперфагового дисплея, гиперфагмиды воспроизводят на своей поверхности мутеины липокалина в виде слияния с инфективным белком оболочки pIII, но не с нативным капсидным белком. Во время инфекции хелперным фагом или гиперфагом либо после нее может быть индуцирована генная экспрессия слитого белка между мутеином липокалина и капсидным белком pIII, например, посредством добавления ангидротетрациклина. Условия индукции выбирают таким образом, чтобы значительная фракция полученных фагмид воспроизводила на своей поверхности по меньшей мере один мутеин липокалина. В случае гиперфагового дисплея условия индукции имеют результатом популяцию гиперфагмид, несущих от трех до пяти слитых белков, состоящих из мутеина липокалина и капсидного белка pIII. Известны различные способы для выделения фагмид, такие как осаждение с помощью полиэтиленгликоля. Выделение обычно происходит после инкубационного периода, составляющего 6-8 часов.
Выделенные фагмиды затем могут быть подвергнуты селекции путем инкубирования с желаемой мишенью, где эта мишень представлена в такой форме, которая обеспечивает возможность по меньшей мере временной иммобилизации тех фагмид, которые несут на своей оболочке мутеины с желаемой связывающей активностью в виде слитых белоков. Среди различных воплощений, известных специалисту в данной области, мишень может, например, быть сконъюгирована с белком-носителем, таким как сывороточный альбумин, и может быть быть связана через этот белок-носитель с белок-связывающей поверхностью, например полистиролом. Для такой иммобилизации мишени могут, например, быть использованы титрационные микропланшеты, подходящие для методик ELISA (твердофазный иммуноферментный анализ), или так называемые "иммуно-адгезивы". Альтернативно могут быть использованы конъюгаты мишени с другими связывающими группами, такими как биотин. Мишень затем может быть иммобилизована на поверхности, которая селективно связывает эту группу, например на титрационном микропланшете или парамагнитных частицах, покрытых стрептавидином, нейтравидином или авидином. Если мишень слита с Fc частью иммуноглобулина, иммобилизация также может быть достигнута с поверхностями, например титрационными микропланшетами или парамагнитными частицами, которые покрыты белком А или белком G.
Неспецифические фагмид-связывающие сайты, присутствующие на поверхностях, могут быть насыщены блокирующими растворами, как известно для методов ELISA. Затем фагмиды, как правило, приводят в контакт с мишенью, иммобилизированной на поверхности, в присутствии физиологического буфера. Несвязанные фагмиды удаляют посредством многократных промывок. Затем элюируют фагмидные частицы, остающиеся на поверхности. Для элюирования возможно использовать различные методы. Например, фагмиды могут быть элюированы посредством добавления протеаз либо в присутствии кислот, оснований, детергентов или хаотропных солей, либо в умеренно денатурирующих условиях. Один такой способ представляет собой элюирование с помощью буферов с рН 2,2, где элюат затем нейтрализуют.Альтернативно может быть добавлен раствор свободной мишени для того, чтобы конкурировать с иммобилизованной мишенью за связывание с фагмидами или мишень-специфичными фагмидами, которые могли быть элюированы посредством конкурирования с иммуноглобулинами или природными белками-лигандами, которые специфически связываются с представляющей интерес мишенью.
После этого клетки Е. coli инфицируют элюированными фагмидами. Альтернативно нуклеиновые кислоты могут быть экстрагированы из элюированных фагмид и использованы для анализа последовательностей, амплификации или трансформации клеток другим образом. Начиная с полученных таким образом клонов Е. coli, свежие фагмиды или гиперфагмиды снова продуцируют посредством суперинфицирования М13 хелперными фагами или гиперфагом согласно способу, описанному выше, и амплифицированные таким образом фагмиды снова подвергают селекции на иммобилизованной мишени. Многократные циклы селекции часто необходимы для того, чтобы получить фагмиды с мутеинами по изобретению в достаточно обогащенной форме. Число циклов селекции в ряде воплощений выбирают таким образом, чтобы в последующем функциональном анализе по меньшей мере 0,1% исследованных клонов продуцировал мутеины с обнаруживаемой аффинностью в отношении заданной мишени. В зависимости от размера, то есть сложности использованной библиотеки, в этом случае обычно требуется от 2 до 8 циклов.
Для функционального анализа отобранных мутеинов штамм Е. coli инфицируют фагмидами, полученными в результате осуществления циклов селекции, и выделяют соответствующую двунитевую фагмидную ДНК. Начиная с этой фазмидной ДНК или также с однонитевой ДНК, экстрагированной из фагмид, последовательности нуклеиновых кислот отобранных мутеинов по изобретению могут быть определегы способами, известными в данной области, и из них могут быть выведены аминокислотные последовательности. Мутированная область последовательности полного мутеина липокалина слезы может быть субклонирована в другой вектор экспрессии и экспрессирована в подходящем организме-хозяине. Например, для экспрессии в штаммах Е. coli, таких как e.coli TG1, может быть использован вектор pTLPC26, сейчас называемый рТ1 с26. Продуцированные таким образом мутеины липокалина слезы могут быть очищены различными биохимическими способами. Мутеин липокалина слезы, продуцированный, например, с помощью рТ1 с26, может нести пептид аффинности, так называемую аффинную метку (tag), например, на своем С-конце, и поэтому может быть очищен с помощью аффинной хроматографии. Примеры аффинной метки включают, но без ограничения ими, биотин, Strep-tag, Strep-tag II (Schmidt et al., выше), олигогистидин, полигистидин, домен иммуноглобулина, мальтоза-связывающий белок, глутатион-3-трансферазу (GST) или кальмодулин-связывающий пептид (СВР).
Некоторые аффинные метки представляют собой гаптены, например, но без ограничения ими, динирофенол и дигоксигенин. Некоторые аффинные метки представляют собой эпитопные метки, такие как FLAG®-пептид (Asp-Tyr-Lys-Asp-Asp-Asp-Asp-Lys-Gly), T7 эпитоп (Ala-Ser-Met-Thr-Gly-Gly-Gln-Gln-Met-Gly), мальтоза-связывающий белок (MBP), HSV эпитоп последовательности GIn-Pro-Glu-Leu-Ala-Pro-Glu-Asp-Pro-Glu-Asp гликопротеина D вируса простого герпеса, эпитоп гемагглутинина (НА) последовательности Tyr-Pro-Tyr-Asp-Val-Pro-Asp-Tyr-Ala, VSV-G эпитоп гликопротеина вируса везикулярного стоматита (Cys-Tyr-The-Asp-lle-Glu-Met-Asn-Arg-Leu-Lys), метка Е эпитопа последовательности Gly-Ala-Pro-Val-Pro-Tyr-Pro-Asp-Pro-Leu-Glu-Pro-Arg, метка Е2 эпитопа последовательности Gly-Val-Ser-Ser-Thr-Ser-Ser-Asp-Phe-Arg-Asp-Arg, метка Tag-100 эпитопа С-концов MAPK/ERK киназ млекопитающих последовательности Glu-Glu-Thr-Ala-Arg-Phe-Gln-Pro-Gly-Tyr-Arg-Ser, S-метка последовательности Lys-Glu-Thr-Ala-Ala-Ala-Lys-Phe-Glu-Arg-Gln-His-Met-Asp-Ser, "myc" эпитоп транскрипционного фактора с-тус последовательности Glu-GIn-Lys-Leu-lle-Ser-Glu-Glu-Asp-Leu, и малый V5 эпитоп, присутствующий на Р и V белках парамиксовируса Simian Virus 5 (Gly-Lys-Pro-lle-Pro-Asn-Pro-Leu-Leu-Gly-Leu-Asp-Ser-Thr). Кроме того может быть использована, но как правило, не в качестве единственной метки, метка, повышающая растворимость метка, такая как NusA, тиоредоксин (TRX), малый убиквитин-подобный модификатор (SUMO) и убиквитин (Ub). Гаптены и эпитопные метки могут быть использованы в комбинации с соответствующим антителом или антитело-подобной белковой молекулой в качестве партнера связывания. Эпитоп S-пептида последовательности Lys-Glu-Thr-Ala-Ala-Ala-Lys-Phe-Glu-Arg-Gln-His-Met-Asp-Ser может быть использован в качестве эпитопной метки в сочетании с соответствующим антителом или в комбинации с S-белком в качестве партнера связывания (Hackbarth, JS, et al., BioTechniques (2004) 37, 5, 835-839).
Селекция также может быть осуществлена с помощью других способов. Многочисленные соответствующие воплощения известны специалисту в данной области или описаны в литературе. Кроме того, может быть использована комбинация способов. Например, клоны, отобранные или по меньшей мере обогащенные посредством "фагового дисплея", могут дополнительно быть подвергнуты "скринингу колоний". Эта процедура обладает тем преимуществом, что могут быть непосредственно выделены индивидуальные клоны в отношении продукции мутеина липокалина слезы с обнаружимой аффинностью связывания в отношении мишени.
В дополнение к использованию Е. coli в качестве организма-хозяина в методике "фагового дисплея" или в способе "скрининга колоний", для этой цели могут быть использованы другие бактериальные штаммы, дрожжи или также клетки насекомых или клетки млекопитающих. В дополнение к селекции мутеина липокалина слезы из случайной библиотеки, как описано выше, развивающие способы, включая ограниченный мутагенез, также могут быть применены для того, чтобы оптимизировать мутеин, который уже обладает некоторой связывающей активностью в отношении мишени, в плане аффинности или специфичности в отношении мишени после повторных циклов скрининга.
Для специалиста совершенно очевидно, что формирование комплекса зависит от многочисленных факторов, таких как концентрация партнеров связывания, присутствие конкурентов, ионная сила буферных систем и так далее. Селекция или обогащение в общем выполняются в условиях, которые обеспечивают возможность выделения мутеинов липокалина, имеющих, в комплексе в желаемой мишенью, константу диссоциации по меньшей мере 200 нМ. Однако стадии промывки или элюирования могут быть осуществлены при варьирущей силе. Также возможна селекция в отношении кинетических характеристик. Например, селекция может быть осуществлена в условиях, которые способствуют образованию комплекса мишени с мутеинами, который демонстрирует медленную диссоциацию от мишени, или, другими словами, низкий показатель koff. Альтернативно, селекция может быть осуществлена в условиях, которые способствуют быстрому образованию комплекса между мутеином и мишенью, или, иными словами, с высоким показателем kon. В качестве дополнительной иллюстративной альтернативы, скрининг может быть осуществлен в условиях, которые осуществляют селекцию в отношении улучшенной термостабильности мутеинов (по сравнению либо с липокалином слезы дикого типа, либо с мутеином, который уже обладает аффинностью в отношении предварительно отобранной мишени).
Как только был отобран мутеин с аффинностью к заданной мишени, дополнительно возможно подвергнуть такой мутеин другому мутагенезу для того, чтобы последовательно отобрать варианты с еще более высокой аффинностью или варианты с улучшенными свойствами, такими как более высокая термостабильность, улучшенная стабильность в сыворотке, термодинамическая стабильность, повышенная растворимость, улучшенное мономерное поведение, повышенная устойчивость против тепловой денатурации, химической денатурации, протеолиза или детергентов и так далее. Этот дополнительный мутагенез, который в случае нацеливания на более высокую аффинность может рассматриваться как "созревание аффинности" in vitro, может быть осущесвлен посредством сайт-специфической мутации, основанной на рациональном дизайне или случайной мутации. Другим возможным подходом для получения более высокой аффинности или улучшенных свойств является использование допускающей ошибки (error-prone) PCR, которая имеет результатом точечные мутации в выбранной области положений последовательности мутеина липокалина. Допускающая ошибки PCR может быть осуществлена в соответствии с любым известным протоколом, таким как описанный Zaccolo et al. (1996) J. Mol. Biol. 255, 589-603. Другие методы случайного мутагенеза, которые пригодны для таких целей, включают мутагенез на основе случайной вставки/делеции (RID) как описано Murakami, H et al. (2002) Nat.Biotechnol. 20, 76-81, или негомологичную случайную рекомбинацию (NRR) как описано Bittker, J. A et al. (2002) Nat. Biotechnol. 20,1024-1029. Если желательно, созревание аффинности также может быть осуществлено согласно процедуре, описанной в WO 00/75308 или Schlehuber, S. et al., (2000) J. Mol. Biol. 297, 1105-1120, где получали мутеины билин-связывающего белка, имеющие высокую аффинность к дигоксигенину.
Мутеин липокалина слезы по изобретению может быть использован для образования комплекса с альфа-рецептором IL 4. Этот мутеин также может быть способен связывать иммуногенный фрагмент альфа-рецептора IL 4. Иммуногенный фрагмент альфа-рецептора JL-4 представляет собой фрагмент, который имеет один или более эпитопов, мимотопов или других антигенных детерминант и поэтому способен индуцировать иммунный ответ, и против которого может вырабатываться антитело. Иммуногенный фрагмент может включать отдельный эпитоп или может иметь множество эпитопов. Поскольку антиген-представляющая система, например белок-носитель, может быть использована для обеспечения размера, необходимого для распознавания иммунной системой, к иммуногенному фрагменту не предъявляется никаких требований в отношении размера. Таким образом, иммуногенный фрагмент может также представвлять собой "гаптен", то есть фрагмент, который не нуждается в том, чтобы быть иммуногенным самому по себе, либо может иметь низкую иммуногенность, в частности благодаря его малой молекулярной массе и соответственно размеру. Как правило, иммуногенный фрагмент может, либо сам по себе, либо будучи представленным на носителе, быть связан иммуноглобулином или Т-клеточным рецептором (TCR) при представлении его молекулами МНС. Как правило, иммуногенный фрагмент, либо сам по себе, либо будучи представленным в форме антиген-представляющей системы, способен индуцировать гуморальный иммунный ответ и/или клеточный иммунный ответ, приводящий, например, к активации В- и/или Т-лимфоцитов.
Мишенью мутеина по изобретению является альфа-цепь рецептора интерлейкина-4, трансмембранного белка, который содержит внеклеточный домен из 207 аминокислот.Существует секретируемая форма внеклеточного домена, slL-4R альфа, которая также известна как CD124 и способна блокировать активности IL-4. Мутеин по изобретению может быть способен связывать альфа-рецептор slL-4, а также любую часть внеклеточного домена альфа-рецептора IL4.
В этом контексте следует также отметить, что на образование комплекса между соответственным мутеином и его лигандом влияют многочисленные разнообразные факторы, такие как концентрации соответственных партнеров связывания, присутствие конкурентов, рН и ионная сила используемой буферной системы и экспериментальный метод, используемый для определения константы диссоциации Ко (например, флуоресцентное титрование, конкурентный ELISA или поверхностный плазменный резонанс в качестве неисчерпывающих примеров), или даже математический алгоритм, который используют для обработки экспериментальный данных.
Таким образом, специалисту в данной области также понятно, что величины Ко (константа диссоциации комплекса, образованного между соответственным мутеином и его лигандом), приведенные в данном описании, могут варьировать в пределах определенного экспериментального диапазона, в зависимости от метода и экспериментальных установок, которые используют для определения аффинности конкретного мутеина липокалина для данного лиганда. Это означает, что может иметь место незначительное отклонение в измеренных величинах KD или доверительный интервал в зависимости от того, например, была ли величина KD определена посредством поверхностного плазменного резонанса (Biacore) или посредством конкурентного ELISA.
В объем настоящего изобретения включены все формы вышеописанных мутеинов, в которые соответственный мутеин был изменен или модифицирован в плане его возможной иммуногенности.
Цитотоксичные Т-клетки распознают пептидные антигены на клеточной поверхности антиген-представляющей клетки в ассоциации с молекулой главного комплекса гистосовместимости (МНС) класса I. Способность пептидов связываться с МНС молекулами является аллель-специфичной и коррелирует с их иммуногенностью. Для того, чтобы снизить иммуногенность данного белка, большое значение имеет возможность предсказания того, какие пептиды в белке имеют потенциал связываться с данной МНС молекулой. Для предсказания связывания данной пептидной последовательности с молекулами МНС класса 1 ранее были описаны подходы, которые задействуют подход компьютерной поточной обработки данных для идентификации потенциальных Т-клеточных эпитопов (Altuvia et al. (1995) J. Mol. Biol. 249, 244-250).
Такой подход также может быть использован для идентификации потенциальных Т-клеточных эпитопов в мутеинах по изобретению, а также для того, чтобы осуществлять селекцию специфического мутеина в зависимости от его предполагаемого использования на основе его предсказанной иммуногенности. Также может быть возможно подвергать области пептида, которые были предсказаны как содержащие Т-клеточные эпитопы, дополнительному мутагенезу для уменьшения или элиминирования этих Т-клеточных эпитопов и тем самым для минимизации иммуногенности. Было описано удаление амфипатических эпитопов из сконструированных генно-инженерным путем антител (Mateo et al. (2000) Hybridoma 19, 6, 463-471), и оно может быть адаптировано для мутеинов по настоящему изобретению.
Полученные таким образом мутеины могут обладать минимизированной иммуногенностью, которая желательна для их применения в терапии и диагностике, так как описано в данном описании ниже.
Для некоторых применений также полезно использовать мутеины по изобретению в меченой форме. Соответственно, изобретение также касается мутеинов липокалина, которые сконъюгированы с меткой, выбранной из группы, состоящей из ферментных меток, радиоактивных меток, окрашенных меток, флуоресцентных меток, хромогенных меток, люминесцентных меток, гаптенов, дигоксигенина, биотина, комплексов металлов, металлов или коллоидного золота. Мутеин также может быть сконъюгирован с низкомолекулярным органическим соединением. Термин "низкомолекулярное органическое соединение", как он использован в данном описании, означает мономерное соединение на основе углерода, которое может иметь алифатические, алициклические и/или ароматические группировки. В типичных воплощениях низкомолекулярное органическое соединение представляет собой органическое соединение, которое имеет основную цепь по меньшей мере из двух атомов углерода, и в ряде воплощений не более чем 7 или 12 вращаемых атомов углерода. Такое соединение имеет молекуляпеую массу в диапазоне от приблизительно 100 до приблизительно 2000 Дальтон, такую как от приблизительно 100 до приблизительно 1000 Дальтон. Оно возможно может содержать один или два атома металла.
В общем возможно метить мутеин липокалина соотвествующим химическим веществом или ферментом, которые прямо или опосредованно генерируют детектируемое соединение или сигнал в химической, физической, оптической или ферментативной реакции. Примером для физической реакции и в то же самое время оптической реакции/маркера является испускание флуоресценции при облучении или испускание рентгеновских лучей при использовании радиоактивной метки. Щелочная фосфатаза, перксидаза хрена или β-галактозидаза являются примерами ферментных меток (и в то же самое время оптических меток), которые катализируют образование хромогенных продуктов реакции. В общем, все метки, традиционно использующиеся для антител (за исключением используемых эксклюзивно с группировкой сахара в Fc части иммуноглобулинов) также могут быть использованы для конъюгирования с мутеинами по настоящему изобретению. Мутеины по изобретению могут также быть сконъюгированы с любым приемлемым терапевтически активным агентом, например, для направленной доставки таких агентов к данной клетке, ткани или органу, или для селективного мечения клеток, например опухолевых клеток, без воздействия на окружающие нормальные клетки. Примеры таких терапевтически активных агентов включают радионуклиды, токсины, небольшие органические молекулы и терапевтические пептиды (такие как пептиды, действующие в качестве агонистов/антагонистов рецептора клеточной поверхности, или пептиды, конкурирующие за сайт связывания белка на данной клеточной мишени). Мутеины липокалина по изобретению могут, однако, также быть сконъюгированы с терапевтически активными нуклеиновыми кислотами, такими как молекулы антисмысловых нуклеиновых кислот, малые интерферирующие РНК, микроРНК и рибозимы. Такие конъюгаты могут быть получены способами, хорошо известными в данной области.
В одном воплощении мутеины по изобретению также могут быть подвергнуты сочетанию с нацеливающей группировкой, которая осуществляет направленную доставку в специфическую область организма для того, чтобы доставлять мутеины по изобретению в желаемую область или площадь в пределах организма. Одним примером того, где такая модификация может быть желательна, является преодоление гемато-энцефалического барьера. Для того, чтобы преодолеть гемато-энцефалический барьер, мутеины по изобретению могут быть подвергнуты сочетанию с группировками, которые способствуют активному транспорту через этот барьер (смотри Gaillard PJ, et al., Diphtheria-toxin receptor-targeted brain drug delivery. International Congress Series, 2005 1277, 185-198 или Gaillard PJ, et al. Targeted delivery across the blood-brain barrier. Expert Opin Drug Deliv. 2005 2, 2, 299-309). Такими группировками являются, например, группировки, имеющиеся в продаже под товарными знаками 2 В-Trans™ (to-BBB technologies BV, Leiden, ML).
Как указано выше, мутеин по изобретению может в ряде воплощений быть сконъюгирован с группировкой, которая увеличивает период полувыведения мутеина из сыворотки крови (в этом отношении смотри также публикацию РСТ заявки WO 2006/56464, где такие стратегии конъюгирования описаны со ссылкой на мутеины липокалина, ассоциированного с человеческой желатиназой нейтрофилов, со связывающей аффинностью в отношении CTLA-4). Группировка, которая увеличивает период полувыведения из сыворотки крови, может представлять собой, например, молекулу полиалкиленгликоля, гидроксиэтилкрахмала, молекулы жирных кислот, таких как пальмитиновая кислота (Vajo & Duckworth 2000, Pharmacol. Rev. 52, 1-9), Fc часть иммуноглобулина, CH3 домен иммуноглобулина, СН4 домен иммуноглобулина, альбумин или его фрагмент, альбумин-связывающий пептид или альбумин-связывающий белок, трансферрин. Альбумин-связывающий белок может представлять собой бактериальный альбумин-связывающий белок, антитело, фрагмент антитела, включая однодоменные антитела (смотри патент США 6,696,245, например), или мутеин липокалина со связывающей активностью в отношении альбумина. Соответственно, подходящие партнеры конъюгирования для увеличения периода полувыведения мутеина липокалина по изобретению включают альбумин (Osborn, B.L. et al., 2002, J. Pharmacol. Exp.Ther. 303, 540-548) или альбумин-связывающий белок, например бактериальный альбумин-связывающий домен, такой домен белка G стрептококка (Konig, Т., & Skerra, A. (1998) J. Immunol. Methods 218, 73-83). Другими примерами альбумин-связывающих пептидов, которые могут быть использованы с качестве партнеров для конъюгирования, являются, например, пептиды, имеющие консенсусную последовательность Cys-Xaa1-Xaa2-Xaa3-Xaa4-Cys, где Xaa1 представляет собой Asp, Asn, Ser, Thr, или Trp; Хаа2 представляет собой Asn, Gin, His, Ile, Leu, или Lys; Хааз представляет собой Ala, Asp, Phe, Trp, или Tyr; и Xaa4 представляет собой Asp, Gly, Leu, Phe, Ser, или Thr, как описано в публикации заявки на патент США 2003/0069395 или в Dennis et al. (Dennis, M.S., Zhang, M., Meng, Y.G., Kadkhodayan, M., Kirchhofer, D., Combs, D. & Damico, L.A. (2002) J Biol Chem 277, 35035-35043).
В других воплощениях сам альбумин или биологически активный фрагмент альбумина может быть использован в качестве партнера для конъюгирования для мутеина липокалина по изобретению. Термин "альбумин" включает все альбумины млекопитающих, такие как человеческий сывороточный альбумин, или бычий сывороточный альбумин, или крысиный альбумин. Альбумин или его фрагмент может быть получен рекомбинантным путем, как описано в патенте США 5,728,553 или в заявках на Европейский патент ЕР 0 330 451 и ЕР 0 361 991. Рекомбинантный человеческий альбумин (Recombumin®) Novozymes Delta Ltd. (Nottingham, UK) может быть сконъюгирован или слит с мутеином липокалина для того, чтобы увеличить период полувыведения мутеина.
Если альбумин-связывающий белок представляет собой фрагмент антитела, он может представлять собой однодоменное антитело. Однодоменные антитела (dAbs) создают для того, чтобы обеспечить возможность точного контроля биофизических свойств или in vivo периода полувыведения для создания оптимального профиля безпасности и эффективности продукта. Однодоменные антитела имеются в продаже, например, от Domantis Ltd. (Cambridge, UK или МА, USA).
При использовании трансферрина в качестве группировки для увеличения периода полувыведения из сыворотки мутеинов по изобретению, мутеины могут быть генетически слиты с N или С концом или ими обоими, негликозилированного трансферрина. Негликозилированный трансферрин имеет период полувыведения порядка 14-17 дней, и слитый с трансферрином белок будет аналогично иметь продленный период полувыведения. Трансферриновый носитель также обеспечивает высокую биодоступность, биораспределение и стабильность в кровотоке. Эта технология коммерчески доступна от BioRexis (BioRexis Pharmaceutical Corporation, PA, USA). Рекомбинантный человеческий трансферрин (DeltaFerrin™) для использования в качестве белка-стабилизатора/партнера для увеличения периода полувыведения также коммерчески доступен от Novozymes Delta Ltd. (Nottingham, UK).
Если часть Fc иммуноглобулина используют для целей пролонгации периода полувыведения мутеинов по изобретению из сыворотки, может быть использована технология SynFusion™, имеющаяся в продаже от Syntonix Pharmaceuticals, Inc (MA, USA). Использование этой технологии Fc-слияния обеспечивает возможность создания биофармацевтических средств длительного действия и может, например, состоять из двух копий мутеина, связанных с Fc областью антитела для улучшения фармакокинетики, растворимотсти или эффективности получения.
Еще одной альтернативой для пролонгации периода полувыведения мутеина по изобретению является слияние с N- или С-концом мутеина по изобретению длинных, неструктурированных, гибких обогащенных глицином последовательностей (например поли-глицина с приблизительно от 20 до 80 последовательными остатками глицина). Этот подход, раскрытый в WO 2007/038619, например, также был назван "rPEG" (рекомбинантный PEG).
Если в качестве партнера для конъюгирования используют полиалкиленгликоль, этот полиалкиленгликоль может быть замещенным, незамещенным, линейным или разветвленным. Он также может представлять собой активированное производное полиалкилена. Примерами подходящих соединений являются молекулы полиэтиленгликоля (PEG), как описано в WO 99/64016, в патенте США 6,177,074 и в патенте США 6,403,564 в отношении интерферона, или как описано для других белков, таких как PEG-модифицированная аспарагиназа, PEG-аденозиндезаминаза (PEG-ADA) или PEG-супероксиддисмутаза (смотри, например, Fuertges et al. (1990) The Clinical Efficacy of Poly(Ethylene Glycol)-Modified Poteins. Release 11, 139-148). Молекулярная масса такого полимера, как полиэтиленгликоль, может варьировать от приблизительно 300 до приблизительно 70000 Дальтон, включая, например, полиэтиленгликоль с молекулярной массой приблизительно 10000, приблизительно 20000, приблизительно 30000 или приблизительно 40000 Дальтон. Более того, как, например, описано в патентах США 6,500,930 и 6,620,413, с мутеином по изобретению с целью пролонгирования периода полувыведения из сыворотки могут быть сконъюгированы углеводные олиго-или полимеры, такие как крахмал или гидроксиэтилкрахмал (HES).
Если одна из вышеописанных группировок сконъюгирована с мутеином липокалина слезы человека по изобретению, благоприятным может быть конъюгирование с боковой цепью аминокислоты. Подходящие аминокислотные боковые цепи могут естественным образом присутствовать в аминокислотной последовательности липокалина слезы человека или могут быть введены посредством мутагенеза. В случае, если подходящий сайт связывания введен посредством мутагенеза, одной возможностью является замена аминокислоты в соответствующем положении остатком цистеина. В одном воплощении такая мутация включает по меньшей мере одну из следующих замен: Thr 40→Cys, Glu 73→Cys, Arg 90→Cys, Asp 95→Cys или Glu 131→Cys. Вновь созданный остаток цистеина по любому из этих положений может в будущем быть использован для конъюгирования мутеина с группировкой, пролонгирующей период полувыведения мутеина из сыворотки, такой как PEG или его активированное производное.
В другом воплощении для того, чтобы обеспечить подходящие аминокислотные боковые цепи для конъюгирования с одной из вышеуказанных группировок с мутеинами по изобретению, посредством мутагенеза могут быть введены искусственные аминокислоты. В общем, такие искусственные аминокислоты сконструированы таким образом, чтобы быть более реакционноспособными и тем самым облегчать конъюгирование с желательной группировкой. Одним примером такой искусственной аминокислоты, которая может быть введена посредством искусственной тРНК, является пара-ацетил-фенилаланин.
Для некоторых применений мутеинов, описанных в данном описании, может быть благоприятным использовать их в форме слитых белков. В ряде воплощений мутеин липокалина слезы человека по изобретению слит по своему N-концу или своему С-концу с белком, белковым домененом или пептидом, таким как сигнальная последовательность и/или метка аффинности.
Для фармацевтических приложений мутеин по изобретению может быть слит с партнером слияния, который продлевает in vivo период полувыведения мутеина из сыворотки (смотри снова РСТ публикацию WO 2006/56464, где подходящие партнеры слияния раскрыты со ссылками на мутеины человеческого ассоциированного с желатиназой нейтрофилов липокалина со связывающей аффинностью в отношении CTLA-4). Аналогично описанным выше конъюгатам, партнер слияния может представлять собой часть Fc иммуноглобулина, CH3 домен иммуноглобулина, СН4 домен иммуноглобулина, альбумин, альбумин-связывающий пептид или альбумин-связывающий белок, и это только немногое из возможных. Опять же, альбумин-связывающий белок может представлять собой бактериальный альбумин-связывающий белок или мутеин липокалина со связывающей активностью в отношении альбумина. Соответственно, подходящие партнеры слияния для увеличения периода полувыведения мутеина липокалина по изобретению, включют альбумин (Osborn, B.L. et al. (2002) supra J. Pharmacol. Exp.Ther. 303, 540-548) или альбумин-связывающий белок, например бактериальный альбумин-связывающий домен, такой как домен стрептококкового белка G (Konig, Т., & Skerra, А. (1998) J. Immuriol. Cnoco6s 218, 73-83). Альбумин-связывающие пептиды, описанные в Dennis et al, выше (2002), или в заявке на патент США 2003/0069395, имеющие консенсусную последовательность Cys-Xaa1-Xaa2-Хаа3-Хаа4-Суз, где Xaa1 представляет собой Asp, Asn, Ser, Thr или Trp; Хаа2 представляет собой Asn, Gin, His, Ile, Leu или Lys; Хааз представляет собой Ala, Asp, Phe, Trp или Tyr; и Хаа4 представляет собой Asp, Gly, Leu, Phe, Ser или Thr, также могут быть использованы в качестве партнера слияния. Также возможно в качестве партнера слияния мутеина липокалина по изобретению использовать сам альбумин или биологически активный фрагмент альбумина. Термин "альбумин" включает все альбумины млекопитающих, такие как человеческий сывороточный альбумин, или бычий сывороточный альбумин, или крысиный сывороточный альбумин. Рекомбинантное продуцирование альбумина или его фрагментов хорошо известно в данной области и раскрыто, например, в патенте США 5,728,553, заявках на европейский патент ЕР 0330451 и ЕР 0361991.
Партнер слияния может придавать мутеину липокалина по изобретению новые характеристики, такие как ферментная активность или связывающая аффинность в отношении других молекул. Примерами подходящих белков слияния являются щелочная фосфатаза, пероксидаза хрена, глутатион-S-трансфераза, альбумин-связывающий домен белка G, белок А, фрагменты антител, олигомеризационные домены, мутеины липокалина с той же самой или другой специфичностью связывания (которые имеют результатом образование "дуокалинов (Duocalins)", смотри Schlehuber, S. and Skerra, A. (2001), Duocalins, engineered ligand-binding proteins with dual specificity derived from the lipocalin fold.В/о/. Chem. 382, 1335-1342) или токсины.
В частности, может быть возможным сливать мутеин липокалина по изобретению с отдельным активным сайтом фермента, так что оба "компонента" полученного слитого белка совместно действуют на данную терапевтическую мишень. Связывающий домен мутеина липокалина присоединяется к вызывающей заболевание мишени, обеспечивая возможность для ферментного домена воздействовать на биологическую функцию мишени.
Метки аффинности, такие как Strep-tag® или Strep-tag® II (Schmidt, T.G.M. et al. (1996) J. Mol. Biol. 255, 753-766), myc-tag, FLAG-tag, Hiss-tag или HA-tag, или белки, такие как глутатион-3-трансфераза, которые также обеспечивают возможность легкого обнаружения и/или очистки рекомбинантных белков, являются дополнительными примерами подходящих партнеров слияния. И наконец, белки с хромогенными или флуоресцентными свойствами, такие как зеленый флуоресцентный белок (GFP) или желтый флуоресцентный белок (YFP), также являются подходящими партнерами слияния для мутеина липокалина по изобретению.
Термин "слитый белок", как он используется в данном описании, включает также мутеины липокалина согласно изобретению, содержащие сигнальную последовательность. Сигнальные последовательности на N-конце полипептида направляют этот полипептид в специфический клеточный компартмент, например в периплазму Е. со// или эндоплазматический ретикулум эукариотических клеток. В уровне техники известно большое число сигнальных последовательностей. Иллюстративной сигнальной последовательностью для секреции полипептида в периплазму Е. со//является ОтрА-сигнальная последовательность.
Настоящее изобретение относится к молекулам нуклеиновых кислот (ДНК и РНК), которые содержат нуклеотидные последовательности, кодирующие мутеины, как они раскрыты в данном описании. Поскольку вырожденность генетического кода дает возможность замены определенных кодонов другими кодонами, определяющими те же самые аминокислоты, данное изобретение не ограничено конкретной молекулой нуклеиновой кислоты, кодирующей мутеин по изобретению, но охватывает все молекулы нуклеиновых кислот, которые содержат нуклеотидные последовательности, кодирующие функциональный мутеин.
Таким образом, настоящее изобретение также включает последовательность нуклеиновой кислоты, кодирующую мутеин согласно изобретению, которая имеет мутацию по меньшей мере в одном кодоне любого из положений 26-34, 56-58, 80, 83, 104-106 и 108 аминокислотной последовательности линейной полипептидной последовательности нативного зрелого липокалина слезы человека, где кодоны, кодирующие по меньшей мере один из остатков цистеина в положениях 61 и 153 последовательности линейной полипептидной последовательности зрелого липокалина слезы человека, были мутированы таким образом, чтобы кодировать любой другой аминокислотный остаток.
Изобретение, как оно раскрыто в данном описании, включает молекулы нуклеиновых кислот, кодирующие мутеины липокалина слезы, которые включают дополнительные мутации вне указанных положений последовательности экспериментального мутагенеза. Такие мутации часто являются допустимыми или даже могут быть благоприятными, например, если они вносят вклад в улучшенную эффективность укладки, стабильность в сыворотке, термостабильность или лиганд-связывающую аффинность мутеина.
Молекула нуклеиновой кислоты, раскрытая в данной заявке, может быть "функциональным образом связана" с ругуляторной последовательностью (или регуляторными последовательностями) для того, чтобы обеспечить возможность экспрессии этой молекулы нуклеиновой кислоты.
Молекула нуклеиновой кислоты, такая как ДНК, упоминается как "способная экспрессировать молекулу нуклеиновой кислоты " или способная "обеспечить возможность экспрессии нуклеотидной последовательности", если она содержит элементы последовательности, которые содержат информацию относительно транскрипционной и/или трансляционной регуляции, и такие последовательности являются "функциональным образом связанными" с нуклеотидной последовательностью, кодирующей полипептид. Функциональная связь представляет собой связь, в которой элементы регуляторной последовательности и последовательность, подлежащая экспрессии, соединены таким образом, который делает возможной экспрессию генов. Точная природа регуляторных областей, необходимых для экспрессии гена, может варьировать между видами, но в общем эти области включают промотор, который в прокариотах содержит как сам промотор, то есть элементы ДНК, направляющие инициацию транскрипции, так и элементы ДНК, которые при их трнскрибировании в РНК будут представлять собой сигнал инициации трансляции. Такие промоторные области обычно включают 5' некодирующие последовательности, вовлеченные в инициацию транскрипции и трансляции, такие как -35/-10 боксы, или элемент Шайна-Далгарно (Shine-Dalgarno) у прокариот, или ТАТА бокс, СААТ последовательности и 5'-кэппирующие элементы у эукариот.Эти области могут также включать энхансерные или репрессорные элементы, а также транслируемый сигнал и лидерные последовательности для направленной доставки нативного полипептида в специфический компартмент клетки-хозяина.
Кроме того, 3' некодирующие последовательности могут содержать регуляторные элементы, вовлеченные в терминацию транскрипции, полиаденилирование и тому подобное. Если, однако, эти последовательности терминации не являются удовлетворительным образом функциональными в конкретной клетке-хозяине, тогда они могут быть заменены сигналами, функциональными в этой клетке.
Таким образом, молекула нуклеиновой кислоты по изобретению может содержать регуляторную последовательность, такую как промоторная последовательность. В ряде воплощений молекула нуклеиновой кислоты по изобретению содержит промоторную последовательность и последовательность терминации транскрипции. Подходящими прокариотическими промоторами являются, например, промотор tet, промотор lacUV5 и промотор Т7. Примерами промоторов, полезных для экспрессии в эукариотических клетках, являются промотор SV40 или промотор CMV.
Молекулы нуклеиновой кислоты по изобретению могут также представлять собой часть вектора или любого другого типа клонирующего носителя, такого как плазмида, фагмида, фаг, бакуловирус, космида или искусственная хромосома.
В одном воплощении молекула нуклеиновой кислоты включена в плазмиду. Плазмидный вектор обозначает вектор, кодирующий внутригенную область умеренного фага, такого как М13 или f1, или его функциональную часть, слитую с представляющей интерес кДНК. После суперинфицирования бактериальных клеток-хозяев таким фагмидным вектором и соответствующим хелперным фагом (например М13К07, VCS-M13 или R408) продуцируются интактные фаговые частицы, тем самым делая возможным физическое сочетание кодируемой гетерологичной кДНК с ее соответствующим полипептидом, выставленным на фаговой поверхности (смотри, например, Lowman, H.B. (1997) Аппи. Rev. Biophys. Biomol. Struct. 26, 401-424, или Rodi, D.J., или Makowski, L. (1999) Curr. Opin. Biotechnol. 10, 87-93).
Такие клонирующие носители могут включать, помимо ругуляторных последовательностей, описанных выше, и последовательности нуклеиновой кислоты, кодирующей мутеин липокалина по изобретению, последовательности репликации и контроля, происходящие из видов, совместимых с клеткой-хозяином, которая используется для экспрессии, а также маркеры селекции, придающие селектируемый фенотип трансформированным или трансфицированным клеткам. В уровне техники известно большое количество подходящих клонирующих векторов, и они имеются в продаже.
Молекула ДНК, кодирующая мутеины липокалина по изобретению, и в частности клонирующий вектор, содержащий кодирующую последовательность такого мутеина липокалина, может быть трансформирована в клетку-хозяина, способную экспрессировать этот ген. Трансформация может быть осуществлена с помощью стандартных методик. Таким образом, изобретение направлено на клетку-хозяина, содержащую молекулу нуклеиновой кислоты, как она раскрыта в данном описании.
Трансформированные клетки-хозяева культивируют в условиях, подходящих для экспрессии нуклеотидной последовательности, кодирующей слитый белок по изобретению. Подходящие клетки-хозяева могут быть прокариотическими, такими как Eschehchia coli (Е. coli) или Bacillus subtilis, либо эукариотическими, такими как клетки-хозяева Saccharomyces cerevisiae, Pichia pastoris, SF9 или High5 клетки насекомых, иммортализированные клеточные линии млекопитающих (например, клетки HeLa или клетки СНО), либо первичные клетки млекопитающих.
Изобретение также относится к способу продуцирования мутеина по изобретению, включающему продуцирование мутеина, фрагмента мутеина или слитого белка мутеина и другого полипептида, начиная с нуклеиновой кислоты, кодирующей мутеин, посредством методов генной инженерии. Этот способ может быть осуществлен in vivo, мутеин может, например, быть продуцирован в бактериальном или эукариотическом организме-хозяине и затем выделен из этого организма-хозяина или его культуры. Также возможно продуцировать белок in vitro, например, путем использования системы in vitro трансляции.
При продуцировании мутеина in vivo нуклеиновую кислоту, кодирующую мутеин по изобретению, вводят в подходящий бактериальный или эукариотический организм-хозяин посредством технологии рекомбинантной ДНК (как уже описывалось выше). Для этой цели клетку-хозяина сначала трансформируют клонирующим вектором, который содержит молекулу нуклеиновой кислоты, кодирующую мутеин по изобретению, используя существующие стандартные способы. Клетку-хозяина затем культивируют в условиях, которые обеспечивают возможность экспрессии гетерологичной ДНК и тем самым синтеза соответствующего полипептида. Затем этот полипептид высвобождают либо из клетки, либо из среды культивирования.
В некоторых мутеинах липокалина по изобретению существующая в природе дисульфидная связь между Cys 61 и Cys 153 удалена. Соответственно, такие мутеины (или любой другой мутеин липокалина слезы, который не содержит внутримолекулярную дисульфидную связь) могут продуцироваться в клеточном компартменте, имеющем восстанавливающую окислительно-восстановительную среду, например в цитоплазме грамотрицательных бактерий. В случае, если мутеин липокалина по изобретению содержит внутримолекулярные дисульфидные связи, может оказаться желательным направлять образующийся полипептид в клеточный компартмент, имеющий окисляющую окислительно-восстановительную среду, используя соответствующую сигнальную последовательность. Такая окисляющая среда может быть обеспечена периплазмой грамотрицательных бактерий, таких как M. coli, во внеклеточном окружении грамположительных бактерий и в просвете эндоплазматического ретикулюма эукариотических клеток и обычно способствует образованию структурных дисульфидных связей. Возможно также, однако, продуцировать мутеин по изобретению в цитозоле клетки-хозяина, такой как Е. coli. В этом случае полипептид может быть либо непосредственно получен в растворимом и уложенном состоянии, либо выделен в форме телец включения с последующей ренатурацией in vitro. Дополнительной возможностью является использование специфических штаммов-хозяев, имеющих оксиляющую внутриклеточную среду, что может тем самым обеспечить возможность образования дисульфидных связей в цитозоле (Venturi M, et al. (2002) J. Mol. Бiol. 315, 1-8).
Однако мутеин по изобретению не обязательно может быть получен или продуцирован только посредством генетической инженерии. Мутеин липокалина может также быть получен посредством химического синтеза, такого как твердофазный полипептидный синтез Меррифильда (Merrifield), или посредством in vitro транскрипции и трансляции. Например, возможно, чтобы перспективные мутации идентифицировали с помощью молекулярного моделирования и затем синтезировали желаемый (сконструированный) полипептид in vitro и исследовали связывающую активность в отношении заданной мишени. Способы твердофазного синтеза и/или синтеза в фазе раствора белков хорошо известны из уровня техники (смотри, например, Bruckdorfer, Т. et al. (2004) Curr. Pharm. Biotechnol. 5, 29-43).
В другом воплощении мутеины по изобретению могут быть продуцированы посредством in vitro транскрипции/трансляции с помощью хорошо разработанных способов, известных специалистам в данной области.
Изобретение также относится к фармацевтической композиции, которая содержит по меньшей мере один мутеин липокалина слезы человека по изобретению, либо его слитый белок, либо конъюгат и фармацевтически приемлемый эксципиент.
Мутеины липокалина согласно изобретению могут быть введены любым парентеральным или непарентеральным (энтеральным) путем, который является терапевтически эффективным для белковых лекарственных средств. Мутеины по изобретению могут быть введены системно или местно в составе композиций, содержащих традиционные нетоксичные фармацевтически приемлемые эксципиенты или носители, добавки и наполнители, как желательно.
В одном воплощении настоящего изобретения фармацевтическое средство вводят парентерально млекопитающему, и в частности человеку. Фармацевтическая композиция может представлять собой водный раствор, эмульсию типа масло-в-воде или эмульсию типа вода-в-масле.
В этом отношении следует отметить, что технологии трансдермальной доставки, например ионофорез, сонофорез или доставка с помощью микроиглы, как описано в Meidan VM and Michniak BB (2004) Am. J. Ther. 11,4, 312-316, также могут быть использованы для трансдермальной доставки раскпытых в данном описании мутеинов. Мутеины по изобретению могут быть введены системно или местно в композициях, содержащих разнообразные традиционные нетоксичные фармацевтически приемлемые эксципиенты или носители, добавки или наполнители.
Используемая дозировка мутеина может варьировать в широких пределах для достижения желательного превентивного эффекта или терапевтического ответа. Она будет, например, зависеть от аффинности соединения в отношении выбранного лиганда, а также от периода полувыведения комплекса между мутеином и лигандом in vivo. Кроме того, оптимальная дозировка будет зависеть от биораспределения мутеина, или его слитого белка, или его конъюгата, пути введения, тяжести заболевания/расстройства, подлежащего лечению, а также от состояния здоровья пациента. Например, когда используют мазь для местного нанесения, может быть использована высокая концентрация мутеина липокалина слезы. Однако, если желательно, мутеин также может быть представлен в композиции отсроченного высвобождения, например в липосомальных дисперсиях или полимерных микросферах на основе гидрогеля, таких как PolyActive™ или OctoDEX™ (смотри Bos et al., Business Briefing: Pharmatech 2003, 1-6). Другими имеющимися в продаже композициями отсроченного высвобождения являются, например, полимеры на основе PLGA (поли(молочная-гликолевая кислота) PR pharmaceuticals), гидрогели на основе PLA-PEG (полимолочная кислота-поли(этиленоксид), Medincell) или полимеры на основе PEA (полиэтилакрилат, Medivas).
Соответственно, мутеины по настоящему изобретению могут быть представлены в виде композиции с использованием фармацевтически приемлемых ингредиентов, а также существующих способов изготовления. Фармацевтическая композиция может также содержать вспомогательные вещества, такие как, например, наполнители, связывающие вещества, увлажняющие агенты, скользящие вещества, стабилизаторы, консерванты, эмульгаторы и, кроме того, растворители или солюбилизаторы или агенты для достижения эффекта депо. Последний заключается в том, что слитые белки могут быть инкорпорированы в системы замедленного или отсроченного высвобождения или направленной доставки, такие как липосомы или микрокапсулы.
Композиции могут быть стерилизованы различным образом, включая фильтрование через удерживающий бактерии фильтр, или посредством включения стерилизующих агентов в форме стерильных твердых композиций, которые могут быть растворены или диспергированы в стерильной воде или другой стерильной среде непосредствоенно перед использованием.
Мутеин липокалина, раскрытый в данном описании, может быть введен в организм, включая пациента - человека, сам по себе или в составе фармацевтической композиции, где он может включать фармацевтически активные ингредиенты или подходящие носители или эксципиент(ы) или может быть смешан с ними. Технологии приготовления композиций и введения соответствующей композиции мутеина липокалина похожи или идентичны технологиям низкомолекулярных соединений, хорошо известных из уровня техники. Иллюстративные пути включают, без ограничения ими, пероральную, трансдермальную или парентеральную доставку.
Композиция, которая содержит мутеин липокалина по изобретению, может, например, быть нанесена на кожу или на рану. В ряде воплощений мутеин липокалина или соответствующая композиция могут быть введены локальным, а не системным образом, например посредством инъекции.
Фармацевтические композиции, содержащие мутеин липокалина по настоящему изобретению, могут быть изготовлены способом, который является сам по себе известным, например посредством методов обычного смешивания, растворения, гранулирования, дражирования, порошкования, эмульгирования, инкапсулирования, захвата или лиофилизации. Фармацевтическая композиция для использования в соответствии с настоящим изобретением может, таким образом, быть приготовлена обычным образом с использованием одного или более физиологически приемлемых носителей, включая эксципиенты и вспомогательные вещества, которые облегчают обработку гидрогеля и/или пептида/пептоида в препараты, которые могут быть использованы фармацевтически. Надлежащая композиция зависит от выбранного пути введения.
Для инъекции мутеин липокалина или соответствующая композиция могут быть приготовлены в виде водных растворов, например в физиологически совместимых буферах, таких как раствор Хэнкса (Hanks's), раствор Рингера (Ringer's) или физиологический солевой буфер. Для введения через слизистые оболочки в композиции используют усилители проникновения, подходящие для барьера, через который должно быть осуществлено проникновение. Такие усилители проникновения хорошо известны в уровне техники.
Для перорального введения мутеин липокалина или соответствующая композиция могут быть легко приготовлены путем объединения их с фармацевтически приемлемыми носителями, хорошо известными в уровне техники. Такие носители обеспечивают возможность приготовления мутеина липокалина или соответствующей композиции, а также фармацевтически активного соединения, когда оно присутствует, в виде таблеток, пилюль, драже, капсул, жидкостей, гелей, сиропов, взвесей, суспензий и тому подобного, для перорального употребления пациентом, подлежащим лечению. Фармацевтические препараты для перорального применения могут быть получены добавлением твердого эксципиента, возможно размола полученной смеси или переработки смеси в гранулы после добавления подходящих вспомогательных веществ, если желательно, с получением ядер таблеток или драже. Подходящими эксципиентами являются, в частности, наполнители, такие как сахара, включая лактозу, сахарозу, маннит или сорбит; препараты целлюлозы, такие как, например, кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, желатин, трагакант, метилцеллюлоза, гидроксипропилметилцеллюлоза, карбоксиметилцеллюлоза натрия и/или поливинилпирролидон (PVP). Если желательно, могут быть добавлены разрыхляющие агенты, такие как поперечносшитый поливинилпирролидон, агар или альгиновая кислота или ее соль, такая как альгинат натрия.
Ядра драже снабжают подходящими покрытиями. Для этой цели могут быть использованы концентрированные растворы Сахаров, которые возможно могут содержать аравийскую камедь, тальк, поливинилпирролидон, гель карбопола, полиэтиленгликоль и/или диоксид титана, расторы лаков или подходящие органические растворители или смеси растворителей. Для идентификации или характеризации разных комбинаций доз активного соединения в покрытия для таблеток и драже могут быть добавлены красители или пигменты.
Фармацевтические препараты, которые могут быть использованы перорально, включают твердые капсулы из двух частей, изготовленные из желатина, а также мягкие запаянные капсулы, изготовленные из желатина и пластификатора, такого как глицерин или сорбит.Твердые капсулы из двух частей капсулы могут содержать активные ингредиенты в смеси с наполнителем, таким как лактоза, связывающим агентом, таким как крахмалы, и/или смазывающими агентами, такими как тальк или стеарат магния, и возможно стабилизаторами. В мягких капсулах пептиды/пептоиды могут быть суспендированы в подходящих жидкостях, таких как жирные масла, жидкий парафин или жидкие полиэтиленгликоли. Кроме того, могут быть добавлены стабилизаторы. Все композиции для перорального введения должны находиться в дозировках, подходящих для такого введения.
Мутеины липокалина могут быть приготовлены для парентерального введения посредством инъекции, например, посредством внутримышечных инъекций или болюсной инъекции либо непрерывной инфузии. Композиции для инъекции могут быть представлены в стандартной лекарственной форме, например в ампулах или многодозовых контейнерах с добавленным консервантом. Соответствующие композиции могут принимать такие формы, как суспензии, растворы или эмульсии в масляных или водных носителях, либо могут содержать вспомогательные агенты, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты.
Субъект, нуждающийся в таком лечении, может представлять собой млекопитающее, такое как человек, собака, мышь, крыса, свинья, обезьяна, такая как игрунка, в качестве только нескольких иллюстративных примеров. Мутеин по настоящему изобретению может быть использован для лечения любого заболевания или расстройства, в которое вовлечен альфа-рецептор IL-4, в развитии такого заболевания или расстройства может проявляться продукт экспрессии библиотеки нуклеиновых кислот по настоящему изобретению или проявляться иначе полученные мутеины липокалина слезы.
В этом контексте следует отметить, что множество опухолевых клеток экспрессируют большее число высокоаффинных рецепторов IL-4 по сравнению с нормальными клетками. Такие клетки включают солидную опухоль человека, такую как меланома, рак молочной железы, карцинома яичника, мезотелиома, глиобластома, астроцитома, почечно-клеточная карцинома головы или шеи, саркома капоши, ассоциированная со СПИДом (синдром приобретенного иммунодефицита)=AIDS KS, гормонозависимые или независимые клетки карциномы предстательной железы и первичные культуры из опухолей предстательной железы, например (смотри Garland, L, et al., (2005) Journal of Immunotherapy 28, 4, 376-381, Rand, RW, et al. Clinical Cancer Research. (2000) 6, 2157-2165; Husain SR, et al. (1999) Nature Medicine 5, 817-822; Puri RK, et al. Cancer Research (1996) 56, 5631-5637; Debinski W, et al, или Husain SR, et al. Cancer Research (1998) 58, 3649-3653, Kawakami К, et al. (2000) Cancer Research, 60, 2981-2987; или Strome SE, et al. Clinical Cancer Research (2002) 8, 281-286, например). Специфические примеры клеток с документированной сверхэкспрессией рецепторов IL-4 включают, без ограничения ими, клеточную линию Jijoye лимфомы Беркитта (Burkitt) (В-клеточная лимфома), карциномы поджелудочной железы (LNCaP, DU145), карциномы головы и шеи (SCC, КССТ873), рака поджелудочной железы (клеточная линия PANC-1), SCC-25: 13.000 (+/-500) клеточная линия рака головы и шеи (АТСС). Альфа-цепь IL4R играет основную роль в IL74-интернационализации. Соответственно, когда они слиты или сконъюгированы с токсином, мутеины липокалина слезы, связывающиеся с цепью альфа-рецептора IL-4, могут поэтому также быть использованы для лечения опухолей (рака). Примеры подходящих токсинов включают экзотоксин Pseudomonas, коклюшный токсин, дифтерийный токсин, рицин, сапорин, экзотоксин pseudomonas, калихеамицин или их производное, токсоид, кантансиноид, тубулизин или аналог доластатина. Примеры аналогов доластатина включают, без ограничения ими, ауристатин Е, монометиллауристатин Е, ауристатин PYE или ауристатин РНЕ.
Для лечения рака возможно также конъюгировать мутеины, связывающиеся с цепью альфа-рецептора IL-4, с цитостатическим агентом. Примеры таких цитостатических агентов включают цисплатин, карбоплатин, оксалиплатин, 5-фторурацил, таксотере (доцетаксел), паклитаксел, антрациклин (доксорубицин), метотрексат, винбластин, винкристин, виндезин, винорелбин, дакарбазин, циклофосфамид, этопозид, адриамицин, каптотецин, комбретатастин А-4 родственные соединения, сульфонамиды, оксадиазолины, бензо[Ь]тиофенсинтетические спирокетальные пираны, монотетрагидрофурановые соединения, курацин и производные курацина, метоксиэстрадиольные производные и лейковорин.
Как очевидно из вышеприведенного описания, мутеин по настоящему изобретению или его слитый белок или конъюгат могут быть использованы во многих приложениях. В целом, такой мутеин может быть использован во всех приложениях, где используют антитела, за исключением тех, которые специфически основываются на гликозилировании Fc части.
Таким образом, в другом аспекте изобретения мутеины липокалина слезы человека по изобретению используют для обнаружения данного лиганда липокалина слезы человека неприродного происхождения. Такое применение может включать стадии приведения мутеина в котакт с образцом, который, как предполагают, содержит данный лиганд, в подходящих условиях, тем самым обеспечивая возможность образования комплекса между мутеином и данным лигандом, и обнаружения комплекса мутеина посредством подходящего сигнала.
Обнаруживаемый сигнал может быть вызван меткой, как объясняется выше, или изменением физических свойств из-за связывания, то есть образования комплекса. Одним примером является плазменный поверхностный резонанс, величина которого изменяется во время связывания партнеров связывания, из которых один иммобилизован на поверхности, такой как золотая фольга.
Описанные в данном описании мутеины липокалина слезы человека могут также быть использованы для отделения данного лиганда неприродного происхождения липокалина слезы человека. Такое применение может включать стадии приведения в контакт мутеина с образцом, который, как предполагают, содержит указанный лиганд, в подходящих условиях, тем самым обеспечивая возможность образования комплекса между мутеином и данным лигандом, и выделения комплекса мутеин/лиганд из образца.
Как в применении мутеина для обнаружения данного лиганда неприродного происхождения, так и при отделении данного лиганда, мутеин и/или мишень могут быть иммобилизованы на подходящей твердой фазе.
Мутеины липокалина слезы человека по изобретению также могут быть использованы для направленной доставки соединения в предварительно выбранный сайт. Для этой цели мутеин приводят в контакт с представляющим интерес соединением для того, чтобы обеспечить возможность образования комплекса. Затем этот комплекс, который включает мутеин и представляющее интерес соединение, доставляют в предварительно выбранный сайт. Такое использование особенно приемлемо, но им не ограничено, для доставки лекарственного средства (селективно) в предварительно выбранный сайт в организме, такой как инфицированная область тела, ткани или органа, которые предполагается лечить с помощью этого лекарственного средства. Помимо образования комплекса между мутеином и представляющим интерес соединеним, мутеин также может быть подвергнут взаимодействию с данным соединением с получением конъюгата мутеина и соединения. Аналогично вышеописанному комплексу, такой конъюгат может быть пригоден для доставки соединения в предварительно выбранный сайт. Такой конъюгат мутеина и соединения может также содержать линкер, который ковалентно связывает мутеин и соединение друг с другом. Возможно, чтобы такой линкер был стабилен в кровотоке, но расщеплялся в клеточном окружении.
Мутеины, раскрытые в данном описании, или их производные могут, таким образом, быть использованы во многих областях аналогично антителам или их фрагментам. В дополнение к их применению для связывания с подложкой, что делает возможным иммобилизацию и отделение мишени данного мутеина, или конъюгата, или слитого белка этой мишени, мутеины могут быть использованы для мечения с помощью фермента, антитела, радиоактивного вещества или любой другой группы, обладающей биохимической активностью или определенными характеристиками связывания. В результате осуществления этого их соответствующие мишени, или конъюгаты, или слитые белки могут быть обнаружены или приведены с ними в контакт.Например, мутеины по изобретению могут служить для обнаружения химических структур посредством существующих аналитических методов (например ELISA или вестерн-блоттинг) или посредством микроскопии или иммуносенсорики. При этом сигнал обнаружения может быть генерирован либо непосредственно посредством использования приемлемого конъюгата мутеина или слитого белка, либо косвенно посредством иммунохимического обнаружения связанного мутеина через антитело.
Многочисленные возможные применения мутеинов по изобретению также существуют в медицине. В дополнение к их применению в диагностике и доставке лекарственных средств, может быть получен мутантный полипептид по изобретению, который связывает, например, молекулы ткане- или опухолеспецифичной клеточной поверхности. Такой мутеин может, например, быть использован в конъюгированной форме или в виде слитого белка для "визуализации опухоли" или непосредственно для раковой терапии. Соответственно, в настоящем изобретении предложена диагностическая композиция, содержащая мутеин по изобретению и средство для диагностики, такое как эксципиенты, буферы, метки (которые могут быть использованы для мечения мутеинов).
Таким образом, настоящее изобретение также охватывает применение мутеинов липокалина слезы человека по изобретению для образования комплексов сданным лигандом неприродного происхождения.
Другим родственным применением мутеина, раскрытого в данном описании, является подтверждение правильности мишени, то есть анализ того, является ли полипептид, который, как предполагается, вовлечен в развитие или прогресс заболевания или расстройства, действительно является причиной этого заболевания или расстройства. Это применение для подтверждения правильности белка в качестве мишени фармакологического лекарственного средства обладает тем преимуществом, что мутеин по настоящему изобретению способен специфически распознавать поверхностную область белка в его нативной конформации, то есть связываться с нативным эпитопом. В этом отношении следует отметить, что об этой способности сообщалось только для ограниченного числа рекомбинантных антител. Однако применение мутеина по изобретению для подтверждения правильности мишени для лекарственного средства не ограничено выявлением белков в качестве мишеней, но также включает выявление белковых доменов, пептидов, молекул нуклеиновых кислот, органических молекул или комплексов молекул.
Примеры воплощений изобретения
На Фиг.1 показана первичная структура ранее описанного мутеина липокалина слезы человека (S191.4-B24), который проявляет связывающую аффинность в отношении альфа-рецептора IL-4. Первые 21 остатков (подчеркнуты) составляют сигнальную последовательность, которая отщепляется при периплазматической экспрессии. N-концевая T7-tag (курсив) и С-концевая Streptag-ll (полужирный) составляют часть охарактеризованного белка. Фиг.1 также показывает, что 4 N-концевых аминокислотных остатка (His1 His2 Leu3 Ala4), а также два последних С-концевых аминокислотных остатка (Ser157 и Asp158) липокалина слезы дикого типа в этом мутеине делегированы.
На Фиг.2 показаны полипептидные последовательности иллюстративных мутеинов с высокой аффинностью в отношении альфа-рецептора IL-4 (SEQ ID Nos: 2-11). Номера, указанные посредством 'SwissProt P31025', показывают нумерацию соответствующих аминокислотных положений непроцессированной последовательности-предшественника при поступлении в SwissProt базу данных. Wt TLc26 по существу соответствует последовательности дикого типа липокалина слезы в векторе pTLc26. Однако, wt TLc26 не содержит дисульфидную связь, поскольку остатки цистеина в положениях 61 и 153 зрелого белка заменены остатками серина. Аналогично, остаток серина в положениях 101 зрелого белка заменен остатком серина. Кроме того, в положении 111 зрелого белка остаток аргинина был заменен пролином, и в положении 114 зрелого белка остаток лизина был заменен триптофаном. Кроме того, две С-концевые аминокислоты, включенные в последовательность при поступлении в SwissProt P31025, не включены в эту последовательность. АВ4004 представляет собой рандомизированную библиотеку, описанную в международной заявке на патент WO 2008/015239, в которой мутированные положения указаны жирным шрифтом. Рандомизированные последовательности идентичны Л 4 за исключением положения 53 и 55. М3-B24(PSM) указывает горячие пятна из PSM B24.
Фиг.3 показывает результаты анализов пролиферации TF-1 клеток. TF-1 клетки инкубировали в течение 1 часа при 37°С с указанными мутеинами по изобретению (S276.2 К04, S308.5 F08, S308.5 NO1, S308.5 L20, S308.5 L04, S308.5 N20, S308.3 010, S191.4 B24 [SEQ ID Nos: 2-11]) в серии разведении, после чего добавляли 0,8 нг/мл IL-4 (А) или 12 нг/мл IL-13 (В) в течение 72 ч. Пролиферацию измеряли по включению 3H-тимидина.
Фиг.4 показывает величины Юзо с Фиг.3 и результаты Biacore измерений мутеинов липокалина слезы человека с аффинностью в отношении альфа-рецептора IL-4. Приблизительно 400 RU IL-4 альфа-рецептор-Fc захватывалось на CN-5 чипе, который предварительно был покрыт моноклональным антителом против человеческого-Fc. Затем мутеин в единственной концентрации 25 нМ пропускали через проточную ячейку и регистрировали изменения в единицах резонанса. Вычитали эталонные сигналы из проточной ячейки, которую обрабатывали таким же образом, за исключением отсутствия в ней IL-4 альфа-рецептор-Fc, и полученные данные откладывали на модели 1:1 Лангмюра (Langmuir), используя программное обеспечение BIAevaluation. В силу медленных кинетик диссоциации двойные эталоны использовали посредством вычитания сигналов из проточной ячейки, которую обрабатывали таким же образом, за исключением отсутствия в ней IL-4 альфа-рецептор-Fc, и вычитания сигнала из эксперимента, в котором инъецировали только буфер для образца. Полученные данные откладывали на модели 1:1 Лангмюра с ограничением по переносу массы, используя программное обеспечение BIAevaluation.
Если не указано иного, использовали существующие методы в области технологии рекомбинантных генов.
Примеры
ПРИМЕР 1: Созревание аффинности мутеина S191.4-B24 с помощью сайт-направленного случайного подхода
Библиотеку вариантов на основе мутеина S191.4-B24 (SEQ ID NO:2), который описан в публикации РСТ заявки WO 2008/015239, создавали посредством рандомизации положений 26, 32, 34, 55, 56, 58 и 63, чтобы обеспечить все 20 аминокислот по этим положениям. Библиотеку конструировали по существу так, как описано в Примере 1 в WO 2008/015239.
Селекцию фагмид осуществляли так, как описано в Примере 2 в WO 2008/015239, используя лимитированную концентрацию мишени (0,5 нМ и 0,1 нМ альфа-рецептора IL-4, Peprotech) в комбинации с увеличенным временем отмывки вместе с конкурентным моноклинальным антителом против альфа-рецептора IL-4 (МАВ230, R&D Systems; отмывка 1 час) или коротким временем инкубирования (10 минут), соответственно. Выполняли три или четыре раунда селекции.
Препаративное получение специфичных в отношении альфа-рецептора IL-4 мутеинов осуществляли с помощью Е. coli К12 штамм JM83, собирая соответствующий мутеин, кодируемый на векторе экспрессии pTLPCIO (SEQ ID No: 1), либо, когда были необходимы большие количества белка, Е. coli штамм W3110, собирая соответствующий вектор экспрессии, как описано в WO 2008/015239.
Пример 2: Измерение аффинности с помощью Biacore
Измерения аффинности проводили по существу так, как описано в Примере 9 в WO 2006/56464 с модификациями, состоявшими в том, что иммобилизовали приблизительно 400 RU IL-4 альфа-рецептор-Fc (R&D Systems) (вместо 2000 RU человеческого CTLA-4 или мышиного CTLA-4-Fc, использовавшегося в качестве мишени в WO 2006/56464), и 100 мкл мутеина инъецировали в концентрации 25 нМ (вместо 40 мкл образца очищенных мутеинов липокалина в концентрациях 5-0,3 мкМ, как было использовано в WO 2006/56464).
Пример 3: анализы проиферации клеток TF-1
Анализы IL-4 и IL-13-стимулированной проиферации клеток TF-1 осуществляли по существу так, как описано у Lefort et al. (Lefort S., et al., (1995) FESS Lett. 366, 2-3, 122-126) и раскрыто в Примере 10 РСТ заявки WO° 2008/015239. Клетки TF-1 инкубировали в тчение 1 часа при 37°С с указанными мутеинами по изобретению (S276.2 К04, S308.5 F08, S308.5 NO1, S308.5 L20, S308.5 L04, S308.5 N20, S308.3 010, S191.4 B24 [SEQ ID №: 3-11]) в серийных разведениях, после чего добавляли 0,8 нг/мл IL-4 (а) или 12 нг/мл IL-13 (b) в течение 72 ч. Пролиферацию измеряли по включению 3H-тимидина. Результаты анализа пролиферации TF-1 представлены на Фиг.и демонстрируют, что варианты с высокой аффинностью S276.2 К04, S308.5 F08, S308.5 NO1, S308.5 L20, S308.5 L04, S308.5 N20 и S308.3010 являются сильными антагонистами IL-4, а также IL-13-индуццированной передачи сигнала и пролиферации.
Специалист в данной области с легкостью поймет, что настоящее изобретение хорошо адаптировано для решения поставленных задач и получения конечного результата и как упомянутых преимуществ, так и ему прсущих преимуществ. Кроме того, для специалиста в данной области очевидно, что в раскрытом в данном описании изобретении могут быть сделаны различные замены и модификации, не выходя за пределы существа и объема изобретения. Раскрытые в данном описании композиции, способы, процедуры, способы лечения, молекулы и конкретные соединения, представляющие собой определенные воплощения, являются иллюстративными и не предназначены для ограничения объема изобретения. Изменения или другие применения, очевидные для специалиста в данной области, которые входят в пределы сущности изобретения, определены объемом формулы изобретения. Упоминание или обсуждение ранее опубликованного документа в данном описании необязательно должно рассматриваться как признание того, что этот документ составляет часть уровня техники или является общепризнанным знанием.
Раскрытое в данном описании иллюстративным образом изобретение может удобным образом быть осуществлено на практике в отсутствие любого элемента или элементов, ограничения или ограничений, специфически в данном описании не раскрытых. Таким образом, например, термины "содержащий", "включающий", "включая" и так далее должны трактоваться расширительным образом и без ограничения. Кроме того, использованные в данном описании термины и выражения, были использованы как термины описания, а не ограничения, и нет намерения использовать такие термины и выражения, исключая любые эквиваленты показанных и описанных признаков или их частей, но признается, что в пределах объема заявленного изобретения возможны различные модификациии. Таким образом, следует понимать, что хотя настоящее изобретение было специфически раскрыто посредством иллюстративных воплощений или возможных признаков, модификация и изменение раскрытых в данном описании воплощенных изобретений может помочь специалисту в данной области, и что такие модификации и изменения считаются находящимися в объеме изобретения.
В данном описании изобретение было раскрыто широко и обобщенно. Каждый из более узких видовых признаков и группировок субгенерических множеств, попадающих в общее описание, также образуют часть изобретения. Это включает общее описание изобретения с условием или отрицательным ограничением, удаляющим любой объект, из заявляемого класса объектов, безотносительно к тому, был или не был специфически раскрыт в данном описании упомянутый материал.
Другие воплощения охватываются следующей далее формулой изобретения. Кроме того, там, где признаки или аспекты изобретения раскрыты в терминах групп Маркуша, специалист должен признавать, что изобретение также раскрыто в терминах любого индивидуального члена подгруппы членов группы Маркуша.
| название | год | авторы | номер документа |
|---|---|---|---|
| БЕЛКИ, СПЕЦИФИЧНЫЕ В ОТНОШЕНИИ CD137 | 2016 |
|
RU2736312C2 |
| НОВЫЕ ПОЛИПЕПТИДЫ СО СПЕЦИФИЧЕСКИМ СВЯЗЫВАНИЕМ И ПУТИ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2723034C2 |
| СЛИТЫЙ ПОЛИПЕПТИД С ПРОТИВОРАКОВОЙ АКТИВНОСТЬЮ | 2016 |
|
RU2754466C2 |
| СЛИТЫЙ ПОЛИПЕПТИД С ПРОТИВОРАКОВОЙ АКТИВНОСТЬЮ | 2016 |
|
RU2727165C2 |
| МУТЕИНЫ ЛИПОКАЛИНА СЛЕЗНОЙ ЖИДКОСТИ, ОБЛАДАЮЩИЕ АФФИННОСТЬЮ К С-МЕТ РЕЦЕПТОРНОЙ ТИРОЗИНКИНАЗЕ ЧЕЛОВЕКА, И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2009 |
|
RU2515063C9 |
| НОВЫЕ СЛИТЫЕ БЕЛКИ, СПЕЦИФИЧЕСКИЕ В ОТНОШЕНИИ CD137 И GPC3 | 2020 |
|
RU2814653C2 |
| НОВЫЙ СЛИТЫЙ БЕЛОК, СПЕЦИФИЧНЫЙ ДЛЯ CD137 И PD-L1 | 2019 |
|
RU2818349C2 |
| НОВЫЕ БЕЛКИ, СПЕЦИФИЧЕСКИЕ В ОТНОШЕНИИ АНГИОГЕНЕЗА | 2016 |
|
RU2720688C2 |
| Белки, связывающиеся с гепсидином | 2011 |
|
RU2625011C2 |
| МУТЕИНЫ ЛИПОКАЛИНА 2 ЧЕЛОВЕКА С АФФИННОСТЬЮ В ОТНОШЕНИИ ГЛИПИКАНА-3 (GPC3) | 2016 |
|
RU2756318C2 |


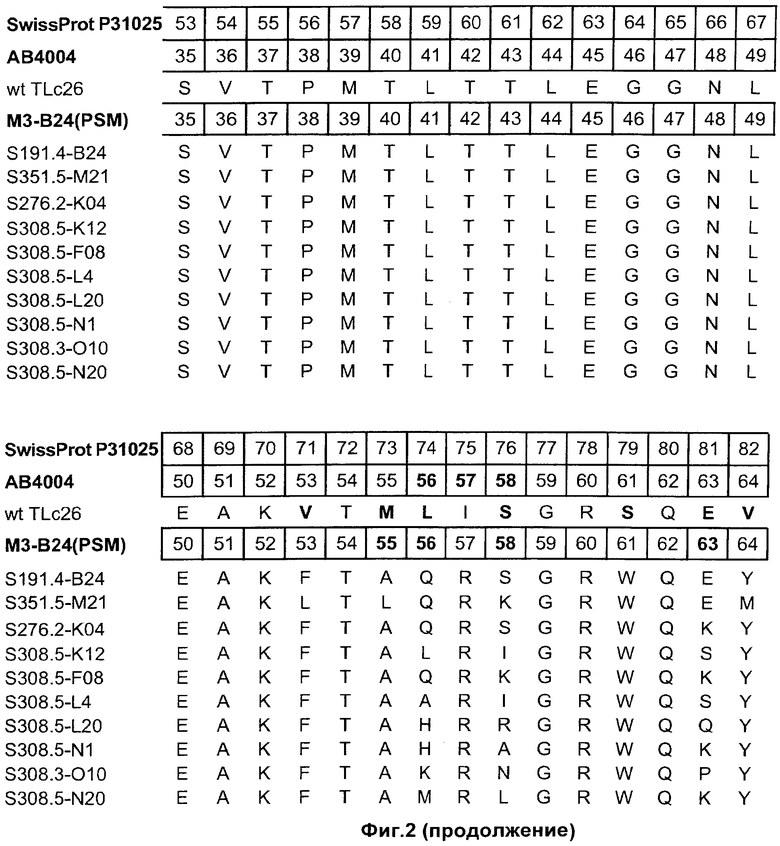
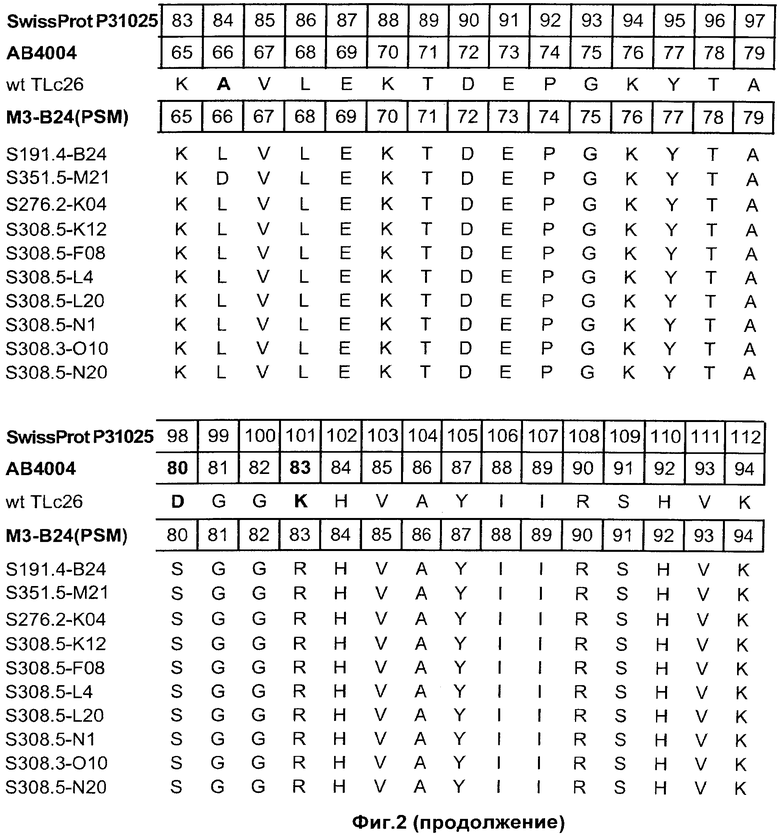
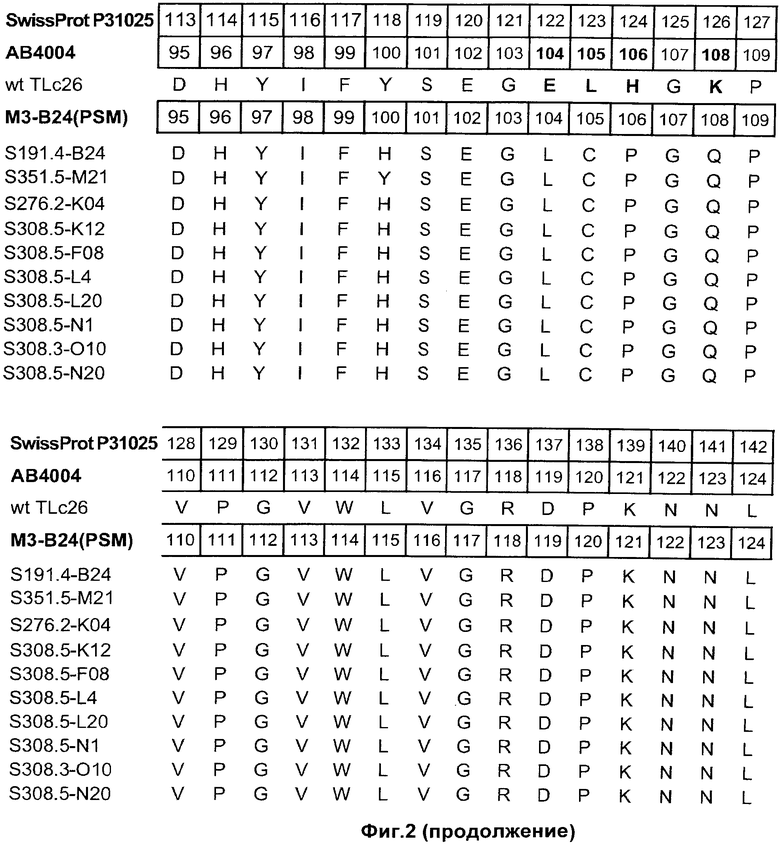
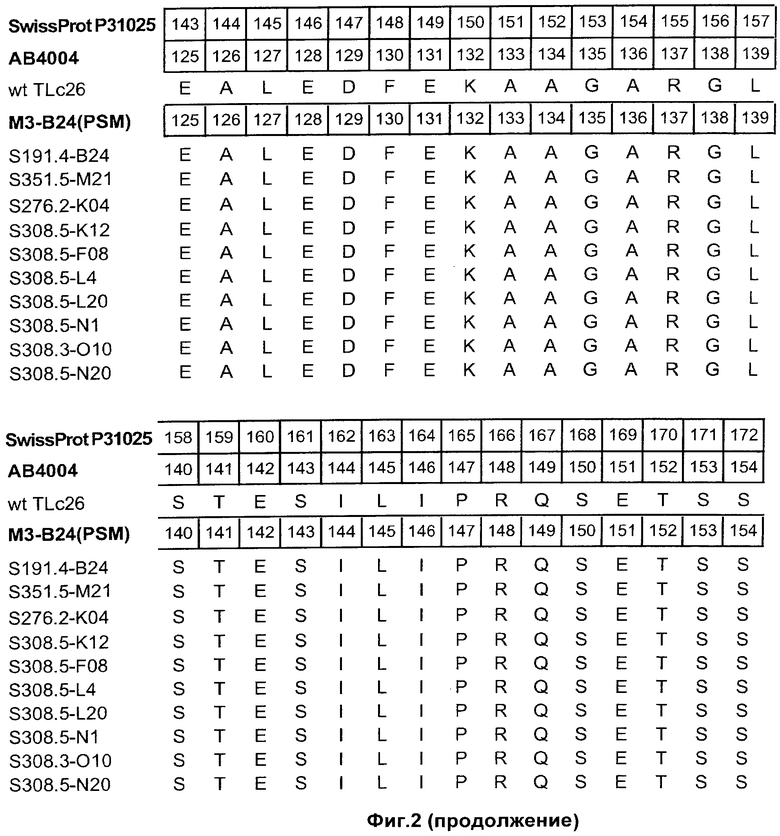

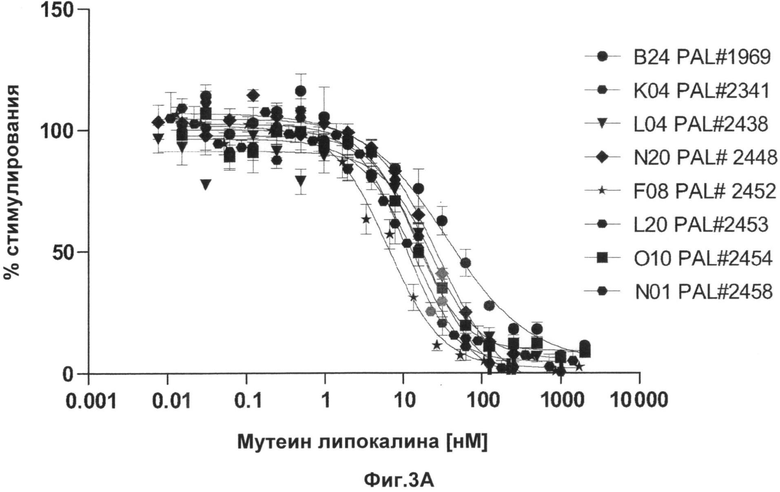
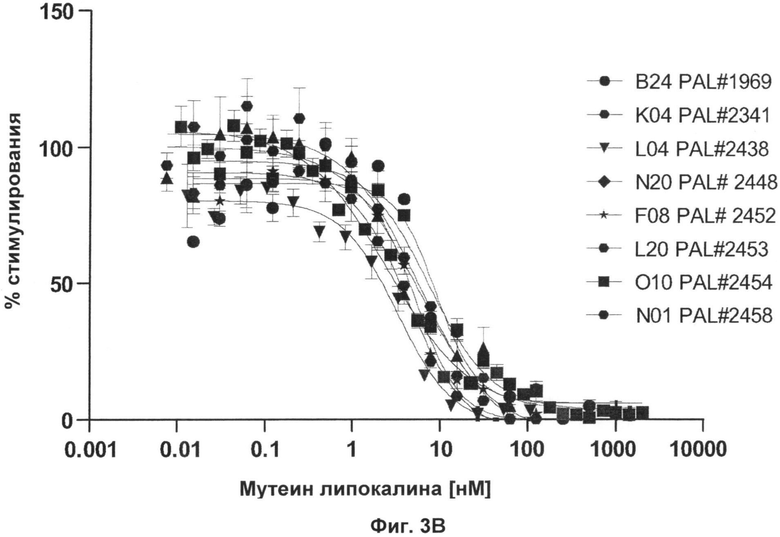
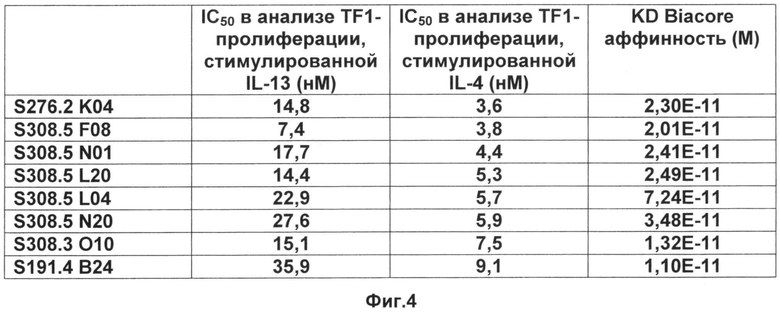
Группа изобретений относится к новым мутеинам, полученным из липокалина слезы человека, которые связываются с альфа-рецептором IL-4. Последовательности этих мутеинов содержат конкретные комбинации аминокислот. В частности, мутированный аминокислотный остаток присутствует по любому одному или более чем одному из положений 27, 28, 30, 31, 33, 53, 57, 61, 64, 66, 80, 83, 104-106 и 108 последовательности линейной полипептидной последовательности зрелого липокалина слезы человека. Мутированный аминокислотный остаток также присутствует по любым 2 или более чем 2 из положений 26, 32, 34, 55, 56, 58 и 63 последовательности линейной полипептидной последовательности зрелого липокалина слезы человека. Группа изобретений также относится к соответствующей молекуле нуклеиновой кислоты, кодирующей такой мутеин, и способу получения такого мутеина и кодирующей его молекуле нуклеиновой кислоты. Группа изобретений имеет улучшенные связывающие свойства в отношении альфа-рецептора IL-4, в частности более высокую связывающую аффинность, что обуславливает их пригодность в диагностических и терапевтических приложениях. 4 н. и 10 з.п. ф-ы, 5 ил., 3 пр.
1. Мутеин липокалина слезы человека, обладающий связывающей аффинностью в отношении альфа-рецептора IL-4 (интерелейкин-4), характеризующийся по меньшей мере одной заменой в положении, соответствующем белку данной аминокислоты зрелого липокалина слезы человека, выбранной из группы, состоящей из: Pro, Leu, Asn, Tyr, Lys, Ser или Glu в положении 26: Lys в положении 32; Trp, Asn, Val, His или Arg в положении 34; Leu, Ala, His, Lys или Met в положении 56; Leu в положении 58; или Lys, Ser, Gln или Pro в положении 63, и содержащий
(1) мутированный аминокислотный остаток в любом одном или более чем одном из положений 27, 28, 30, 31, 33, 53, 57, 61, 64, 66, 80, 83, 104-106 и 108 последовательности линейной полипептидной последовательности зрелого липокалина слезы человека, а также
(2) мутированный аминокислотный остаток в любых 2 или более чем 2 из положений 26, 32, 34, 55, 56, 58 и 63 последовательности линейной полипептидной последовательности зрелого липокалина слезы человека.
2. Мутеин липокалина слезы человека по п. 1, в котором аминокислотная последовательность мутеина содержит одну из следующих совокупностей аминокислотных комбинаций:
(1) Ser 26, Glu 34, Leu 55, Lys 58,
(2) Ser 26, Asn 34, Ala 55, Lys 58,
(3) Ser 26, Val 34,
(4) Pro 26, Ser 34,
(5) Pro 26, Ala 55,
(6) Leu 26, Trp 34, Ala 55,
(7) Leu 26, Trp 34, Ile 58,
(8) Asn 26, Asp 34,
(9) Asn 26, Ala 55,
(10) Tyr 26, His 34, Ala 55,
(11) Tyr 26, His 34, Ala 58,
(12) Lys 26, Arg 34, Ala 55,
(13) Lys 26, Arg 34, Asn 58,
(14) Glu 26, Gly 34, Ala 55,
(15) Glu 26, Gly 34, Leu 58.
3. Мутеин по п. 1 или 2, дополнительно содержащий, по меньшей мере, одно из следующего: Ala 31, Tyr 33, Trp 61, Ser 80, Leu 104, Pro 106 и Gln 108.
4. Мутеин по п. 1 или 2, дополнительно содержащий, по меньшей мере, одно из следующего: Phe 53, Leu 53, Tyr 64, Met 64, Leu 66 и Asp 66.
5. Мутеин по п. 1 или 2, дополнительно содержащий по меньшей мере одно из следующего: Arg 27, Cys 28, Arg 30, Ala 31, Tyr 33, Arg 57, Trp 61, Ser 80, Arg 83, Leu 104, Cys 105, Pro 106 и Gln 108.
6. Мутеин по п. 1 или 2, дополнительно содержащий одну или обе из следующих совокупностей:
(1) Phe 33, Tyr 64, Leu 66;
(2) Leu 53, Met 64, Asp 66.
7. Мутеин по п. 1 или 2, содержащий одну из следующих совокупностей:
(1) Ser 26; Tyr 32; Leu 55; Gln 56; Lys 58;
(2) Pro 26; Tyr 32; Ser 34; Ala 55; Gln 56; Lys 63;
(3) Leu 26; Phe 32; Trp 34; Ala 55; Ile 58; Ser 63;
(4) Ser 26; Tyr 32; Val 34; Ala 55; Ala 56; Ile 58; Ser 63;
(5) Ser 26; Val 32; Asn 34; Ala 55; Gln 56; Lys 58; Lys 63;
(6) Asn 26; Lys 32; Asp 34; Ala 55; His 56; Arg 58; Gln 63;
(7) Tyr 26; Tyr 32; His 34; Ala 55; His 56; Arg 58; Lys 63;
(8) Lys 26; Tyr 32; Arg 34; Ala 55; Lys 56; Asn 58; Pro 63; и
(9) Glu 26; His 32; Gly 34; Ala 55; Met 56; Leu 58; Lys 63.
8. Мутеин по п. 1 или 2, как представлено в любой из SEQ ID No: 3-11, или его фрагмент или вариант.
9. Способ получения мутеина липокалина слезы человека по п. 1, который связывается с альфа-рецептором IL-4, при котором:
(a) молекулу нуклеиновой кислоты, кодирующую липокалин слезы человека, подвергают мутагенезу по
(1) любому одному или более чем одному из положений 27, 28, 30, 31, 33, 53, 57, 61, 64, 66, 80, 83, 104-106 и 108 аминокислотной последовательности линейной полипептидной последовательности зрелого липокалина слезы человека,
(2) любым двум или более чем двум из положений 26, 32, 34, 55, 56, 58 и 63 аминокислотной последовательности линейной полипептидной последовательности зрелого липокалина слезы человека, тем самым получая одну или более нуклеиновых кислот, кодирующих мутеин липокалина слезы человека, где если мутировано положение 26, то мутация содержит Ser, Pro, Leu, Asn, Tyr, Lys или Glu;
если мутировано положение 32, то мутация содержит Tyr, Val, Lys или His;
если мутировано положение 34, то мутация содержит Glu, Ser, Trp, Asn, Val, Asn, His, Arg или Gly;
если мутировано положение 55, то мутация содержит Leu или Ala;
если мутировано положение 56, то мутация содержит Gln, Leu, Ala, His, Lys или Met;
если мутировано положение 58, то мутация содержит Lys, Ser, Ile, Arg, Ala, Asn или Leu;
если мутировано положение 63, то мутация содержит Glu, Lys, Ser, Gln или Pro;
(б) экспрессируют одну или более молекул нуклеиновой кислоты мутеина, полученных на стадии (а), в системе экспрессии, тем самым получая один или более мутеинов, и
(в) обогащают один или более мутеинов, полученных на стадии (б), и отбирают мутеины, которые связываются с альфа-рецептором IL-4 с константой диссоциации менее чем 10 нМ, посредством селекции и/или выделения.
10. Способ по п. 9, где на стадии (в) дополнительно:
(в1) обеспечивают альфа-рецептор IL-4 или его иммуногенный фрагмент,
(в2) приводят один или более мутеинов в контакт с альфа-рецептором IL-4 или его иммуногенным фрагментом, тем самым обеспечивая возможность образования комплекса между альфа-рецептором IL-4 или его иммуногенным фрагментом и мутеином, обладающим связывающей аффинностью.
11. Способ по п. 9 или 10, где селекцию на стадии (в) осуществляют в конкурентных условиях.
12. Способ по п. 9, где мутеин содержит одну из следующих совокупностей аминокислот:
(1) Ser 26, Glu 34, Leu 55, Lys 58,
(2) Ser 26, Asn 34, Ala 55, Lys 58,
(3) Ser 26, Val 34,
(4) Pro 26, Ser 34,
(5) Pro 26, Ala 55,
(6) Leu 26, Trp 34, Ala 55,
(7) Leu 26, Trp 34, Ile 58,
(8) Asn 26, Asp 34,
(9) Asn 26, Ala 55,
(10) Tyr 26, His 34, Ala 55,
(11) Tyr 26, His 34, Ala 58,
(12) Lys 26, Arg 34, Ala 55,
(13) Lys 26, Arg 34, Asn 58,
(14) Glu 26, Gly 34, Ala 55,
(15) Glu 26, Gly 34, Leu 58.
13. Молекула нуклеиновой кислоты, содержащая нуклеотидную последовательность, кодирующую мутеин по любому из пп. 1-8.
14. Клетка-хозяин, содержащая молекулу нуклеиновой кислоты по п. 13.
| WO2008015239 A2, 07.02.2008 | |||
| МОДИФИЦИРОВАННЫЙ АНТАГОНИСТ РЕЦЕПТОРА IL-4 И ПРЕДНАЗНАЧЕННЫЙ ДЛЯ ЕГО ПОЛУЧЕНИЯ ОЧИЩЕННЫЙ ПОЛИНУКЛЕОТИД | 2004 |
|
RU2389796C2 |
| WO2005019256 A2, 03.03.2005. | |||
Авторы
Даты
2015-11-27—Публикация
2011-06-08—Подача