Изобретение относится к медицине, а именно иммунологии, и может быть использовано при производстве сальмонеллезных диагностических и профилактических препаратов.
В прикладной иммунологии, практической и научной бактериологической работе одним из наиболее распространенных тестов является реакция агглютинации (РА).
Известно получение сальмонеллезных жидких инактивированных (нагреванием, ацетоном, спиртом или формалином) корпускулярных антигенов, очищенных от среды культивирования центрифугированием с последующей стандартизацией [1].
Наиболее близким к заявляемому способу является способ, заключающийся в культивировании сальмонелл на мясопептонном агаре, получении взвеси микробов в 0,9% растворе натрия хлорида после смыва с питательной среды, инактивации их формалином (группы A, B, C, D, E) или спиртом (брюшнотифозные бактерии), центрифугировании инактивированной взвеси после осаждения сальмонелл, стандартизации по оптическому стандарту и изучении специфических свойств в РА [2] . При соответствии результатов исследования регламентированным требованиям взвеси сальмонелл разливали в ампулы и герметизировали.
Однако полученные по способу-прототипу сальмонеллы содержат антигенные структуры, обуславливающие ложноположительные результаты в РА с возбудителями кишечной группы.
Кроме того, для получения диагностикума по способу-прототипу требуются значительные затраты питательных сред и биомассы сальмонелл.
Исходя из этих негативных явлений был предложен экономичный способ получения сальмонеллезного диагностикума, повышающий качество препарата, сокращающий затраты.
Изобретение направлено на решение задачи - получение комплексного сальмонеллезного диагностикума за счет повышения чистоты и специфичности препарата, обусловленных способом очистки. (Таблица 1).
Решение данной задачи заключается в дополнительной обработке взвесей сальмонелл хлороформом, конъюгацией их с флуоресцентным красителем - изотиоцианатом флуоресцеина.
Существенные признаки заявляемого способа:
ограничительные - инактивация сальмонелл, центрифугирование, стандартизация;
отличительные - инактивация сальмонелл всех групп формалином, обработка хлороформом с последующей конъюгацией с флуоресцентным красителем - изотиоцианатом флуоресцеина, многократное центрифугирование до полного отсутствия красителя в надосадочной жидкости.
Способ осуществляется следующим образом: Культуры сальмонелл серогрупп A, B, C, D, E, выращенные на МПА, смывают (каждую в отдельности) 0,9% раствором натрия хлорида, стандартизируют и соединяют в комплексную взвесь. Взвесь сальмонелл A, B, C, D, E инактивируют формалином. После этого из взвеси сальмонелл путем низкоскоростного центрифугирования осаждают агаровые частицы. Надосадочную жидкость, содержащую сальмонеллы, декантируют и подвергают высокоскоростному центрифугированию для осаждения сальмонелл. Полученный осадок ресуспендируют в 0,9% растворе натрия хлорида и обрабатывают хлороформом для удаления денатурированных белков, а также липидов. Очищенную взвесь сальмонелл центрифугируют, а осадок ресуспендируют и коньюгируют с изотиоцианатом флуоресцеина. По истечении времени конъюгации меченые сальмонеллы отмывают от непрореагировавшего-красителя, стандартизируют и оценивают в иммунофлуоресцентной реакции микроагглютинации (ИФРМА). При получении результатов, соответствующих регламентированным данным, меченые сальмонеллы лиофилизируют. Для проведения исследований с приготовленным диагностикумом на 1000 проб сывороток потребуется 1 мл культуры сальмонелл с концентрацией 20•109 в 1 мл микробной взвеси.
ПРИМЕР 1. Получение целевого продукта по заявляемому способу.
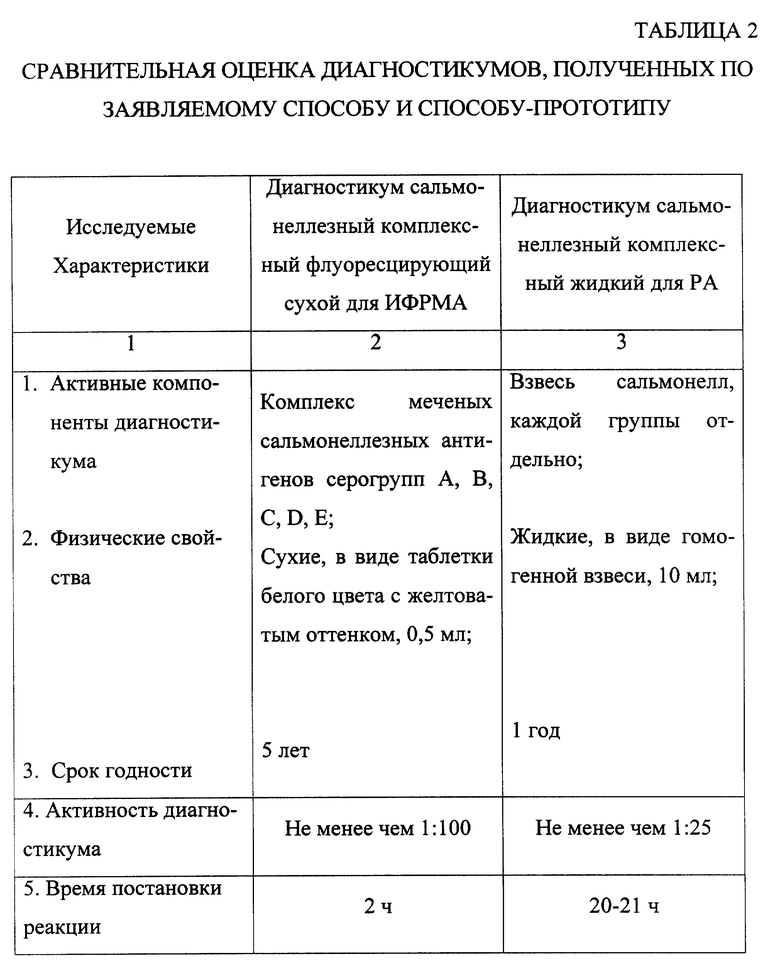
С 1,5 мл скошенного МПА получали 1,0 мл взвесь сальмонелл группы А с концентрацией 20 млрд. в 1 мл микробной взвеси (табл. 1). Полученную взвесь доводили до концентрации 5•109 сальмонелл в 1 мл микробной взвеси. Приготовленные аналогичным образом взвеси сальмонелл групп B, C, D, E объединяли по 1 мл и получали комплексную взвесь. В 8 мл взвеси сальмонелл групп A, B, C, D, E добавляли 0,04 мл формалина и выдерживали в течение 7 суток при температуре +4-10oC. Из инактивированной взвеси осаждали крупные агаровые частицы путем центрифугирования при 1500 об/мин, в течение 10 мин. Надосадочную жидкость, содержащую сальмонеллы, декантировали и центрифугировали при 10000 об/мин, в течение 30 мин с целью осаждения сальмонелл. Полученный осадок ресуспендировали в 8,0 мл 0,9% раствора натрия хлорида. К полученной взвеси добавляли хлороформ до конечной концентрации 0,5%. Смесь встряхивали в течение 5 мин и центрифугировали при 1500 об/мин, в течение 10 мин для осаждения хлороформа и денатурированных белков. Надосадочную жидкость декантировали и центрифугировали при 10000 об/мин, в течение 30 мин. Осадок сальмонелл ресуспендировали в 8,0 мл забуферного физиологического раствора. В сальмонеллезную взвесь добавляли изотиоцианат флуоресцеина из расчета 2,5 мг на 1•109 микробов. Конъюгацию красителя с сальмонеллами проводили в течение 16 часов при постоянном перемешивании при температуре +4-10oC. После этого взвесь центрифугировали при 10000 об/мин, в течение 30 мин. Образовавшийся осадок ресуспендировали в 8,0 мл забуферного физиологического раствора. Процедуру отмывания путем центрифугирования повторяли до полного отсутствия красителя в надосадочной жидкости. Осадок очищенных меченых сальмонелл ресуспендировали в дистиллированной воде до концентрации 5•109 сальмонелл в 1 мл микробной взвеси и исследовали в ИФРМА на специфическую активность. (Таблица 2).
Как следует из данных, представленных в таблице, серии диагностикумов, полученные по заявленному способу, взаимодействуют со специфическими антителами сывороток крови людей, больных сальмонеллезом, моноспецифическими диагностическими сальмонеллезными сыворотками и не реагируют с гетерологичными и близкородственными антителами диагностических сывороток.
На постановку ИФРМА для скрининга 1000 сывороток потребуется 5 мл флуоресцирующего сальмонеллезного диагностикума с концентрацией 5•109 в 1 мл микробной взвеси.
Таким образом, меченый антиген сальмонелл, полученный по заявленному способу пригоден для применения в качестве диагностикума сальмонеллезного комплексного флуоресцирующего для ИФРМА.
ПРИМЕР 2. Получение целевого продукта по способу-прототипу.
Культуру сальмонелл группы A, выращенную на 45 мл мясопептонного агара, смывали 0,9% раствором натрия хлорида, стандартизировали до концентрации 20•109 сальмонелл в 1 мл. Получали 30 мл взвеси культуры сальмонелл группы A. Приготовленную взвесь инактивировали путем добавления формалина до конечной концентрации 0,5% и выдерживали 7 суток. Затем инактивированную взвесь центрифугировали при 1500 об/мин, в течение 10 мин, отделяли надосадочную жидкость и подвергали ее центрифугированию при 3000 об/мин, в течение 30 мин. Полученный осадок ресуспендировали в 250 мл 0,9% раствора натрия хлорида, стандартизировали до 2•109 сальмонелл в 1 мл микробной взвеси и исследовали в РА. (Таблица 2).
При соответствии результатов регламентированным данным препарат разливали в ампулы по 10 мл и герметизировали.
Аналогичным образом готовили другие сальмонеллезные диагностикумы серогрупп B, C, D, E. Получали по 250 мл диагностикумов групп B, C, D, E с концентрацией 2•109 в 1 мл микробной взвеси.
Как следует из данных таблицы 2, препарат взаимодействовал с сальмонеллезными сыворотками группы A и диагностической сывороткой группы A. Кроме этого, были отмечены ложно-положительные результаты с сыворотками к кишечной группе.
Использованные источники
1. Медуницин Н.В. Брюшнотифозные вакцины. Вакцинология. - М.: Триада - X. - 1999. - С. 172-173.
2. Петросян E.А., Коссова А.К., Ефимова А.А. Разработка метода получения очищенных антигенов в производственных условиях. Поливакцины. - Москва, - 1956. - Т. 8. - С. 245-276.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ДИАГНОСТИКУМА РИККЕТСИАЛЬНОГО СИБИРИКА КОРПУСКУЛЯРНОГО | 1994 |
|
RU2122427C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТРЕПОНЕМНОГО АНТИГЕНА ДЛЯ ИММУНОФЕРМЕНТНОГО АНАЛИЗА | 2002 |
|
RU2216743C1 |
| СПОСОБ ПОЛУЧЕНИЯ АНТИГЕНА ДЛЯ ДИАГНОСТИКИ САЛЬМОНЕЛЛОНОСИТЕЛЬСТВА У КУР | 1998 |
|
RU2158133C2 |
| СПОСОБ ПОЛУЧЕНИЯ БРУЦЕЛЛЕЗНОГО ДИАГНОСТИКУМА | 2004 |
|
RU2269360C2 |
| СПОСОБ ПРИГОТОВЛЕНИЯ ВАКЦИНЫ ДЛЯ ПРОФИЛАКТИКИ ХЛАМИДИЙНЫХ ИНФЕКЦИЙ У ЧЕЛОВЕКА | 2002 |
|
RU2242993C2 |
| Способ получения бруцеллезного полистирольного латексного диагностикума | 2022 |
|
RU2798124C1 |
| Способ получения бруцеллезного диагностикума | 2023 |
|
RU2831699C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИАГНОСТИКУМА ЭРИТРОЦИТАРНОГО САПНОГО ИММУНОГЛОБУЛИНОВОГО МОНОКЛОНАЛЬНОГО | 2017 |
|
RU2658434C1 |
| СПОСОБ СПЕЦИФИЧЕСКОЙ ПРОФИЛАКТИКИ РАДИАЦИОННЫХ ПОРАЖЕНИЙ ОРГАНИЗМА И СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА ДЛЯ ПРОФИЛАКТИКИ РАДИАЦИОННЫХ ПОРАЖЕНИЙ ОРГАНИЗМА | 2001 |
|
RU2226106C2 |
| Способ выявления эндотоксинов грамотрицательных бактерий | 1982 |
|
SU1142122A1 |




Изобретение относится к области медицины и может быть использовано при производстве сальмонеллезных диагностических и профилактических препаратов. Способ заключается в том, что инактивацию сальмонелл осуществляют формалином, очищают хлороформом, центрифугируют и конъюгируют с изотиоционатом флуоресцина. Затем отмывают от непрореагировавшего красителя путем многократного центрифугирования, стандартизуют и лиофилизируют. Техническим результатом является повышение чистоты и специфичности получаемого препарата. 1 з.п. ф-лы, 2 табл.
| ПЕТРОСЯН Е.А | |||
| и др | |||
| Разработка метода получения очищенных антигенов в производственных условиях | |||
| Поливакцины | |||
| - М., 1956, т.8, с.245 - 276 | |||
| ХАЛИТОВА В.И | |||
| и др | |||
| Диагностика сальмонеллеза у детей с использованием иммунофлуоресцентного метода | |||
| Актуальные вопросы педиатрии | |||
| - Кишинев, 1988, с.141 и 142 | |||
| ВОЙТЕНКОВА Е.В | |||
| Применение иммунологических методов для диагностики сальмонеллезов | |||
| Автореф | |||
| канд | |||
| дисс | |||
| - Л., 1988 | |||
| WO 8604352 A1, 31.07.1986 | |||
| КОРОТЯЕВ А.И | |||
| Медицинская микробиология иммунология и вирусология | |||
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
Авторы
Даты
2001-11-10—Публикация
2000-11-27—Подача