Изобретение относится к области медицинской микробиологии, в частности к способам получения вакцин, применяемых для профилактики лептоспироза у людей.
Лептоспироз в России является одним из наиболее распространенных зоонозных инфекций, играющих важную роль в патологии человека и животных и наносящих существенный социально-экономический ущерб народному хозяйству. Наличие на территории Российской Федерации активных природных и антропургических очагов лептоспироза представляет постоянную угрозу заражения людей этой инфекцией. Несмотря на это эффективные лечебно-профилактические иммунобиологические препараты отсутствуют.
Известна коммерческая поливалентная гретая феноловая вакцина для профилактики лептоспироза у людей [ФС 42-435 ВС-94. Вакцина лептоспирозная инактивированная жидкая] . Способ ее получения включает выращивание лептоспир 4-х серогрупп на фосфатно-сывороточной среде Терских с кроличьей сывороткой, инактивирование микробной массы прогреванием, смешивание выращенных культур в определенных сочетаниях с последующим консервированием фенолом, расфасовку, проверку стерильности, безвредности и специфической активности.
Однако этот способ не позволяет получить в вакцине достаточную концентрацию специфических антигенов, что вынуждает вводить ее людям двукратно в относительно больших дозах (2,0 и 2,5 мл). Несмотря на это вакцина не вызывает у привитых напряженного иммунитета и требует повышения ее протективных свойств.
Цель изобретения - получение лептоспирозной вакцины, вызывающей иммунитет высокой напряженности.
Настоящая цель достигается тем, что в качестве исходных штаммов лептоспир используют новые штаммы 4-х серогрупп: Leptospira Icterohaemorrhagiae Copenhageni 466, L. Grippotyphosa grippotyphosa 30, L. Pomona mozdok 48B, L. Sejroe sejroe 751, обладающие высокой антигенной и иммуногенной активностью. Штаммы депонированы, хранятся в коллекции микроорганизмов НИИЭМ им. Н.Ф.Гамалеи.
Штамм "Крыса 2" НИИЭМ 466 изолирован в 1984 г. в Ростовской области из почки серой крысы и принадлежит к серовару Copenhageni серогруппы Ictearohaemonhagiae. Культивируется на питательных средах с кроличьей сывороткой и активно размножается на полусинтетических средах с белками крови человека. Обладает стабильной вирулентностью и высокой иммуногенностью.
Штамм "Microtus arvalis 30" НИИЭМ 30/469 выделен в 1987 г. из почки обыкновенной полевки и принадлежит к серовару grippotyphosa серогруппы Grippotyphosa. Культивируется на питательных средах с кроличьей сывороткой и на полусинтетических средах с белками крови человека. В дозах 106-107 клеток вызывает у золотистых хомяков острую летальную инфекцию, а в дозах менее 106 клеток - бессимптомную ренальную инфекцию.
Штамм "48B" НИИЭМ 48В/470 выделен в 1989 г. в Волгоградской области из почки обыкновенной полевки и принадлежит к серовару mozdok серогруппы Pomona. Размножается на питательных средах с кроличьей сывороткой и на полусинтетических средах с белками крови человека. Вызывает острую летальную инфекцию у золотистых хомяков в дозах 103-104 клеток.
Штамм "Mus musculus 751" НИИЭМ 751/471 изолирован в 1987 г. из почки домовой мыши и принадлежит к серовару Sejroe серогруппы Sejroe. Культивируется на питательных средах с кроличьей сывороткой, а также на полусинтетических средах с белками крови человека. В дозах 5х107-108 клеток вызывает у золотистых хомяков бессимптомную ренальную инфекцию.
Штамм Leptospira Icterohaemorrhagiae Copenhageni 466, изолированный в 1984 г. в Ростовской области из почки серой крысы.
Морфологические признаки. При микроскопировании в темном поле (х400) представляет собой хорошо подвижные серебристо-белые спиралеподобные нити длиной 7-10 мкм, диаметром 0,06-0,1 мкм, заканчивающиеся крючками на концах.
Физиологические свойства. Размножается на жидких сывороточных питательных средах Терских и Фервоорта-Вольфа и на твин-протеиновых и твин-альбуминовых средах при температуре 28-30oС и рН 7,2-7,6, достигая максимума на 7-10 сутки. Максимальное накопление в логарифмической фазе роста в сывороточных средах составляет от 5х107 до 7х10 клеток/мл, а в твин-протеиновых средах - 8х107-108 клеток/мл. Характерно вращение лептоспир вокруг своей оси и перемещение без полярной дифференциации. Относятся к микроаэрофилам. Ассимилируют углерод из органических соединений белковой и липидной природы.
Вирулентность. Штамм обладает высокой и стабильной вирулентностью, вызывая у золотистых хомячков при внутрибрюшинном заражении в дозе 1,0 мл и концентрации 103-104 клеток летальную инфекцию.
Штамм Leptospira Grippotyphosa grippotyphosa НИИЭМ 30/469 выделен в 1987 г. из почки обыкновенной полевки.
Морфологические признаки. Типичен по морфологии клеток и представлен крючковыми формами.
Физиологические свойства. Культивируется на жидких сывороточных питательных средах и на твин-протеиновых и твин-альбуминовых средах при температуре 28-30oС и рН 7,2-7,6, достигая максимума на 5-7 сутки. Максимальное накопление в логарифмической фазе роста в сывороточных питательных средах составляет от 5х107 клеток/мл, а в твин-протеиновых средах - 8х107 клеток/мл. Относится к микроаэрофилам.
Вирулентность. В дозах 106-107 клеток вызывает у золотистых хомяков бессимптомную ренальную инфекцию.
Штамм Leptospira Pomona mozdok НИИЭМ 48В/70 выделен в 1989 г. в Волгоградской области из почки обыкновенной полевки.
Морфологические признаки. Типичен по морфологии клеток и представлен крючковыми формами.
Физиологические свойства. Размножается на жидких сывороточных питательных средах (Терских, Фервоорта-Вольфа) и на твин-протеиновых и альбуминовых средах при температуре 28-30oС и рH 7,2-7,6, достигая максимума на 6-10 сутки. Максимальное накопление в логарифмической фазе роста в сывороточных питательных средах составляет от 5х107 до 7х107 клеток/мл, а в твин-протеиновых средах - 8х107 клеток/мл.
Вирулентность. В дозах 103-104 клеток вызывает гибель или заболевание золотистых хомяков.
Штамм Leptosoira Sejroe sejroe НИИЭМ 751/471 изолирована 1987 г. из почки домовой мыши.
Морфологические признаки. Типичные по морфологии хорошо подвижные спиралеподобные нити длиной 6-10 мкм, диаметром 0,10-0,15 мкм, заканчивающиеся крючками на концах.
Физиологические свойства. Культивируется на жидких сывороточных питательных средах и на твин-протеиновых и альбуминовых средах при температуре 28-30oС и рН 7,2-7,6, достигая максимума на 6-8 сутки. Максимальное накопление в логарифмической фазе роста в сывороточных питательных средах составляет от 5х107 до 7х107 клеток/мл, а в твин-протеиновых средах - 8х107 клеток/мл.
Вирулентность. В дозах 5х107 - 108 клеток вызывает у золотистых хомяков бессимптомную ренальную инфекцию.
Выращивают биомассу лептоспир на среде с белками крови человека, инактивируют ее формальдегидом. Концентрируют микробную массу методом ультрафильтрации на полых полиамидных волокнах, а ее очистку от компонентов среды культивирования и формальдегида проводят путем двукратного отмывания физраствором. Затем стандартизуют микробную массу по оптическому кишечному стандарту мутности ОСО 42-28-29-86 10 единиц и используют формальдегид в качестве консерванта.
Пример 1. Получение вакцины. Культуру штаммов лептоспир Icterohaemorrhagiae Copenhageni 466, Grippotyphosa grippotyphosa 30, Pomona mozdok 48В и Sejroe sejroe 751, выращенную на фосфатной среде Терских с 5% кроличьей сыворотки, пересевают во флаконы с полусинтетической накопительной средой с человеческим протеином. Посевы инкубируют в термостате при температуре 28-30oС в течение 7-10 суток. Выращенную микробную массу инактивируют путем добавления в нее формальдегида (0,35+0,05)% концентрации в среде и выдерживают 24 часа при комнатной температуре.
Инактивированную биомассу лептоспир каждого штамма концентрируют на установке УПЛ-0,6 с ультрафильтрационными колонками на полиамидных полых волокнах с заданным диаметром пор. Концентрированную микробную массу двукратно отмывают от компонентов среды культивирования и формальдегида стерильным раствором натрия хлорида 0,9%-ного. Затем биомассу лептоспир каждого штамма разводят 0,9%-ным раствором хлористого натрия до 1 млрд микробных тел по оптическому кишечному стандарту мутности ОСО 42-28-29-86 10 единиц. Стандартизованную биомассу лептоспир каждого штамма в равных объемах сводят в бутыли. Полученную вакцину расфасовывают в ампулы и контролируют общепринятыми методами на стерильность, токсичность, безвредность, подлинность и специфическую активность.
Полученная по указанной технологии лептоспирозная вакцина содержит в 1 мл следующие химические и биологические вещества: следы пастеризованного протеина человека, до 0,0003 г формальдегида, смесь инактивированных лептоспир 4-х серогрупп в концентрации клеток 70х106±30х106.
Пример 2. Получение вакцины.
Как в примере 1, но культуру штаммов лептоспир пересевают во флаконы с полусинтетической средой с человеческим альбумином.
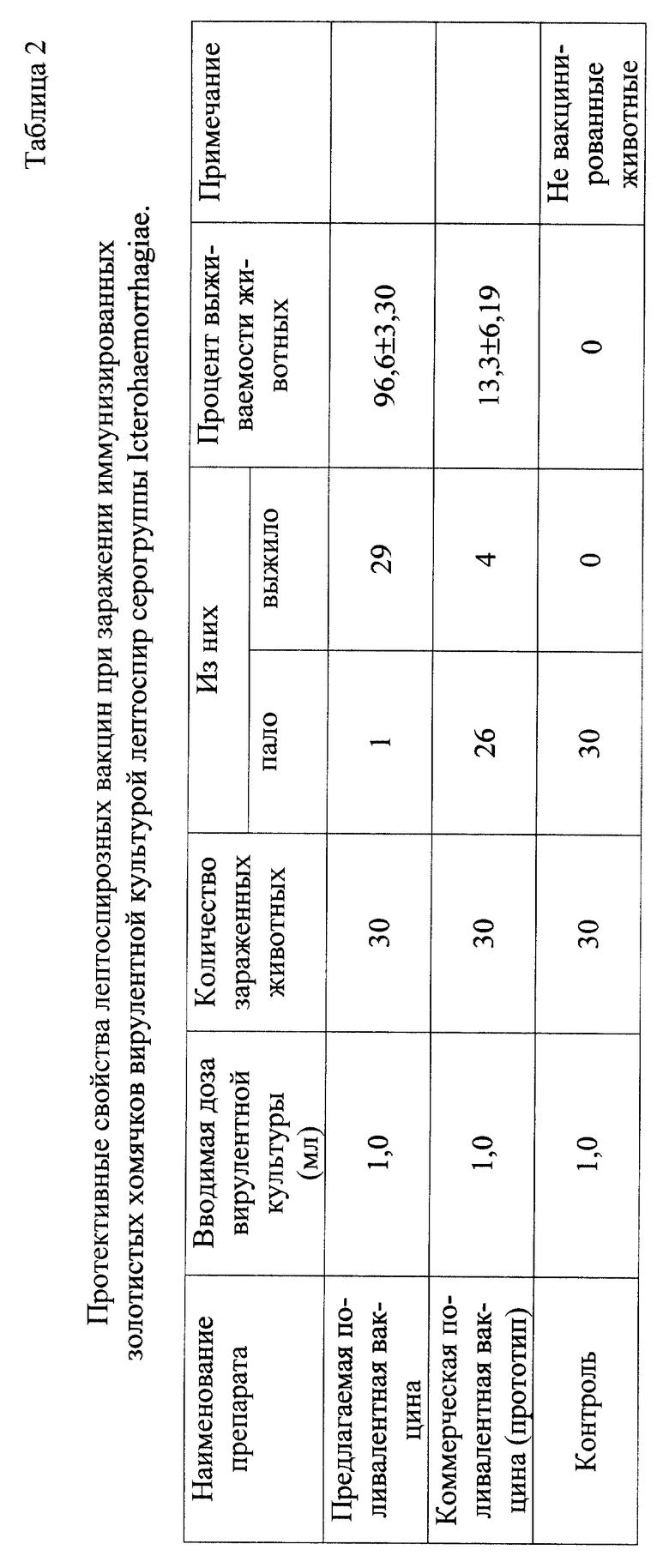
Пример 3. Изучение антигенных и протективных свойств новой вакцины.
Изучение проводят на золотистых хомячках весом (22±3) г в сравнении с коммерческой вакциной (таблицы 1, 2). Экспериментальную вакцину вводят животным внутрибрюшинно однократно дозой 1,0 мл. При иммунизации коммерческой вакциной используют двукратную схему, рекомендуемую в Инструкции по применению препарата. Через 30 дней от начала вакцинации животных проводят забор крови для получения иммунной сыворотки и исследования ее на наличие специфических антител, которые определяют с помощью реакции микроагглютинации и лизиса (РМАЛ). После забора крови животных заражают внутрибрюшинно по 1,0 мл вирулентной культуры лептоспир серогруппы Icterohaemorrhagiae и ведут наблюдения за ними в течение 10 суток.
Предлагаемая новая поливалентная лептоспирозная вакцина по сравнению с коммерческой вакциной (прототип) обладает более выраженными антигенными и протективными свойствами.
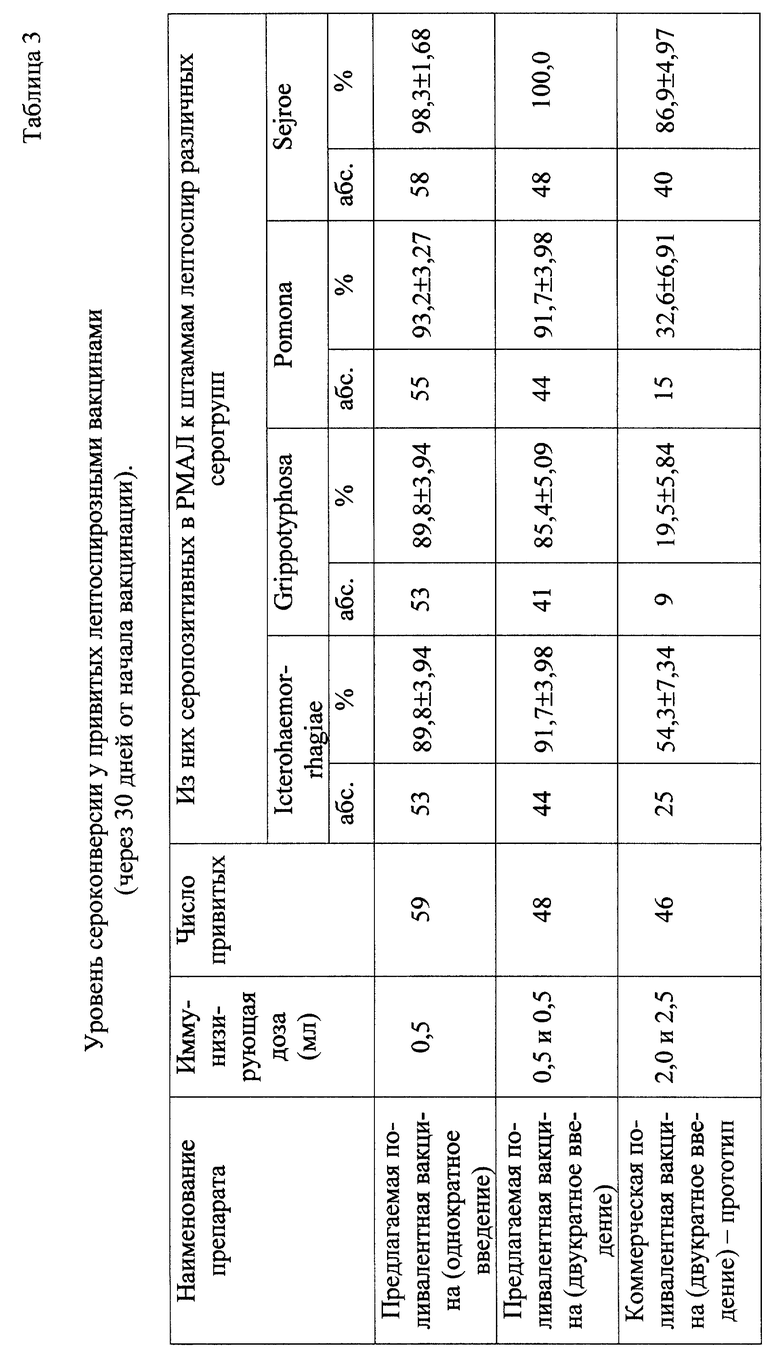
Пример 4. Результаты государственных испытаний поливалентной лептоспирозной вакцины на добровольцах
Государственные испытания вакцины проведены на 153 добровольцах. Испытания показали, что предлагаемая вакцина слабореактогенна и обладает высокой специфической активностью (табл. 3, 4). В качестве препарата сравнения служила коммерческая поливалентная лептоспирозная вакцина (прототип). В ходе испытаний отрабатывались 2 схемы вакцинации: двукратная в дозе по 0,5 мл и однократная в дозе 0,5 мл. Коммерческую вакцину использовали согласно Инструкции по ее применению при двукратном введении в дозах 2,0 мл и 2,5 мл.
Предлагаемая новая поливалентная лептоспирозная вакцина по сравнению с коммерческой вакциной (прототипом) обладает более высокой сероконверсией ко всем штаммам лептоспир, входящим в ее состав. Титры специфических антител в сыворотках крови привитых с достоверностью 95% значительно выше, чем у иммунизированных коммерческой вакциной. Различия в антительном ответе между привитыми двукратно и однократно статистически равнозначны (Отчет Государственных испытаний вакцины прилагается).
Предлагаемая вакцина имеет важное практическое значение. Она обладает высокой специфической активностью и вызывает у привитых напряженный иммунитет при однократном введении в дозе 0,5 мл. Это позволяет использовать ее для активной профилактики лептоспироза у людей и открывает перспективы разработки новых иммунобиологических препаратов, в частности противолептоспирозного иммуноглобулина человека для лечения больных с отягощенными формами.
Внедрение в практику предлагаемой вакцины имеет социально-экономическую значимость. Ее использование в работе лечебно-профилактических учреждений России будет способствовать снижению заболеваемости людей лептоспирозом и сокращению летальных исходов.
| название | год | авторы | номер документа |
|---|---|---|---|
| Новая поливалентная вакцина против лептоспироза человека и способ её получения | 2021 |
|
RU2753972C1 |
| ВАКЦИНА ПРОТИВ ЛЕПТОСПИРОЗА ЖИВОТНЫХ | 1990 |
|
RU2030915C1 |
| Способ изготовления вакцины поливалентной против лептоспироза лошадей | 2023 |
|
RU2815538C1 |
| ВАКЦИНА ИНАКТИВИРОВАННАЯ КОМБИНИРОВАННАЯ ПРОТИВ ИНФЕКЦИОННОГО РИНОТРАХЕИТА, ВИРУСНОЙ ДИАРЕИ И ЛЕПТОСПИРОЗА КРУПНОГО РОГАТОГО СКОТА | 2009 |
|
RU2395297C1 |
| ШТАММ БАКТЕРИЙ LEPTOSPIRA INTERROGANS "РЯБУХИН" СЕРОГРУППЫ ICTEROHAEMORRHAGIAE, СЕРОВАРА COPENHAGENI, ИСПОЛЬЗУЕМЫЙ ДЛЯ ПРИГОТОВЛЕНИЯ ВАКЦИНЫ ПРОТИВ ЛЕПТОСПИРОЗА | 1991 |
|
RU2005779C1 |
| ВАКЦИНА ИНАКТИВИРОВАННАЯ КОМБИНИРОВАННАЯ ПРОТИВ ИНФЕКЦИОННОГО РИНОТРАХЕИТА, ВИРУСНОЙ ДИАРЕИ, РОТА-, КОРОНАВИРУСНОЙ БОЛЕЗНЕЙ И ЛЕПТОСПИРОЗА КРУПНОГО РОГАТОГО СКОТА | 2009 |
|
RU2395299C1 |
| ШТАММ БАКТЕРИЙ LEPTOSPIRA INTERROGANS "МИТРОНОВ" СЕРОГРУППЫ CANICOLA ДЛЯ ПРИГОТОВЛЕНИЯ ВАКЦИНЫ | 2002 |
|
RU2227160C1 |
| АССОЦИИРОВАННАЯ ВАКЦИНА ПРОТИВ ЛЕПТОСПИРОЗА И КАМПИЛОБАКТЕРИОЗА КРУПНОГО РОГАТОГО СКОТА | 1992 |
|
RU2021818C1 |
| Вирулентный штамм бактерий Leptospira interrogans серогруппы Icterohaemorrhagiae серовара copenhageni, используемый для экспериментального изучения лептоспирозной инфекции | 2021 |
|
RU2768008C1 |
| Тест-штамм Leptospira interrogans серогруппы Icterohaemorrhagiae для детекции антител к L. icterohaemorrhagiae | 2023 |
|
RU2799846C1 |


Изобретение относится к области медицинской микробиологии и касается поливалентной вакцины против лентоспироза человека и способа ее получения. Вакцина содержит в качестве антигенов штаммы 4-х серогрупп: Leptospira Icterohaemorrhagiae Copenhageni НИИЭМ 466, Leptospira Grippotyphosa grippotyphosa НИИЭМ 30/469, Leptospira Pomona mozdok НИИЭМ 48В/470 и Leptospira Sejroe sejroe НИИЭМ 751/471. Способ получения вакцины включает выращивание биомассы лептоспир на полусинтетической среде с белками крови человека, инактивирование ее формальдегидом, концентрацию микробной массы методом ультрафильтрации на полых полиамидных волокнах, очистку биомассы от компонентов среды культивирования путем двукратного отмывания физиологическим раствором, стандартизацию микробной массы по оптическому кишечному стандарту мутности 10 единиц и консервирование формальдегидом. Предлагаемая вакцина по сравнению с существующей коммерческой поливалентной лептоспирозной вакциной обладает более высокими антигенными и протективными свойствами. 2 с.п. ф-лы, 4 табл.
Формальдегид - 0,0002-0,0003 г
Пастеризованный протеин человека - Следы
2. Способ получения поливалентной вакцины против лептоспироза человека, отличающийся тем, что культуру штаммов лептоспир Icterohaemorrhagiae Copenhageni НИИЭМ 466, Grippotyphosa grippotyphosa НИИЭМ 30, Pomona mozdok НИИЭМ 48B и Sejroe sejroe НИИЭМ 751 выращивают на жидкой полусинтетической накопительной среде с белками крови человека, инактивируют формальдегидом, концентрируют ультрафильтрацией на полых полиамидных волокнах, очищают двукратным отмыванием физиологическим раствором и стандартизуют по оптическому кишечному стандарту мутности 10 единиц и используют в качестве консерванта формальдегид до 0,0003 г.
| ВАКЦИНА ПРОТИВ ЛЕПТОСПИРОЗА ЖИВОТНЫХ | 1990 |
|
RU2030915C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИВАЛЕНТНОЙ ВАКЦИНЫ ПРОТИВ ЛЕПТОСПИРОЗА ЖИВОТНЫХ | 1996 |
|
RU2096042C1 |
| US 5679353, 21.10.1997 | |||
| US 5000951, 19.03.1991 | |||
| JP 06228010 А, 16.08.1994. | |||
Авторы
Даты
2002-07-10—Публикация
1998-10-29—Подача