Область изобретения
Изобретение относится к новым нестероидным лигандам для рецепторов эстрогена, которые обладают тканезависимой эстрогенной и антиэстрогенной активностью, а также к способам их получения и к их применению для лечения различных болезненных состояний.
Предпосылки изобретения
Эстрогены являются важным классом стероидных гормонов, которые стимулируют развитие и сохранение фундаментальных сексуальных характеристик у людей. В прошлом было обнаружено, что эстрогены полезны при лечении некоторых медицинских состояний и заболеваний. Например, эстрадиол, стероидный гормон, вырабатываемый яичниками, полезен при лечении остеопороза, сердечно-сосудистых заболеваний, предменструального синдрома, вазомоторных симптомов, связанных с менопаузой, атрофических вагинитов, вульвы Kraurosis, женского гипогонадизма, первичной недостаточности яичников, избыточного роста волос и рака простаты. К сожалению, введение таких стероидов было связано с рядом побочных эффектов, включая инфаркт миокарда, тромбоэмболию, заболевания сосудов головного мозга и эндометриальную карциному.
Например, гормонозамещающая терапия (HRT) эстрогеном, как был обнаружено, является клинически эффективным лечением остеопороза для женщин в период постменопаузы, однако, менее чем 15% пациенток в этом возрасте в настоящее время прописывают HRT, несмотря на клинические испытания, которые продемонстрировали 50% уменьшение количества переломов бедер и 30% уменьшение случаев сердечно-сосудистых заболеваний. Неприятие обусловлено точками зрения пациенток и врачей в отношении более чем двукратного увеличения риска возникновения эндометриального рака, наблюдаемого в случаях HRT с использованием одного эстрогена, а также связи между эстрогеновой терапией и раком груди. Хотя это не доказано в клиниках, такой предполагаемый риск возникновения рака груди привел к противопоказаниям HRT у значительного процента женщин в период постменопаузы. Было показано, что совместное лечение с прогестинами защищает матку от рака, сохраняя при этом остеозащитные эффекты эстрогена, однако, прогестин приводит к другим побочным эффектам, таким как прекращение менструаций, боль в груди и смена настроений.
В свете проблем, связанных с терапией с использованием эстрогена, было проведено значительное количество исследований для определения эффективных нестероидных эстрогенных и антиэстрогенных соединений. В общем такие соединения можно охарактеризовать как одновременно эстрогенные и антиэстрогенные, так как, хотя все они связываются с рецепторами эстрогена, они могут вызывать как эстрогенные, так и антиэстрогенные действия, в зависимости от расположения рецептора. Ранее постулировалось, что связывание различных эстрогенных и антиэстрогенных соединений с рецепторами эстрогена обусловлено присутствием общего фармакофора (представлен далее в схеме А, см. в конце описания), который повторяется в химической структуре этих соединений.
Этот фармакофор позднее стал структурным скелетом, на основании которого были созданы нестероидные эстрогенные и антиэстрогенные соединения. Его присутствие в структурах различных соединений, таких как гексестрол, тамоксифен, хроман, трифенилэтилен, DES, кломифен, центхроман, нафоксиден, триоксифен, торемифен, зиндоксифен, ралоксифен, дролоксифен, DAВP, ТАТ-59 и других структурно родственных соединений, рассматривалось специалистами как молекулярный ключ к специфичности связывания с рецепторами эстрогена.
Примером одного заслуживающего внимания нестероидного антиэстрогена является тамоксифен (ТАМ), (Z)-1,2-дифенил-1-[4-[2-(диметиламино)этокси]фенил] -1-бутен, который является производным трифенилэтилена. Тамоксифен является эффективным антагонистом промотирующих рост эффектов эстрогенов в первичных мишеневых тканях, таких как грудь и яичники.
В настоящее время этот нестероидный эстроген, а также структурно схожее соединение, известное как ралоксифен, были разработаны для лечения и/или профилактики остеопорозов, сердечно-сосудистых заболеваний и рака груди в дополнение к лечению и/или профилактике различных других болезненных состояний. Было показано, что оба эти соединения демонстрируют остеозащитный эффект в отношении минеральной плотности костных тканей наряду с положительным действием на уровни холестерина в плазме и значительно снижают число случаев возникновения рака груди и матки. К сожалению, как тамоксифен, так и ралоксифен обладают неприемлемыми уровнями угрожающих жизни побочных эффектов, таких как рак эндометрия и гепатоцеллюлярная карцинома.
Соответственно было бы желательным создать ряд нестероидных соединений, которые сохраняли бы благоприятные характеристики, такие как остеозащитная активность, сводя при этом к минимуму нежелательные побочные эффекты. Хотя в настоящее время принято, что упомянутый выше фармакофорный скелет отвечает за специфичность связывания эстрогенных рецепторов, в настоящее время было обнаружено, что можно создать, как будет раскрыто далее, такие новые связывающие эстроген лиганды, которые включают особые фрагменты в таких соединениях на основе фармакофоров, значительно усиливая такие благоприятные характеристики, как остеозащитная функция, при этом сводя к минимуму такие нежелательные характеристики, как повышенный риск возникновения рака.
Краткое описание рисунков
Фиг. 1 представляет данные относительно утеротрофической активности соединений настоящего изобретения у молодых крыс.
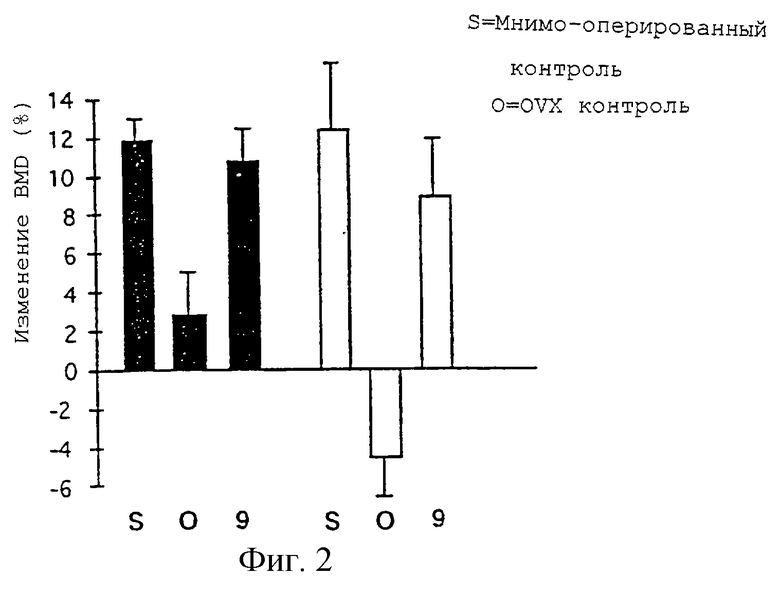
Фиг. 2 представляет данные относительно изменений минеральной плотности костной ткани в поясничном отделе позвоночника и в большой берцовой кости у крыс, подвергшихся овароэктомии.
Краткое содержание изобретения
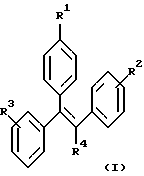
Настоящее изобретение включает ряд соединений, представленных формулой (I)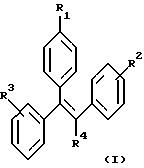
где R1-R4 имеют указанные далее значения. Кроме того, часть настоящего изобретения составляют фармацевтические композиции, включающие одно или более из соединений формулы (I), а также их использование, способы их получения и промежуточные соединения, участвующие в их синтезе.
Подробное описание изобретения
Настоящее изобретение включает ряд соединений, представленных формулой (I)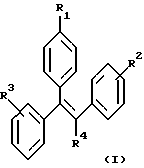
где R1 представляет -(CH2)nCR5=CR6R7; -(CH2)mC(X)NR8R9 или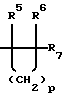
R2 и R3 независимо представляют H, -СН3, -ОН, -OCH3, -ОСН2СН3 или -СН2(СН3)2;
R4 представляет -CN, -NO2, -СН3, -СН2СН3, -CH2CH2-Y или -Y;
R5 и R6 независимо представляют Н, -С1-4алкил, -С2-4алкенил, -С2-4алкинил, -Х-С1-3aлкил, -Х-С2-4алкенил, -Х-С2-4алкинил или -Y;
R7 представляет -CN, -C1-4алкил-ОН, -С(О)О(СН3)3, -С(O)NR10R11, -С(O)NR12R13, -С1-4алкил-NR10R11, -C(О)R12, -С(О)OR12, -C(O)NR12OR13, -C(О)NHC(О)R12, -С(О)NHCH2R12, -С(NH2)(NOR12), -S(О)R12, -S(O)(О)(OR12), -S(О)(О)(NHCO2R12), PO3R12, -P(О)(NR12R13)(NR12R13), -P(O)(NR12R13)(OR14),
-C)NR12(CH2)qOCH3, -CONR12(CH2)qNR8R9 или оксадиазол, замещенный метилом; R8 и R9 независимо представляют водород, -С1-7алкил, -С3-7циклоалкил, -O-С1-7алкил, -С1-7алкил-Y или фенил;
R10 и R11 независимо представляют метил или этил или, взятые вместе, образуют морфолиногруппу, связанную через ее атом азота;
R12, R13 и R14 независимо представляют H, -С1-12алкил, -С2-12алкенил, -С2-12алкинил, -O-С1-12алкил, -О-С2-12алкенил, -О-С2-12алкинил, -С3-7циклоалкил, -С3-7циклоалкенил, линейный и циклический гетероалкил, арил, гетероарил или -Y;
Х представляет кислород или серу;
Y представляет галоген;
n представляет целое число, выбранное из 0, 1 или 2;
m представляет целое число 1 или 2;
р представляет целое число от 1 до 4;
q представляет целое число от 1 до 12.
В данном контексте термин "алкил", используемый один или в комбинации, обозначает разветвленную или неразветвленную цепочку углеводородных групп от C1 до C7, если нет других обозначений для длины цепочки. Термин "низший алкил" здесь относится к С1-4алкилу, если нет других обозначений для длины цепочки. Примеры алкильных групп включают метил, этил, н-пропил, изопропил, изобутил, н-бутил, н-гексил и т.п.
Термин "галоалкил" здесь обозначает алкил, замещенный одним или более галогенов. Термин "циклоалкил" здесь обозначает циклические углеводородные радикалы С3-С7. Некоторые примеры циклоалкильных радикалов включают циклопропил, циклобутил и циклопентил.
Термин "арил", используемый один или в сочетании, здесь обозначает моноциклическую или полициклическую группу, предпочтительно моноциклическую или бициклическую группу, т.е. фенил или нафтил, которые могут быть незамещенными или замещенными, например одним или более, в частности одним-тремя заместителями, выбранными из галогена, алкила, гидрокси, алкокси, галоалкила, нитро, амино, ациламино, алкилтио, алкилсульфинила и алкилсульфонила. Некоторыми примерами являются арильные группы, включая фенил, 2-хлорфенил, 3-хлорфенил, 4-хлорфенил, 2-метилфенил, 4-метоксифенил, 3-трифторметилфенил, 4-нитрофенил и т.п.
Термин "гетероарил" здесь обозначает 5-членную или 6-членную гетероциклическую ароматическую группу, которая может необязательно содержать конденсированное бензольное кольцо и которая может быть незамещенной или замещенной, например одним или более, в частности одним-тремя заместителями, выбранными из галогена, алкила, гидрокси, алкокси, галоалкила, нитро, амино, ациламино, алкилтио, алкилсульфинила и алкилсульфонила.
Термин "галоген" здесь обозначает фтор, хлор, бром и йод.
Термины "линейный и циклический гетероалкил" определены в соответствии с термином "алкил" при соответствующей замене атомов углерода каким-либо другим атомом, таким как азот или сера, которые придают химическую стабильность соединению.
Кроме того, указанные выше функциональные группы представлены далее в скобках "( )", окружающих некоторые атомы или группы атомов, там, где, по-видимому, желательно уточнить молекулярную структуру или схемы связывания. В частности, отдельный атом, такой как "О", или группа атомов, такая как "NН2", могут быть представлены в скобках в формулах одной из функциональных групп, представленных выше [см. например, где R7 представляет -C(О)R12, -C(О)OR12, -C(О)NR12OR13, C(NH2)(NOR12) и т.д.]. В такой ситуации скобки предназначены для того, чтобы указать, что атом или группа атомов, заключенная в них, связана с ближайшим предшествующим химически стабильным атомом, который не заключен в скобки.
Более конкретно, например, -C(О)R12 представляет функциональную группу, в которой кислород связан с углеродом, ближайшим предшествующим атомом, который не заключен в скобки и химически пригоден для связывания в соответствии с классической теорией связывания электронных орбиталей. В другом варианте -C(NH2)(NOR12) представляет функциональную группу, в которой азот, присутствующий как в NH2, так и в NOR12, связан с углеродом, ближайшим предшествующим атомом, который не заключен в скобки. Эти примеры проиллюстрированы в (а) и (b) далее. Специалистам должно быть ясно, что подходящие схемы связывания (т.е. простая, двойная связь и т.д.) очевидны в соответствии с правилами связывания орбиталей.
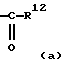
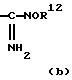
Кроме того, некоторые из указанных выше функциональных групп представлены в виде "( )" вокруг некоторых атомов или групп атомов, где сразу после скобок следуют буквенные или численные индексы [см., например, где R представляет -CONR12(CH2)qOCH3] . В этой ситуации подразумевается, что атом или группы атомов, заключенные в скобки, присутствуют в функциональной группе в количестве, указанном индексом. Например, если q=2, в формуле, где R7 представляет -CONR12(CH2)qOCH3, тогда R7 = -CONR12C2CH2OCH3.
Специалистам понятно, что в соединениях формулы (I) имеется стереоцентр. Соответственно, настоящее изобретение включает все возможные стереоизомеры и геометрические изомеры формулы (I) и включает не только рацемические смеси, но также и оптически активные изомеры. Если соединение формулы (I) необходимо в виде отдельного энантиомера, его можно получить либо разделяя конечный продукт, либо в результате стереоспецифического синтеза, либо из изомерно чистого исходного материала, либо из любого удобного промежуточного соединения. Разделение конечного продукта, промежуточного продукта или исходного материала можно осуществить любым удобным известным специалистам способом. См. , например, Stereochemistry of Carbon Compounds by E.L. Eliel (Mcgraw Hill, 1962) и Tables of Resolving Agents by S.H. Wilen. Кроме того, в тех случаях, когда возможны таутомеры соединений формулы (I), настоящее изобретение включает все таутомерные формы этих соединений.
Далее перечислены некоторые конкретные соединения формулы (I), синтез которых осуществляют в соответствии с представленными далее примерами.
1. 3-[4-(1,2-Дифенилбут-1-енил)фенил]-N,N-диэтилакриламид.
2. 3-[4-(1,2-Дифенилбут-1-енил)фенил]-N,N-диэтилпропионамид.
3. Диэтиламид 2-[4-(1,2-дифенилбут-1-енил)фенил] циклопропанкарбоновой кислоты.
4. 3-[4-(1,2-Дифенилбут-1-енил)фенил]-N,N-диэтил-2-метилакриламид.
5. Диэтиламид 3-[4-(1,2-дифенилбут-1-енил)фенил]бут-2-еновой кислоты.
6. Метиловый сложный эфир 3-[4-(1,2-дифенилбут-1-енил)фенил]акриловой кислоты.
7. 3-[4-(1,2-Дифенилбут-1-енил)фенил]акрилонитрил.
8. трет-Бутиловый сложный эфир 3-[4-(1,2-дифенилбут-1-енил)фенил]aкриловой кислоты.
9. 3-[4-(1,2-Дифенилбут-1-енил)фенил]акриловая кислота.
10. 3-[4-(1,2-Дифенилбут-1-енил)фенил]-1-морфолин-4-ил-проп-2-ен-1-он.
11. 3-[4-(1,2-Дифенилбут-1-енил)фенил]-N-(3-метоксипропил)акриламид.
12. N,N-Дициклогексил-3-[4-(1,2-дифенилбут-1-енил)фенил]акриламид.
13. N-(2-Диметиламиноэтил)-3-[4-(1,2-дифенилбут-1-енил)фенил] -N-этилакриламид.
14. 3-[4-(1,2-Дифенилбут-1-енил)фенил]-N-метил-N-октилакриламид.
15. 3-[4-[1,2-Дифенилбут-1-енил)фенил]акриламид.
16. 3-[4-(1,2-Дифенилбут-1-енил)фенил]-N-этилакриламид.
17. 1-Амино-3-[4-(1,2-дифенилбут-1-енил)фенил]проп-2-ен-1-он- оксим.
18. 3-{2-[4-(1,2-Дифенилбут-1-енил)фенил]винил}-5-метил-[1,2,4]-оксадиазол.
19. 3-[4-(1,2-Дифенилбут-1-енил)фенил]проп-2-ен-1-ол.
20. {3-[4-(1,2-Дифенилбут-1-енил)фенил]аллил}диметиламин.
21. 3-[4-(1,2-Дифенилбут-1-енил)фенил]-N,N-диэтилтиоакриламид.
22. 3-[4-(1,2-Дифенилбут-1-енил)фенил]-N-(3-гидроксипропил)акриламид.
Обычно соединения формулы (I) можно получить в соответствии со следующими схемами синтеза. Во всех приведенных далее схемах специалистам хорошо понятно, что при необходимости следует использовать защитные группы в соответствии с общими принципами химии. Эти защитные группы удаляют на конечных стадиях синтеза в основных, кислотных или гидрогенолитических условиях, которые совершенно очевидны специалистам. Используя соответствующие манипуляции и защиту любых химических функциональностей, можно осуществить синтез любых представленных далее соединений формулы (I) способами, которые аналогичны способам, представленным в схемах B-G далее, а также способами, описанными в разделе Примеры.
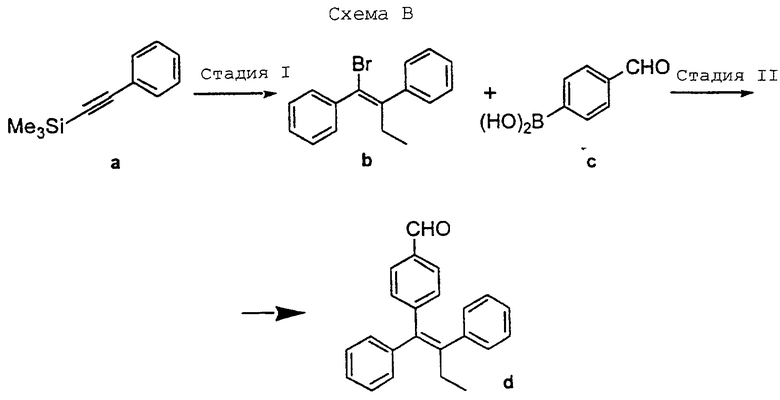
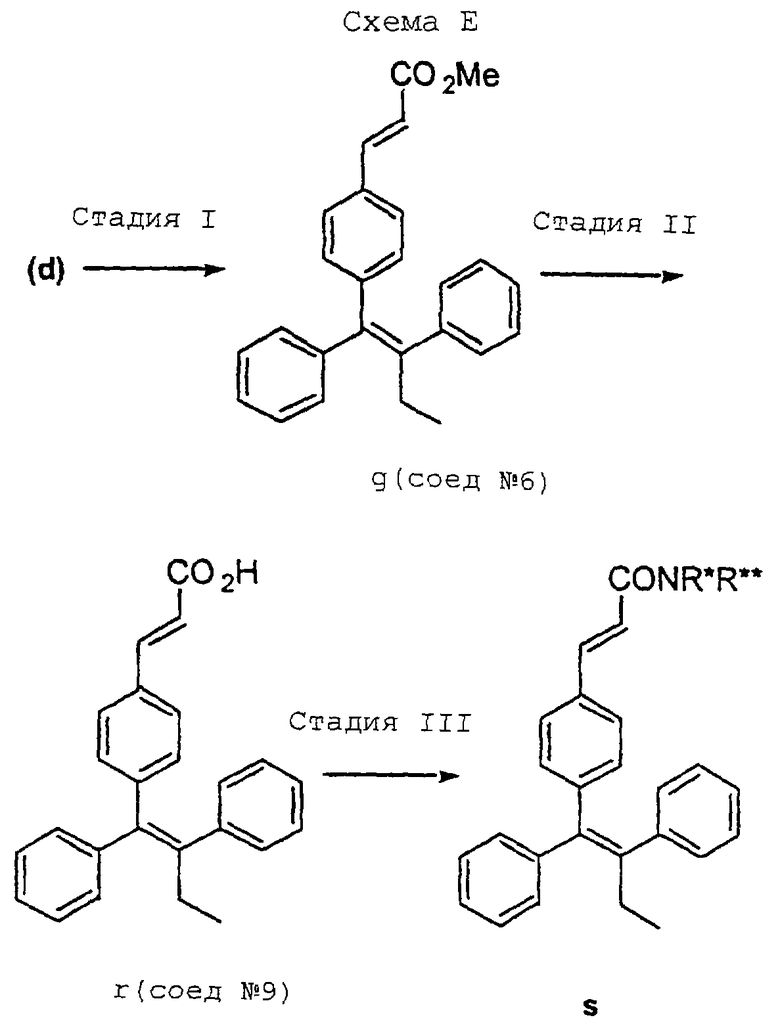
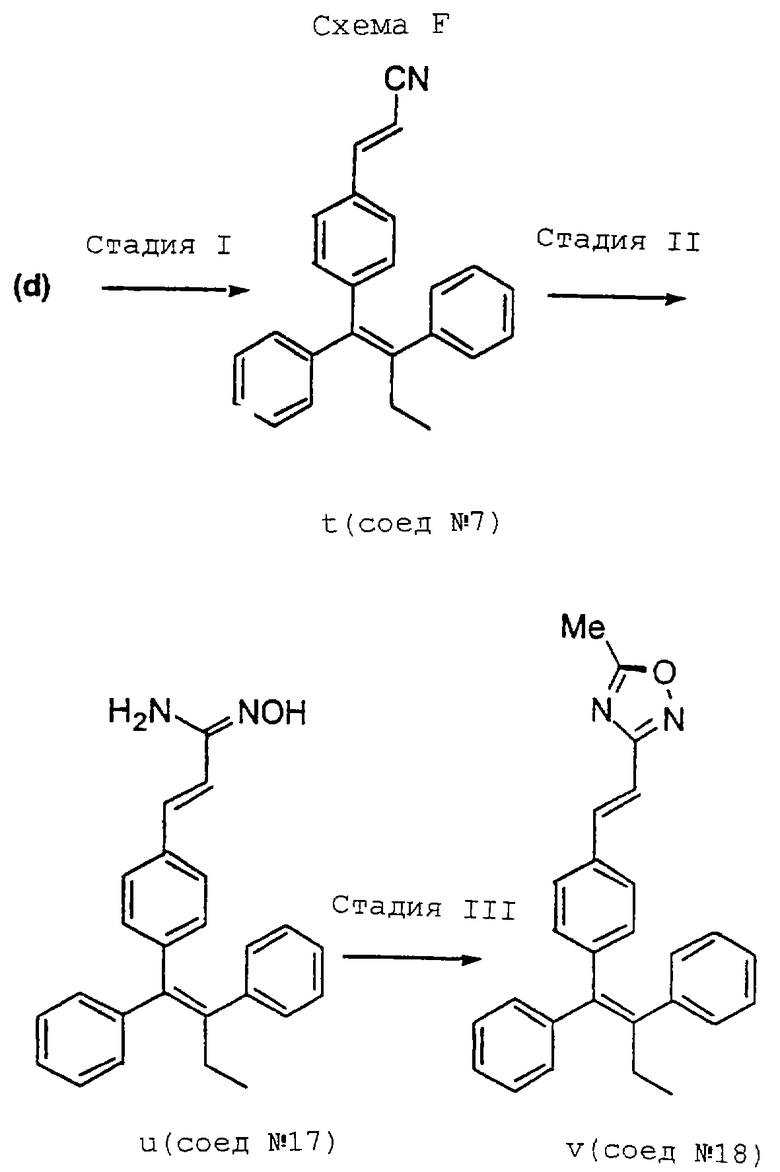
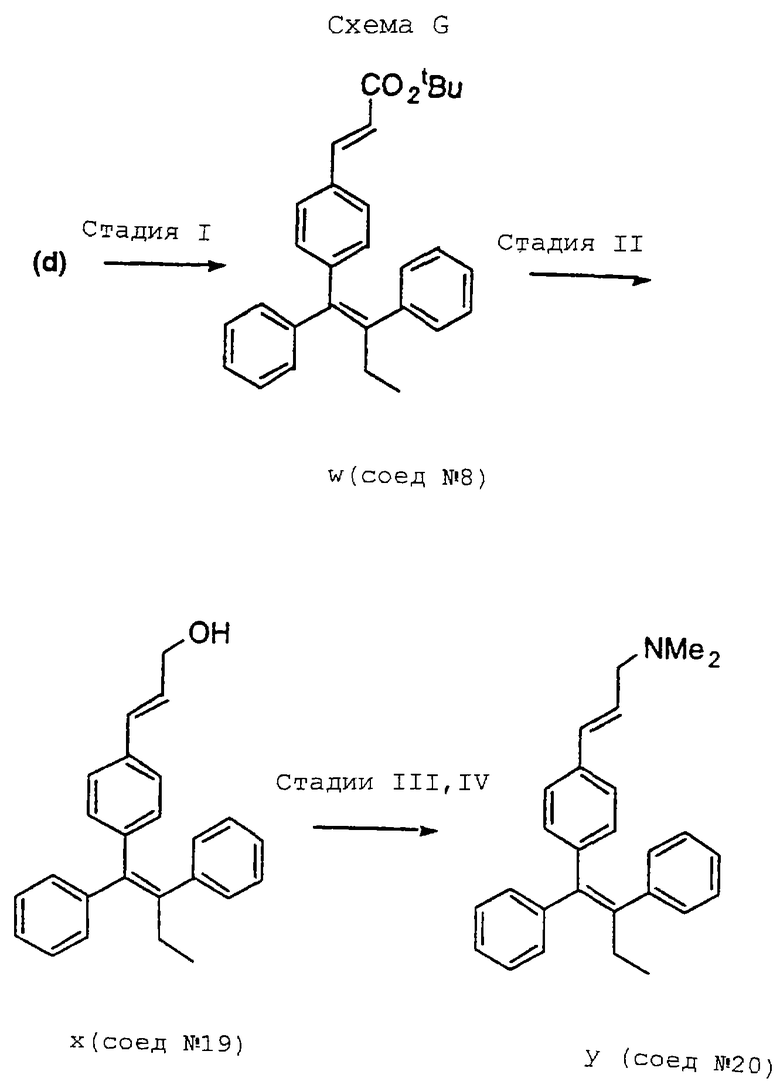
Обычно синтез, используемый для получения соединений настоящего изобретения, конструируют таким образом, чтобы обеспечить доступ к аналогам В-кольца с Е-конфигурацией центральной тетразамещенной двойной связи. Один способ получения соединений формулы (I) включает схему В, представленную в конце описания, где подходящий бромид, такой как бромид (b) [например, (Е)-1-бром-2-фенил-1-(триметилсилил)-1-бутен], синтезируют в количестве нескольких грамм из ацетилена (а), используя способ Миллера (см. Miller R.B., Al-Hassan, M. I. Stereospecific Synthesis of (Z)-Tamoxifen via Carbometalation of Alkylsilanes. J. Org. Chem., 1985, 50, 2121-2123). Осуществляют реакцию сочетания бромида (b) с подходящей арилбороновой кислотой, такой как (с), над палладиевым катализатором, получая целевой альдегид (d) [например, (Z)-1,2-дифенил-1-(4-формилфенил)-1-бутен] , в виде индивидуального изомера. Бромид (b) и альдегид (d) являются универсальными промежуточными соединениями для синтеза аналогов В-кольца тамоксифена.
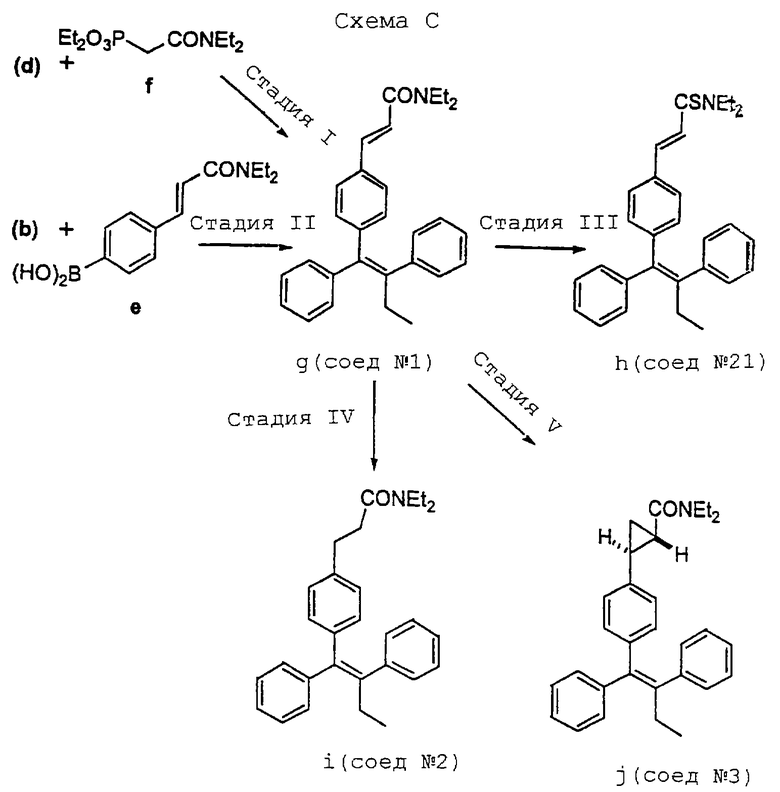
Как представлено (в конце описания) на схеме С, в результате реакции сочетания бромида (b) и арилбороновой кислоты (е) получают а,b-ненасыщенный диэтиламид (g), который является Соединением 1 в вышеприведенном списке, и проиллюстрирован далее в примере 2. Следует отметить, что такой способ синтеза этого диэтиламида может привести к низкому выходу, возможно из-за термической нестабильности арилбороновой кислоты (е). Было также отмечено при создании соединений настоящего изобретения, что идентификация диэтиламида (g) как представляющего интерес соединения (т.е. Соединения 1: 3-[4-(1,2-дифенилбут-1-енил)фенил] -N,N-диэтилакриламида) диктует необходимость в более эффективном способе синтеза для получения аналогов. Соответственно было обнаружено, что в результате реакции Horner-Emmons альдегида (d) с фосфонатом (f) достигается значительно более высокий выход диэтиламида (g).
Кроме того, представленная выше схема С иллюстрирует, что а,b-ненасыщенный диэтиламид (g) можно превратить в:
(a) тиоамид (h) [Соединение 21: 3-[4-(1,2-дифенилбут-1-енил)фенил]-N, N-диэтилтиоакрилэмид], используя реагент Lawesson's;
(b) насыщенный амид (i) [Соединение 2: 3-[4-(1,2-дифенилбут-1-енил)фенил]-N,N-диэтилпропионамид], используя гидрирование, или
(c) циклопропиламид (j), [Соединение 3: 2-[4-(1,2-дифенилбут-1-енил)фенил]циклопропанкарбоновой кислоты диэтиламид], используя илид Соrey.
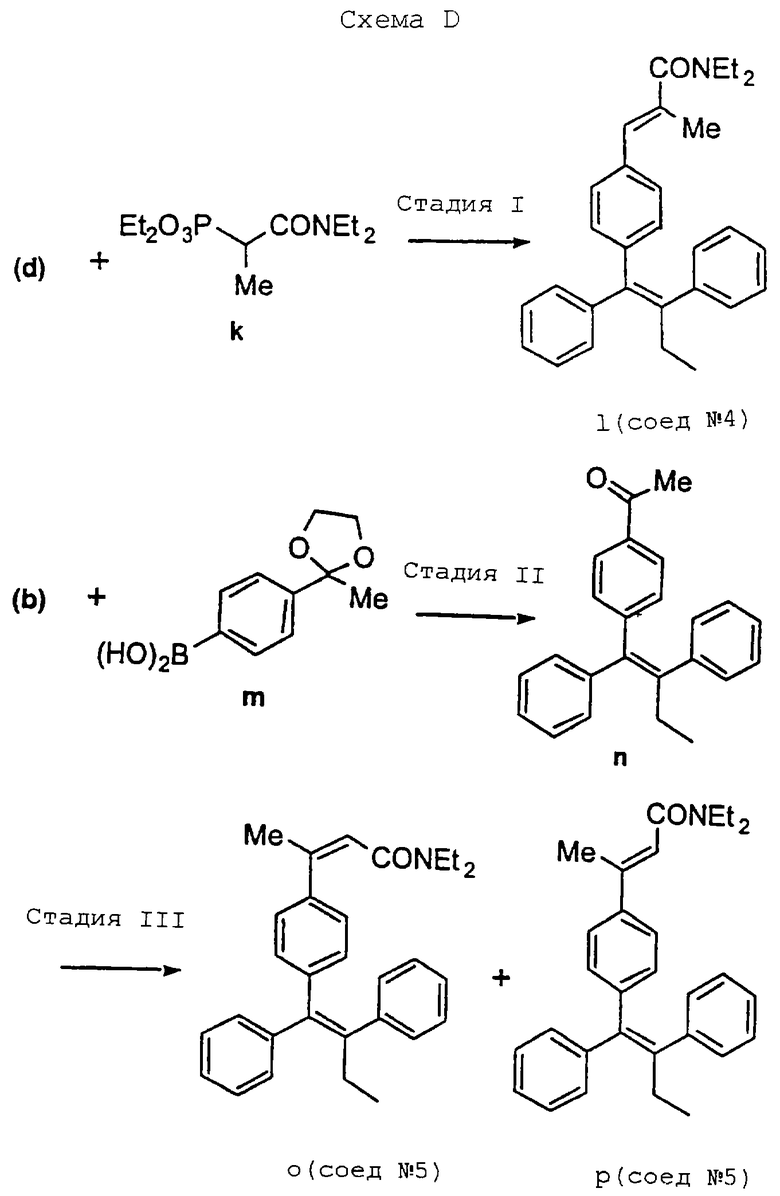
В соответствии с представленной (в конце описания) схемой D аналоги диэтиламида (g), включающие тризaмещенную а,b-ненасыщенную двойную связь, можно синтезировать из соответствующего альдегида, такого как (d), или подходящего кетона, такого как (n).
Более конкретно реакцию Hommer-Emmons метилфосфоната (к) с альдегидом (d) можно использовать для получения а-метиламида (I) [Соединение 4: 3-[4-(1,2-дифенилбут-1-енил)фенил] -N, N-диэтил-2-метилакриламид] в виде индивидуального изомера, а реакцию фосфоната (f) с кетоном (n) можно использовать для получения смеси Е- и Z-b-метиламидов (о,р) [Соединение 5: 3-[4-(1,2-дифенилбут-1-енил)фенил]-бут-2-еновой кислоты диэтиламид, (Z)- и (E)-изомеры], которые можно разделить с помощью флеш-хроматографии, причем их относительную стереохимию определяют с помощью 1Н ЯМР, NOE последующих исследований.
На схеме Е, приведенной в конце описания, показано, как можно получить карбоновую кислоту (r) [Соединение 9: 3-[4-(1,2-дифенилбут-1-енил)фенил]акриловая кислота] в результате омыления метилового сложного эфира (q) [Соединение 6: 3-[4-(1,2-дифенилбут-1-енил)фенил]акриловой кислоты сложный метиловый эфир] , который, в свою очередь, можно получить в результате конденсации альдегида (d) с триметилфосфоноацетатом, как представлено на схеме D. Схема Е иллюстрирует также как карбоновую кислоту (r) можно использовать в качестве ключевого промежуточного соединения для синтеза целого ряда а, b-ненеасыщенных амидов с последующим присоединением ряда линейных и циклических алкил- и гетероалкиламинов.
В соответствии со схемой F, представленной в конце описания, оксадиазол (v) [Соединение 18: 3-{2-[4-(1,2-дифенилбут-1-енил)фенил]винил}-5-метил-[1,2,4] -оксадиазол] можно синтезировать из нитрила (t) [Соединение 7: 3-[4-(1,2-дифенилбут-1-енил)фенил] акрилонитрил] в результате реакции с гидроксиламимом, получая амидоксим (u) [Соединение 18: 3-{2-[4-(1,2-дифенилбут-1-енил)фенил]винил}-5-метил-[1,2,4]-оксадиазол] с последующей циклизацией за счет ангидрида уксусной кислоты.
На представленной в конце описания схеме G показано, как спирт (х) [Соединение l9: 3-[4-(1,2-дифенилбут-1-eнил)фенил] проп-2-ен-1-ол] и диметиламин (y) [Соединение 20: {3-[-4-(1,2-дифенилбут-1-енил)фенил]аллил}диметиламин] можно синтезировать из трет-бутилового сложного эфира (w) [Соединение 8: 3-[4-(1,2-дифенилбут-1-енил)фенил] акриловой кислоты трет-бутиловый сложный эфир] путем восстановления водородом с последующим мезилированием и алкилированием диметиламином.
Общие процедуры
Если нет других указаний, все исходные материалы получают из коммерческих источников и используют без дальнейшей очистки. Температуры плавления определяют в капиллярных трубках на приборе Mel-Temp и не вносят поправки. Спектры 1Н ЯМР и 13С ЯМР получают на приборе Varian Unity-300 и Varian XRL-300, используя ТМС в качестве внутреннего стандарта в CDC13. Химические сдвиги даны в м. д. (δ); мультиплетность обозначена как с (синглет), д (дублет), т (триплет), кв (квартет), м (мультиплет), шир. (уширенный). Константы взаимодействия (J) представлены в Гц (Герц). Микроанализ проводили в Atlantic Microlabs, Inc., и все значения отличаются от теоретических величин на±0,4%. Масс-спектры получены на масс-спектрометре JEOL JMS-AX505HA с использованием ионизации за счет бомбардировки быстрыми атомами. Инфракрасные спектры записаны на инфракрасном спектрофотометре Perkin-Elmer 1280. Аналитическую тонкослойную хроматографию осуществляют на стеклянных пластинках с покрытием ЕМ Science silica 60 F254, а визуализацию осуществляют с помощью УФ-света, иода или молибдата аммония. Флеш-хроматографию осуществляют на силикагеле ЕМ Science 230-400 меш., жидкостную хроматографию среднего давления осуществляют на Pharmacia LKB Series системе, используя детектор Rainin Dynamax UV-C и колонку с силикагелем Merck Lobar SI 60 (40-63 мм). ВЭЖХ осуществляют на Shimadzu LC-6A Series ВЭЖХ, используя либо колонку Rainin Dynamax Ct8 RP, либо колонку Rainin Dynamax Silica column. Все растворители были реагентной степени чистоты и использовались без дополнительной очистки. (Е)-1-Бром-2-фенил-1-(триметилсилил)-1-бутен [см. (b), Схема В, выше] получают по способу Miller, как указано выше, а 4-формилбороновую кислоту получают по способу Noth (см. Feulner Н., Linti G., Noth H. Preparation and Structural Characterization of p-Formylbenzeneboronic Acid. Chem. Ber. , 1990, 123, 1841-1843. Бороновые кислоты [см. (е) и (m), Схемы С и D соответственно] были получены в Glaxo Group Research Ltd., Hertfordshire, UK, из 3-(4-бромфенил)-N,N-диэтилакриламида и 4-бромацетофенона соответственно с использованием способа Gilman (see Gilman H., Santucci L., Swayampati D. R. , Ranck R.O. Hydroxybenzeneboronic Acids and Anhydrides. J. Am. Chem. Soc., 1957, 79, 3077-3082.
Нижеследующие соединения получают в соответствии с общими способами синтеза, изложенными выше, и примеры приведены для лучшей иллюстрации способов получения соединений настоящего изобретения. Эти примеры являются лишь иллюстративными и ни коим образом не ограничивают объем настоящего изобретения.
Пример 1
(Z)-1,2-Дифенил-1-(4-формилфенил)-1-бутен
Раствор 1,0 г (3,5 ммоль) (Е)-1-бром-2-фенил-1-(триметилсилил)-1-бутена, 625 мг (4,2 ммоль, 1,2 экв.) бороновой кислоты [см. (с), Схема В] и 400 мг (0,35 ммоль, 0,1 экв) Pd(PPh3)4 в 10 мл DME обрабатывают 2 мл 2 н. Nа2СО3, а затем кипятят с обратным холодильником в течение 6 часов. Раствор охлаждают до комнатной температуры, выливают в NаНСО3 (40 мл), экстрагируют этилацетатом (2 х 40 мл), сушат над сульфатом магния и растворитель удаляют в вакууме. В результате очистки с помощью флеш-хроматографии на силикагеле, используя в качестве элюента смесь гексан/этилацетат 20:1, получают 700 мг (69%) указанного в заголовке целевого соединения в виде твердого вещества желтого цвета.
1Н ЯМР (CDC13, 300 МГц) δ: 9,82 (с, 1Н), 7,55-7,00 (м, 14Н), 2,48 (кв, 2Н), 0,97 (т, 3Н). Масс-спектр низкого разрешения m/е 313 (МH+) [см., например, (d), Схема В].
Пример 2
3-[4-(1,2-Дифенилбут-1-енил)фенил]-N,N-диэтилакриламид
Процедура А. Раствор 51 мг (0,18 ммоль, 1,1 экв.) (Е)-1-бром-2-фенил-1-(триметилсилил)-1-бутена, 40 мг (0,16 ммоль) арилбороновой кислоты [см. (е), Схема С] и 20 мг (16,2 ммоль, 0,1 экв.) Pd(PPh3)4 в 5 мл DME обрабатывают 0,5 мл 2 н. Nа2СО3, а затем кипятят с обратным холодильником в течение 2 часов. Раствор охлаждают до комнатной температуры, выливают в NaHCO3 (20 мл), экстрагируют этилацетатом (2 х 20 мл), сушат над сульфатом магния и растворитель удаляют в вакууме. В результате очистки с помощью флеш-хроматографии на силикагеле, используя в качестве элюента смесь гексан/этилацетат 3: 1, получают 10 мг (15%) указанного в заголовке целевого соединения в виде твердого вещества белого цвета. Т. пл. 138-140oС.
1Н ЯМР (CDCl3, 300 МГц) δ: 7,53 (д, 1Н, J=15,4), 7,38-7,11 (м, 12Н), 6,86 (д, 2Н, J=8,3), 6,66 (д, 1H, J=15,4), 3,40 (м, 4Н), 2,47 (кв, 2Н, J= 7,3), 1,19 (м, 6Н), 0,93 (т, 3H, J=7,3). Масс-спектр высокого разрешения: рассчитано 410,2483, найдено 410,2484.
Процедура В. Используя диэтилдиэтилкарбамоилметиленфосфонат [см. (f), Схема С], как указано в общей процедуре для реакции сочетания Horner-Emmons (см. пример 7) с альдегидом, получают (Z)-1,2-дифенил-1-(4-формилфенил)-1-бутен, после очистки с помощью флеш-хроматографии на силикагеле, используя градиент гексан/этилацетат 20:1-->2:1, 110 мг (42%) указанного в заголовке целевого соединения в виде твердого вещества белого цвета. Т. пл. 137-138oС.
1H ЯМР (СDС13, 300 МГц) δ: 7,53 (д, 1Н, J=15,4), 7,36-7,11 (м, 12Н), 6,86 (д, 2H, J=8,3), 6,66 (д, 1Н, J=15,4), 3,42 (м, 4Н), 2,47 (кв, 2H, J= 7,3), 1,19 (м, 6Н), 0,93 (т, 3H, J=7,3). Анализ: (C29H31NO) С, Н, N [см., например, (g), Схема С, выше].
Пример 3
3-[4-(1,2-Дифенилбут-1-енил)фенил]-N,N-диэтилтиоакриламид
Смесь 65 мг (0,16 ммоль) 3-[4-(1,2-дифенилбут-1-енил)фенил]-N,N-диэтилакриламида (см. пример 2) и 39 мг (95,2 ммоль, 0,6 экв.) реагента Lawesson's нагревают в 2 мл сухого толуола при 85oС в течение 2 часов. Раствор охлаждают до комнатной температуры и вводят непосредственно в колонку с силикагелем для флеш-хроматографии. В результате очистки, элюируя смесью гексан/этилацетат 10: 1, получают 54 мг (83%) тиоамида указанного в заголовке целевого соединения в виде пены желтого цвета. Т. пл. 43-61oС.
1Н ЯМР (СDС13, 300 МГц) δ: 7,85 (д, 0,5Н), 7,75 (д, 0,5Н), 7,65 (д, 0,5Н), 7,40-6,80 (м, 13,5Н), 4,05 (м, 2Н), 3,70 (м, 2Н), 2,45 (м, 2Н), 1,30 (м, 6Н), 0,95 (м, 3Н).
13Н ЯМР (СDC13, 75 МГц) δ: 193,83, 144,56, 143,96, 143,18, 143,11, 141,92, 138,26, 133,00, 131,22, 130,83, 129,66, 128,28, 128,01, 127,91, 127,86, 127,70, 127,48, 127,02, 126,83, 126,45, 124,04, 48,54, 46,40, 29,19, 13,86, 13,67, 13,62, 11,66.
ИК (СРС13): 3050, 1520, 1210, 950, 750.
Анализ: (C29H31NS) С, H, N [см., например, (h), Схема С выше].
Пример 4
3-[4-(1,2-Дифенилбут-1-енил)фенил]-N,N-диэтилпропионамид
Раствор 50 мг (0,12 ммоль) 3-[4-(1,2-дифенилбут-1-енил)фенил]-N,N-диэтилакриламида (см. пример 2) и 3 мг комплекса трис(трифенилфосфин)родий(I)хлорид (катализатор Вилкинсона) в 1 мл сухого толуола перемешивают в атмосфере газообразного водорода при 50oС в течение 16 часов. Раствор охлаждают до комнатной температуры и толуол удаляют в вакууме. В результате очистки остатка с помощью флеш-хроматографии на силикагеле, используя в качестве элюента смесь гексан/этилацетат 2:1, получают 48 мг (95%) указанного в заголовке целевого соединения в виде прозрачного бесцветного масла.
1Н ЯМР (СDС13, 300 МГц) δ: 7,37-7,11 (м, 10H), 6,85 (д, 2Н, J=8,3), 6,78 (д, 2H, J=8,3), 3,31 (кв, 2H, J=7,1), 3,08 (кв, 2H, J=7,3), 2,81 (т, 2H, J= 8,3), 2,44 (м, 4Н), 1,03 (м, 6Н), 0,91 (т, 3H, J=7,3). Масс-спектр низкого разрешения m/e 412 (МН+). Анализ: (C29H33NO) С, H, N [см., например, (i), Схема С, выше].
Пример 5
Диэтиламид 2-[4-(1,2-дифенилбут-1-енил)фенил] циклопропанкарбоновой кислоты
Раствор 12 мг (0,24 ммоль, 2,0 экв.) гидрида натрия (50% в масле) и 54 мг (0,24 ммоль, 2,0 экв.) триметилоксосульфонийиодида в 2 мл сухого диметилсульфоксида перемешивают в течение 30 минут при комнатной температуре, причем к этому времени прекращается выделение газа. Затем добавляют раствор 50 мг (0,12 ммоль) амида, полученного в примере 2, в 0,5 мл диметилсульфоксида и полученный раствор нагревают при 50oС в течение 16 часов. Реакционную смесь охлаждают до комнатной температуры, выливают в 20 мл воды, экстрагируют этилацетатом (2 х 20 мл). Органические слои объединяют, сушат над сульфатом магния и растворитель удаляют в вакууме. В результате очистки с помощью жидкостной хроматографии среднего давления на силикагеле, используя в качестве элюента смесь гексан/этилацетат 4:1, получают 32 мг (62%) указанного в заголовке целевого соединения в виде твердого вещества белого цвета. Т. пл. 42-44oС.
1Н ЯМР (СDС13, 300 МГц) δ: 7,37-7,10 (м, 10Н), 6,76 (м, 4Н), 3,38 (кв, 4H, J=7,1), 2,45 (кв, 2Н, J=7,4), 2,30 (м, 1Н), 1,79 (м, 1Н), 1,55 (м, 1Н), 1,11 (м, 7Н), 0,92 (т, 3H, J=7,4). Масс-спектр низкого разрешения m/е 424 (MH+). Анализ: (С30Н33NО) С, Н, N [см., например, (j), Схема С, ранее].
Пример 6
(Метил)диэтилдиэтилкарбамоилметиленфосфонат
Раствор 4,4 мл (2,2 ммоль, 1,1 экв.) KN(TMS)2 (0,5 М в толуоле) добавляют к охлажденному (-78oС) раствору 500 мг (2,0 ммоль) диэтилдиэтилкарбамоилметиленфосфоната в 5 мл сухого ТГФ. Полученный раствор перемешивают в течение 10 мин, затем добавляют 0,15 мг (2,4 ммоль, 1,2 экв.) метилиодида (без растворителя). Полученному раствору дают нагреться до комнатной температуры и перемешивают 1 час, затем выливают в рассол (70 мл) и экстрагируют этилацетатом (2 х 60 мл). Органические слои объединяют, сушат над сульфатом магния и растворитель удаляют в вакууме. В результате очистки желтого остатка перегонкой в Kugelrohr получают 525 мг (100%) указанного в заголовке целевого соединения в виде прозрачного бесцветного масла. Т. кип. 155oС при 0,15 мм рт. ст.
1Н ЯМР (CDC13, 300 МГц) δ: 4,18 (м, 4Н), 3,60 (м, 1Н), 3,22 (м, 4Н), 1,37 (м, 9Н), 1,18 (м, 6Н). [см., например, (k), Схема С].
Пример 7
Общая процедура для реакций Horner-Emmons с (Z)-1,2-дифенил-1-(4-формилфенил)-1-бутенoм
Раствор 1,2 экв. KN(TMS)2 (0,5 М в толуоле) добавляют к перемешиваемому при 0oС раствору 1,2 экв. соответствующего фосфоната в сухом ТГФ. Полученный раствор перемешивают в течение 15 мин при 0oС, затем охлаждают до -78oС и по каплям добавляют раствор (Z)-1,2-дифенил-1-(4-формилфенил)-1-бутена в ТГФ. Полученному раствору дают нагреться до комнатной температуры и перемешивают в течение 4 часов, затем нагревают при 50oС в течение 2 часов, чтобы обеспечить завершение реакции. Реакционную смесь охлаждают до комнатной температуры, выливают в рассол и дважды экстрагируют этилацетатом. Органические слои объединяют, сушат над сульфатом магния, растворитель удаляют в вакууме, а остаток очищают с помощью флеш-хроматографии на силикагеле.
Пример 8
3-[4-(1,2-Дифенилбут-1-енил)фенил]-N,N-диэтил-2-метилакриламид
Используя (метил)диэтилдиэтилкарбамоилметиленфосфонат, как указано ранее, после очистки с помощью флеш-хроматографии на силикагеле, используя в качестве элюента смесь гексан/этилацетат 3:1, получают 36 мг (53%) указанного в заголовке целевого соединения в виде прозрачного бесцветного масла.
1Н ЯМР (CDCl3, 300 МГц) δ: 7,39-7,11 (м, 10Н), 6,97 (д, 2Н, J=8,0), 6,85 (д, 2Н, J=8,3), 6,32 (с, 1Н), 3,38 (м, 4Н), 2,47 (кв, 2Н, J=7,3), 2,00 (с, 3Н), 1,14 (т, 6Н, J=7,1), 0,93 (т, 3Н, J=7,3). Масс-спектр низкого разрешения m/е 424. Анализ: (С30Н33NО) С, Н, N [см., например, (1), Схема D ранее].
Пример 9
Диэтиламид (Z)- и (Е)-3-[4-(1,2-дифенилбут-1-енил)фенил]-бут-2-еновой кислоты
Используя диэтилдиэтилкарбамоилметиленфосфонат, как использован выше, в результате очистки с помощью флеш-хроматографии на силикагеле, используя в качестве элюента смесь гексан/этилацетат 5:2, получают 95 мг (49%) указанного в заголовке целевого (Z)-изомера в виде твердого вещества белого цвета и 11 мг (6%) (Е)-изомера в виде бесцветного масла.
Аналитические данные для (Z)-изомера: т. пл. 109-111oС.
1H ЯМР (CDC13, 300 МГц) δ: 7,39-7,09 (м, 12Н), 6,85 (д, 2Н, J=8,3), 6,20 (д, 1Н, J=1,0), 3,44 (кв, 2Н, J=7,1), 3,33 (кв, 2H, J=7,1), 2,47 (кв, 2Н, J= 7,5), 2,16 (д, 3Н, J=1,0), 1,13 (м, 6Н), 0,93 (т, 3Н, J=7,6). Масс-спектр низкого разрешения m/с 424. Анализ: (С30Н33NО) С, Н, N.
Аналитические данные для (Е)-изомера.
1Н ЯМР (CDCl3, 300 МГц) δ: 7,36-7,09 (м, 10Н), 7,00 (д, 2Н, J=8,3), 6,81 (д, 2Н, J=8,2), 5,80 (д, 1Н, J=1,0), 3,22 (кв, 2Н, J=7,2), 2,91 (кв, 2Н, J= 7,1), 2,45 (кв, 2Н, J=7,6), 2,04 (д, 3Н, J=1,0), 0,89 (м, 6Н), 0,74 (т, 3Н, J= 7,6). Масс-спектр низкого разрешения m/е 424. Анализ: (С30Н33NО) [см., например, (о,р), Схема D ранее].
Пример 10
Метиловый сложный эфир 3-[4-(1,2-дифенилбут-1-енил)фенил]акриловой кислоты
Используя триметилфосфоноацетат, как указано выше, в результате очистки с помощью флеш-хроматографии на силикагеле, используя в качестве элюента смесь гексан/этилацетат 20:1, получают 2,33 г (100%) указанного в заголовке целевого соединения в виде твердого вещества белого цвета. Т. пл. 133-135oС.
1Н ЯМР (CDCl3, 300 МГц) δ: 7,53 (д, 1Н, J=16,0), 7,39-7,10 (м, 12Н), 6,88 (д, 2Н, J=8,3), 6,27 (д, 1Н, J=16,0), 3,76 (с, 3Н), 2,48 (кв, 2H, J= 7,3), 0,93 (т, 3Н, J=7,3). Масс-спектр низкого разрешения m/е 369. Анализ: (C26H24O2) С, Н, N [см., например, (q), Схема Е ранее].
Пример 11
3-[4-(1,2-Дифенилбут-1-енил)фенил]акрилонитрил
Используя диэтил цианометилфосфонат, как указано выше, в результате очистки с помощью флеш-хроматографии на силикагеле, используя в качестве элюента смесь гексан/этилацетат 10:1, получают 125 мг (93%) указанного в заголовке целевого соединения в виде прозрачного бесцветного масла, которое отверждается при стоянии. Т. пл. 101-102oС.
1Н ЯМР (CDC13, 300 МГц) δ: 7,40-7,07 (м, 13Н), 6,90 (д, 2Н, J=8,6), 5,79 (д, 1Н, J= 16,6), 2,46 (кв, 2H, J= 7,3), 0,93 (т, 3H, J=7,3). Анализ: (C25H21N) С, Н, N [см., например, (t), Схема F ранее].
Пример 12
трет-Бутиловый сложный эфир 3-[4-(1,2-дифенилбут-1-енил)фенил]акриловой кислоты
Используя трет-бутилдиэтилфосфоноацетат, как указано выше, в результате очистки с помощью флеш-хроматографии на силикагеле, используя в качестве элюента смесь гексан/этилацетат 20:1, после перекристаллизации из горячего гексана получают 52 мг (95%) указанного в заголовке целевого соединения в виде твердого вещества белого цвета. Т. пл. 139-140oС.
1Н ЯМР (CDC13, 300 МГц) δ: 7,44-7,09 (м, 13Н), 6,86 (д, 2H, J=8,3), 6,20 (д, 1H, J= 16,1), 2,47 (кв, 2H, J=7,4), 1,49 (с, 9H), 0,93 (т, 3H, J=7,4). Масс-спектр низкого разрешения m/e 373, МН+ отсутствует. Анализ: (С29Н30О2) С, H, N [см., например, (w), Схема G ранее].
Пример 13
1-[4-(1,2-Дифенилбут-1-енил)фенил]этанон
Раствор 172 мг (0,60 ммоль) (Е)-1-бром-2-фенил-1-(триметилсилил)-1-бутена [см (b), Схема В, ранее] , 125 мг (0,60 ммоль, 1,0 экв.) бороновой кислоты [см. (м), Схема D] и 70 мг (0,06 ммоль, 0,1 экв.) Pd(PPh3)4 в 8 мл DME обрабатывают 0,4 мл 2 н. Na2CO3, а затем кипятят с обратным холодильником в течение 18 часов. Раствор охлаждают до комнатной температуры, выпивают в рассол (20 мл), экстрагируют этилацетатом (2 х 20 мл), сушат над сульфатом магния, и растворитель удаляют в вакууме. В результате очистки с помощью флеш-хроматографии на силикагеле, используя в качестве элюента смесь гексан/этилацетат 20: 1, получают 152 мг (78%) указанного в заголовке целевого соединения в виде твердого вещества желтого цвета.
1Н ЯМР (CDC13, 300 МГц) δ: 7,6 (д, 2Н), 7,45-7,10 (м, 10Н), 6,98 (д, 2Н), 2,48 (м, 3Н), 0,94 (т, 3Н) [см., например, (n), Схема D ранее].
Пример 14
3-[4-(1,2-Дифенилбут-1-енил)фенил]акриловая кислота
Раствор 50 мл (16 ммоль, 10,0 экв.) 0,2 М КОН добавляют по каплям в течение 2 минут к раствору 600 мг сложного эфиpa, полученного по способу примера 10 (1,6 ммоль, 1,0 экв.), в 90 мл смеси метанол/ТГФ 1:2. Полученный раствор перемешивают в течение 18 часов при комнатной температуре и растворитель удаляют в вакууме. Остаток растворяют в 30 мл 1М НСl и экстрагируют этилацетатом (2 х 60 мл). Органические слои объединяют, сушат над сульфатом магния и растворитель удаляют в вакууме. В результате очистки с помощью флеш-хроматографии на силикагеле, используя в качестве элюента смесь метиленхлорид/метанол 95: 5, получают 370 мг (63%) указанного в заголовке целевого соединения в виде твердого вещества белого цвета. Т. пл. 148-150oС.
1Н ЯМР (СDС13, 300 МГц) δ: 7,60 (д, 1Н, J=15,9), 7,39-7,10 (м, 12Н), 6,89 (д, 2Н, J=8,1), 6,27 (д, 1H, J=15,9), 2,48 (кв, 2Н, J=7,3), 0,93 (т, 3Н, J=7,3). Масс-спектр низкого разрешения m/е 355. Анализ: (С25Н2202) С, Н, N [см., например, (r), Схема Е ранее].
Пример 15
Общая процедура для реакций сочетания 3-[4-(1,2-дифенилбут-1-енил)фенил] акриловой кислоты
К раствору 1,0 экв. кислоты (20) в сухом метиленхлориде добавляют 1,0 экв. ЕDC, 1,3 экв. НОВТ и 1,0 экв. Et3N, a затем 1,2 экв. соответствующего амина. Полученный раствор перемешивают в течение 18 часов при комнатной температуре, затем выливают в 20 мл Н2О и дважды экстрагируют этилацетатом (2 х 60 мл). Органические слои объединяют, промывают Н2О (1 х 20 мл), сушат над сульфатом магния, растворитель удаляют в вакууме, а остаток очищают с помощью флеш-хроматографии на силикагеле, жидкостной хроматографии на силикагеле или перекристаллизацией.
Пример 16
3-[4-(1,2-Дифенилбут-1-енил)фенил]-1-морфолин-4-ил-проп-2-ен-1-он
Используя морфолин, в результате последующей счистки с помощью жидкостной хроматографии среднего давления на силикагеле, используя в качестве элюента смесь гексан/этилацетат 2:1, после перекристаллизации из горячего гексана получают 12 мг (14%) указанного в заголовке целевого соединения в виде твердого вещества белого цвета. Т. пл. 150-154oС.
1Н ЯМР (CDCl3, 300 МГц) δ: 7,53 (д, 1Н, J=15,4), 7,39-7,10 (м, 12Н), 6,87 (д, 2H, J=8,3), 6,67 (д, 1H, J=15,4), 3,65 (м, 8H), 2,48 (кв, 2H, J= 7,3), 1,26 (шир. 8H), 0,93 (т, 3H, J=7,3). Масс-спектр низкого разрешения m/е 424. Анализ: (C29H29NO2) С, H, N [см., например, (s), Схема Е ранее].
Пример 17
3-[4-(1,2-Дифенилбут-1-енил)фенил]-N-(3-метоксипропил)акриламид
Используя 3-метоксипропиламин, в результате последующей очистки с помощью жидкостной хроматографии среднего давления на силикагеле, используя в качестве элюента смесь гексан/этилацетат 2:1, получают 20 мг (30%) указанного в заголовке целевого соединения в виде твердого вещества белого цвета. Т. пл. 132-135oС.
1Н ЯМР (CDC13, 300 МГц) δ: 7,43 (д, 1Н, J=15,7), 7,36-7,10 (м, 12Н), 7,86 (д, 2Н, J=8,3), 6,20 (д, 1Н, J=15,7), 3,46 (м, 4Н), 3,34 (с, 1Н), 2,48 (кв, 2Н, J=7,5), 1,80 (м, 2Н), 0,92 (т, 3H, J=7,5). Масс-спектр низкого разрешения m/е 426. Анализ: (С29Н31NO2) С, Н, N [см., например, (s), Схема Е ранее].
Пример 18
N,N-Дициклогексил-3-[4-(1,2-дифенилбут-1-енил)фенил]акриламид
Используя дициклогексиламин, в результате последующей очистки путем перекристаллизации из смеси горячий гексан/этилацетат 2:1 получают 29 мг (28%) указанного в заголовке целевого соединения в виде твердого вещества белого цвета. Т. пл. 194-200oС.
1Н ЯМР (CDC13, 300 МГц) δ: 7,43-7,11 (м, 13Н), 6,86 (д, 2Н, J=8,3), 6,69 (д, 1H, J=15,4), 3,50 (м, 2Н), 2,48 (кв, 2Н, J=7,3), 2,25 (м, 2Н, 1,77-1,62 (2 м, 12H), 1,30-1,10 (м, 8H), 0,93 (т, 3Н, J=7,3). Масс-спектр низкого разрешения m/e 518. Анализ: (С37Н43NO) С, Н, N [см., например (s), Схема Е ранее].
Пример 19
Кислый оксалат N-(2-диметиламиноэтил)-3-[4-[1,2-дифенилбут-1- енил)фенил]-N-этилакрилата
Используя 2-диметиламиноэтиламин, в результате последующей очистки с помощью флеш-хроматографии на силикагеле, используя в качестве элюента смесь метиленхлорид/метанол 15:1, после получения соли - кислого оксалата с использованием 1,1 экв. щавелевой кислоты в Et2О, получают 58 мг (53%) указанного в заголовке целевого соединения в виде твердого вещества белого цвета. Т. пл. 145-147oС.
1Н ЯМР (CDC13, 300 МГц) δ: 7,51 (д, 1Н, J=15,1), 7,38-7,10 (м, 12Н), 6,88 (д, 2Н), 6,60 (д, 1Н, J=15,1), 6,12 (м, 2Н), 3,70 (м, 2Н), 3,47 (м, 3Н), 3,35 (м, 2Н), 2,90 (м, 4Н), 2,48 (кв, 2H, J=7,4), 1,20 (м, 2Н); 0,93 (т, 3Н, J=7,4). Масс-спектр низкого разрешения m/е 453. Анализ: (С31Н36N2О С2Н2О4) С, Н, М [см., например, (s), Схема Е ранее].
Пример 20
3-[4-(1,2-Дифенилбут-1-енил)фенил]-N-(3-гидроксипропил)акриламид
Используя 3-гидроксипропиламин, в результате последующей очистки с помощью жидкостной хроматографии среднего давления на силикагеле, используя в качестве элюента градиент смеси гексан/этилацетат 2:1 до 100% этилацетата, после перекристаллизации из горячего гексана получают 14 мг (15%) указанного в заголовке целевого соединения в виде твердого вещества белого цвета. Т. пл. 144-146oС.
1Н ЯМР (СDС13, 300 МГц) δ: 7,47 (д, 1Н, J=15,6), 7,36-7,10 (м, 12Н), 7,86 (д, 2Н, J=8,3), 6,22 (д, 1H, J=15,6), 3,62 (м, 2Н), 3,51 (м, 2Н), 3,25 (т, 1Н), 2,47 (кв, 2Н, J=7,3), 1,71 (м, 2Н), 0,94 (т, 3H, J=7,3). Масс-спектр низкого разрешения m/е 412. Анализ: (C28H29NO2) С, Н, N [см., например, (s), Схема Е ранее].
Пример 21
3-[4-(1,2-Дифенилбут-1-енил)фенил]-N-метил-N-октилакриламид
Используя N-метил-N-октиламин, в результате последующей очистки с помощью жидкостной хроматографии среднего давления на силикагеле, используя в качестве элюента смесь гексан/этилацетат 3:1, получают 56 мг (41%) указанного в заголовке целевого соединения в виде твердого вещества белого цвета, Т. пл. 150-154oС. 108-109oС.
1Н ЯМР (CDC13, 300 МГц) δ: 7,52 (д, 1Н, J=15,4), 7,38-7,14 (м, 12Н), 6,86 (д, 2Н, J=7,8), 6,68 (дд, 1Н, J=15,4), 3,00 (д, 4Н), 2,48 (кв, 2Н, J= 7,3), 1,26 (м, 8Н), 0,93 (т, 3H, J=7,3), 0,86 (м, 6Н). Масс-спектр низкого разрешения m/е 480. Анализ: (С34H41NО) С, Н, N [см., например, (s), Схема Е ранее].
Пример 22
3-[4-(1,2-Дифенилбут-1-енил)фенил]акриламид
Используя насыщенный раствор аммиака в СН2С12, в результате последующей очистки с помощью жидкостной хроматографии среднего давления на силикагеле, используя в качестве элюента смесь гексан/этилацетат 2:1, получают 39 мг (39%) указанного в заголовке целевого соединения в виде твердого вещества белого цвета. Т. пл. 200-202oС.
1Н ЯМР (CDC13, 300 МГц) δ: 7,47 (д, 1Н, J=15,6), 7,39-7,10 (м, 12Н), 6,87 (д, 2Н, J=8,3), 6,27 (д, 1H, J=15,6), 2,48 (кв, 2H, J=7,3), 0,93 (т, 3H, J=7,3). Масс-спектр низкого разрешения m/е 354. Анализ: (С25Н30NO) С, H, N.
Пример 23
3-[4-(1,2-Дифенилбут-1-енил)фенил]-N-этилакриламид
Раствор 0,2 мл (0,4 ммоль, 1,2 экв.) оксалилхлорида (2 М в СН2С12) добавляет к перемашиваемому при 0oС раствору 120 мг (0,3 ммоль) кислоты, полученной по способу примера 14, в 2 мл сухого метиленхлорида. Полученный раствор оставляют нагреваться до комнатной температуры и перемешивают в течение ночи. Растворитель удаляют в вакууме, а остаток растворяют в 2 мл эфира и затем добавляют к быстро перемешиваемому раствору 23 мл этиламина (70 вес. % в Н2О) (0,4 ммоль, 1,2 экв.) в 2 мл 1М NaOH. Полученный раствор перемешивают при комнатной температуре в течение 2 часов. Реакционную смесь выливают в этилацетат и экстрагируют; водный слой промывают этилацетатом (3 х 10 мл). Органические слои объединяют, сушат над сульфатом магния, растворитель удаляют в вакууме, а остаток очищают путем перекристаллизации из горячего этилацетата, получая 45 мг (35%) указанного в заголовке целевого соединения в виде твердого вещества белого цвета. Т. пл. 192-193oС.
1Н ЯМР (CDCl3, 300 МГц) δ: 7,45 (д, 1H, J=15,6), 7,39-7,10 (м, 12H), 6,86 (д, 2H, J=8,1), 6,20 (д, 1H, J=15,6), 3,38 (м, 2Н, J=7,3], 2,48 (кв, 2Н, J= 7,3), 1,17 (т, 3H, J=7,3), 0,93 (т, 3H, J=7,3). Масс-спектр низкого разрешения m/e 382. Анализ: (C27H27NO) С, H, N [см., например, (s), Схема Е ранее].
Пример 24
1-Амино-3-[4-(1,2-дифенилбут-1-енил)фенил]-проп-2-ен-3-он- оксим
Раствор 1,16 мл (1,16 ммоль, 3,1 экв.) метоксида натрия в метаноле (1,0 М) добавляют к раствору 78 мг (1,12 ммоль, 3,0 экв.) гидрохлорида гидроксиламина в 4 мл сухого метанола. Полученный раствор кипятят с обратным холодильником в течение 15 минут, затем охлаждают до комнатной температуры. Добавляют раствор 125 мг (0,37 ммоль) нитрила, полученного по способу примера 11, который растворен в 2 мл смеси сухой метанол/ТГФ 2:1, и реакционную смесь кипятят с обратным холодильником в течение 16 часов. Реакционную смесь охлаждают, выливают в 20 мл рассола и экстрагируют этилацетатом (2 х 20 мл), сушат над сульфатом магния и растворители удаляют в вакууме. В результате очистки с помощью флеш-хроматографии на силикагеле получают 61 мг (47%) указанного в заголовке целевого соединения в виде твердого вещества белого цвета. Т. пл. 182-185oС.
1Н ЯМР (CDC13, 300 МГц) δ: 7,38-7,07 (м, 12Н), 6,85 (д, 2Н, J=8,0), 6,68 (д, 1Н, J=16,7), 6,32 (д, 1H, J=16,7), 4,60 (с, шир, 2Н), 2,47 (кв, 2Н, J= 7,6), 2,17 (с, 1Н), 0,93 (т, 3Н, J=7,6). Масс-спектр низкого разрешения m/e 369. Анализ: (С25Н24N2О) С, Н, N [см., например, (u), Схема F ранее].
Пример 25
3-{2-[4-(1,2-Дифенилбут-1-енил)фенил]винил}-5-метил-[1,2,4]-оксадиазол
Раствор 60 мг (0,16 ммоль) амидоксима, полученного по способу примера 24, который находится в 5 мл уксусного ангидрида, нагревают при 80oС в течение 18 часов, охлаждают до комнатной температуры, выливают в 10 мл 4 н. NaOH и экстрагируют этилацетатом (2 x 20 мл). Органические слои объединяют, сушат над сульфатом магния, а растворитель удаляют в вакууме. Сырой материал очищают с помощью флеш-хроматографии на силикагеле, используя в качестве элюента смесь гексан/эталацетат 10: 1, получая 21 мг слегка загрязненного продукта, который перекристаллизовывают из смеси горячий метанол/этилацетат 10: 1, получая 13 мг (20%) указанного в заголовке целевого соединения в виде твердого кристаллического вещества белого цвета. Т. пл. 158-159oС.
1Н ЯМР (CDC13, 300 МГц) δ: 7,50 (д, 1Н, J=16,4), 7,37-7,12 (м, 13Н), 6,87 (м, 2Н), 2,58 (с, 3Н), 2,47 (кв, 2Н, J=7,3), 0,93 (т, 3Н, J=7,3). Масс-спектр низкого разрешения m/е 392. Анализ: (С27Н24N2О) С, Н, N (см., например, (v), Схема F ранее].
Пример 26
3-[4-(1,2-Дифенилбут-1-енид)фенил]-проп-2-ен-1-ол
Раствор 1,35 мл (1,35 ммоль, 2,5 экв.) 1,0 М DIBAL-H в ТГФ добавляют по каплям к охлажденному до -78oС раствору сложного эфира, полученного по способу примера 12, который находится в 3 мл ТГФ. Полученный раствор перемешивают в течение 30 минут при -78oС, затем нагревают до комнатной температуры и перемешивают в течение 16 часов. Избыток DIBAL-H гасят 1 н. НСl и реакционную смесь выливают в 20 мл 1 н. НСl и экстрагируют этилацетатом (2 х 20 мл). Органические слои объединяют, сушат над сульфатом магния и растворитель удаляют в вакууме. В результате очистки остатка с помощью флеш-хроматографии на силикагеле, используя в качестве элюента смесь гексан/этилацетат 5: 1, получают 94 мг (60%) указанного в заголовке целевого соединения в виде твердого вещества белого цвета. Т. пл. 80-83oС.
1Н ЯМР (CDCl3, 300 МГц) δ: 7,41-7,02 (м, 12Н), 6,82 (д, 2Н, J=8,3), 6,45 (д, 1H, J=15,8), 6,23 (дт, 1Н, J=5,8, 15,9), 4,24 (м, 2Н), 2,47 (кв, 2H, J= 7,6), 1,31 (т, 1Н, J=5,9), 0,93 (т, 3H, J=7,6). Масс-спектр низкого разрешения m/e 340. Анализ: (C25H24O) С, Н [см., например, (х), Схема G ранее].
Пример 27
{3-[4-(1,2-Дифенилбут-1-енил)фенил]аллил}диметиламин
Раствор 90 мг (0,27 ммоль) спирта, полученного по способу примера 26, и 41 мг (0,32 ммоль, 1,2 экв.) диизопропилэтиламина в 2 мл сухого дихлорметана обрабатывают 33 мг (0,29 ммоль, 1,1 экв.) метансульфонилхлорида и полученный раствор перемешивают при комнатной температуре в течение 3 часов. Затем раствор выливают в 10 мл этилацетата и экстрагируют 10 мл рассола, сушат над сульфатом магния и растворители удаляют в вакууме, получая 108 мг (97%) густого золотистого масла. Этот материал немедленно растворяют в 3 мл сухого метанола, а затем добавляют 1 мл диметиламина. Полученный раствор перемешивают в течение 16 часов при комнатной температуре, затем растворители удаляют в вакууме. Остаток растворяют в 10 мл этилацетата и экстрагируют 1 н. НСl. Водный слой выделяют и подщелачивают, добавляя 3 н. NaOH, а затем экстрагируют этилацетатом (2 х 10 мл). Щелочные экстракты объединяют, сушат над сульфатом магния и растворитель удаляют в вакууме. В результате очистки с помощью жидкостной хроматографии среднего давления на силикагеле, используя в качестве элюента смесь дихлорметан/метанол 15:1, получают 37 мг (40%) указанного в заголовке целевого соединения в виде прозрачного бесцветного масла.
1Н ЯМР (CDC13, 300 МГц) δ: 7,37-7,09 (м, 10Н), 7,02 (д, 2Н, J=8,5), 6,81(д, 2Н, J=8,1), 6,34 (д, 1Н, J=15,9), 6,14 (дт, 1Н, J=6,6, 15,9), 3,17 (д, 2Н, J=6,6), 2,59-2,42 (м, 6Н), 1,01 (т, 6Н, J=7,3), 0,92 (т, 3Н, J=7,4). Масс-спектр низкого разрешения m/е 396. Анализ: (C29H33N) С, Н, N [см., например, (y), Схема G ранее].
Соединения формулы (I), которые содержат кислотные фрагменты, могут образовывать фармацевтически приемлемые соли с подходящими катионами. Подходящие фармацевтически приемлемые катионы включают катионы щелочных металлов (например, натрия или калия) и щелочноземельных металлов (например, кальция или магния). В свете вышеизложенного любые ссылки на соединения настоящего изобретения, появляющиеся здесь, включают как соединения формулы (I), так и их фармацевтически приемлемые соли и сольваты.
Как было указано ранее, соединения настоящего изобретения пригодны для лечения и/или профилактики различных нарушений или состояний, таких как сердечно-сосудистые заболевания, рак груди, остеопороз и артриты. Некоторые другие примеры нарушений или состояний, при которых соединения настоящего изобретения также полезны для лечения и/или профилактики, включают предменструальный синдром, вазомоторные симптомы, связанные с менопаузой, атрофические вагиниты, Kraurosis вульву, женский гипогонадизм, первичную недостаточность яичников, избыточный рост волос и рак простаты.
Специалистам должно быть ясно, что сделанные здесь ссылки на лечение распространяются как на профилактику, так и на лечение стабильных заболеваний или симптомов. Следует учитывать также, что количество соединения настоящего изобретения, необходимое для использования при лечении, будет меняться в зависимости от природы состояния подлежащего лечению, возраста и состояния пациента и, в конечном счете, зависит от решения лечащего врача или ветеринара. Однако обычно дозы, используемые для лечения взрослых, находятся в интервале значений от 0,001 мг/кг до около 100 мг/кг в день. Нужная доза может быть как в виде единичной дозы, так и может быть разделена на отдельные дозы, принимаемые с соответствующими интервалами, например, как две, три, четыре или более доли дозы в день.
В настоящем изобретении предложены также новые фармацевтические композиции соединений формулы (I). Хотя возможно, что соединения настоящего изобретения можно принимать с терапевтической целью просто как химический препарат, предпочтительно, чтобы активный ингредиент был в виде фармацевтической композиции. Соответственно в настоящем изобретении предложены далее фармацевтические композиции, включающие соединение формулы (I) или его фармацевтически приемлемую соль, вместе с одним или более из фармацевтически приемлемых носителей, и необязательно другие терапевтические и/или профилактические ингредиенты. Носитель (носители) должен быть "приемлемым" в том смысле, что он должен быть совместим с другими ингредиентами композиции и не должен наносить вреда реципиенту.
Композиции настоящего изобретения можно вводить стандартными способами для лечения указанных заболеваний, например перорально, парэнтерально, сублингвально, трансдермально, ректально, за щеку или с помощью ингаляций. Для приема за щеку композиции могут иметь форму таблеток или пастилок, приготовленных обычные способом. Например, таблетки или капсулы для перорального приема могут содержать обычные эксципиенты, такие как связывающие агенты (например, сиропы, акацию, желатин, сорбит, трагакант, растительный крахмал, или поливинилпирролидон), наполнители (например, лактозу, сахар, микрокристаллическую целлюлозу, кукурузный крахмал, кальцийфосфат или сорбит), смазывающие агенты (например, стеарат магния, стеариновую кислоту, тальк, полиэтиленгликоль или двуокись, кремния), разрыхлители (например, картофельный крахмал или натрийкрахмалгликоллят) или смачивающие агенты, такие как натрийлаурилсульфат. На таблетки может быть нанесено покрытие в соответствии с известными специалистам способами.
В другом варианте соединения настоящего изобретения могут быть включены в жидкие препараты для перорального приема, такие как, например водные или масляные суспензии, растворы, эмульсии, сиропы или эликсиры. Кроме того, композиции, содержащие эти соединения, могут быть в виде сухих продуктов, предназначенных для разбавления водой или другими подходящими носителями перед употреблением. Такие жидкие препараты могут содержать обычные добавки, такие как суспендирующие агенты, такие как сироп сорбита, метилцеллюлоза, глюкозо/сахарный сироп, желатин, гидроксиэтилцеллюлоза, карбоксиметалцеллюлоза, гель стеарата алюминия или гидрированные пищевые жиры; эмульгирующие агенты, такие как лектин, сорбитанмоноолеат или акация; неводные носители (которые могут включать пищевые масла), такие как миндальное масло, фракционированное кокосовое масло, сложные эфиры масел, пропиленгликоль или этиловый спирт, и консерванты, такие как метил- или пропил-п-гидроксибензоаты или сорбиновая кислота.
Такие препараты можно также приготовить в виде суппозиториев, например содержащих обычные основания для суппозиториев, такие как масло какао и другие глицериды. Композиции для ингаляций обычно можно приготовить в форме растворов, суспензий или эмульсий, которые можно принимать в виде сухого порошка или в форме аэрозолей, используя удобные пропелланты, такие как дихлордифторметан или трихлорфторметан. Типичные трансдермальные композиции включают обычные водные или неводные носители, такие как кремы, мази, лосьоны или пасты, или могут быть в форме лечебных пластырей, накладок или мембран.
Кроме того, композиции настоящего изобретения можно приготовить для парентерального введения путем инъекций или непрерывных вливаний. Композиции для инъекций могут быть в таких формах, как суспензии, растворы или эмульсии в масляных или в водных носителях, и могут содержать такие принятые в фармацевтике агенты, как суспендирующие, стабилизирующие и/или разрыхляющие агенты. В другом варианте, активный ингредиент может быть в форме порошка для разбавления перед употреблением подходящим носителем (например, стерильной, не содержащей пирогена водой).
Композиции настоящего изобретения могут быть также приготовлены в виде препаратов пролонгированного действия. Такие композиции длительного действия могут вводиться путем имплантации (например, подкожно или внутримышечно) или путем внутримышечной инъекции. Соответственно соединения настоящего изобретения могут быть приготовлены вместе с подходящими полимерными или гидрофобными материалами (как, например, в виде эмульсий в подходящем масле), ионообменными смолами или в виде слабо растворимых производных, таких как, например, слабо растворимые соли.
Биологическую активность соединений формулы (I) оценивают в соответствии со следующими схемами, результаты которых приводятся далее. В частности, соединения формулы (I) можно оценить в отношении их профилей остеозащитной активности и антиутеротрофической активности, используя способы, изложенные далее в следующих схемах.
Специалистам, должно быть ясно, что некоторые приемлемые варианты анализов связывания эстрогенных рецепторов у крыс известны и доступны для начального скринирования соединений настоящего изобретения в отношении их способности связывать соответствующие рецепторы. Соединения вначале оценивают, как изложено далее в анализе связывания рецепторов эстрогена у крыс по их способности ингибировать связывание [3Н] -эстрадиола. Соединения, которые демонстрируют ИК50<10 мкМ, направляют для in vitro функционального анализа эстрогенной активности в отношении человеческой эндометриальной клеточной линии Ишикавы (Ishikava), как изложено далее.
Субконфлюэнтные клетки Ishikava-Var удаляют из поддерживающих рост условий и снова суспендируют в не содержащей фенола красного DMEM-F12, содержащей 5% очищенной древесным углем FBS и 2 мМ глутамина в концентрации 58500 клеток/мл. Клетки высевают при плотности 13000 клеток/см2 и помещают в инкубатор (37oС, 5% СО2) на 3 дня. Клетки собирают и снова суспендируют в не содержащей фенола красного DMEM-F12, содержащей 1% очищенной древесным углем FBS, 2 мМ глутамина, 100 Ед/мл пенициллина и 100 мкг/мл стрептомицина в концентрации 83000 клеток/мл. Клетки высевают при плотности 8300 клеток/ячейку в 96-ячеечные пластины и оставляют для прикрепления на ночь. Добавляют соответствующую обработку лекарствами в 2 Х концентрациях в 0,1 мл среды, содержащей 0,2% ДМСО. Пластины инкубируют в течение 2 дней, среду отсасывают и пластины промывают один раз 300 мкл 0,9% стерильного рассола. Пластины замораживают при -70oС, а затем нагревают до комнатной температуры. Прикрепившиеся клетки анализируют на активность щелочной фосфатазы, добавляя 200 мкл 5 мМ п-нитрофенилфосфата в 1 М диэтаноламине, рН 10,4, содержащем 0,1% (вес/объем) Triton Х-100, инкубируя при 37oС в течение 30 минут и измеряя поглощение на 405 нм на считывающем устройстве Molecular Devices ThermoMax plate reader.
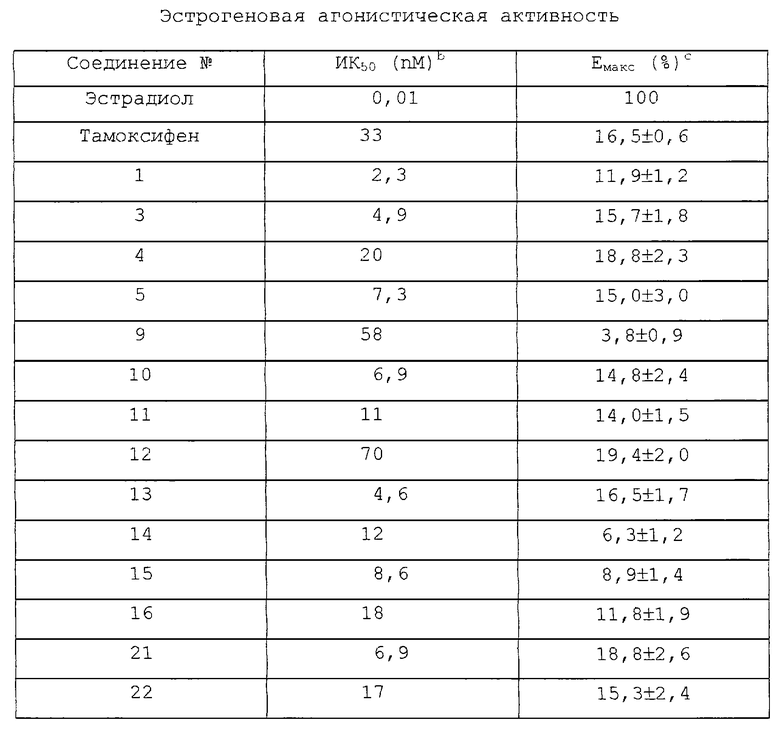
Соединения настоящего изобретения анализируют, как указано выше, для того, чтобы оценить их способность вызывать экспрессию щелочной фосфатазы, in vitro реакцию, специфическую для агонистов эстрогена, которая, как было показано, коррелирует с in vitro утеротрофической реакцией агонистов эстрогена у крыс. В таблице далее результаты выражены как концентрация различных представительных соединений настоящего изобретения, которая вызывает 50% их максимальной активности щелочной фосфатазы (Емакс), причем максимальную активность выражают как процент активности щелочной фосфатазы, вызванной насыщающей концентрацией эстрадиола. В дополнительных исследованиях было показано, что все соединения, в которою Емакс было <20%, действуют как антагонисты эстрадиола в концентрациях, которые отражают их сходства с рецепторным связыванием.
Было обнаружено, что соединение 1 связывается с эстрогеновым рецептором с приблизительно 10-кратно большим сродством, нежели тамоксифен, что сдвигает его к более низким ЕС50 в функциональном анализе клеток Ишикавы (см. таблицу ). Кроме того, соединение 1 обладает значительно более низкой агонистической активностью (Емакс), нежели тамоксифен. Оценивался ряд амидных аналогов соединения 1 для того, чтобы установить структурные требования для снижения ЕС50 и минимизации Емакс в функциональном анализе Ишикавы. Результаты показывают, что широкий круг структурных отличий (лиофильность, стерическая объемность, доноры и акцепторы Н-связи) возможен в этом диапазоне молекул, и лишь объемное соединение 12 демонстрирует пониженное сродство с рецептором. Соединение 1 демонстрирует наивысшее сродство в анализе связывания рецепторов и обладает наименьшей EC50 в функциональном анализе, однако, при анализе результатов для Емакс оказывается, что соединения 9, 14 и 15 демонстрируют самую низкую остаточную агонистическую активность.
Для того чтобы оценить представленные ранее соединения в отношении их in vivo антиутеротрофической активности, группы из пяти 21 дневных самок SD крыс (30-35 г) взвешивают и регистрируют веса для каждой обрабатываемой группы, как представлено на фиг.1. Исходные растворы (10Х) аналогов трифенилэтилена в этаноле разбавляют 0,5% метилцеллюлозой и животным принудительно вводят дозы по 10 мкмоль/кг. Эстрадиол растворяют в кунжутном масле и подкожной инъекцией вводят дозы 100 нмоль/кг. Животным вводят дозы в течение 3 дней, а на 4 день их умерщвляют путем удушения СО2. Тела взвешивают, матки удаляют, осушают и взвешивают. Результаты выражают как вес матки/вес тела± стандартная ошибка. Сплошные прямоугольники представляют результаты, полученные для животных, которым вводили только тестовое соединение. Пустые прямоугольники представляют результаты, полученные для животных, которым тестовые соединения вводили за 6 часов до дозы эстрадиола. Соединения 9 и 15 демонстрируют остаточную агонистическую активность, которая меньше, чем у тамоксифена.
В качестве примера функционального профиля этих соединений в отношении костной ткани соединение 9 оценивали для 90 дневных крыс с дефицитом эстрогена после овароэктомии по их способности ингибировать уменьшение плотности костной ткани. 90 дневных SD крыс разделили на группы по 6. Трем группам хирургическим путем удалили яичники. Через 2 дня после овароэктомии животным принудительно вводили либо 10 мкмоль/кг соединения 9 в 0,5% метилцеллюлозе, либо носитель раз в день в течение 28 дней. Одной группе провели симуляцию операции и через 2 дня после операции вводили носитель раз в день в течение 28 дней. На 0, 14 и 28 день крыс анестезировали изофлураном и помещали в положение на спине, причем их спины были параллельны длинной оси денситометрического стола. Поясничный отдел позвоночника сканировали, используя тазовые кости в качестве маркировочного знака. Для сканирования правой большеберцовой кости лапу фиксировали в положении, параллельном длинной оси стола, и сканировали вплоть до соединения с бедром. Анализы поясничного отдела позвоночника осуществляли путем деления позвоночного и межпозвоночного пространства, используя нормальные аналитические программы и включая только мишеневые позвонки во всем интересующем участке. Правую большеберцовую кость анализировали с помощью субрегиональных программ высокого разрешения, фокусируя на 3-5 мм к периферии от пластины роста, ранее идентифицированной как участок ускоренной потери костной ткани, связанной с овароэктомией. Результаты на 14 и 28 день существенно не отличались. Результаты, полученные на 28 день, представлены на фиг.2. На фиг.2 пероральное введение дозы в 10 мкмоль/кг соединения 9 демонстрирует полную агонистическую активность, сохраняя BMD на уровнях для крыс, подвергшихся симуляционной операции, на протяжении 28 дневных исследований. Результаты биохимического анализа показывают, что механизм действия осуществляется за счет ингибирования костной резорбции, что соответствует их активности в качестве агонистов эстрогена в костной ткани. BMD определяют с помощью двухэнергетической рентгеноскопической абсорбциометрии, используя костный денситометр Hologic QDR-2000 и региональный пакет программ высокого разрешения с граничной длиной сканирования, шириной, положением линии и точечным разрешением 5,2705, 0,0254 и 0,0127 см соответственно.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛИДИНОНА В КАЧЕСТВЕ АГЕНТОВ МУСКАРИНОВЫХ РЕЦЕПТОРОВ | 2002 |
|
RU2288919C2 |
| КОНДЕНСИРОВАННЫЕ ТРИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ДЛЯ ЛЕЧЕНИЯ ПСИХОТИЧЕСКИХ РАССТРОЙСТВ | 2005 |
|
RU2409582C2 |
| ЗАМЕЩЕННЫЕ ДИАЛКИЛ (ОКСИДО)-Λ-СУЛЬФАНИЛИДЕН НИКОТИНАМИД ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ | 2014 |
|
RU2711749C2 |
| ПРОИЗВОДНЫЕ ХИНОЛИНА И ХИНАЗОЛИНА СО СРОДСТВОМ К 5HT-РЕЦЕПТОРАМ | 2004 |
|
RU2402533C2 |
| ИМИДАЗО[1,2-А]ПИРИДИНОВЫЕ И ПИРАЗОЛ[2,3-А]ПИРИДИНОВЫЕ ПРОИЗВОДНЫЕ | 2000 |
|
RU2248976C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИНГИБИТОРОВ ФОСФОДИЭСТЕРАЗЫ-4 | 2003 |
|
RU2323938C2 |
| СОЕДИНЕНИЯ | 2003 |
|
RU2327690C2 |
| МУСКАРИНОВЫЕ АГОНИСТЫ | 2001 |
|
RU2269523C2 |
| ЗАМЕЩЕННЫЕ ЭФИРЫ ФЕНИЛУКСУСНОЙ КИСЛОТЫ В КАЧЕСТВЕ КОРОТКОДЕЙСТВУЮЩИХ СЕДАТИВНЫХ СНОТВОРНЫХ АГЕНТОВ ДЛЯ КРАТКОВРЕМЕННОЙ АНЕСТЕЗИИ И СОЗДАНИЯ СЕДАТИВНОГО ЭФФЕКТА, ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ | 2003 |
|
RU2315037C2 |
| МАКРОЦИКЛИЧЕСКИЕ АНТИБИОТИКИ ШИРОКОГО СПЕКТРА ДЕЙСТВИЯ | 2020 |
|
RU2834484C2 |

Изобретение относится к области органической химии. Описываются производные трифенилэтилена общей формулы (I)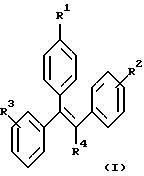
где R1 представляет -(CH2)nCR5=СR6R7; -(CH2)mC(X)NR8R9 или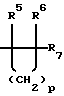
R2 и R3 представляют H; R4 представляет -СН2СН3; R5 и R6 независимо представляют Н, -С1-4алкил; R7 представляет -CN, -С1-4алкил-ОН, C(O)NR10R11, -C(O)NR12R13, -C1-4алкин-NR10R11, -C(О)OR12 или оксадиазол, замещенный метилом; R8 и R10 представляют -С1-7алкил; R10 и R11 независимо представляют метил или этил; R12, R13 представляют -С1-12алкил; Х представляет кислород; n представляет целое число, выбранное из 0, 1 или 2; m представляет целое число 1 или 2; р представляет целое число от 1 до 4, при условии, что когда R4 представляет -СН2СН3, R2 и R3 не являются оба водородами. Также описываются способы лечения и профилактики остеопороза, рака груди и сердечно-сосудистого заболевания. Технический результат - получены новые соединения, обладающие полезными биологическими свойствами. 5 с. и 10 з.п.ф-лы, 2 ил., 1 табл.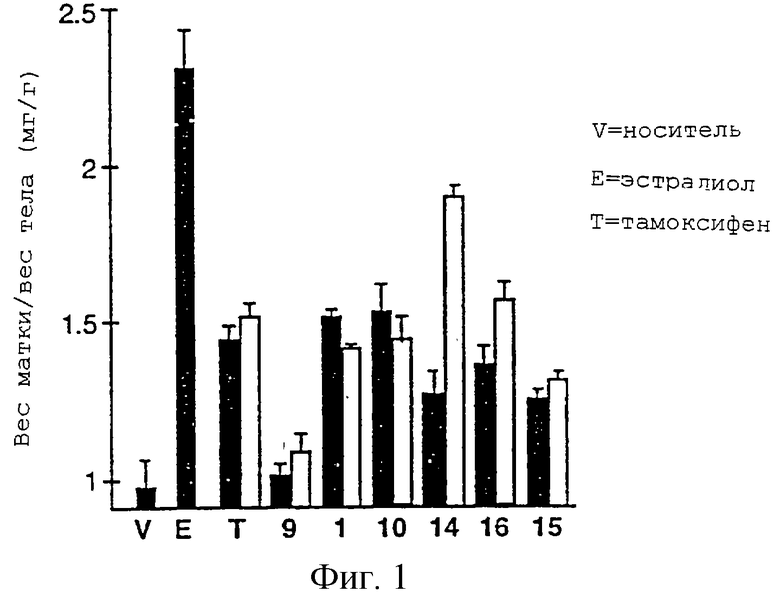
где R1 представляет -(СН2)nCR5= CR6R7; -(CH2)mC(X)NR8R9 или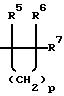
R2 и R3 независимо представляют Н, -СН3, -ОН, -ОСН3, -OCH2CH3 или -СН(СН3)2;
R4 представляет -СН3, -СН2СН3, -CH2CH2-Y или -Y;
R5 и R6 независимо представляют Н, -С1-4алкил, -С2-4алкенил, -С2-4алкинил, -X-C1-3алкил, -Х-С2-4алкенил, -Х-С2-4алкинил или -Y;
R7 представляет -CN, -С1-4алкил-ОН, -С(О)NR10R11, -С(O)NR12R13, -C1-4алкил-NR10R11, -С(О)OR12 или оксадиазол, замещенный метилом;
R8 и R9 независимо представляют водород, -С1-7алкил, -С3-7циклоалкил, -О-С1-7алкил, -С1-7алкил-Y;
R10 и R11 независимо представляют метил или этил;
R12 и R13 независимо представляют Н, -С1-12алкил, -С2-12алкенил, -С2-12алкинил, -О-С1-12алкил, -О-С2-12алкенил, -О-С2-12алкинил, -С3-7циклоалкил, -С3-7циклоалкенил или -Y;
Х представляет кислород;
Y представляет галоген;
n представляет целое число, выбранное из 0, 1 или 2;
m представляет целое число 1 или 2;
р представляет целое число от 1 до 4,
при условии, что когда R4 представляет -СН2СН3, R2 и R3 не являются оба водородами.
3-[4-(1,2-дифенилбут-1-енил)фенил] -N, N-диэтилпропионамида;
диэтиламида 2-[4-(1,2-дифенилбут-1-енил)фенил] циклопропанкарбоновой кислоты;
3-[4-(1,2-дифенилбут-1-енил)фенил] -N, N-дизтил-2-метилакриламида;
диэтиламида 3-[4-(1,2-дифенилбут-1-енил)фенил] бут-2-еновой кислоты;
метилового эфира 3-[4-(1,2-дифенилбут-1-енил)фенил] акриловой кислоты;
3-[4-(1,2-дифенилбут-1-енил)фенил] акрилонитрила;
трет-бутилового эфира
3-[4-(1,2-дифенилбут-1-енил)фенил] -акриловой кислоты;
1-амино-3-[4-(1,2-дифенилбут-1-енил)фенил] проп-2-ен-1-он-оксима;
3-{ 2-[4-(1,2-дифенилбут-1-енил)фенил] винил} -5-метил-[1,2,4] оксадиазола;
3-[4-(1,2-дифенилбут-1-енил)фенил] проп-2-ен-1-ола;
{ 3-[4-(1,2-дифенилбут-1-енил)фенил] аллил} диметиламина или 3-[4-(1,2-дифенилбут-1-енил)фенил] -N, N-диэтилтиоакриламида.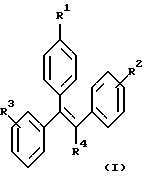
где R1 представляет -(СН2)nCR5= CR6R7; -(CH2)mC(X)NR8R9 или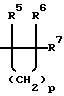
R2 и R3 независимо представляют Н, -СН3, -ОН, -ОСН3, -ОСН2СН3 или -CН(СН3)2;
R4 представляет -СН3, -СН2СН3, -CH2CH2-Y или -Y;
R5 и R6 независимо представляют Н, -С1-4алкил, -С2-4aлкенил, -С2-4алкинил, -X-C1-3алкил, -Х-С2-4алкенил, -Х-С2-4aлкинил или -Y;
R7 представляет -CN, -С1-4алкил-ОН, -С(О)NR10R11, -С(О)NR12R13, -C1-4aлкил-NR10R11, -С(О)OR12 или оксадиазол, замещенный метилом;
R8 и R9 независимо представляют водород, -С1-7алкил, -С3-7циклоалкил, -О-С1-7алкил, -С1-7алкил-Y;
R10 и R11 независимо представляют метил или этил;
R12 и R13 независимо представляют Н, -С1-12алкил, -С2-12алкенил, -С2-12алкинил, -O-С1-12алкил, -O-С2-12алкенил, -O-С2-12алкинил, -С3-7циклоалкил, -С3-7циклоалкенил или -Y;
Х представляет кислород;
Y представляет галоген;
n представляет целое число, выбранное из 0, 1 или 2;
m представляет целое число 1 или 2;
р представляет целое число от 1 до 4.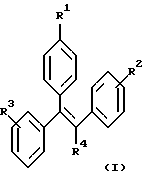
где R1 представляет -(СН2)nCR5= CR6R7; -(СН2)mC(X)NR8R9 или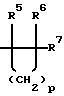
R2 и R3 независимо представляют Н, -СН3, -ОН, -ОСН3, -ОСН2СН3 или -СН(СН3)2;
R4 представляет -СН3, -СН2СН3, -CH2CH2-Y или -Y;
R5 и R6 независимо представляют Н, -С1-4алкил, -С2-4алкенил, -С2-4алкинил, -X-C1-3алкил, -Х-С2-4алкенил, -Х-С2-4алкинил или -Y;
R7 представляет -CN, -С1-4алкил-ОН, -С(О)NR10R11, -С(О)NR12R13, -С1-4алкил-NR10R11, -С(О)OR12 или оксадиазол, замещенный метилом;
R8 и R9 независимо представляют водород, -С1-7алкил, -С3-7циклоалкил, -О-С1-7алкил, -С1-7алкил-Y;
R10 и R11 независимо представляют метил или этил;
R12 и R13 независимо представляют Н, -С1-12алкил, -С2-12алкенил, -С2-12алкинил, -O-С1-12алкил, -O-С2-12алкенил, -O-С2-12алкинил, -С3-7циклоалкил, -С3-7циклоалкенил или -Y;
Х представляет кислород;
Y представляет галоген;
n представляет целое число, выбранное из 0, 1 или 2;
m представляет целое число 1 или 2;
р представляет целое число от 1 до 4.
| Автоматический огнетушитель | 0 |
|
SU92A1 |
| ПРОИЗВОДНЫЕ ОМЕГА-ФЕНИЛАЛКАНОВЫХ КИСЛОТ, ПРОЯВЛЯЮЩИЕ АНТИГЛЮКОКОРТИКОИДНЫЕ, АНТИАНДРОГЕННЫЕ И АНТИПРОГЕСТОМИМЕТИЧЕСКИЕ СВОЙСТВА | 1992 |
|
RU2041236C1 |
Авторы
Даты
2003-03-20—Публикация
1997-08-12—Подача