Изобретение относится к медицине, в частности к акушерству и гинекологии.
Известен способ оценки риска нарушений плода у женщин детородного возраста с ранними сроками беременности или до беременности путем определения иммунной реактивности сывороточных антител по отношению к антигенам, таким как белок миелина, белок S 100, анионный прочносвязанный белок хроматина АСВР 14-18, мембранный белок МР65, и при получении данных об отклонении иммунореактивности тестируемых сывороток от уровня нормальных значений к любому из них, по степени выраженности отклонений определяют уровень риска нарушений развития плода (патент РФ 2107913, кл. 01 N 33/53, 1998 г.).
Недостатком способа является его сравнительно невысокая точность, обусловленная тем, что при скрининге определяются лишь изменения в сывороточном содержании регуляторных эмбриотропных тел, определяющих ход развития эмбриона и плода на ранних этапах беременности (до 14-16 недель), и не определяются изменения в содержании эмбриоцидных антител, влияющих на течение беременности на всем ее протяжении.
Задачей изобретения является повышение точности скрининга.
Поставленная задача решается способом, заключающимся в том, что проводят забор крови, получают сыворотку и определяют отклонения иммунореактивности ее от нормальных значений по отношению к основному белку миелина, белку S 100, анионному прочносвязанному белку хроматина АСВР 14-18, мембранному белку МР65, хорионическому гонадатропину, суммарной фракции фосфолипидов, ДНК, ревматоидному фактору, коллагену и анионовым цитоплазматическим антигенам нейтрофилов от уровня нормальных значений и по степени выраженности отклонений устанавливают уровень риска нарушений развития плода, исходя из данных "Таблицы прогноза" (см. табл. 1), составленной на основе анализа данных.
Антигены - основной белок миелина (антиген-1), белок S 100 (антиген-02), прочносвязанный анионный белок ядерного хроматина (АСВР 14-18, антиген-3), мембранносвязанный белок (МР65, антиген-4) получают способом, описанным в соответствии с вышеуказанным патентом.
Для оценки риска используют коммерческий хорионический гонадотропин.
Суммарную фракцию фосфолипидов получают следующим образом.
10 г ткани свежего или свежезамороженного мозга крупного рогатого скота, хранившегося до использования не более 3 месяцев при температуре -20oC, гомогенизируют 3-5 мин в 17 объемах смеси хлороформ-метанол (2:1 по объему; смесь 1). Гомогенат переносят в мерный цилиндр, куда затем добавляют смесь 1 для получения конечного разведения ткани 1:20. Перемешивают 15-20 мин и фильтруют. Фильтрат доводят смесью 1 до первоначального объема.
К отфильтрованному экстракту липидов прибавляют 0,73%-ный раствор хлорида натрия в объеме, равном 20% от объема липидного экстракта, энергично перемешивают и центрифугируют 15-20 мин при 2400 об/мин.
Осторожно декантируют верхнюю фазу, а к нижней фазе добавляют по каплям метанол до образования однофазной системы, переносят в колбу и высушивают при 60oС в вакууме водоструйного насоса.
В центрифужную пробирку помещают 1 г кремниевой кислоты и 40-50 мг липидов, растворенных в 4 мл диэтилового эфира, перемешивают 15 мин и центрифугируют 10 мин при 3000 об/мин.
Слой, содержащий кремниевую кислоту, промывают 5 мл диэтилового эфира. Элюируют фосфолипиды 3-кратной промывкой 25 мл метанола, элюат высушивают в вакууме водоструйного насоса. Используют полученный материал.
Получение двуспиральной ДНК.
а) 10 г ткани свежего или свежезамороженного мозга, хранившегося до использования не более 3 месяцев при температуре -20oС, гомогенизируют 5-10 мин в 10 объемах 0,14 М раствора хлорида натрия, содержащего 0,05 М цитрата натрия и центрифугируют в течение 20 мин при 3000 g и 0-3oС.
б) К центрифугату добавляют равный объем (около 100 мл) водонасыщенного фенола (рН 6,0), перемешивают 40 мин и центрифугируют в течение 40 мин при 3000 g и 0-3oС. Смесь расслаивается на 4 слоя.
в) Отбирают второй слой, остальные отбрасывают. Ко второму слою приливают 50 мл водонасыщенного фенола (рН 6,0), перемешивают и добавляют 50 мл 0,14 М раствора хлорида натрия. Перемешивают 30 мин и центрифугируют 30 мин при 3000 g.
г) Повторяют процедуры п.п. б) и в).
д) К объединенным вторым слоям добавляют 100 мл водонасыщенного фенола (рН 8,3) и равный объем дистиллированной воды, перемешивают смесь 40 мин и центрифугируют 1 ч при 6000 g, при этом образуется 3 слоя.
е) Верхний слой собирают, а нижние слои перемешивают с 100 мл 0,14 М раствора хлорида натрия 20 мин и центрифугируют 1 ч при 6000 g.
ж) Объединенные водные слои обрабатывают 50 мл водонасыщенного фенола (рН 8,3), перемешивают смесь 20 мин и центрифугируют 30 мин при 6000 g.
з) Обрабатывают водный слой полуторным объемом диэтилового эфира, содержащего 6-7 капель уксусной кислоты на 100 мл, эфирный слой отделяют на делительной воронке и отбрасывают.
и) Осаждают ДНК из водного слоя 2-2,5 объемами спирта, отделяют осадок центрифугированием в течение 30 мин при 6000 g, промывают 80%-ным спиртом, затем абсолютным спиртом, эфиром и высушивают в вакууме водоструйного насоса. Используют полученный материал.
Получение Fc-фрагментов IgG кролика.
Сыворотку интактного кролика разводят вдвое 0,1 М фосфатным буферным раствором, рН 8,0 и пропускают через хроматографическую колонку.
Элюируют связавшиеся белки 3 М раствором роданида калия и элюат диализуют против 0,1 М фосфатного буферного раствора, рН 7,0.
Добавляют к диализату хлористоводородный цистеин (1 мг/10 мг IgG), ЭДТА (0,5 мг/10 мг IgG) и папаин (1 мг/10 мг IgG).
Инкубируют смесь при 37oС в течение 4 ч, а затем останавливают реакцию замораживанием.
Диализуют продукт против 0,1 М фосфатного буферного раствора, рН 8,0 и наносят на хроматографическую колонку.
Элюируют связавшиеся белки 3 М раствором роданида калия и элюат диализуют против 0,1 М фосфатного буферного раствора, рН 6,5.
Выкристаллизовавшиеся Fc-фрагменты отделяют центрифугированием в течение 20 мин при 3000 g и используют препарат.
Для скрининга в качестве коллагена используют его коммерческий препарат.
Получение анионных цитоплазматических антигенов нейтрофилов.
10 объемов свежей донорской крови смешивают с 1 объемом тринатрий цитрат-декстрозы и 2 объемами 6%-ного раствора декстрана в 0,14 М растворе хлорида натрия. Инкубируют в термостате при 37oС 30-45 мин. Декантируют суспензию клеток над осадком эритроцитов и наслаивают на фиколл-пак в объемном соотношении 2:1.
Центрифугируют 30-40 мин при комнатной температуре и 400 g.
Супернатант и слой лимфоцитов отбрасывают, а осадок отмывают 3-5 раз 0,8%-ным раствором хлорида аммония в 0,01 М фосфатном буферном растворе до полного разрушения эритроцитов.
Осадок гранулоцитов суспендируют в 0,14 М растворе хлорида натрия и разрушают клетки 10-кратным замораживанием-оттаиванием.
Отбрасывают нерастворимый материал центрифугированием в течение 20 мин при 3000 g, а надосадочную жидкость диализуют против 0,01 М трис-хлоридного буферного раствора, рН 8,0, и наносят на анионообменную хроматографичеческую колонку и элюируют связавшиеся белки 3 М раствором роданида калия. Используют полученный материал.
МЕТОДИКА ПРОВЕДЕНИЯ НЕПРЯМОГО ИФА
1. Для сорбции на стандартные 96-луночные плоскодонные планшеты для иммуноферментного анализа готовят растворы каждого из антигенов на карбонатном буфере. Приготовленные растворы вносят в отдельные лунки планшета. Накрытые крышками планшеты инкубируют ночь при 2-4oС.
2. Удаляют (стряхнуть) из лунок растворы белков и заливают в них блокирующий буфер (например, 0,5% раствор желатина на 0,15 М NaCl). Инкубируют 1 ч при 37oС.
3. Отмывают планшеты отмывочным буфером (0,15 М NaCl с 0,05% твин-20).
4. Внесение тестируемых сывороток:
а) Готовят разведения сывороток 1:200 на отмывочном буфере.
б) Вносят разведенные сыворотки в лунки.
в) Планшеты инкубируют ночь при 2-4oС.
5. Отмывают планшеты отмывочным буфером.
6. Проявление реакции:
а) исходный раствор конъюгата пероксидазы хрена (или иного фермента) с антителами к иммуноглобулинам IgG человека разводят в необходимое число раз (в зависимости от его активности) отмывочным буфером;
б) раствор конъюгата вносят во все лунки планшета;
в) планшеты инкубируют 60-90 мин при 37oС, либо 12-16 ч при 2-4oС. Коньюгат удаляют, а планшеты отмывают отмывочным буфером;
г) сразу после этого в лунки вносят раствор субстрата (например 0,01-0,05% о-фенилендиамина с 0,001-0,01% перекиси водорода на 0,01-0,05 М цитрат-фосфатном буфере рН 4,5-5 в случае применения пероксидазных конъюгатов). Инкубируют планшеты в темноте 15-20 мин при комнатной температуре.
9. По достижении оптимального уровня окрашивания (через 10-20 мин инкубации в темноте) реакцию останавливают добавлением 0.2-0.4 М серной кислоты.
10. Регистрация результатов реакции: интенсивность окрашивания оценивают с помощью ИФА-ридера любой модели.
ОБРАБОТКА ПОЛУЧЕННЫХ ДАННЫХ
1. Из нескольких (обычно трех) дублирующих друг друга значений результатов реакции эталонной и тестируемых сывороток выбирают среднее (в случае, если из 3 дублей один сильно отличается от двух других, т.е. является заведомо артефактом, его значение не принимают в расчет).
2. По полученным значениям оптической плотности лунок рассчитывают относительную интенсивность реакции тестировавшихся сывороток с каждым из использовавшихся антигенов по отношению к реакции референс-сыворотки.
ИНТЕРПРЕТАЦИЯ ПОЛУЧЕННЫХ ДАННЫХ
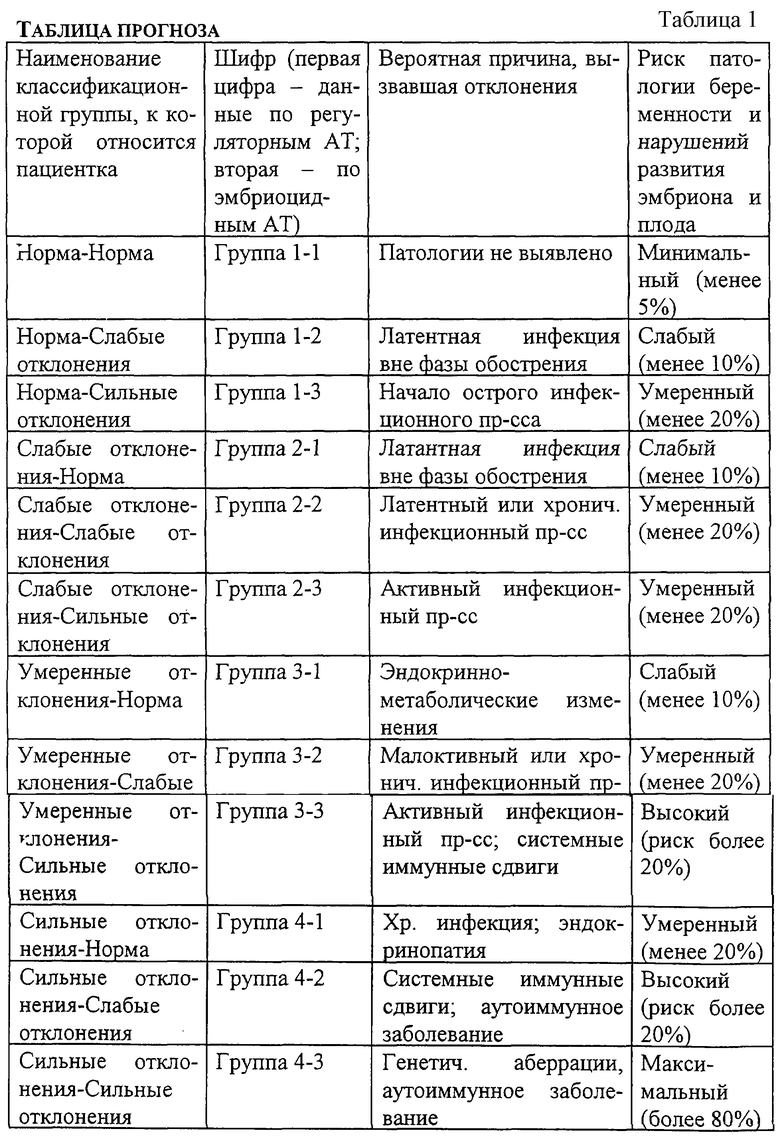
1. При анализе иммунореактивности тестируемой сыворотки, обусловленной присутствующими в ней регуляторными эмбриотропными аутоантителами, взаимодействующими с антигенами 1-4, используют следующие градации:
1.1. В случае, если интенсивность реакции исследуемой сыворотки с любым из четырех белков-антигенов не выходит за пределы от -15% до +40% по отношению к реакции референс-сыворотки (эталона), данную сыворотку относят к классификационной группе нормы (группа-1).
1.2. В случае, если интенсивность реакции исследуемой сыворотки с любым из четырех белков-антигенов выходит за пределы группы 1, но не превышает отклонений от -40% до +65% по отношению к реакции сыворотки-эталона, данную сыворотку относят к классификационной группе слабых отклонений (группа-2).
1.3. В случае, если интенсивность реакции исследуемой сыворотки с любым из четырех белков-антигенов выходит за пределы группы-2, но не превышает отклонений от -60% до +100% по отношению к реакции сыворотки-эталона, данную сыворотку относят к классификационной группе умеренных отклонений (группа-3).
1.4. В случае, если интенсивность реакции исследуемой сыворотки с любым из четырех белков-антигенов выходит за пределы группы-3, данную сыворотку относят к классификационной группе сильных отклонений (группа-4).
1.5. Следует учесть, что чем более выражены отклонения иммунореактивности сыворотки в реакции с антигенами 1-4 от нормы, тем выше риск нарушений развития эмбриона и плода или его гибели.
2. При анализе иммунореактивности тестируемой сыворотки, обусловленной присутствующими в ней эмбриоцидными аутоантителами, взаимодействующими с антигенами 5-10, используют следующие градации:
2.1. В случае, если интенсивность реакции исследуемой сыворотки с любым из антигенов 5-10 не выходит за пределы от -20% до +10% по отношению к реакции референс-сыворотки (эталона), данную сыворотку относят к классификационной группе нормы (группа-1).
2.2. В случае, если интенсивность реакции исследуемой сыворотки с любым из антигенов 5-10 выходит за пределы группы 1, но не превышает отклонений от -50% до +40% по отношению к реакции сыворотки-эталона, данную сыворотку относят к классификационной группе слабых отклонений (группа-2).
2.3. В случае, если интенсивность реакции исследуемой сыворотки с любым из антигенов 5-10 выходит за пределы группы-2, данную сыворотку относят к классификационной группе умеренных отклонений (группа-3).
2.4. Следует учесть, что чем более выражены отклонения иммунореактивности сыворотки в реакции с антигенами 5-10 от нормы, тем выше риск нарушений развития беременности и гибели плода.
3. Дополнительные замечания по интерпретации данных.
3.1. С учетом того, что изменения в продукции и сывороточном содержании эмбриотропных регуляторных аутоантител (взаимодействуют с антигенами 1-4) и эмбриоцидных аутоантител (взаимодействуют с антигенами 5-10) могут быть разнонаправлены, рекомендуется оценка полученных результатов, приведенная в табл. 1.
Таким образом, полученные данные, с одной стороны, позволяют количественно оценить вероятность благоприятного развития и исхода беременности (частота случаев остановки развития беременности, выкидышей и рождений аномальных новорожденных прямо коррелирует с уровнем отклонений уровня определяемых регуляторных и эмбриоцидных антител), а с другой - выявить наиболее вероятную причину, вызвавшую соответствующие изменения (и наметить тактику лечения).
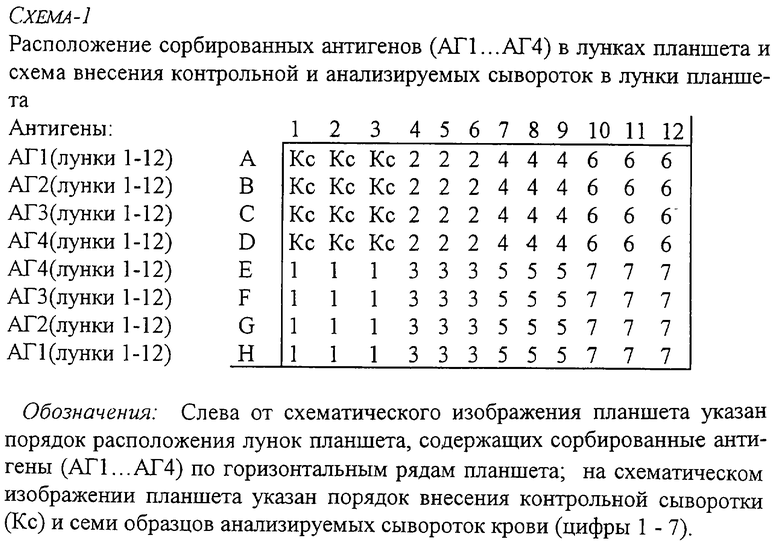
При постановке реакций удобно использовать 2 планшета с разными группами сорбированных антигенов, на каждом из которых тестируется по 7 сывороток обследуемых женщин.
А) При этом на первом сорбируются антигены 1-4 и вносятся исследуемые сыворотки по схеме-1, приведенной в конце описания.
Б) На втором планшете сорбируются антигены 5-10 и вносятся исследуемые сыворотки по схеме-2, приведенной в конце описания.
Нижеследующие примеры иллюстрируют способ по изобретению
Пример 1
Обследуемая Е.Т., 24 года. Детей нет. Вторая беременность 6 нед. Наследственность не отягощена.
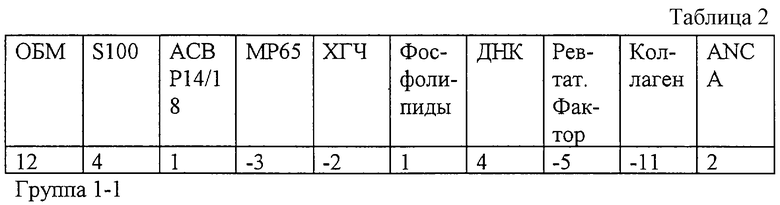
Результаты обследования заявляемым способом (значения иммунореактивности с антигенами) представлены в табл. 2.
Результаты беременности: Срочные роды, здоровая девочка, рост 54 см, вес 3600 г, балльность по шкале Апгар - 9.
Пример 2
Обследуемая И.С., 18 лет. Детей нет. Первая беременность 15 нед. Наследственность не отягощена.
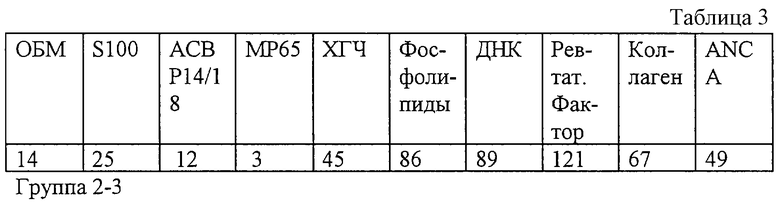
Результаты обследования заявляемым способом (значения иммунореактивности с антигенами) представлены в табл. 3.
Результаты беременности: Остановка развития беременности на сроке 22 нед.
При дополнительном обследовании выявлена хронич. герпетическая инфекция, уреаплазмоз. После 3-месячного пролечивания при контроле заявляемым способом результаты нормализовались. В настоящее время планирует беременность.
Пример 3
Обследуемая П.Р., 26 лет. Детей нет. Привычное невынашивание (в анамнезе 3 выкидыша на сроках до 12 недель). Наследственность не отягощена.
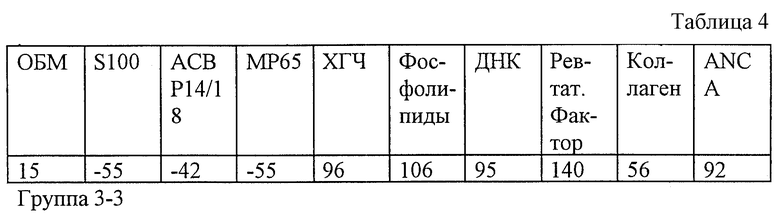
Результаты обследования заявляемым способом (значения иммунореактивности с антигенами) представлены в табл. 4.
По данным обследования предположено наличие хронической вялотекущей вирусной и/или урогенитальной инфекции в сочетании с эндокринопатией.
До лечения было рекомендовано от беременности воздержаться.
При дополнительном обследовании была выявлена хроническая смешанная герпетическая/ЦМВ инфекция, уреаплазмоз, микоплазмоз; была выявлена гиперпролактинемия.
После 4-месячного противоинфекционного лечения и нормализации гормонального статуса результаты нормализовались (см. пример 4).
Пример 4 (та же пациентка после лечения).
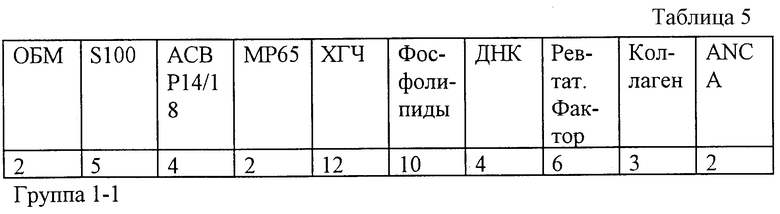
Результаты контрольного обследования способом пациентки П.Р. (см. пример 3) представлены в табл.5.
По результатам прегравидарной подготовки была рекомендована беременность. Беременность развивалась без особенностей и завершилась срочными родами; девочка рост 48 см, вес 2900 г, балльность по шкале Апгар 8-9
Способ по изобретению позволяет повысить точность скринингового обследования женщин детородного возраста.

Изобретение относится к медицине и может быть использовано для оценки нарушений развития плода. Проводят забор крови и получение сыворотки. Определяют отклонения ее иммунореактивности от уровня нормальных значений по отношению к основному белку миелина, белку S 100, анионному прочносвязанному белку хроматина АСВР 14/18 и мембранному белку МР 65. Дополнительно определяют отклонения иммунореактивности по отношению к хорионическому гонадотропину, суммарной фракции фосфолипидов, ДНК, ревматоидному фактору, коллагену и анионовым цитоплазматическим антигенам нейтрофилов от уровня нормальных значений и по степени выраженности отклонений устанавливают уровень риска нарушений развития плода. Способ позволяет повысить эффективность оценки нарушений развития плода. 5 табл.
Способ оценки нарушений развития плода, включающий забор крови, получение сыворотки и определение отклонений иммунореактивности ее от уровня нормальных значений по отношению к основному белку миелина, белку S 100, анионному прочносвязанному белку хроматина АСВР 14/18, мембранному белку МР 65, отличающийся тем, что дополнительно определяют отклонения иммунореактивности по отношению к хорионическому гонадотропину, суммарной фракции фосфолипидов, ДНК, ревматоидному фактору, коллагену и анионовым цитоплазматическим антигенам нейтрофилов от уровня нормальных значений и по степени выраженности отклонений устанавливают уровень риска нарушений развития плода.
| СПОСОБ СКРИНИНГОВОГО ОБСЛЕДОВАНИЯ ЖЕНЩИН ДЕТОРОДНОГО ВОЗРАСТА С ПОМОЩЬЮ ТЕСТ-СИСТЕМЫ ELI-P ДЛЯ ПРОГНОЗА РАЗВИТИЯ ЭМБРИОНА/ПЛОДА И РОЖДЕНИЯ ЗДОРОВОГО ЛИБО АНОМАЛЬНОГО РЕБЕНКА | 1995 |
|
RU2107913C1 |
| ПОЛЕТАЕВ А.Б | |||
| и др | |||
| Региональные особенности естественного иммунитета у женщин фертильного возраста: связь с уровнем риска возникновения аномалий развития эмбриона и плода | |||
| - Вест | |||
| Российск | |||
| ассоц | |||
| акуш.-гинек., 1998, №1, с.29-32 | |||
| ШАБАЛДИН А.В | |||
| и др | |||
| Развитие иммунопатологии у детей раннего возраста - продолжение нарушений иммунных взаимодействий между матерью и плодом | |||
| - Педиатрия, 1999, №5, с.26-30. | |||
Авторы
Даты
2003-07-20—Публикация
2002-04-08—Подача