Область техники: медицина, иммунология, акушерство и гинекология
УРОВЕНЬ ТЕХНИКИ
В настоящее время уже не вызывает сомнений участие иммунной и эндокринной систем организма в регуляции процессов гестации и эмбрионального развития. Данная регуляция осуществляется посредством гормональных и, по-видимому, недостаточно изученных реакций иммунной системы, тесно сопряженных с процессами гестации и закладки органов и тканей эмбриона и плода (Абрамов В. В. , Взаимодействие нервной и иммунной систем. Новосибирск: Наука, 1988). Вызванные различными причинами нарушения эндокринной регуляции и продукции антител различной направленности сопряжены с патологическим течением гестационного процесса и эмбриогенеза.
Ценным диагностическим методом исследования в практике акушера-гинеколога является определение количественного содержания гормонов-регуляторов репродуктивной функции. Из белковых гормонов наиболее важным является хорионический гонадотропин человека (β-субъединица ХГЧ). Биологическое действие ХГЧ связано с поддержанием стероидогенеза в желтом теле яичника, стимуляцией непрерывной продукцией прогестерона, который, в свою очередь, определяет степень развития децидуальной оболочки. Сегодня ХГЧ рассматривается как основной иммунодепрессант в предотвращении иммуноконфликта и отторжения плода.
Определение β-субъединицы ХГЧ (β-ХГЧ) в крови имеет большое диагностическое значение. Изменение содержания β-ХГЧ в крови беременных (повышение или снижение) позволяет диагностировать следующие патологические состояния: пузырный занос, хорионэпителиома, замершая беременность, внематочная беременность, угроза самопроизвольного аборта и т.д. (Сидорова И.С., Макаров И. О. Фетоплацентарная недостаточность, М.: Знание, 2000 г.).
Неблагоприятное течение беременности (угроза прерывания, неразвивающаяся беременность) может быть обусловлено увеличением концентрации андрогенов в крови. Поэтому уровень ДГЭА (дегидроэпиандростерона) в крови, являющегося одним из наиболее важных андрогенов, синтезируемых корой надпочечников из 17-гидроксипрогестерона, - важный диагностический показатель гиперандрогении. Его определение при подготовке к беременности и на ранних ее сроках позволяет вовремя выявить группу риска по перинатальной патологии и назначить патогенетически обоснованную терапию.
Большое значение для физиологического течения гестационного процесса имеет иммунная система. Известно, что в норме иммунная система продуцирует антитела не только к чужеродным, но и практически ко всем антигенам собственного организма, т.е. аутоантитела (а-АТ). Причем эти аутоантитела участвуют практически во всех процессах, происходящих в организме. В условиях нормы сывороточное содержание аутоантител поддерживается в определенных границах. А патологическое повышение или снижение их уровней может вести к различным патологическим состояниям. Изменения продукции а-АТ различной специфичности могут быть следствием влияния как различных внешних, так и внутренних факторов (экологические факторы, стрессы, инфекции, эндокринно-метаболические нарушения). Причем эти изменения могут касаться и тех а-АТ, поддержание физиологических концентраций которых критически важно для физиологического течения беременности и нормального эмбриогенеза. В литературе имеется ряд данных, свидетельствующих о различных нарушениях эмбрионального развития при различных изменениях в содержании материнских аутоантител (Takeuchi S. - Is production of blocking antibodies in successful human pregnancy an epiphenomenon. Amer. J. Reprod. Immunol., 1990, 24, 4, 108-119).
Антифосфолипидные антитела могут нарушать обмен мембранных фосфолипидов и повреждать сосуды плаценты во время гестации (Серова О.Ф. Прегравидарная подготовка женщин с невынашиванием беременности (патогенетическое обоснование, критерии эффективности). Дисс. докт. мед. наук., М., 2000). Существует даже такое понятие как "антифосфолипидный синдром", означающий повышение уровней антифосфолипидных антител у женщин, страдающих различными осложнениями беременности.
По данным Полетаева А. Б. и Селифановой О.П. повышение уровней материнских аутоантител к белку ткани мозга S100 приводит к различной патологии со стороны нервной системы у плода (Poletaev А.В., Selifanova О.Р., Transfer of elevated anti-S100 autoimmunity from mother to their offsprings in rats. Life Sci.,1994, V.54, 18, 1377-1381).
Что касается генетически обусловленных пороков развития, то частота их встречаемости не превышает 3-6% от всех врожденных пороков. Остальные 94-97% врожденной патологии обусловлены различными изменениями в организме матери.
В настоящее время отсутствует комплексный подход к прогнозированию и мониторингу течения беременности, включающий определение гормонов и иммунологических показателей, отражающих течение беременности и состояние плода. В то же время есть основания полагать, что интегральный анализ этих показателей в динамике позволит на качественно новом уровне решать данные задачи. Все это послужило основанием для создания набора диагностических тест-систем для определения антител класса IgG к ОБМ, белкам S100, АСВР-14/18 и МР-65 с определением коэффициента f, а также β-ХГЧ (у беременных) и ДГЭА (при подготовке к беременности) с последующим интегральным анализом полученных данных в динамике и относительно эталонных значений.
Аналогом заявленного изобретения является способ скринингового обследования женщин детородного возраста для прогноза развития эмбриона/плода и рождения здорового либо аномального ребенка с помощью тест-системы ELI-P (Патент РФ 2107913, МПК-7 G 01 N, 27 марта 1998 г.). В основе данного метода лежит определение сывороточного уровня а-АТ к ОБМ, белкам S100, АСВР-14/18 и МР-65. По наибольшей степени отклонения одного или нескольких определяемых показателей судят о прогнозе развития эмбриона/плода и рождения здорового либо аномального ребенка в соответствии с приведенной таблицей прогноза.
В то же время рассмотренный способ обладает рядом существенных недостатков:
- отсутствует дифференцированный подход к прогнозу развития эмбриона/плода в зависимости от характера изменений содержания исследуемых а-АТ (гипо- или гиперреактивность);
- невозможно достоверное прогнозирование течения беременности в зависимости от определяемых показателей;
- невозможно прогнозирование развития эмбриона/плода и течения беременности в зависимости от соотношения определяемых показателей;
- не учитывается динамика изменений определяемых показателей;
- способ недостаточно точен.
В отличие от известного способа скринингового обследования предлагаемый нами способ, заключающийся в определении в динамике в течение 20-30 дней двух- или трехкратно комплекса показателей: антител к ОБМ, белкам S100, АСВР14/18, МР65, последующее определение параметра f, характеризующего соотношение уровней определяемых аутоантител (выраженность дисперсии в уровнях определяемых антител относительно дисперсии их средних показателей в популяции), а также хорионического гонадотропина (во время гестации) и дополнительно ДГЭА (в случае отсутствия беременности), позволяет:
- существенно повысить точность прогнозирования развития эмбриона/плода;
- оценить течение беременности в динамике и дать дифференцированный прогноз развития возможных осложнений;
- оптимизировать прегравидарную подготовку и оценить эффективность проводимой терапии;
- снизить процент рождения детей с пороками развития;
- выполнение исследования безопасно для женщины и будущего ребенка.
Целью заявляемого способа является возможность прогнозирования с достаточно высокой степенью точности развития эмбриона и плода, течения гестационного процесса, оптимизации прегравидарной подготовки и оценки эффективности проводимой терапии.
Поставленные цели достигаются путем реализации существенных признаков предлагаемого способа, а именно: проведение иммуноферментного анализа для определения в динамике в течение 20-30 дней двух- или трехкратно уровней а-АТ к белкам - компонентам тест-системы ELI-P со сравнением интенсивности реакции в лунках, содержащих тестируемые образцы сыворотки с лунками, содержащими образцы референс-сыворотки, с последующем определением соотношения между уровнями (выраженность дисперсии в уровнях определяемых антител относительно дисперсии их средних показателей в популяции) данных а-АТ; проведение иммуноферментного анализа для определения сывороточного уровня β-ХГЧ (у беременных) и дополнительно ДГЭА (в случае отсутствия беременности) с последующим интегральным анализом всех полученных данных.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Иммуноферментное определение β-ХГЧ проводили у беременных во время 1 или 2 триместра и дополнительно определение ДГЭА проводили в случае отсутствия беременности по общепринятым методикам, например, с помощью наборов производства ЗАО "Алкор Био".
Определение уровней а-АТ к ОБМ, белкам S100, АСВР14/18, МР65 с последующим определением соотношения между уровнями а-АТ к данным белкам, характеризуемым параметром f, проводили следующим образом.
I. Получение белков - компонентов тест-системы ELI-P.
1. Для получения ОБМ можно использовать методы, описанные в литературе (например, Deibler et al. - J. Neurochem., 1986, V.47, 4, 1219-1225) или применять коммерческие препараты данного белка производства различных фирм (например, CALBIOCHEM, SIGMA).
2. Для получения белка S100 можно использовать приводимые в литературе различные методы очистки (например, Полетаев А.Б. - Докт. дисс., Москва, 1988) или применять коммерческие препараты данного белка производства различных фирм (например, CALBIOCHEM, SIGMA).
3. За основу схемы получения АСВР14/18 взята схема, предложенная А.Б. Полетаевым с соавт. (Патент РФ 2107913, 27 марта 1998 г.). В нее внесено изменение, позволяющее повысить выход данного белка на 9%. Данное изменение заключается, в первую очередь, в том, что во время ионообменной хроматографии на ДЕАЕ-сефарозе отбирали фракцию, элюирующуюся в более широком диапазоне концентраций NaCl.
Из свежего или свежезамороженного мозга крупного рогатого скота получают фракцию клеточных ядер (например, следующим способом: мозг гомогенизируют в 0,15 М NaCl с 0,01 М трис-НСl рН 7,5; центрифугируют 5 мин при 1000 g; полученный осадок ресуспендируют в 0,32 М сахарозе; повторно центрифугируют 5 мин при 1000 g; процедуры ресуспендирования/центрифугирования повторяют 5-7 раз).
Полученные ядра гомогенизируют в 0,2 М NaCl, центрифугируют и отбрасывют экстракт, содержащий белки нуклеоплазмы и слабосвязанные белки хроматина. Отмытый осадок гомогенизируют в 0,01 М трис-НСl буфера рН 8, с 2М NaCl, 2M мочевины и 0,1% тритона Х-100. Центрифугируют, собирают супернатант, диализуют его против того же буфера без NaCl и наносят его на колонку ДЕАЕ-сефарозы, уравновешенную тем же буфером. Проводят ступенчатую элюцию белков, используя градиенты NaCI на том же буфере. Отбирают фракцию, элюируемую в диапазоне 0,2-0,8 М NaCl. После диализа против того же буфера без NaCl, белки наносят на колонку анионообменника и проводят элюцию в линейном градиенте 0,1 М - 1,0 М KSCN с УФ-детекцией на 280 нм. Собирают последний пик. Полученный материал используется в работе.
4. За основу схемы получения МР65 взята схема, предложенная А.Б. Полетаевым с соавт. (Патент РФ 2107913, 27 марта 1998 г.). В нее внесено изменение, позволяющее повысить выход данного белка на 7%. На последнем этапе очистки при хроматографии на Mono-Q элюцию проводили в градиенте с более высокой концентрацией KSCN.
Из свежего мозга крупного рогатого скота любым методом выделяют фракцию клеточных мембран (например, мозг гомогенизируют в 0,15 М NaCl с 0,01 М трис-НСl рН 7,5; центрифугируют 5 мин при 1000 g; полученный осадок отбрасывают. К супертатанту добавляют сахарозу до 0,32 М; повторно центрифугируют 10 мин при 3000 g; осадок отбрасывают; к супернатанту добавляют равный объем 0,32 М сахарозы. Процедуру повторяют 2-3 раза. Затем супернатант разбавляют 2-кратно водой и центрифугируют 60 мин при 20000 g. Собирают осадок клеточных мембран).
Полученные мембраны гомогенизируют в 0,01 М трис-НСl буфера рН 7, с 0,2 М NaCl. Центрифугируют, собирают осадок, отмывют его 0,01 М трис-НСl буфера рН 7,5. Гомогенизируют осадок в 0,01 М трис-НСl буфере рН 7,5 с 0,1% тритона Х-100 и 2 М мочевиной. Центрифугируют 60 мин при 20000 g. Супернатант наносят на колонку анионообменника, уравновешенную тем же буфером. Проводят ступенчатую элюцию белков, используя градиенты NaCl на том же буфере. Отбирают фракцию, элюируемую в диапазоне 0,1 - 0,3 М NaCl. После диализа против 0,01% тритона Х-100 с 1 М мочевиной на трис-НСl буфере рН 7,5 белки наносят на колонку Mono-Q и проводят элюцию в линейном градиенте 0,01-0,6 М KSCN с 0.01% тритона Х-100 с УФ-детекцией на 280 нм. Собирают последний пик. Полученный материал используется в работе.
II. Проведение иммуноферментного анализа.
1. Для сорбции на стандартные 96-луночные плоскодонные планшеты для иммуноферментного анализа готовят растворы каждого из белков-антигенов на карбонатном буфере. Приготовленные растворы вносят в отдельные лунки планшета. Накрытые крышками планшеты инкубируют ночь при +2 - 4oС.
2. Удаляют (стряхиванием) из лунок растворы белков и заливают в них блокирующий буфера (например, 0,5% раствор желатина на 0,15 М NaCl). Инкубируют 1 час при 37oС.
3. Отмывают планшеты отмывочным буфером (0,15 М NaCl с 0,05% твин-20).
4. Внесение тестируемых сывороток:
а) готовят разведения сывороток 1:200 на отмывочном буфере;
б) вносят разведенные сыворотки в лунки;
в) планшеты инкубируют ночь при +2 - 4oС.
5. Отмывают планшеты отмывочным буфером.
6. Проявление реакции:
а) исходный раствор конъюгата пероксидазы хрена (или иного фермента) с антителами к иммуноглобулинам IgG человека разводят в необходимое число раз (в зависимости от его активности) отмывочным буфером;
б) раствор конъюгата вносят во все лунки планшета;
в) планшеты инкубируют 60-90 мин при 37oС, либо 12-16 ч при +2 -4oС. Коньюгат удаляют, а планшеты отмывают отмывочным буфером;
г) сразу после этого в лунки вносят раствор субстрата (например 0,01-0,05% о-фенилендиамина с 0,001-0,01% перекиси водорода на 0,01-0,05 М цитрат-фосфатном буфере рН 4,5-5 в случае применения пероксидазных конъюгатов). Инкубируют планшеты в темноте 15-20 мин при комнатной температуре.
9. По достижении оптимального уровня окрашивания (через 10-20 мин инкубации в темноте) реакцию останавливают добавлением 0,2-0,4 М серной кислоты.
10. Регистрация результатов реакции: Интенсивность окрашивания оценивают с помощью ИФА-ридера любой модели.
11. Обработка полученных данных.
а) Из нескольких (обычно трех) дублирующих друг друга значений результатов реакции эталонной и тестируемых сывороток выбирают среднее (в случае если из 3 дублей один сильно отличается от двух других, т.е. является заведомо артефактом, его значение не принимают в расчет);
б) По полученным значениям оптической плотности содержимого лунок рассчитывают относительную интенсивность реакции тестировавшихся сывороток с основным белком миелина, белками S100, АСВР14/18, МР65 по отношению к эталону (в процентах).
12. При интерпретации полученных данных нами определены иные границы иммунореактивности определяемых антител для некоторых из перечисленных ниже классификационных групп по сравнению с известными (патент РФ 2107913 от 27 марта 1998 г. ), что позволило не только повысить точность проводимого прогноза, но и дифференцировать возможные патологии.
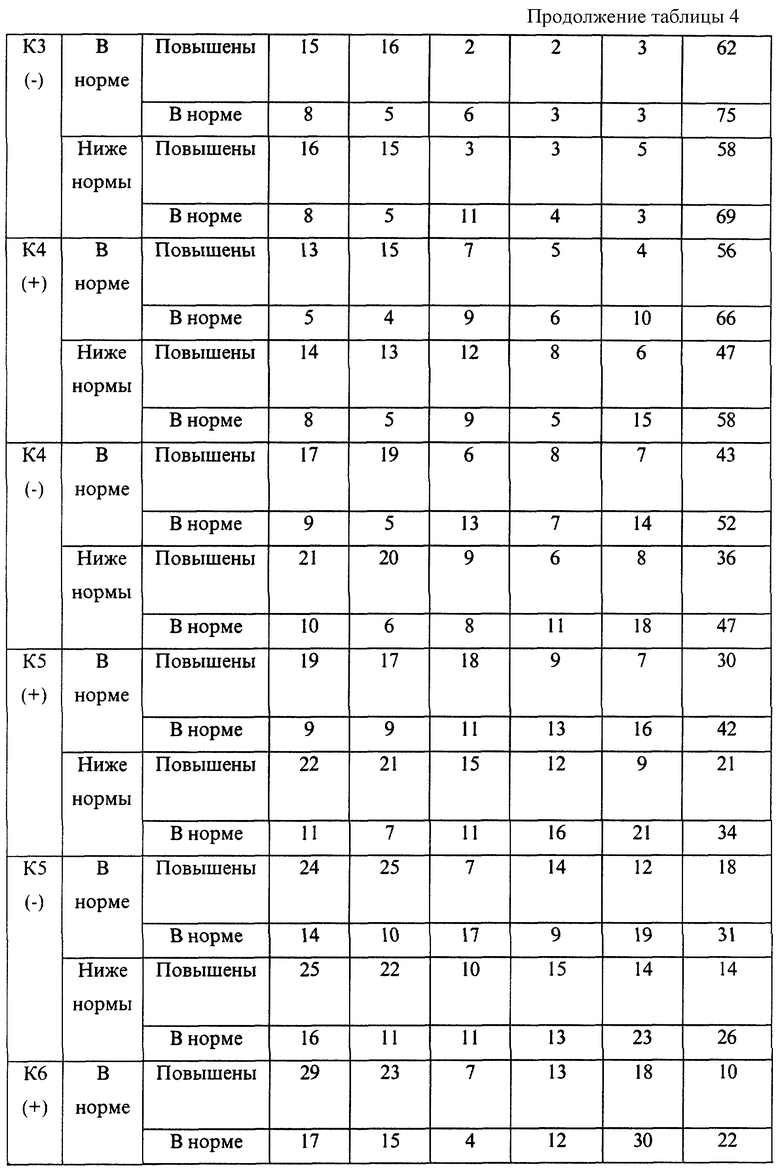
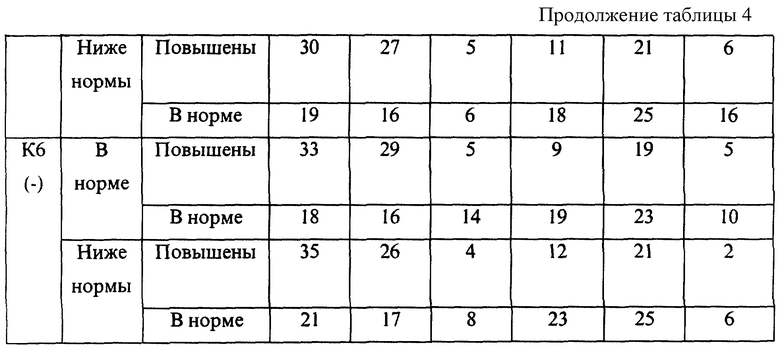
В случае если интенсивность реакции исследуемой сыворотки с любым из четырех белков-антигенов не выходит за пределы от -15% до +40% по отношению к реакции референс-сыворотки (эталона), данную сыворотку относят к классификационной группе К1 (норма).
В случае если интенсивность реакции исследуемой сыворотки с любым из четырех белков-антигенов выходит за пределы группы К1, но составляет не менее -25% и не более +65% по отношению к реакции сыворотки-эталона, данную сыворотку относят к классификационной группе К2 (слабые отклонения).
В случае если интенсивность реакции исследуемой сыворотки с любым из четырех белков-антигенов выходит за пределы групп К1 и К2, но составляет не менее -45% и не более +100% по отношению к реакции сыворотки-эталона, данную сыворотку относят к классификационной группе К3 (умеренные отклонения).
В случае если интенсивность реакции исследуемой сыворотки с любым из четырех белков-антигенов выходит за пределы групп К1, К2 и К3, но составляет не менее -65% и не более +150% по отношению к реакции сыворотки-эталона, данную сыворотку относят к классификационной группе К4 (значительные отклонения).
В случае если интенсивность реакции исследуемой сыворотки с любым из четырех белков-антигенов выходит за пределы групп К1, К2, К3 и К4, но составляет не менее -75% и не более +200% по отношению к реакции сыворотки-эталона, данную сыворотку относят к классификационной группе К5 (резкие отклонения).
В случае если интенсивность реакции исследуемой сыворотки с любым из четырех белков-антигенов выходит за пределы групп К1, К2, К3, К4 и К5, данную сыворотку относят к классификационной группе К6 (очень резкие, эксквизитные отклонения).
Далее проводили определение параметра f, который характеризует соотношение между уровнями а-АТ к различным определяемым белкам.
При анализе 12000 результатов ЭЛИ-П-Теста был сделан вывод о нормальном распределении уровней а-АТ для всех 4 используемых антигенов. Для анализа степени различия в изменениях уровней а-АТ к разным антигенам - компонентам указанной тест-системы были применены методы дисперсионного анализа. При этом дисперсия значений аргументов массива, представляющего собой уровни а-АТ по каждому из 4 антигенов для каждого конкретного пациента, сравнивалась с дисперсией эмпирически найденных аргументов массива, представляющих собой средние значения уровней а-АТ к каждому из 4 белков. Средними значениями в генеральной совокупности из 12000 результатов являлись следующие: для а-АТ к ОБМ - 10% (относительно эталона), для S100 - 13%, для АСВР14/18 - 9%, для МР65 - 9%.
При анализе исходили из того, что дисперсии аргументов массива тестируемых значений и эталонного массива (10; 13; 9; 9) различаются несущественно. Значение данной вероятности обозначено как параметр f для каждого набора тестируемых значений (уровень а-АТ к ОБМ; уровень а-АТ к S100; уровень а-АТ к АСВР14/18; уровень а-АТ к МР65). Таким образом, параметр f характеризует степень отклонения дисперсии аргументов массива тестируемых значений от дисперсии аргументов эталонного массива. Поскольку величина параметра f находится в пределах от 0 до 1, то чем более отличается его значение от 1 (единицы), тем более выражено в этом случае различие в уровнях определяемых а-АТ.
При сопоставлении различных значений параметра f с результатами клинического обследования пациенток было выявлено, что снижение параметра f ниже определенного значения, установленного для каждой классификационной группы, свидетельствует об эндокринно-метаболических нарушениях. Так, для группы К1 f= 0,38; для К2 f=0,24; для К3 f=0,17; для К4 f=0,09; для К5 f=0,06; для К6 f=0,01 (р<0,01).
Снижение параметра f ниже указанных значений свидетельствует об эндокринных нарушениях (в 85-90%) и/или различного рода ферментопатиях (10-15%). Чаще всего у пациентов с эндокринной патологией выявлялись нарушения секреции следующих гормонов:
а) гормонов щитовидной железы (Т3, Т4, ТТГ) в 50-55% случаев;
б) пролактина в 25-28% случаев;
в) кортикостероидов, минералкортикоидов в 18-20% случаев;
г) ЛГ, ФСГ, эстрадиола, прогестерона в 12-15% случаев;
д) инсулина, глюкагона в 2-5% случаев.
Уровень β-ХГЧ становится детектируемым в материнской сыворотке крови довольно быстро: уже на 8-9 день после зачатия. В течение 1 триместра беременности концентрация β-ХГЧ очень быстро повышается, удваиваясь каждые 2-3 дня. Концентрация β-ХГЧ достигает максимума на 8-10 неделе беременности, после чего снижается и в течение 2 половины беременности остается более или менее стабильной.
Общеизвестны уровни содержания β-ХГЧ на разных сроках беременности. Отклонения концентрации β-ХГЧ как в сторону повышения, так и в сторону снижения свидетельствуют о патологическом течении беременности. Определение данного показателя в комплексе с а-АТ к ОБМ, белкам S100, АСВР14/18, МР65 и коэффициентом f позволяет более точно проводить диагностику течения беременности и прогнозировать ее исход.
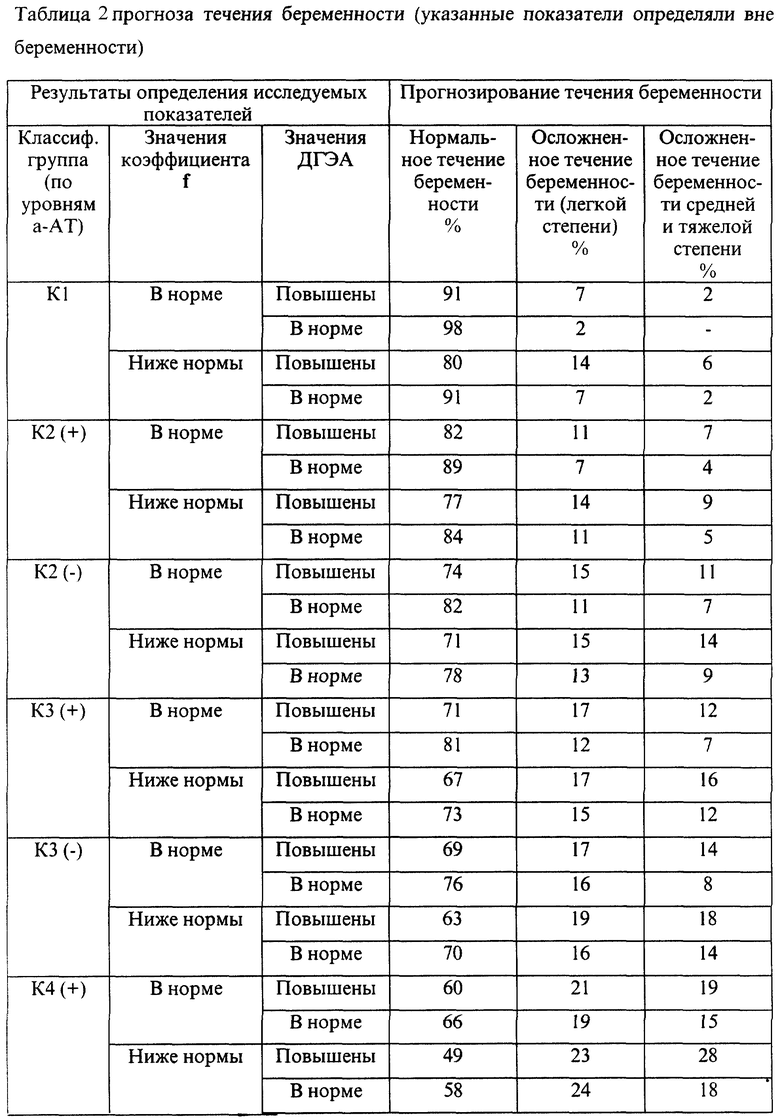
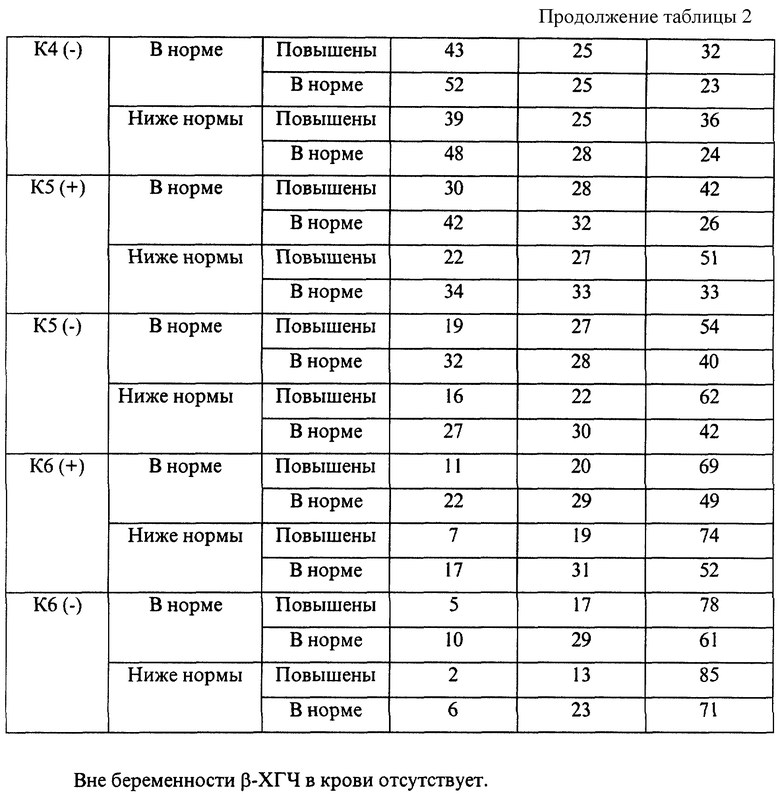
Определяемый в сыворотке крови ДГЭА является андрогеном, синтезируемым надпочечниками. Содержание ДГЭА в крови имеет циркадный ритм с наиболее высокой концентрацией гормона в утренние часы. Зависимость уровня ДГЭА от фазы менструального цикла практически отсутствует. Повышение содержания ДГЭА в крови является причиной неблагоприятного течения беременности (угроза прерывания, неразвивающаяся беременность), бесплодия. Определение ДГЭА в комплексе с а-АТ к ОБМ, белкам S100, АСВР14/18, МР65 и параметром f при отсутствии беременности позволяет более точно определить степень риска осложнений предстоящей беременности и прогнозировать ее исход.
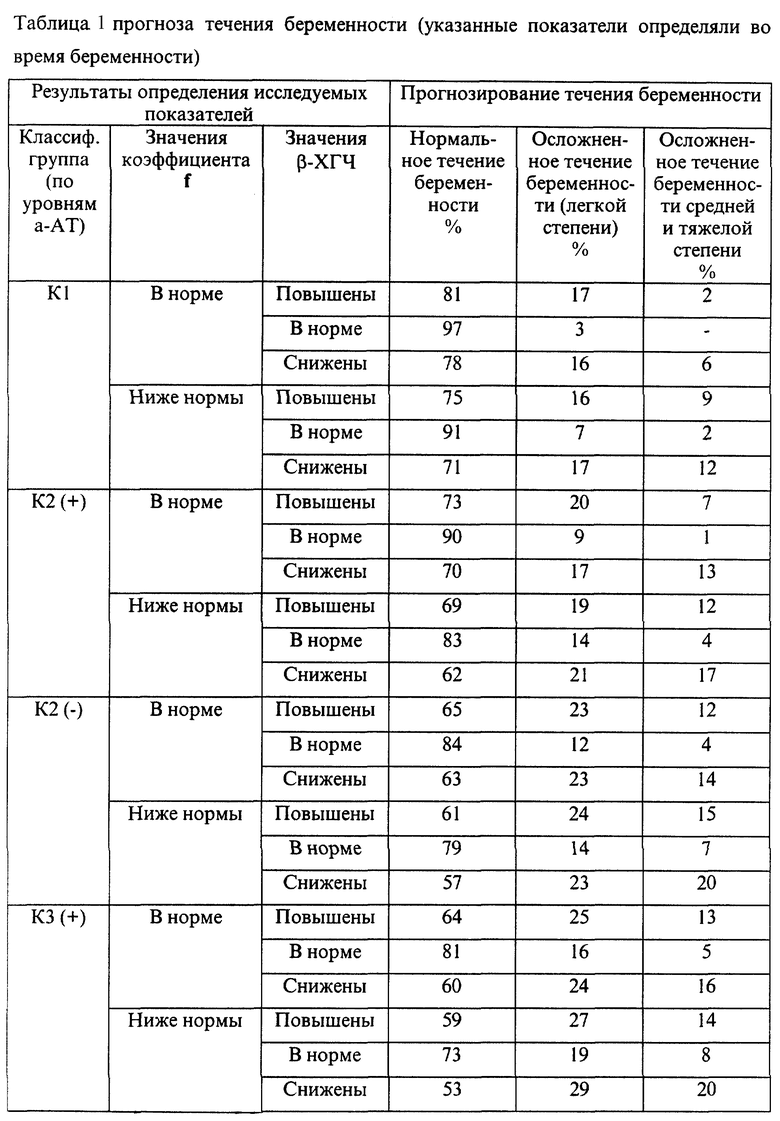
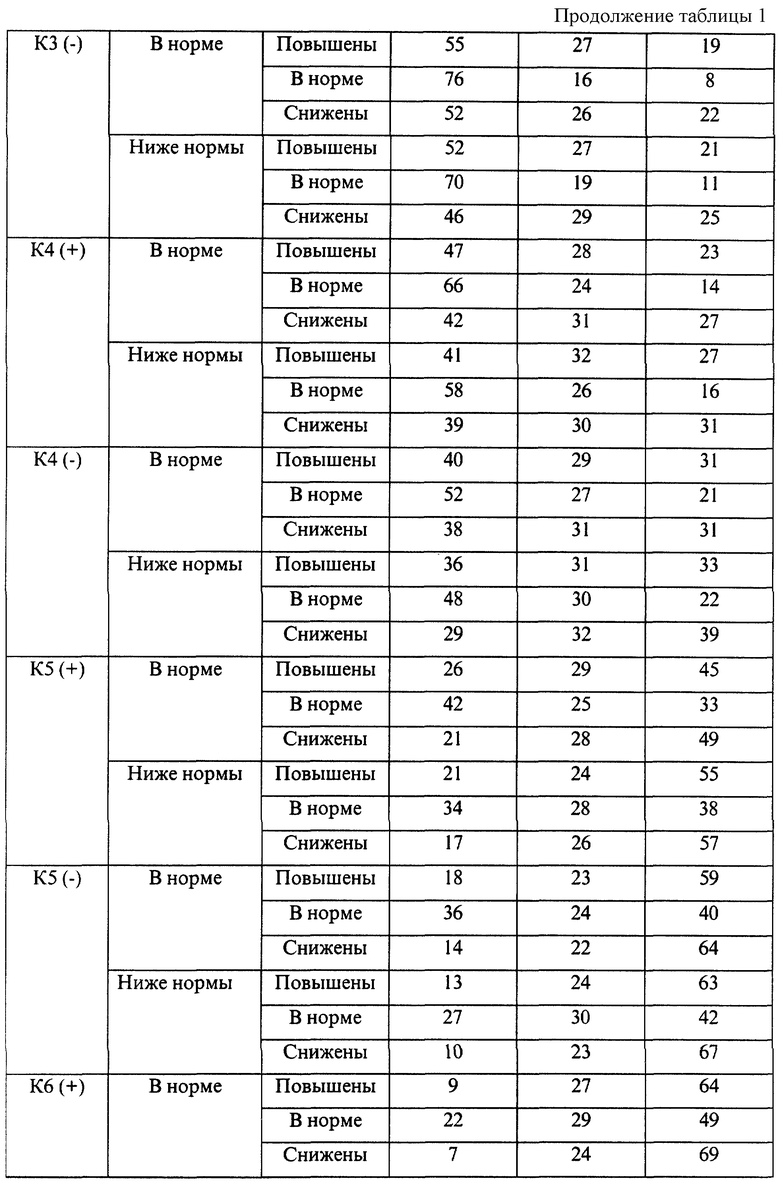
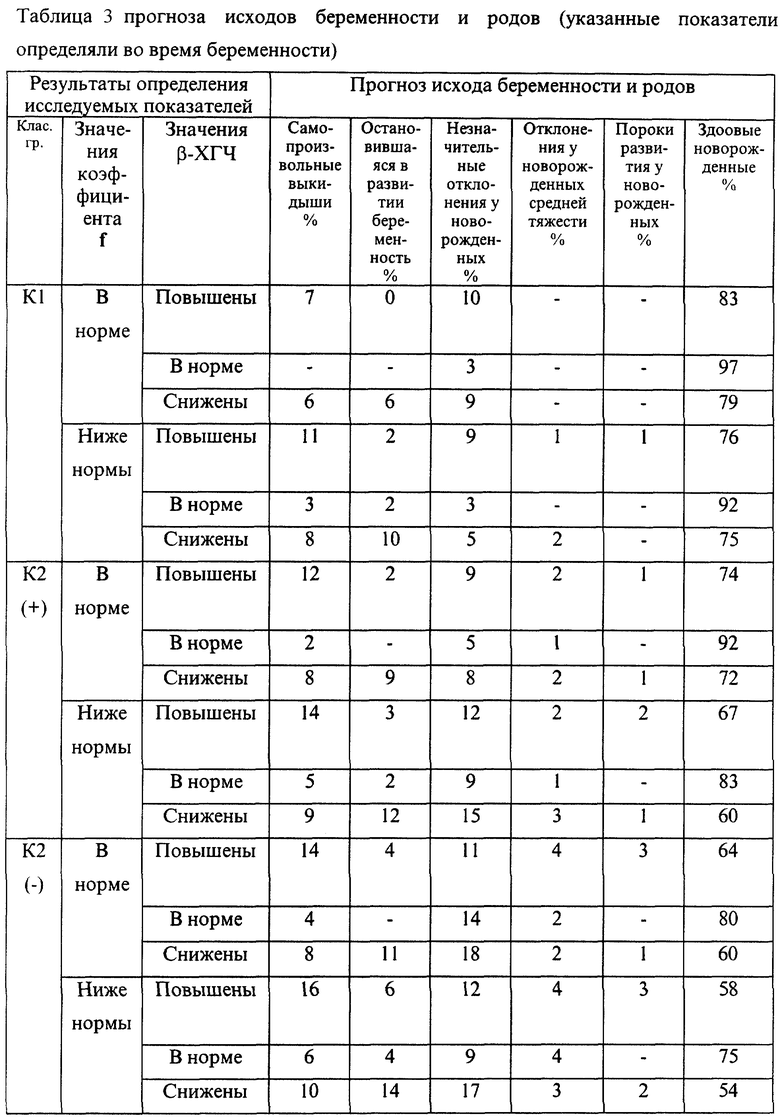
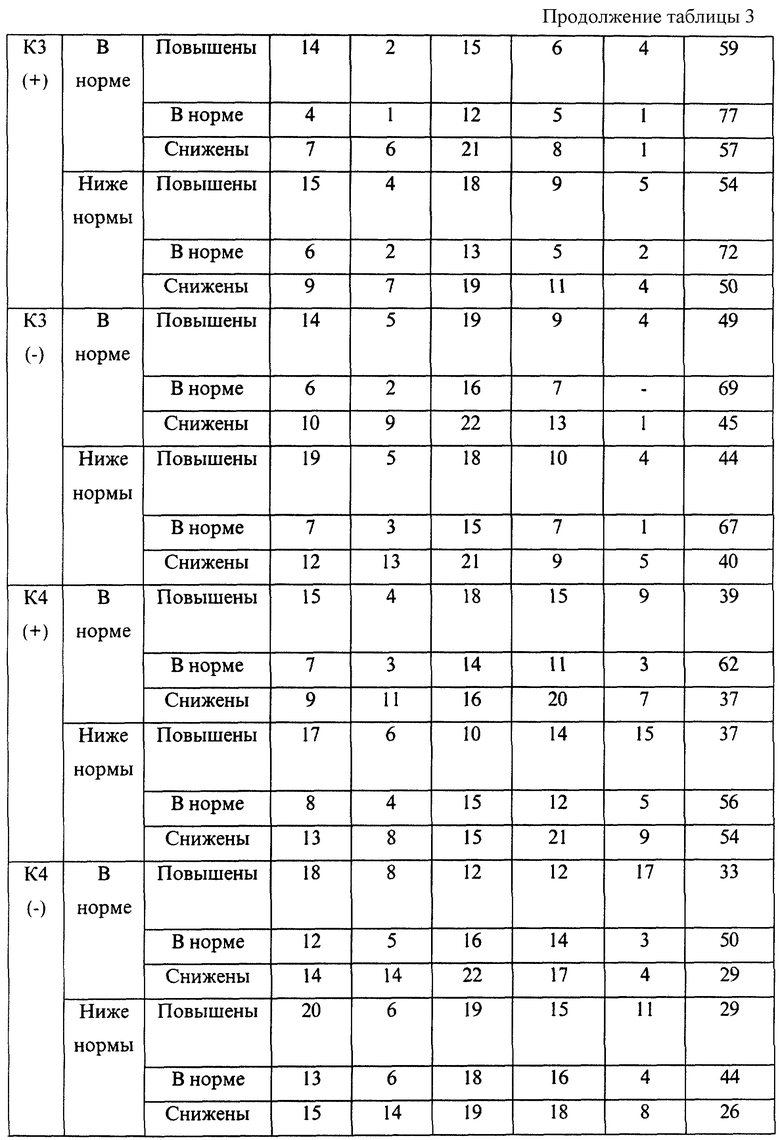
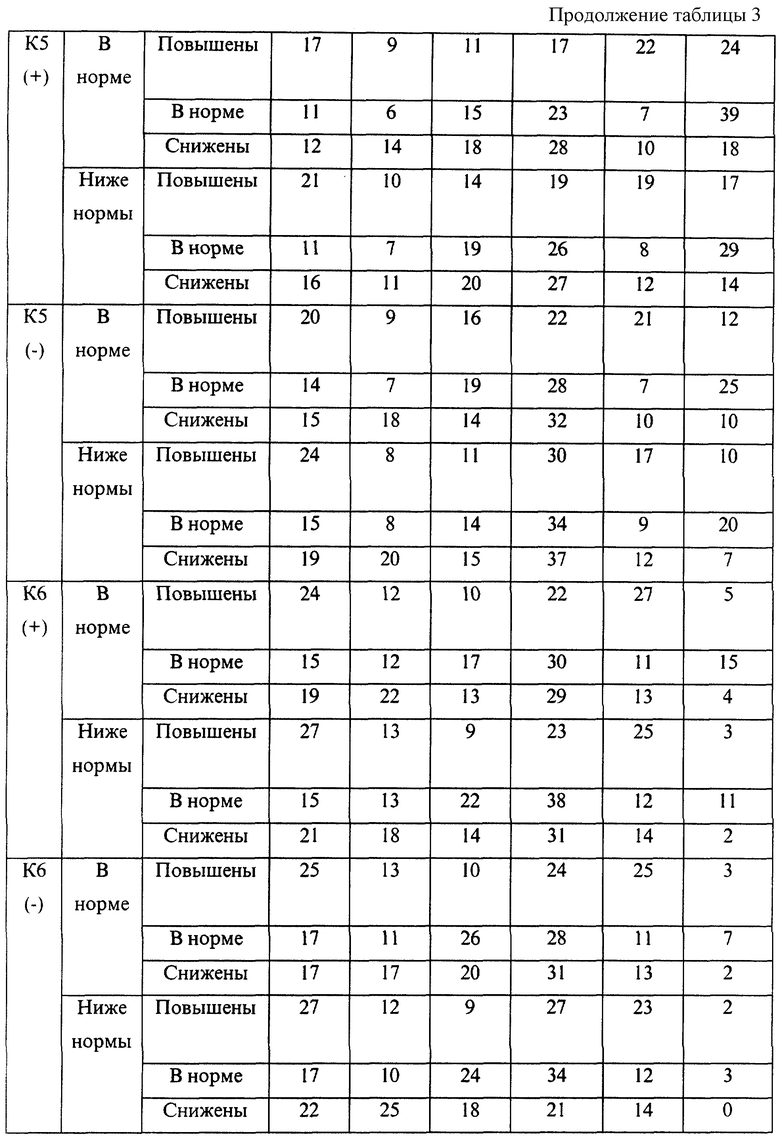
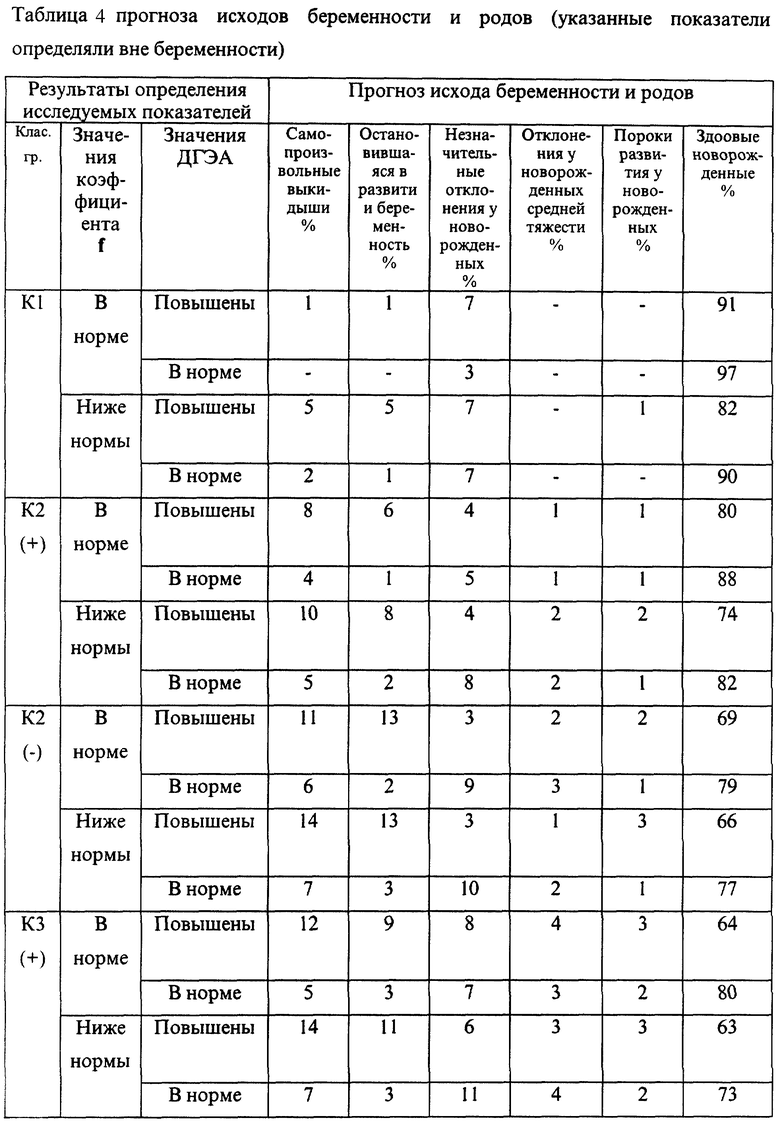
Эмпирические данные, полученные при анализе течения беременности и результатов родов 7975 женщин, обследовавшихся с помощью указанной технологии, позволили выявить закономерности, представленные в таблицах 1-4.
Вне беременности β-ХГЧ в крови отсутствует.
В представленных таблицах после классификационной группы женщины, например К3, в скобках указана направленность уровней исследуемых а-АТ (которая определила классификационную группу): (-) - снижение; (+) - повышение
В случае если исходные показатели а-АТ значительно изменяются в течение 20-30 дней и женщина переходит из любой группы риска с гипореактивностью (-) в любую группу риска с гиперреактивностью (+) или наоборот, то процент прогноза осложненного течения беременности или неблагоприятного исхода беременности возрастает в среднем в 1,5 раза по сравнению с первоначальным значением, но не превышает 95%.
Кроме того, при анализе характера патологии новорожденных, наблюдаемой при изменении уровней каждого из 4 а-АТ, определяемых с помощью ЭЛИ-П-Теста, при условии нормальной иммунореактивности 3 других видов а-АТ (что наблюдалось при снижении коэффициента f ниже установленных границ нормы), был установлен ряд закономерностей.
Показано, что изменение уровня а-АТ к ОБМ в крови матери может приводить у новорожденных к нарушениям иннервации различных органов и систем, нарушениям гемопоэза, порокам клапанного аппарата сердца. Реже наблюдаются изменения со стороны ЦНС. Так, у новорожденных могут наблюдаться врожденные иммунодефициты, нарушения свертывающей системы крови, анемии, лимфопении.
Изменения уровня а-АТ к S100 могут вести к различной патологии со стороны ЦНС, часто проявляющейся к 1-2 годам жизни. У детей могут наблюдаться задержки психомоторного развития, аутизм, различная неврологическая симптоматика.
Изменения уровня а-АТ к АСВР14/18 и МР65 могут вести к бесплодию, остановкам развития эмбриона и плода, различным изменениям со стороны внутренних органов новорожденных (врожденные пороки сердца, гипоплазии внутренних органов, гидронефроз почек и др.). При изменениях уровней а-АТ к МР65 могут наблюдаться различные анатомические уродства.
Выявленные закономерности статистически достоверны (р<0,05).
Анализ всех полученных данных свидетельствовал о том, что комплексный анализ указанных показателей, а именно сывороточного уровня β-ХГЧ (у беременных) или ДГЭА (при подготовке к беременности); а-АТ к белкам - компонентам тест-системы ELI-P с последующем определением соотношения уровней аутоантител (f) позволяет на качественно новом уровне определить прогноз течения беременности, ее исход, а также возможные отклонения в состоянии здоровья новорожденных.
В целом риск неблагоприятного течения беременности и исходов родов повышался с увеличением классификационной группы (от К1 до К6). Однако внутри каждой группы часто наблюдались достоверные различия в прогнозе в зависимости от снижения или повышения уровней аутоантител и содержания определяемого гормона. Так, например, в группе К1 при значениях параметра f, близких к эталонному, и неизмененном содержании β-ХГЧ, остановок развития беременности не наблюдалось. В то же время при группе К1, но сниженных значениях параметра f и β-ХГЧ у 10% женщин отмечалась остановка развития.
Гипореактивность а-АТ к ОБМ, S100, АСВР14/18 и МР65 достоверно чаще, чем гиперреактивность ведет к внутриутробному инфицированию плода на поздних сроках беременности. Гипореактивность эффективно корригируется с помощью иммуномодулирующих средств в 81% случаев. Гиперреактивность данных а-АТ поддается корригирующей терапии значительно хуже (р<0,01) и, как видно из таблиц прогноза, достоверно чаще приводит к рождению детей с пороками развития.
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ СПОСОБА
Пример 1.
Обследуемая О. А. 24 года. Беременность 8 недель. Наследственность не отягощена.
Классификационная группа по тесту ELI-P - К1;
Коэффициент f - снижен
Содержание β-ХГЧ - снижено.
Исход беременности: неразвивающаяся беременность на сроке 5 недель.
Пример 2.
Обследуемая О. А. , 20 лет. Беременность 5 недель. Наследственность не отягощена.
Классификационная группа по тесту ELI-P - К3 (-);
Коэффициент f - в норме;
Содержание β-ХГЧ - в норме.
Результаты родов: Срочные роды, здоровый мальчик рост 52 см, вес 3450 г, балльность по шкале Апгар - 8-9.
Пример 3.
Обследуемая А. А., 32 года. Беременность 10-11 недель. Наследственность не отягощена.
Классификационная группа по тесту ELI-P - К5(-);
Коэффициент f - снижен;
Содержание β-ХГЧ - повышено.
Течение беременности и ее исход. Беременность протекала на фоне угрозы выкидыша, нефропатии 2 степени, маловодья, фетоплацентарной недостаточности. Беременность завершилась рождением ребенка с задержкой внутриутробного развития II степени, с признаками внутриутробного инфицирования.
Пример 4.
Обследуемая О. С., 26 лет. Беременность 7-8 недель. Наследственность не отягощена.
Классификационная группа по тесту ELI-P - К6 (+);
Коэффициент f - в норме;
Содержание β-ХГЧ - повышено.
При проведении ультразвукового исследования на сроке 20-21 недель беременности выявлены грубые пороки развития. Проведено искусственное прерывание беременности.
Пример 5.
Обследуемая Л. М. , 29 лет. Планирует беременность. Наследственность не отягощена.
Классификационная группа по тесту ELI-P - К2 (-);
Коэффициент f - в норме; β-ХГЧ - отсутствует.
Содержание ДГЭА - повышено.
Наступила беременность; на сроке 15-16 недель наступила остановка развития беременности.
Наблюдения показали, что гипореактивность а-АТ к ОБМ, S100, АСВР14/18 и МР65 эффективно корригируется с помощью иммуномодулирующих средств в 81% случаев. Гиперреактивность данных а-АТ поддается корригирующей терапии значительно хуже (р<0,01) и, как видно из таблиц прогноза, достоверно чаще приводит к рождению детей с пороками развития.
ТЕХНИКО-ЭКОНОМИЧЕСКАЯ И СОЦИАЛЬНАЯ ЗНАЧИМОСТЬ
Применение описанного комплексного подхода к прогнозированию течения беременности и ее исхода может значительно снизить процент женщин с осложненным течением беременности за счет своевременного выявления групп риска и проведения адекватных лечебно-профилактических мероприятий, а также снизить процент рождения детей с пороками развития. Выполнение исследования производится на основе иммуноферментного анализа сыворотки крови и безопасно для женщины и будущего ребенка.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЕЧЕНИЯ БЕРЕМЕННОСТИ И ОПРЕДЕЛЕНИЯ СТЕПЕНИ РИСКА НАРУШЕНИЙ РАЗВИТИЯ ЭМБРИОНА/ПЛОДА И РОЖДЕНИЯ РЕБЕНКА С РАЗЛИЧНЫМИ ОТКЛОНЕНИЯМИ | 2003 |
|
RU2233121C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЕЧЕНИЯ НЕРВНО-ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2003 |
|
RU2258934C9 |
| СПОСОБ СКРИНИНГОВОГО ОБСЛЕДОВАНИЯ ЖЕНЩИН ДЕТОРОДНОГО ВОЗРАСТА С ПОМОЩЬЮ ТЕСТ-СИСТЕМЫ ELI-P ДЛЯ ПРОГНОЗА РАЗВИТИЯ ЭМБРИОНА/ПЛОДА И РОЖДЕНИЯ ЗДОРОВОГО ЛИБО АНОМАЛЬНОГО РЕБЕНКА | 1995 |
|
RU2107913C1 |
| СПОСОБ ВЫЯВЛЕНИЯ ГРУПП РИСКА РАЗВИТИЯ НЕРВНО-ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2002 |
|
RU2218569C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СТЕПЕНИ РИСКА РАЗВИТИЯ НЕРВНО-ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ | 1997 |
|
RU2147128C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЕЧЕНИЯ БЕРЕМЕННОСТИ И ОПРЕДЕЛЕНИЯ СТЕПЕНИ РИСКА НАРУШЕНИЙ РАЗВИТИЯ ЭМБРИОНА/ПЛОДА И РОЖДЕНИЯ РЕБЕНКА С РАЗЛИЧНОЙ НЕ ГЕНЕТИЧЕСКОЙ ПАТОЛОГИЕЙ | 2022 |
|
RU2808266C1 |
| СПОСОБ ОЦЕНКИ НАРУШЕНИЙ РАЗВИТИЯ ПЛОДА | 2002 |
|
RU2208791C1 |
| СПОСОБ СКРИННИНГОВОГО ВЫЯВЛЕНИЯ ЛИЦ ГРУППЫ РИСКА РАЗВИТИЯ ПАТОЛОГИИ НЕРВНОЙ СИСТЕМЫ И МОНИТОРИНГА ЗА СОСТОЯНИЕМ БОЛЬНЫХ, СТРАДАЮЩИХ НЕРВНО-ПСИХИЧЕСКИМИ ЗАБОЛЕВАНИЯМИ | 2003 |
|
RU2259567C2 |
| СПОСОБ МОНИТОРИНГА ЗА СОСТОЯНИЕМ БОЛЬНЫХ САХАРНЫМ ДИАБЕТОМ И РАЗВИТИЕМ НЕВРОЛОГИЧЕСКИХ И СОСУДИСТЫХ ЕГО ОСЛОЖНЕНИЙ | 2004 |
|
RU2291437C2 |
| СПОСОБ ЛЕЧЕНИЯ БЕСПЛОДИЯ У ЖЕНЩИН С МИОМОЙ МАТКИ | 2014 |
|
RU2585367C1 |

Изобретение относится к области медицины, а именно к иммунологии, акушерству и гинекологии. Способ обеспечивает высокую точность прогноза за счет определения параметров, с помощью которых можно проводить мониторинг гестационного процесса и давать прогноз исхода наступившей или предстоящей беременности. Проводят иммуноферментный анализ для определения иммунореактивности аутоантител (а-АТ) к основному белку миелина, белкам S100, АСВР14/18, МР65 в течение 20-30 дней двух- или трехкратно и дополнительно определяют соотношение иммунореактивности сывороточных аутоантител у обследуемой женщины (f) методом дисперсионного анализа как отклонения дисперсии аргументов массива тестируемых значений от дисперсии аргументов эталонного массива и сывороточный уровень хорионического гонадотропина (β-ХГЧ) (вне беременности дополнительно определяют сывороточный уровень дегидроэпиандростерона ДГЭА), а прогноз осуществляют по степени отклонений полученных значений от исходного уровня и эталонных значений при условии: чем более выражены отклонения иммунореактивности сывороточных аутоантител, чем ниже значения f и повышения или снижения сывороточного уровня β-ХГЧ (повышения ДГЭА), тем более неблагоприятные течение и исход беременности прогнозируют у женщин фертильного возраста. 1 з.п.ф-лы, 4 табл.
| СПОСОБ СКРИНИНГОВОГО ОБСЛЕДОВАНИЯ ЖЕНЩИН ДЕТОРОДНОГО ВОЗРАСТА С ПОМОЩЬЮ ТЕСТ-СИСТЕМЫ ELI-P ДЛЯ ПРОГНОЗА РАЗВИТИЯ ЭМБРИОНА/ПЛОДА И РОЖДЕНИЯ ЗДОРОВОГО ЛИБО АНОМАЛЬНОГО РЕБЕНКА | 1995 |
|
RU2107913C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ИСХОДА БЕРЕМЕННОСТИ ПРИ УГРОЖАЮЩИХ ПРЕЖДЕВРЕМЕННЫХ РОДАХ | 1997 |
|
RU2132069C1 |
| СПОСОБ ДОКЛИНИЧЕСКОГО ПРОГНОЗИРОВАНИЯ НЕВЫНАШИВАНИЯ БЕРЕМЕННОСТИ | 1997 |
|
RU2123698C1 |
| СПОСОБ ДИАГНОСТИКИ ОСЛОЖНЕНИЙ БЕРЕМЕННОСТИ И ПРОГНОЗИРОВАНИЯ СОСТОЯНИЯ ПЛОДА И НОВОРОЖДЕННОГО | 1995 |
|
RU2120636C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ИСХОДА БЕРЕМЕННОСТИ У ЖЕНЩИН С УГРОЖАЮЩИМ ВЫКИДЫШЕМ РАННИХ СРОКОВ | 1994 |
|
RU2103686C1 |
| Способ прогнозирования пороков развития у новорожденных | 1986 |
|
SU1364309A1 |
Авторы
Даты
2002-10-10—Публикация
2001-07-13—Подача