Изобретение относится к биотехнологии, а именно к технологии получения рекомбинантных белков.
Терапевтически значимые белки, полученные на основе технологии рекомбинантных ДНК, в последние годы получили широкое распространение для лечения широкого круга заболеваний. К наиболее распространенным препаратам данного класса относятся, в частности, альфа-интерфероны человека.
Известны способы получения лейкоцитарного интерферона человека из лейкоцитов крови человека с вирусной индукцией (авт. св. СССР №297296, 1970, кл. С 12 N 15/00; №1366064, 1983; пат. РФ №1364343, 1984; №1709615, 1990; №1713591, 1986; №2066188, 1993, кл. С 12 N 15/00).
Основными недостатками этого подхода являются сложность и дороговизна масштабирования, высокая вероятность контаминации конечного продукта вирусами человека и невысокий выход конечного продукта. Технология рекомбинантных ДНК позволяет исключить эти ограничения. Важно отметить, что белки, для которых посттрансляционные изменения (например, гликозилирование) не являются существенными, могут быть получены в прокариотических системах.
Так, известно, что для получения альфа-интерферонов человека в качестве реципиента используется Pseudomonas. Putida (пат. РФ №1616143, 1995, кл. C 12 N 15/21).
Основным недостатком этого реципиента является невысокая продуктивность и неспособность к формированию телец включения. Следствием этого является трудоемкость и многостадийность процесса выделения продукта, а также низкий его выход.
С другой стороны, широко используемые штаммы-продуценты на основе Е. Coli (пат. РФ №2118366, 1998, C 12 N 15/21, №1312962, 1994, C 12 N 15/19, №1312961, 1994, C 12 N 15/19) характеризуются недостаточно высоким (100-300 мкг/мл) уровнем экспрессии интерферона и недостаточной стабильностью.
Наиболее близким (прототип) по совокупности существенных признаков к заявляемому продуценту является пат. РФ №2165455, 2001, кл. C 12 N 15/21, согласно которому рекомбинантная плазмида pSS5, кодирующая синтез рекомбинантного альфа-2b-интерферона под триптофановым промотором, содержит ген устойчивости к канамицину. Согласно прототипу достигается относительно высокий (до 800 мкг/мл) уровень экспрессии при оптической плотности бактериальной культуры 15-16 ОЕ, т.е. примерно 30 мкг целевого продукта на 1 мг клеточной массы. Одним из существенных недостатков данного штамма является, практически, конститутивный синтез интерферона на протяжении всего процесса культивирования. Действительно, хотя ген, контролирующий синтез интерферона, и находится под контролем триптофанового промотора, но в среде для культивирования (кислотный гидролизат казеина) триптофан отсутствует и синтез начинается сразу же после внесения инокулята. Это обстоятельство может приводить к повышенному уровню протеолиза конечного продукта. Другим недостатком является невысокая стабильность конструкции, что явствует из необходимости проведения всего процесса культивирования под селективным давлением высоких концентраций канамицина. С одной стороны, при дальнейшем выделении готового продукта с неизбежностью потребуется проведение контроля на остаточный антибиотик, а с другой стороны, для поддержания работоспособности продуцента требуется постоянная селекционная работа со штаммом. И, наконец, высокий уровень экспрессии на единицу объема культивирования при столь высоких оптических плотностях культуры означает невысокую пропорцию целевого продукта в клеточной биомассе, а именно это определяет технологичность и, в конечном счете, экономику процесса в целом.
Техническая задача, решаемая в заявляемом способе получения рекомбинантного штамма-продуцента альфа-интерферона, заключается в создании высокопродуктивного стабильного штамма, пригодного для промышленного культивирования.
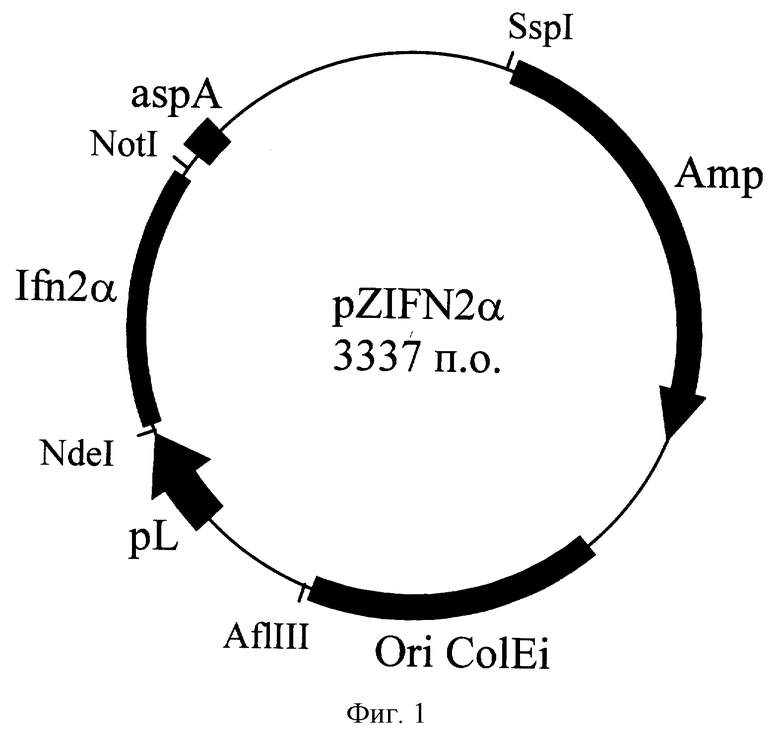
Поставленная задача решается посредством создания рекомбинантной плазмидной ДНК pZIFN2α и штамма Escherichia coli ZIFN2α.
Плазмида pZIFN2α (см. фиг.1) имеет 3337 пар оснований (п.о.) и характеризуется наличием следующих фрагментов:
NdeI-NotI - фрагмент ДНК размером 525 п.о., включающий последовательность полусинтетического гена альфа-2b-интерферона человека;
NotI-NdeI - фрагмент ДНК плазмиды pLEX размером 2812 п.о. (PL Expression Sistems, Cat. №K450-01, Invitrogen, США).
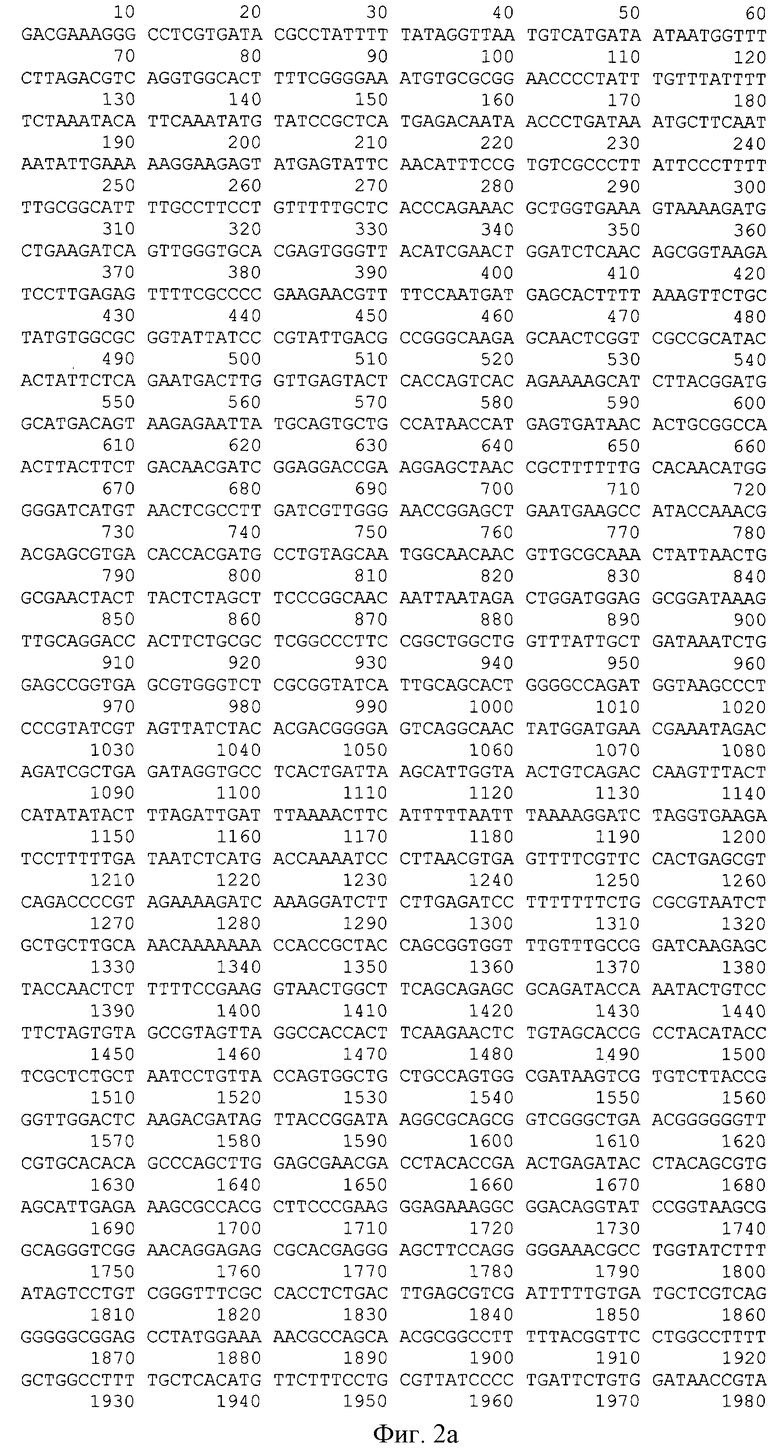
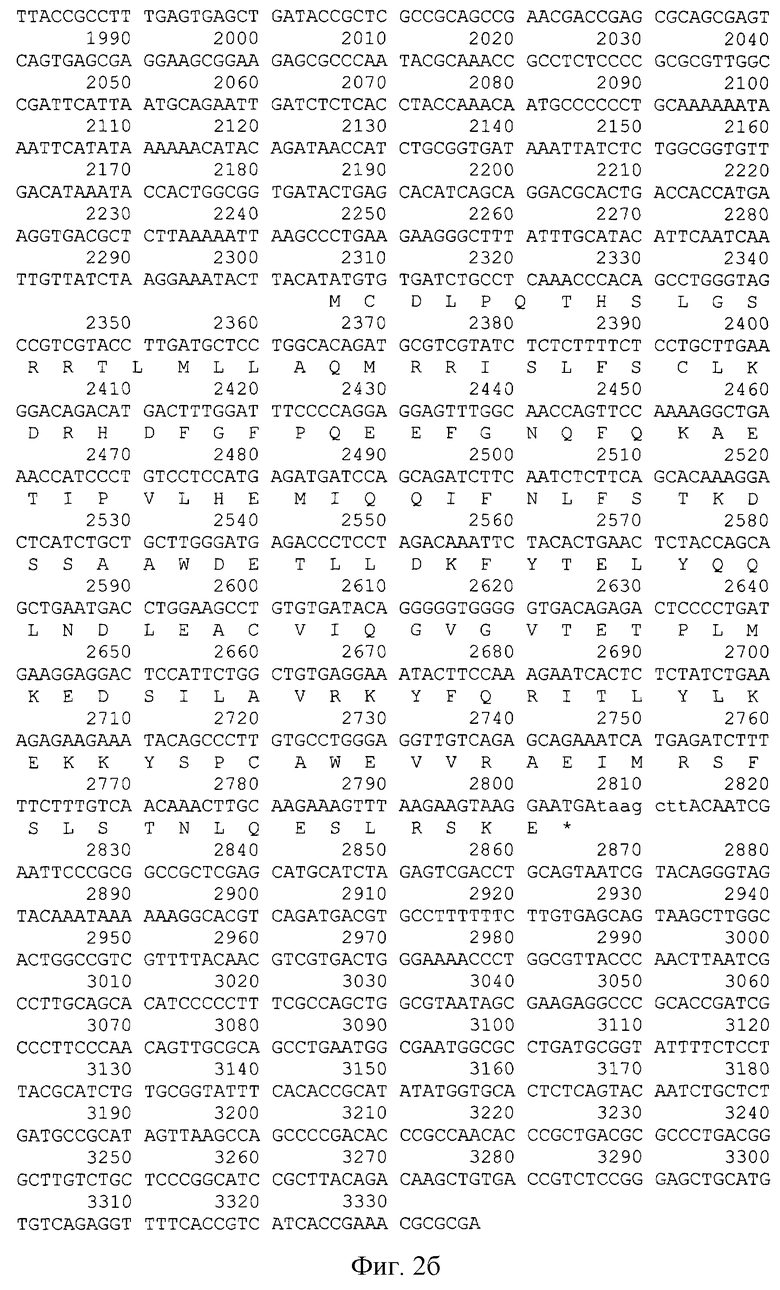
На фиг.2 (нуклеотидная последовательность плазмиды pZIFN2α, а также аминокислотная последовательность рекомбинантного белка альфа-2b-интерферона человека, выровненная относительно своего гена) представлена последовательность нуклеотидов плазмиды pZIFN2α.
Штамм Escherichia coli ZIFN2α получен трансформацией клеток Escherichia coli GI724 плазмидой pZIFN2α с использованием традиционной генно-инженерной технологии.
Штамм Е. cоli ZIFN2α характеризуется следующими признаками:
Культурально-морфологические свойства:
Грамотрицательные прямые палочки с закругленными краями, размером 1,1-1,5×2,0-3,0 мкм, одиночные, спор и капсул не образуют.
Клетки хорошо растут на простых питательных средах. На агаризованной среде - колонии гладкие, круглые, слабовыпуклые, край ровный. В жидких средах образуют равномерную светорассеивающую суспензию.
Клетки растут в интервале температур от 8 до 43°С, интервал для культивирования - 28-38°С, оптимум роста при 37°С. Интервал рН 5-7.
Катаболизируют D-глюкозу и другие углеводы с образованием кислоты и газа, не сбраживают лактозу.
Не образуют H2S, но гидролизуют мочевину.
Аэроб. Температурный диапазон роста 5-40°С при оптимуме рН 6,5-7,5.
Способ, условия размножения штамма:
Культивирование при температуре 28-30°С в течение 6-8 ч в термостате или на качалке в среде М9 (см.: Маниатис Т. и др., 1984), содержащей 2% кислотного гидролизата казеина, 1% глюкозы, 0,5% дрожжевого экстракта, 100 мкг/мл ампициллина.
Способ, условия хранения:
Хранится в суспензии 6-8-часовой культуры с 15% глицерином при минус 70°С (±10°С); срок хранения штамма - 2 года; частота обновления штамма -1 раз в 6 месяцев.
Генетические особенности:
Штамм Escherichia coli ZIFN2α дефектен по β-галактозидазе, содержит сI репрессор под контролем триптофанового промотора (генотип F-, λ-, laqIq, lacPL8, ampC::Ptrp cI, mcrA, mcrB, INV(rnnD-rnnE) и несет плазмиду pZIFN2α.
Плазмида pZIFN2α содержит последовательность Ori ColE1, необходимую для репликации, ген В1a, контролирующий устойчивость к ампициллину, и ген интерферона 2α человека под контролем PL промотора из бактериофага λ. Размер плазмиды - 3337 п.о.
Пример 1. Получение рекомбинантной плазмиды.
Технология получения плазмиды pZIFN2α включает следующие этапы:
- получение полусинтетического гена альфа-интерферона;
- конструирование рекомбинантной плазмиды pZIFN2α.
Получение полусинтетического гена альфа-интерферона:
Для клонирования гена альфа-интерферона был использован метод прямой полимеразной цепной реакции (ПЦР) для амплификации фрагмента ДНК из тотальной геномной плацентарной ДНК человека, содержащей ген, кодирующий альфа-интерферон. Для амплификации использовали два праймера: 1 и 2, нуклеотидная последовательность которых была составлена на основе известной первичной структуры гена альфа-2b-интерферона человека (ACCESSION J00207, GenBank NCBI).
1 - 5' CTCATATGTGTGATCTGCCTCAAACCCAC - 3'
2 - 5' GTAAGCTTATCATTCCTTACTTCTTAAACT - 3'
Данную и последующие ПЦР реакции проводили в следующих условиях:
10 мМ Трис-НСl рН 8.3, 50 мМ KCl, 200 мкМ каждого из дНТФ, 200 нМ каждого из праймеров, 100 нг матричной ДНК и 2.5 ед. Taq-полимеразы.
Процесс амплификации состоял из следующих стадий: 2 цикла (95°С 1 мин, 55°С 1 мин, 72°С 1 мин) и 35 циклов (95°С 10 с, 58°С 15 с, 72°С 40 с) и инкубация при 72°С 2 мин. Полученный фрагмент ДНК размером 515 п.о. клонировали в вектор pGEM-T Easy (Promega, США), в соответствии с протоколом набора. Структуру клонированного фрагмента подтверждали определением нуклеотидной последовательности. В результате была получена плазмида pGIFN2α размером 3530 п.о., в которой ДНК гена альфа-2b-интерферона фланкирована сайтами рестрикции NdeI и NotI.
Мутагенез гена альфа-интерферона заключался в замене редко встречающихся триплетов в Е. coli, кодирующих соответствующие аминокислоты на часто встречающиеся триплеты в Е. coli, кодирующие эти же аминокислоты. Мутагенез проводится методом ПЦР. Для амплификации ДНК использовали праймеры 3 и 2:
3 - 5' CTCATATGTGTGATCTGCCTCAAACCCACAGCCTGGGTAGCC
GTCGTACCTTGATGCTCCTGGCACAGATGCGTCGTATCTCTC - 3'
2 - 5' GTAAGCTTATCATTCCTTACTTCTTAAACT - 3'
В реакции ПЦР ДНК плазмиды pGIFN2α использовали в качестве матрицы. Реакцию проводили в тех же условиях, но при использовании 2,5 ед. LR-полимеразы. Полученный фрагмент размером 515 п.о. (фиг.3 - последовательность рекомбинантного гена альфа-2b-интерферона человека, приведенная на фиг. 2 с фланкирующими сайтами рестрикции NdeI и NotI, подчеркнуты инициирующий (ATG) и терминирующий (TGA) кодоны) клонировали в вектор pGEM-T Easy (Promega, США) в соответствии с протоколом набора. Структуру клонированного фрагмента подтверждали определением нуклеотидной последовательности. В результате была получена плазмида pGZIFN2α размером 3530 п.о., в которой ДНК гена альфа-интерферона фланкирована сайтами рестрикции NdeI и NotI.
Конструирование рекомбинантной плазмиды pZIFN2α:
Для получения рекомбинантной плазмиды pZIFN2α плазмиду pGZIFN2α обрабатывали ферментами рестрикции NdeI - NotI и ДНК фрагмент размером 525 п.о., содержащий последовательность модифицированного гена альфа-интерферона, клонировали в плазмидный вектор pLEX (PL Expression Sistems, Cat. №K450-01, Invitrogen, США), обработанный этими же рестриктазами. Лигированной ДНК трансформировали клетки штамма Е. coli DH10B/R, клетки высевали на среду LB, содержащую 100 мкг/мл ампициллина и инкубировали 12 ч при 37°С. Клоны, устойчивые к ампициллину, пересеивали, выделяли из них плазмидную ДНК, проводили ее рестрикционный анализ и определяли нуклеотидную последовательность.
В результате была получена рекомбинантная плазмида pZIFN2α, кодирующая синтез рекомбинантного альфа-2-интерферона человека, размером 3337 п.о., круговая схема которой приведена на фиг. 1 (круговая схема плазмиды pZIFN2α).
Пример 2. Получение штамма Е. coli ZIFN2α - продуцента интерферона.
Штамм-продуцент альфа-интерферона Е. coli ZIFN2α получали путем трансформации клеток Е. coli GI724 (F-, λ-, laqIq, lacPL8, ampC::Ptrp cI, mcrA, mcrB, INV(rnnD-rnnE) рекомбинантной плазмидой pZIFN2α с последующим отбором рекомбинантных клонов на среде с ампициллином при 30°С и с количественным определением альфа-интерферона в экстрактах клеток методом иммуноферментного анализа (тест-система ПроКон IF2, ООО “Протеиновый контур”, Россия), выращенных до оптической плотности 0,5-0,7 о.е. в среде М9, содержащей 20% кислотного гидролизата казеина (Difco, США), 1% глюкозы, 100 мкг/мл ампициллина при температуре 30°С. Синтез альфа-интерферона индуцировали добавлением триптофана до концентрации 100 мкг/мл и подъемом температуры до 37°С. Культивирование продолжали до оптической плотности культуральной среды 10-12 о.е., после чего биомассу отделяли центрифугированием и подвергали анализу.
Выделенные и подвергнутые анализу 5 случайных клонов показали уровни продукции 400, 750, 110, 540 и 255 мкг интерферона на 1 мл культуральной жидкости. Наиболее продуктивный клон был подвергнут реклонированию. Полученные субклоны характеризовались стабильным уровнем продукции в интервале 700-800 мкг/мл и были использованы для создания банка клеток и депонирования.
Пример 3. Крупномасштабное культивирование штамма Е. coli ZIFN2α
Культивирование проводили в лабораторном ферментере емкостью 10 л в объеме 8 л питательной среды М9 с добавками 20% кислотного гидролизата казеина (Difco, США), 1% глюкозы, 100 мкг/мл ампициллина при температуре 30°С. Инокулят для засева ферментера представлял собой ночную культуру, выращенную на качалке в той же среде. Ферментацию проводили на протяжении 9 часов в условиях, стандартных для культивирования аналогичных штаммов Е. Соli. На протяжении всего культивирования отбирали пробы для контроля оптической плотности при λ=460 нм, уровня продукции альфа-интерферона, содержания ампициллина, количества жизнеспособных клеток и клеток, содержащих плазмиду. Данные приведены в таблице.
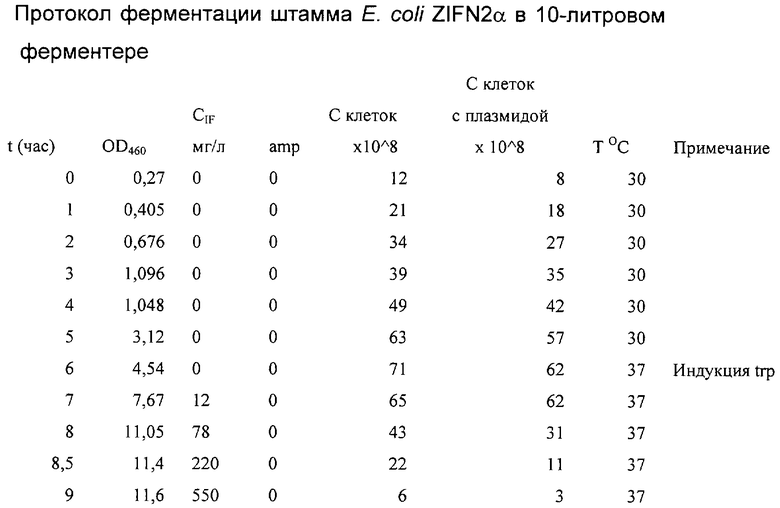
В результате культивирования было собрано 77,7 г биомассы, содержащей 4,4 г альфа-2b-интерферона человека. Продуктивность штамма составила 56,6 мкг/мг биомассы. Из данных таблицы видно, что несмотря на отсутствие в питательной среде ампициллина, полностью разрушенного бета-лактамазой, накопившейся в инокуляте, заметной потери плазмиды в процессе культивирования не происходит, т.е. штамм является достаточно стабильным даже в условиях отсутствия селективного давления.
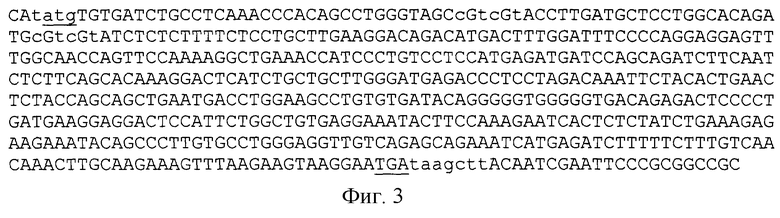
Изобретение относится к биотехнологии, в частности к технологии получения рекомбинантных белков, и может быть использовано для получения рекомбинантного альфа-2b-интерферона человека. Рекомбинантная плазмидная ДНК pZIFN2α, кодирующая синтез альфа-2b-интерферона человека, размером 3337 п.о., содержит NdeI-NotI фрагмент ДНК размером 525 п.о., включающий нуклеотидную последовательность, кодирующую альфа-2b-интерферон человека, NotI-NdeI фрагмент ДНК плазмиды pLEX размером 2812 п.о. Штамм бактерий Escherichia coli ZIFN2α - продуцент рекомбинантного альфа-2b-интерферона человека получают путем трансформации бактерий Escherichia coli плазмидой pZIFN2α. Изобретение позволяет получить высокопродуктивный штамм Escherichia coli ZIFN2α, пригодный для промышленного синтеза альфа-2b-интерферона человека. 2 с.п.ф-лы, 4 ил., 1 табл.
Авторы
Даты
2004-05-27—Публикация
2002-11-12—Подача