Изобретение относится к биотехнологии, в частности к способу получения афинного сорбента для очистки коллагеназ, и может быть использовано для выделения высокоочищенных и высокоактивных ферментных препаратов, которые используются в медицине, биохимии, пищевой промышленности, в ферментативном синтезе пептидов, а также для исследовательских целей.
Наиболее перспективным для избирательной очистки ферментов является метод афинной хроматографии, основанный на сродстве ферментов к специфичным аналогам субстрата или ингибиторам - лигандам, ковалентно связанным с нерастворимыми носителями, что позволяет разделять ферменты на основе их биологической специфичности и достигать высокой степени очистки.
Известен сорбент для очистки протеолитического фермента биоспецифической хроматографией на основе полиакриламидного или агарозного геля, содержащий в качестве лиганда гемоглобин, иммобилизованный на биогеле. Биогель активируется глутаровым альдегидом (авт. свид. СССР №962302, C 12 N 9/50, 1982 г.).
Однако производные агарозы неустойчивы в кислой среде и могут разрушаться в процессе хроматографии. Кроме того, указанный сорбент не специфичен к коллагеназам.
Известен способ получения афинного сорбента для очистки протеиназ, включающий взаимодействие аминосодержащего нерастворимого носителя с антибиотиками - полипептидами и конденсирующим агентом с использованием в качестве носителя природных биополимеров, например хитина или хитозана, а в качестве конденсирующего агента - водный раствор глутарового альдегида, в качестве антибиотика - полипептида используют бацитрацин или грамицидин С. Обычно используют 10-25% водный раствор глутарового альдегида, а на 1 г природного биополимера берут 0,15-0,5 г антибиотика и 0,15-0,5 г глутарового альдегида. Синтез сорбента ведут при 15-37°С.
Сорбент получают следующим образом. Хитозан перемешивают с раствором глутарового альдегида в 0,1 М фосфатном буфере при рН 6,9 в течение 4 час, после чего смесь помещают в термостат при 37°С на 12 часов. После фильтрования сорбент промывают тем же буфером и помещают в раствор антибиотика - полипептида в том же буфере, выдерживают 12 час при 37°С, промывают буфером и водой. Определение включения антибиотика проводят по содержанию аминокислот. Выход сорбента - 21-94% (патент РФ 2065877, C 12 N 9/50, 1996 г.).
Недостатком данного способа является отсутствие специфичности лигандов бацитрацина и грамицидина к коллагеназам, практически важным протеолитическим ферментам, способным гидролизовать коллаген и неустойчивый выход сорбента.
Наиболее близким к заявляемому является способ получения афинного сорбента для очистки протеолитических ферментов, включающий взаимодействие нерастворимого инертного носителя с раствором конденсирующего агента и лиганда. В качестве носителя используют аминопроизводные макропористого микросферического кремнезема типа Поросил, Диасорб или Силохром (обычно аминосилохром), имеющие внутри зерен крупные поры более или менее однородного размера.
В качестве конденсирующего агента используют п-бензохинон, карбодиимид или гексаметилендиизоционат, а в качестве лиганда - п-(ω-аминометил)-фенилборную кислоту или антибиотик - полипептид: бацитрацин, бациллихин, грамицидин С.
Сорбент получают следующим образом. Аминосилохром обрабатывают смесью конденсирующего агента и лиганда, например смесью бензохинона и антибиотика - полипептида в 0,1 М NаНСО3, (рН 10,0) в диметилформамиде. Смесь осторожно перемешивают 4 часа и оставляют на 12 час при 5°С. Затем сорбент тщательно промывают 0,1 М NaHCO3, рН 10,0, водой, спиртом, а перед очисткой ферментов элюирующим раствором (авт. свид. СССР №942427, C 12 N 9/50, 1984 г.).
Указанный сорбент позволяет с выходом 75-100% очищать протеолитические ферменты с увеличением активности в 1,4-100 раз в зависимости от чистоты исходного препарата, однако не обладают специфичностью к коллагеназам. К недостаткам указанного способа получения сорбента следует также отнести необходимость проведения элюции при последующем применении сорбентов для очистки ферментов в жестких условиях, что приводит к инактивации некоторых ферментов.
Задачей изобретения является создание способа получения новых сорбентов, специфичных к коллагенолитическим ферментам.
Поставленная цель достигается тем, что в способе получения афинного сорбента для очистки ферментных препаратов, включающем взаимодействие в среде органического растворителя аминосодержащего нерастворимого носителя с пептидным лигандом и конденсирующим агентом - п-бензохиноном или карбодиимидом, в качестве пептидного лиганда используют антибиотик - полипептид-полимиксин М или модифицированный полипептид, имитирующий структурные мотивы цепей молекулы коллагена, процесс ведут при рН 5,5-8,0, причем на 1 г носителя берут 9-80 мг пептидного лиганда и 10-500 мг конденсирующего агента.
При использовании в качестве модифицированного пептида, имитирующего структурные мотивы цепей коллагена, используют Z-Gly-DL-Pro-Gly-, причем на 1 г носителя берут 9-40 мг пептида и 20-23 мг водорастворимого карбодиимида и процесс ведут при рН 5,5.
При использовании в качестве модифицированного пептида, имитирующего структурные мотивы цепей коллагена используют Рrо-Gly-Gly-, (Pro-OH)-Gly-Gly-, причем на 1 г носителя берут 40-80 мг пептида и до 500 мг водорастворимого карбодиимида и процесс ведут при рН 5,5.
Обычно взаимодействие осуществляют в течение 0,5-1,0 часа в вакууме с использованием роторного испарителя.
Желательно в качестве растворителя использовать диметилформамид, этанол, а в качестве аминосодержащего нерастворимого носителя - аминосилохром, аминодиасорб.
Для облегчения стерических условий взаимодействия сорбента с высокомолекулярными ферментами сорбент предварительно можно обработать диаминокапроновой кислотой.
Пример 1.
2 г аминосилохрома ( 90-110 аминогрупп на 1 г) перемешивают в вакууме на роторном испарителе в течение 30-40 мин с рабочим буфером, включающим 0,05 М Трис НСl, рН 8 и 20% диметилформамид.
Готовят раствор 50 г полимиксина в 3 мл того же буфера и 200 мг п-бензохинона в 2 мл диметилформамида. Полученные растворы смешивают, перемешивают на роторном испарителе 2-4 часа.
Темноокрашенный сорбент отфильтровывают, промывают рабочим буфером, спиртом, водой.
Содержание полимиксина 1-8,2 мкМ/г, выход 6-33%. Для определения включения антибиотика в сорбент навеску 20 г гидролизуют 5,7 н НСl 48 час при 105°С и измеряют количественное содержание аминокислот на аминокислотном анализаторе.
Выход реакции рассчитывают по отношению количества присоединившегося антибиотика к количеству антибиотика, вводимого в реакцию, принимая за 100% исходное содержание антибиотика в реакционной смеси.
Примеры №2-7 сведены в таблицу №1.
Из данных таблицы видно, что наибольший выход сорбента достигается при избытке конденсирующего агента - п-бензохинона.
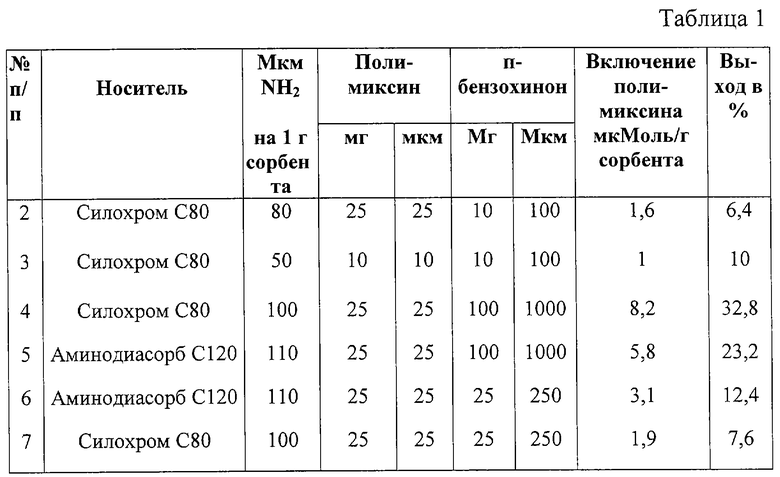
При проведении афинной хроматографии на вышеназванных сорбентах оказалось, что лучшими из них являются сорбенты, полученные в примерах 4 и 5. Степень очистки коммерческого препарата коллагеназы камчатского краба составила 2-6 раз, неспецифичная сорбция мала. Потерь активности в процессе очистки не наблюдалось.
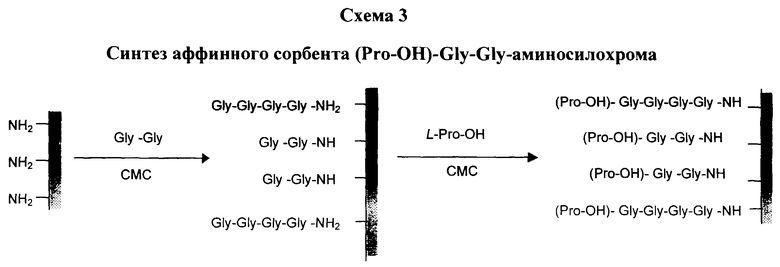
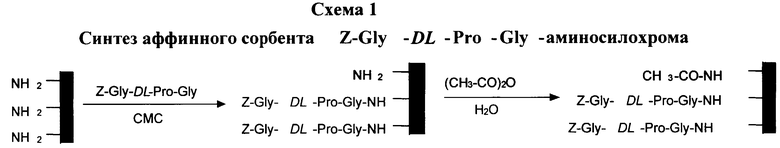
Схемы №1-3 иллюстрируют синтезированные афинные сорбенты с использованием синтетических пептидных лигандов, строение которых имитируют структурные мотивы цепей молекул коллагана: Z-Gly-DL-Pro-Gly-аминосилохром (схема 1), Pro-Gly-Gly-аминосилохром (схема 2), (Pro-OH)-Gly-Gly-аминосилохром (схема 3).
Для синтеза сорбентов могут быть использованы готовые пептиды или пептиды, синтезированные известными методами. Согласно приведенным схемам пептидный лиганд конденсировали непосредственно с аминогруппами аминосилохрома.
Известно, что для улучшения сорбции белков, которая обеспечивается гидрофобной вставкой, предпочтительно присоединять спейсер из 6-8 метиленовых групп, в качестве которой обычно используют остаток ε-аминокапроновой кислоты, обеспечивая таким образом более протяженную длину спейсерной области сорбента.
Это обстоятельство особенно важно для хроматографии ферментов, активный центр которых глубоко "утоплен" внутрь, или для облегчения стерических условий взаимодействия с высокомолекулярными фрагментами. 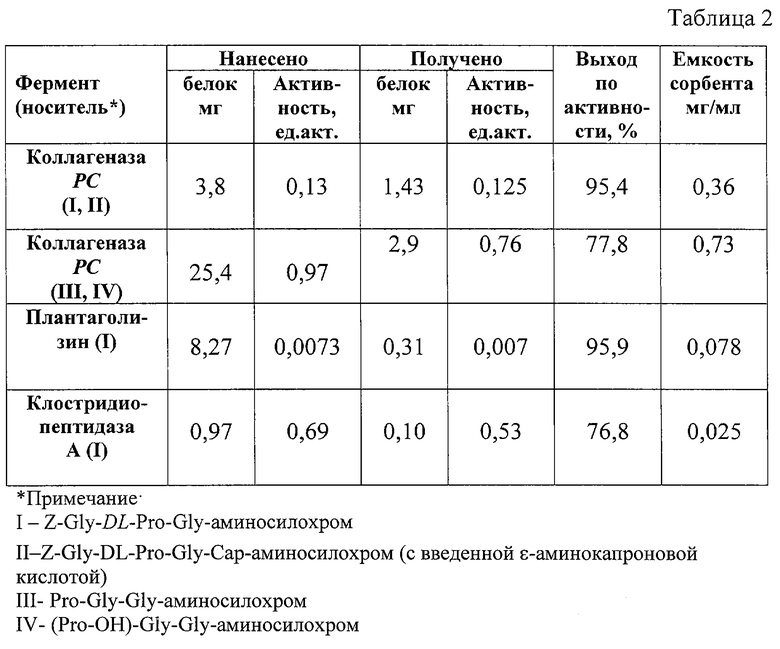
Пример 8.
Синтез Z-Glу-DL-Рrо-Clу-аминосилохрома.
К 10 г аминосилохрома, замоченного в 35 мл воды, добавляют раствор 91 мг (250 мкмоль) Z-Gly-DL-Pro-Gly в 5 мл этанола и 212 мг (500 мкмоль) карбодиимида (CMC) - [N-циклогексил, N-2-(N'-метилморфолино) этилкарбодиимид в 10 мл воды. Подкисляют реакционную смесь до рН 5,5 с помощью конц. НСl и медленно перемешивают в течение 20 ч. Помутневшую желтоватую жидкость над сорбентом удаляют декантацией, после чего модифицированный сорбент промывают от остатков исходных веществ этанолом, затем - большим количеством воды. Непрореагировавшие аминогруппы аминосилохрома блокируют ацетилированием. Для этого к сорбенту добавляют раствор 10 мл уксусного ангидрида в 50 мл воды и выдерживают смесь в течение 40 мин, после чего добавляют раствор 10 г ацетата натрия в 10 мл воды. Сорбент отмывают большим количеством воды и высушивают. Для определения включения пептидного лиганда навеску (100 мг) сухого сорбента гидролизуют 600 мкл 5,7М НСl в течение 24 ч при 105°С. Гидролизат анализируют на аминокислотном анализаторе. Масса сухого модифицированного сорбента - 12,6 г. Включение Z-Gly-DL-Pro-Gly - 5,3 мкмоль/г.
Пример 9.
Синтез Pro-Gly-Gly-аминосилохрома.
Смесь 1 г сухого аминосилохрома (100 мкмоль аминогрупп на г сорбента), замоченного в 3 мл воды, перемешивают в вакууме на роторном испарителе в течение 30-40 мин для удаления воздуха из пор сорбента, добавляют раствор 40 мг (0,3 ммоль) Gly-Gly в 2 мл воды. Избыток глицилглицина в молярном соотношении NH2 (аминосилохрома):СОО (глицилглицина)=1:3 используется для забивки всех возможных сайтов связывания (иначе сорбент будет работать как ионообменник).
Затем прибавляют 0,5 г (1,2 ммоль) водорастворимого карбодиимида CMC, предварительно растворенного в 5 мл воды. Смесь медленно перемешивают на роторном испарителе 2 ч при 20°С. Модифицированный сорбент отделяют от водной фазы декантацией и промывают водой, этанолом, затем большим количеством воды. Далее сорбент высушивают. Масса сухого модифицированного сорбента - 1,17 г.
К такому сухому модифицированному сорбенту, растворенному в 3 мл воды, прибавляют 69 мг (0,6 ммоль) L-пролина (шестикратный избыток) в 12 мл дистиллированной воды. Смесь медленно перемешивают на роторном испарителе 2 ч. при 20°С. Модифицированный сорбент отделяют от водной фазы декантацией и промывают водой, этанолом, затем большим количеством воды. Далее сорбент высушивают. Масса сухого модифицированного сорбента - 2,21 г.
Для определения включения пептидного лиганда в сорбент навеску 20 мг гидролизуют 5,7 н НСl 48 ч при 105°С и измеряют количественно содержание аминокислот в гидролизате на аминокислотном анализаторе Hitachi-835. Выход реакции рассчитывают по отношению количества присоединившихся аминокислот к количеству аминокислот, вводимых в реакцию, принимая за 100% исходное содержание аминокислот в реакционной смеси. Включение пептидных лигандов составило 26 мкмоль/г сухого сорбента соответственно, выход 4-10%.
Пример 10.
Синтез (Рrо-ОН)-Glу-Glу-аминосилохрома.
Синтез Gly-Gly-аминосилохрома производится по той же методике, как описано в примере 4. Масса сухого модифицированного сорбента - 1,15 г. К такому сухому модифицированному сорбенту, растворенному в 3 мл воды, прибавляют 78,6 мг (0,6 ммоль) L-оксипролина (шестикратный избыток) в 12 мл дистиллированной воды. Смесь медленно перемешивают на роторном испарителе 2 ч. при 20°С. Модифицированный сорбент отделяют от водной фазы декантацией и промывают водой, этанолом, затем большим количеством воды. Далее сорбент высушивают. Масса сухого модифицированного сорбента - 2,25 г.
Для определения включения пептидного лиганда в сорбент навеску 20 мг гидролизуют 5,7 н НСl 48 ч при 105°С и измеряют количественно содержание аминокислот в гидролизате на аминокислотном анализаторе Hitachi-835. Выход реакции рассчитывают по отношению количества присоединившихся аминокислот к количеству аминокислот, вводимых в реакцию, принимая за 100% исходное содержание аминокислот в реакционной смеси. Включение пептидных лигандов составило 30 мкмоль/г сухого сорбента соответственно, выход 5-15%.
Следует отметить, что степень включения пептидного лиганда в синтезированных нами аффинных сорбентах (5-10 мкмоль/г) попадает в рабочий диапазон для аффинных сорбентов и значения от 0,5 до 10 мкмоль/г являются оптимальными для сорбции и особенно для последующего процесса элюции.
В таблице 2 приведены данные сорбции коллагеназ на афинных сорбентах, в частности, полученных в примерах 8-10.
Данные, приведенные в таблице 2, показывают, что согласно этому способу можно применять сорбенты для выделения коллагеназ из разных источников - из животных, растений, микроорганизмов.
Таким образом, благодаря особому строению лигандов предлагаемые аффинные сорбенты позволяют избирательно выделять из природных источников ферменты с коллагеназным действием. Ранее коллагеназы выделяли стандартными методами, включая ионообменную хроматографию, гель-фильтрацию, ультрафильтрацию. Специфические аффинные сорбенты для коллагеназ неизвестны.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения биоспецифического сорбента для очистки аминопептидаз | 1981 |
|
SU1074877A1 |
| Способ очистки протеолитических ферментов | 1978 |
|
SU942427A1 |
| СПОСОБ ПОЛУЧЕНИЯ АФИННОГО СОРБЕНТА ДЛЯ ОЧИСТКИ ПРОТЕИНАЗ | 1995 |
|
RU2065877C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕПТИДА ЭКСЕНАТИДА | 2011 |
|
RU2458066C1 |
| МОДУЛЯЦИЯ СПЕЦИФИЧНОСТИ СТРУКТУРИРОВАННЫХ БЕЛКОВ | 2012 |
|
RU2745572C2 |
| МОДУЛЯЦИЯ СПЕЦИФИЧНОСТИ СТРУКТУРИРОВАННЫХ БЕЛКОВ | 2012 |
|
RU2631931C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА КОЛЛАГЕНАЗЫ | 2003 |
|
RU2236460C1 |
| НОВЫЕ СПОСОБЫ ОПОСРЕДОВАННОГО ФЕРМЕНТАМИ КОНЪЮГИРОВАНИЯ ПОЛИПЕПТИДОВ С ИСПОЛЬЗОВАНИЕМ СОРТАЗЫ | 2015 |
|
RU2714963C2 |
| ФЕРМЕНТАТИВНАЯ ОДНОРЕАКТОРНАЯ РЕАКЦИЯ ДВОЙНОГО КОНЪЮГИРОВАНИЯ ПОЛИПЕПТИДОВ ЗА ОДНУ СТАДИЮ С ИСПОЛЬЗОВАНИЕМ СОРТАЗЫ | 2015 |
|
RU2711364C2 |
| БИФУНКЦИОНАЛЬНЫЕ СВЯЗЫВАЮЩИЕ ПОЛИПЕПТИДЫ | 2019 |
|
RU2806747C2 |

Описан способ получения афинного сорбента для очистки ферментных препаратов, включающий взаимодействие в среде органического растворителя аминосодержащего нерастворимого носителя с пептидным лигандом и конденсирующим агентом, отличающийся тем, что в качестве пептидного лиганда используют антибиотик - полипептид-полимиксин М или модифицированный полипептид, имитирующий структурные мотивы цепей молекулы коллагена, имеющий последовательность Z-Gly-DL-Pro-Gly-, Pro-Gly-Gly- или (Pro-OH)-Gly-Gly-, процесс ведут при рН 5,5-8,0, причем на 1 г носителя берут 9-80 мг пептидного лиганда и 10-500 мг конденсирующего агента. Технический результат: возможность использования для выделения высокоочищенных и высокоактивных ферментных препаратов, используемых в медицине, биохимии, пищевой промышленности, в ферментативном синтезе пептидов, а также для исследовательских целей. 6 з.п. ф-лы, 2 табл., 3 ил.
| Способ очистки протеолитических ферментов | 1978 |
|
SU942427A1 |
| Способ одновременной очистки протеолитического фермента и его обратимого ингибитора | 1979 |
|
SU962302A1 |
| Способ получения афинного сорбента | 1987 |
|
SU1479511A1 |
| СПОСОБ ПОЛУЧЕНИЯ АФИННОГО СОРБЕНТА ДЛЯ ОЧИСТКИ ПРОТЕИНАЗ | 1995 |
|
RU2065877C1 |
| КУЗНЕЦОВА А.В | |||
| и др | |||
| Биоорганическая химия | |||
| Электрическое сопротивление для нагревательных приборов и нагревательный элемент для этих приборов | 1922 |
|
SU1997A1 |
| ИГОЛКИНА Л.А | |||
| и др | |||
| Вестник МГУ | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
Авторы
Даты
2004-06-10—Публикация
2003-03-05—Подача